Российские нанотехнологии, 2023, T. 18, № 1, стр. 24-32
ОБ УЧАСТИИ ПРОТОНОВ В РАБОТЕ ФАКТОРА F1 АТФ-СИНТАЗЫ ПРИ СИНТЕЗЕ АДЕНОЗИНТРИФОСФАТА
С. В. Нестеров 1, *, Л. С. Ягужинский 2, 3
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Научно-исследовательский институт физико-химической биологии им. А.Н. Белозерского
МГУ им. М.В. Ломоносова
Москва, Россия
3 Институт цитохимии и молекулярной фармакологии
Москва, Россия
* E-mail: semen.v.nesterov@phystech.edu
Поступила в редакцию 05.10.2022
После доработки 05.10.2022
Принята к публикации 11.10.2022
Аннотация
Показано, что в работе F1-субъединицы АТФ-синтазы, на которой осуществляется реакция синтеза аденозитрифосфата (АТФ), принимают участие ионы водорода, попадающие на F1 после трансмембранного переноса через FO-субъединицу. Протонирование аминокислотных остатков глутамата и аспартата существенно меняет конформацию фермента, что наряду с описанным в литературе механическим движением γ-субъединицы является важным фактором, обеспечивающим конформационные переходы в АТФ-синтазе. Связывание с F1-фактором АТФ-синтазы протонов во время работы фермента также необходимо для обеспечения самой реакции синтеза АТФ, которая благодаря использованию трансмембранно перенесенных через FO протонов не замедляется в неравновесных условиях защелачивания примембранной зоны во время работы протонных помп. Вращение АТФ-синтазы при этом может катализировать обмен протонами между фазами примембранной и объемной воды. Сделано заключение, что конформационная модель работы АТФ-синтазы должна быть дополнена и в ней должно быть учтено протонирование F1-фактора.
ОГЛАВЛЕНИЕ
Введение
1. Общность принципов устройства и функционирования АТФ-синтаз F-типа различных организмов
2. Экспериментальное обоснование конформационной модели Бойера функционирования АТФ-синтаз F-типа
3. Обоснование наличия кинетического барьера для обмена протонами между объемной фазой и примембранной зоной искусственных и биологических мембран
4. Депротонирование АТФ-синтазы митохондрий при включении протонных помп
5. Энергозависимое протонирование фактора F1 АТФ-синтазы с участием FO-субъединицы
6. Участие протона в каталитическом акте синтеза АТФ в F1-факторе
Заключение
ВВЕДЕНИЕ
Одним из наиболее рациональных методов для формирования подходов к достижению углероднейтрального энергобаланса является использование в качестве основы природных заведомо сбалансированных процессов, причем необходимо проведение анализа не только на глобальном уровне экосистем и биосферы, но и на самом базовом уровне – от отдельных организмов до молекулярных метаболических процессов в них. Ключевую роль во взаимодействии живых систем играют биоэнергетические процессы фотосинтеза и окислительного фосфорилирования (ОКСФС).
На основании глубокого анализа имеющихся биохимических данных по энергетике митохондрий, Р. Вильямс в 1961 г. обосновал роль полупроницаемых мембран в качестве ключевого структурного элемента в системе энергетики клетки, а также отметил роль ионов водорода в качестве основного носителя энергии в биоэнергетических мембранных системах [1]. Параллельно П. Митчелл предложил широко известную конкретную модель работы фосфорилирующей системы митохондрий, основанную на трансмембранном переносе ионов водорода [2]. Эта модель позволила определить промежуточную стадию запасания энергии биологических реакций в форме электрохимического потенциала ионов водорода. Прямое участие ионов водорода в функционировании АТФ-синтазы было показано в Институте электрохимии РАН и Институте физико-химической биологии МГУ [3]. Настоящая работа посвящена анализу ряда работ, посвященных прямому участию ионов водорода в функционировании фактора F1 АТФ-синтазы хлоропластов и митохондрий. Эти данные, в том числе полученные соавторами настоящей статьи, подвергнуты повторному теоретическому анализу в связи с очевидной необходимостью согласовать их с конформационной моделью работы АТФ-синтазы, предложенной П. Бойером (нобелевская премия по химии 1997 г.).
1. ОБЩНОСТЬ ПРИНЦИПОВ УСТРОЙСТВА И ФУНКЦИОНИРОВАНИЯ АТФ-СИНТАЗ F-ТИПА РАЗЛИЧНЫХ ОРГАНИЗМОВ
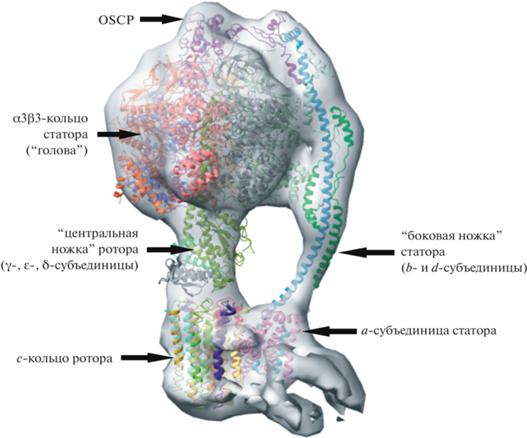
Рассмотрим АТФ-синтазы из различных живых организмов. Отметим, что все АТФ-синтазы F-типа, в том числе синтазы митохондрий и хлоропластов, крайне схожи как по общему строению (организации и наличия основных субъединиц), так и в атомарных аспектах функционирования – каталитический центр β-субъединицы и ключевые аминокислоты протонных каналов FO очень консервативны [4, 5]. Структура АТФ-синтазы (FOF1) растений и многоклеточных организмов включает в себя два качественно различных фрагмента – мембранный Fo, осуществляющий трансмембранный перенос протонов, а также гидрофильный фактор F1, в котором осуществляется синтез АТФ. У всех АТФ-синтаз имеются вращающееся с-кольцо в мембране, передающая крутящий момент от FO на F1 центральная ножка, гетеротример из каталитических β- и регуляторных α-субъединиц, мембранная статорная субъединица с двумя протонпроводящими полуканалами, а также переферическая ножка, дополнительно связывающая FO и F1 (рис. 1). Основное различие между АТФ-синтазами F-типа разных организмов заключается в разном количестве с-субъединиц в мембранной части ротора, что принципиально не меняет механизма функционирования.
Рис. 1.
Структура АТФ-синтазы митохондрий [6]. Альфа-спиральное отображение взято со структуры АТФ-синтазы быка (PDB: 5AR). Электронная плотность фермента с разрешением 13 Å получена с помощью криоэлектронной томографии в НИЦ “Курчатовский институт” в нативных условиях без выделения из митохондриальной мембраны.
Важным свойством АТФ-синтазы хлоропластов является способность к активации на свету и инактивации в темноте. Высокоточные структурные данные позволяют заключить, что в основе этой регуляции находятся два цистеина γ-субъединицы, образование и разрыв дисульфидной связи между которыми регулируются светозависимой (потенциал-зависимой) работой тиоредоксиновой системы [7, 8]. У митохондрий и бактерий также есть система ингибирования активности гидролитической активности АТФ-синтазы при снижении потенциала [9]. Вместо характерной для хлоропластов редкос-регуляции активности в митохондриях реализуется потенциал-зависимое ингибирование гидролиза АТФ присоединением специальной регуляторной субъединицы IF1 [10], которая при снижении мембранного потенциала блокирует вращение ротора в сторону, соответствующую гидролизу АТФ. Это говорит о том, что, несмотря на некоторые регуляторные различия, качественно регуляция гидролитической активности различных АТФ-синтаз не различается – снижение потенциала ведет к блокированию гидролиза.
Таким образом, функционирование всех АТФ-синтаз F-типа в основном идентично, а различия проявляются лишь в некоторых деталях и регуляторных аспектах, связанных с адаптацией к конкретным условиям среды и особенностям метаболизма живых организмов, в которых эти АТФ-синтазы функционируют. Это позволяет вести мета-анализ и синтез имеющихся данных о работе АТФ-синтаз F-типа в различных организмах.
2. ЭКСПЕРИМЕНТАЛЬНОЕ ОБОСНОВАНИЕ КОНФОРМАЦИОННОЙ МОДЕЛИ БОЙЕРА ФУНКЦИОНИРОВАНИЯ АТФ-СИНТАЗ F-ТИПА
За последние три десятилетия произошел большой прогресс в изучении механизма работы АТФ-синтаз. Одним из важнейших открытий в этой области является предложенный и обоснованный П. Бойером механизм катализа синтеза АТФ, согласно которому образование АТФ в каталитическом центре фермента происходит практически изоэнергетически, а вся внешняя энергия расходуется на стадии отсоединения АТФ от каталитического центра [11]. Структурные исследования, проведенные при активном участии Дж. Уокера [12], подтвердили концепцию механохимического сопряжения, согласно которой энергия на каталитический центр передается механически при вращении центральной ножки фермента (γ-субъединицы), что индуцирует конформационные изменения в активном центре. Вращение АТФ-синтазы в процессе гидролиза АТФ удалось визуализировать [13, 14], а также индуцировать in vitro синтез АТФ за счет механического вращения в магнитном поле ротора АТФ-синтазы с пришитой магнитной частицей [15]. Эта же методика позволила дополнительно подтвердить, что вращение γ-субъединицы приводит к изменению сродства нуклеотидов к ферменту [16].
Несмотря на значительный прогресс, достигнутый в исследовании АТФ-синтаз, полная теория функционирования этой уникальной природной машины на атомарном уровне не доработана. Приблизительно один и тот же механизм, предложенный П. Бойером, приводится с дополнением его промежуточными конформациями в большинстве последних научных работ по теме [17–22]. Кратко, при достижении необходимой упругой энергии после нескольких поворотов с‑кольца происходят поворот γ-субъединицы на 120° и изменение конформации β-субъединиц таким образом, что происходит изменение сродства к нуклеотидам и из одной β-субъединицы АТФ высвобождается.
В рамках данной публикации сконцентрируемся на двух факторах, которые не учитываются в большинстве работ. Во-первых, на наличии высокого барьера для отрыва протонов от поверхности белков и липидов мембраны [23], а во-вторых, на том, что F1-фактор АТФ-синтазы способен связывать на себе большое количество протонов. Далее оба эти положения подкрепим экспериментальными свидетельствами, а также рассмотрим их влияние на функционирование АТФ-синтазы.
3. ОБОСНОВАНИЕ НАЛИЧИЯ КИНЕТИЧЕСКОГО БАРЬЕРА ДЛЯ ОБМЕНА ПРОТОНАМИ МЕЖДУ ОБЪЕМНОЙ ФАЗОЙ И ПРИМЕМБРАННОЙ ЗОНОЙ ИСКУССТВЕННЫХ И БИОЛОГИЧЕСКИХ МЕМБРАН
До сих пор остается открытым вопрос о функциональной значимости кинетического барьера в примембранной зоне, блокирующего реакцию быстрого отрыва ионов водорода от поверхности искусственных мембран [24], мембран митохондрий [25] и митопластов [26]. По-видимому, основной причиной наличия такого барьера является сниженная диэлектрическая постоянная фракции воды в приграничной зоне гидрофобной границы мембрана–вода. Если в объеме воды ε ≈ 80, то в приграничных слоях с поверхностями ε ≤ 10 [27]. Известно, что механическое перемешивание межфазной границы может устранять барьер для обмена протонами между объемом и примембранной зоной [28]. В [23] эффект замедленного отрыва ионов водорода от поверхности мембран подробно описан и подкреплен массивом экспериментальных данных. Было показано, что слабые основания (такие как HEPES, MES) катализируют реакцию отрыва неравновесно связанных протонов от поверхности мембран. Этот каталитический механизм часто путают с буферными свойствами тех же слабых оснований, которые проявляются и используются при работе с равновесными системами.
Кинетический барьер в реакции переноса протона из объема водной фазы на внутренней поверхности мембраны был также обнаружен при работе протонной помпы на субмитохондриальных частицах (СМЧ), обладающих инвертированной ориентацией внутренней мембраны [29]. Эффект кинетического барьера на митохондриях и СМЧ наблюдается и в присутствии стандартных концентраций протонофоров (FCCP, пентахлорфенола) (подробнее об особенностях работы разобщителей с учетом наличия примембранной фазы воды в обзоре [30]). Добавление слабых оснований Льюиса снижает этот кинетический барьер, а добавление ингибитора протонных помп переводит систему в равновесное состояние и блокирует защелачивание поверхности СМЧ. Таким образом, условия по обе стороны мембраны схожи, и с обоих сторон мембраны существует достаточно высокий барьер для обмена протонами между примембранной зоной и водной фазой.
Эффект образования межфазных границ между различными водными растворами биополимеров активно исследуется в последнее десятилетие. Это явление носит название фазового разделения жидких фаз (фазовой сепарации жидкость–жидкость) и согласно новым данным находится наряду с мембранами в основе клеточной самоорганизации (обзоры [31, 32]). Фазовое разделение жидких фаз внутри клетки предполагалось еще в конце IXX – начале XX века [33, 34], однако такой взгляд на клеточную организацию был вытеснен мембранной теорией клетки. Новый импульс развития это направление исследований получило только в XXI веке, когда было показано существование жидких безмембранных конденсатов в клетке, отделенных от остальной цитоплазмы [35]. Наибольший эффект стимуляции фазовой сепарации имеют неупорядоченные активно взаимодействующие с водой части биополимеров [36]. Важно указать, что поверхность F1-фактора АТФ-синтаз покрыта гидрофильными аминокислотами, а сами β- и α-субъединицы имеют области низкой упорядоченности [5], неупорядоченность которых может еще больше возрастать в процессе конформационных перестроек. Это говорит о том, что АТФ-синтаза может влиять на фазовое разделение.
Фазовая сепарация с образованием жидкого конденсата может стимулироваться и образованием кластеров (“рафтов”) в мембране [37] ввиду поляризации воды и ее взаимодействия с липидными и белковыми компонентами мембраны. Интересно, что кластеризация системы ОКСФОС недавно была показана экспериментально в митохондриях сердца [38]. Далее при рассмотрении процессов переноса протона будем учитывать описанный выше феномен и рассматривать примембранные зоны по обе стороны мембраны как отдельные фазы, отрыв протонов из которых или приход в них из объема будет затруднен в отсутствие слабых оснований, катализирующих обмен протонами через межфазную границу.
4. ДЕПРОТОНИРОВАНИЕ АТФ-СИНТАЗЫ МИТОХОНДРИЙ ПРИ ВКЛЮЧЕНИИ ПРОТОННЫХ ПОМП
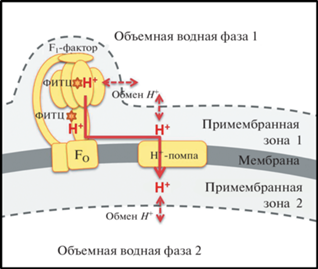
Рассмотрим подробно эксперименты по измерению локального pH с помощью ковалентной пришивки pH-чувствительного флуоресцентного зонда – флуоресцеинизотиоционата (ФИТЦ) [25, 29, 39]. В рамках этих работ показано, что основная часть зонда ФИТЦ связывается с поверхностью внутренней мембраны митохондрий, а именно с γ- и α-субъединицами фактора F1 АТФ-синтазы [39]. При этом и на препаратах митохондрий, и на препаратах СМЧ с инвертированной топологией внутренней мембраны удалось наблюдать изменения флуоресценции ФИТЦ при включении и выключении протонных помп. По измерению спектров флуоресценции ФИТЦ было показано, что включение протонных помп приводит к диссоциации протонов от зонда. Учитывая, что местом пришивки значительной части зонда является F1-фактор, выводы можно дополнительно уточнить – в условиях работы протонных помп происходит диссоциация протонов с ионогенных групп фактора F1. Это говорит о переносе протонов между протонными помпами и АТФ-синтазой вдоль мембраны по межфазной границе (примембранной зоне на рис. 2), а также о том, что прямой обмен протонами между объемной фазой и примембранной зоной затруднен. Схема процесса переноса протона в экспериментах на СМЧ приведена на рис. 2.
5. ЭНЕРГОЗАВИСИМОЕ ПРОТОНИРОВАНИЕ ФАКТОРА F1 АТФ-СИНТАЗЫ С УЧАСТИЕМ FO-СУБЪЕДИНИЦЫ
В [40] методом титрования буферной емкости хлоропластов показано, что буферная емкость органелл в диапазоне pH 7–9 резко возрастает при освещении. Позднее этот эффект был подробно изучен в работах Е.К. Золотаревой и соавторов. В [41, 42] эффект был подтвержден (рис. 3в), а также обнаружено, что гиперпротонирование F1 блокируется дициклогексилкарбодиемидом (DCCD), ингибирующим работу с-ротора FO-фрагмента АТФ-синтазы. Специальные опыты в среде, содержащей тритиевую воду, показали, что в условиях наличия потенциала на мембране тилакоидов (на свету) тритиевая метка обнаруживалась и в выделенном F1-факторе АТФ-синтазы, причем с одной молекулой F1 может связаться более 100 ионов трития (рис. 3г). Таким образом, при высокой концентрации трития в среде он активно связывается с F1-фактором АТФ-синтазы, однако это происходит только при наличии трансмембранного переноса ионов водорода через FO-субъединицу. Это позволяет предположить механизм, согласно которому на свету в условиях работы протонной помпы (цитохром-b6 f-комплекс) тритий сначала из среды попадает в люмен тилакоида (а точнее, в примембранный слой со стороны люмена), а далее уже под действием электрохимического градиента проходит через FO, попадая на F1 и связываясь с ионогенными группами на его поверхности (рис. 3а).
Рис. 3.
Накопление трития на F1-факторе АТФ-синтазы в различных экспериментальных условиях. При высокой концентрации трития в среде наблюдается светозависимое протонирование F1, которое блокируется при ингибировании протонного переноса через FO (+DCCD) (а). В условиях отмывки хлоропластов от трития и наличия только фракции мембраносвязанного трития статистически значимое увеличение связывания трития с F1 удается наблюдать только в условиях фосфорилирования, т.е. при высокой скорости транспорта ионов водорода через FO (б).
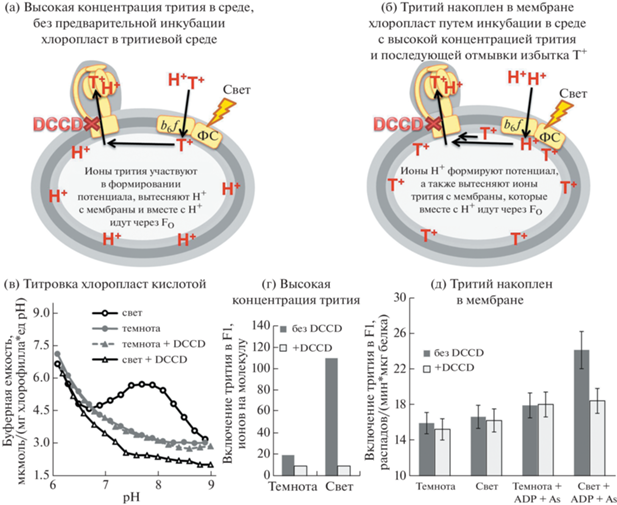
Более детальные опыты по исследованию стабильности связи трития с F1 показали, что при многочасовой инкубации хлоропластов в среде с тритием в них формируется фракция мембраносвязаных ионов трития, которая сохраняется даже после многократных отмывок хлоропластов от трития [43]. Исследования на свету и в темноте при наличии мембраносвязанной фракции трития в хлоропластах показали, что в этих условиях перемещение трития с внутренней поверхности мембраны тилакоидов через FO на фактор F1 наблюдается только при фосфорилировании, т.е. при очень активном трансмембранном переносе через FO [44] (рис. 3б, 3д). Этот эффект блокируется как ингибитором протонного канала в FO – DCCD, так и высокими дозами разобщителя (грамицидина А), блокирующими фосфорилирование [44].
На следующем этапе исследований обнаружили, что при светозависимом переносе протонов между FO и F1 происходит структурная перестройка АТФ-синтазы, проявляющаяся в резком ослаблении связи между гидрофильной F1-субъединицей и мембранной субъединицей FO [45]. Важно указать, что эта перестройка также блокируется DCCD. Такое протон-зависимое снижение связи между субъединицами объясняется протонированием части аминокислотных остатков γ-субъединицы, которые при этом перестают участвовать в образовании мультивалентной связи между FO и F1, образуемой противоположно заряженными аминокислотами. Ионогенными группами, протонирование которых меняется в F1 и влияет на конформацию фермента, являются карбоксильные группы глутамата и аспартата [46].
Таким образом, детальный анализ результатов упомянутых выше работ по исследованию протонирования F1-субъединицы АТФ-синтазы в хлоропластах в разных условиях убедительно показывает, что имеющиеся на ней в большом количестве (несколько сотен на молекулу) поверхностные карбоксильные группы связывают ионы водорода (или трития), трансмембранно перенесенные из люмена через FO-субъединицу во время функционирования фермента.
6. УЧАСТИЕ ПРОТОНА В КАТАЛИТИЧЕСКОМ АКТЕ СИНТЕЗА АТФ В F1-ФАКТОРЕ
Как известно, протон вместе с фосфатом и аденозиндифосфатом (АДФ) является одним из субстратов в реакции синтеза АТФ, а при синтезе АТФ на выделенных митохондриях наблюдается защелачивание среды. Протоны, как правило, с помощью методов структурного анализа не идентифицируются, или получаемого разрешения недостаточно для их однозначной идентификации. В связи с этим детального рассмотрения движения протона в каталитических центрах АТФ-синтазы обычно не проводится, лишь указывается, что донорами протона могут выступать имеющиеся там аминокислоты. При этом каталитические центры АТФ-синтазы выступают из мембраны в сторону слабощелочной среды матрикса митохондрий, находясь, как показано в предыдущем разделе, в примембранной зоне, где наблюдается устойчивое защелачивание при работе протонных помп. В связи с этим не праздным является вопрос, как осуществляется репротонирование донорных аминокислот, отдающих протон в ходе реакции синтеза АТФ.
На рис. 4 приведены детальные структуры каталитических центров трех разных β-субъединиц в одном и том же F1-факторе, конформация которых соответствует трем разным состояниям цикла синтеза/гидролиза АТФ по Бойеру. Можно видеть, что адениновый нуклеотид скоординирован π-связями с ароматическими аминокислотами фенилаланином и треонином. В ходе Бойеровского цикла конформация этой части активного центра немного меняется, что может влиять на сродство нуклеотида к ферменту, однако более интересные и существенные изменения происходят в самом реакционном центре, в области иона магния, катализирующего реакцию. В момент перед синтезом (или после гидролиза) субстраты достаточно крепко связаны с активным центром: неорганический фосфат и β-фосфат АДФ удерживаются положительно заряженными аргининами. Отметим, что в активный центр ион магния попадает вместе с молекулой АДФ, но не с фосфатом. В положении на рис. 4a, 4г магний уже переместился в каталитическое положение, в котором связан с обоими основными субстратами реакции. На другом этапе (рис. 4б, 4д) уже произошло формирование фосфатной связи, однако молекула АТФ наиболее крепко связана с ферментом. Можно видеть, что в этом положении все четыре валентности иона магния заняты, причем он взаимодействует не только с АТФ, но и с двумя аминокислотами фермента (глутамат 194 и координационная связь с треонином 165). Вместе с тем кислороды фосфатных групп АТФ взаимодействуют с двумя положительно заряженными аргининами. Таким образом, фосфатный участок молекулы АТФ посредством иона магния очень крепко связан с ферментом. Ситуация меняется при следующей конформации фермента (рис. 4в). Аргинины 191 и 365 (α-субъединицы) удаляются от молекулы АТФ на расстояния более 4 и 5 Å соответственно. Отчетливо видно, что связь магния с глутаматом 194 распадается (расстояние более 6 Å), сохраняются только связь с γ‑фосфатом и слабая координационная связь с треонином. Свободные валентности магния, вероятно, могут быть заполнены связями с водой, присутствующей в полости между ним и аспартатами 190 и 252 (наличие воды в этой полости, например, показано в одной из доступных структур АТФ-синтазы хлоропластов, PDB: 6FKF). Такая конформация активного центра соответствует гораздо более слабой связи АТФ с ферментом. При небольшом изменении конформации он может оторваться от каталитического центра. Отметим, что согласно последним структурным данным, уточняющим изначально предложенную Бойером модель, у каждого из основных трех состояний синтазы (состояния поворота γ-субъединицы на 120°) существуют дополнительные подсостояния. До шести состояний фермента наблюдалось на выделенном F1-факторе [20] и семь обнаружено на FOF1 АТФ-синтазе [47].
Рис. 4.
Структура каталитического центра на трех различных β-субъединицах АТФ-синтазы аэробной бактерии Bacillus subtilis (структура из банка данных PDB: 7L1Q, рисунок подготовлен с помощью программы ChimeraX). В первом каталитическом центре со связанными молекулами АДФ и фосфата ион магния взаимодействует с неорганическим фосфатом и β-фосфатом АДФ (а, г). Во втором центре со связанной молекулой АТФ ион магния взаимодействует с γ‑и β-фосфатами АТФ (расстояния 2.2 и 2.8 Å соответственно), а также с глутаматом 194 (б, д). В третьем центре со связанной молекулой АТФ ион магния слабее связан с фосфатами АТФ (расстояние 2.4 Å до γ и 3.3 Å до β-фосфата) и непосредственно не связан с глутаматом 194 (в, е).

Приведенные структуры показывают, что донорами протона являются консервативные карбоксильные группы, присутствующие в активном центре всех АТФ-синтаз. В то время как глутамат 194 участвует в реакции, аспартаты 190 и 252 могут служить для транспорта в активный центр протона, который может передвигаться по цепочкам молекул воды и карбоксильных групп подобно тому, как это происходит в d-канале цитохром с-оксидазы – ключевой протонной помпы в митохондриях [48], имеющем в своем составе консервативные глутаматы/аспартаты [49]. Именно протонирование карбоксильных групп гидрофильной части F1-фактора наблюдалось в экспериментах на хлоропластах при работе АТФ-синтазы. Приведенный структурный анализ позволяет заключить, что протонирование F1-фактора является не просто случайным феноменом, а необходимо для бесперебойной подачи протонов в активный центр и тем самым обеспечения высокой скорости синтеза АТФ.
ЗАКЛЮЧЕНИЕ
Проведен анализ цикла экспериментальных работ, который позволил сделать заключение, что конформационная модель работы АТФ-синтазы должна быть дополнена приведенной выше информацией. Помимо непосредственного изменения конформации активных центров за счет механического вращения ротора важным фактором при работе этой молекулярной машины является передача протонов от FO-субъединицы на каталитический центр фактора F1, что обеспечивает эффективное протекание реакции синтеза АТФ в неравновесных условиях защелачивания примембранной зоны во время работы протонных помп. Рассмотрение этих данных с учетом наличия барьера переноса протона между фазами позволяет также предположить, что вращение АТФ-синтазы с перемешиванием межфазной границы способствует ускорению обмена ионами водорода между примембранной зоной и объемной водной фазой.
Работа выполнена при поддержке НИЦ “Курчатовский институт” в рамках тематического плана “Изучение процессов генерации, передачи и распределения энергии в живых организмах”.
Список литературы
Williams R.J.P. // J. Theor. Biol. 1961. V. 1. P. 1. https://doi.org/10.1016/0022-5193(61)90023-6
Mitchell P. // Nature. 1961. V. 191. P. 144. https://doi.org/10.1038/191144a0
Yaguzhinsky L.S., Boguslavsky L.I., Volkov A.G., Rakhmaninova A.B. // Nature. 1976. V. 259. P. 494. https://doi.org/10.1038/259494a0
Junge W., Nelson N. // Annu. Rev. Biochem. 2015. V. 84. P. 631. https://doi.org/10.1146/annurev-biochem-060614-034124
Vlasov A.V., Osipov S.D., Bondarev N.A. et al. // Cell. Mol. Life Sci. 2022. V. 79. P. 179. https://doi.org/10.1007/s00018-022-04153-0
Nesterov S.V., Chesnokov Yu.M., Kamyshinsky R.A. et al. // Nanotechnologies in Russia. 2020. V. 15. P. 83. https://doi.org/10.1134/S1995078020010139
Hisabori T., Sunamura E.I., Kim Y., Konno H. // Antioxid. Redox Signal. 2013. V. 19. P. 1846. https://doi.org/10.1089/ars.2012.5044
Yang J.-H., Williams D., Kandiah E. et al. // Commun. Biol. 2020. V. 3. P. 1. https://doi.org/10.1038/s42003-020-01221-8
Fischer S., Gräber P., Turina P. // J. Biol. Chem. 2000. V. 275. P. 30157. https://doi.org/10.1074/jbc.275.39.30157
Bason J.V., Montgomery M.G., Leslie A.G.W., Walker J.E. // Proc. Natl. Acad. Sci. 2014. V. 111. P. 11305. https://doi.org/10.1073/pnas.1411560111
Boyer P.D. // Biochim. Biophys. Acta. Bioenerg. 1993. V. 1140. P. 215. https://doi.org/10.1016/0005-2728(93)90063-L
Walker J.E. // Angew. Chem. Int. Ed. 1998. V. 37. P. 2308. https://doi.org/10.1002/(SICI)1521-3773(19980918)37:17<2308::AID-ANIE2308>3.0.CO;2-W
Noji H., Yasuda R., Yoshida M., Kinosita K. // Nature. 1997. V. 386. P. 299. https://doi.org/10.1038/386299a0
Sambongi Y., Iko Y., Tanabe M. et al. // Science. 1999. V. 286. P. 1722. https://doi.org/10.1126/science.286.5445.1722
Itoh H., Takahashi A., Adachi K. et al. // Nature. 2004. V. 427. P. 465. https://doi.org/10.1038/nature02212
Adachi K., Oiwa K., Yoshida M. et al. // Nat. Commun. 2012. V. 3. P. 1022. https://doi.org/10.1038/ncomms2026
Düser M.G., Zarrabi N., Cipriano D. J. et al. // EMBO J. 2009. V. 28. P. 2689. https://doi.org/10.1038/emboj.2009.213
Guo H., Rubinstein J.L. // Structure of ATP synthase under strain during catalysis. 2022. P. 2022.01.24.477618. https://doi.org/10.1101/2022.01.24.477618
Murphy B.J., Klusch N., Langer J. et al. // Science. 2019. V. 364. P. eaaw9128. https://doi.org/10.1126/science.aaw9128
Sobti M., Ueno H., Noji H., Stewart A.G. // Nat. Commun. 2021. V. 12. P. 4690. https://doi.org/10.1038/s41467-021-25029-0
Watanabe R., Tabata K.V., Iino R. et al. // Nat. Commun. 2013. V. 4. P. 1. https://doi.org/10.1038/ncomms2631
Yanagisawa S., Frasch W.D. // eLife. 2021. V. 10. P. E70016. https://doi.org/10.7554/eLife.70016
Нестеров С.В., Смирнова Е.Г., Ягужинский Л.С. // Биохимия. 2022. Т. 87. С. 216. https://doi.org/10.31857/S0320972522020063
Antonenko Y.N., Kovbasnjuk O.N., Yaguzhinsky L.S. // Biochim. Biophys. Acta. Biomembr. 1993. V. 1150. P. 45. https://doi.org/10.1016/0005-2736(93)90119-K
Yurkov V.I., Fadeeva M.S., Yaguzhinsky L.S. // Biochem. Mosc. 2005. V. 70. P. 195. https://doi.org/10.1007/s10541-005-0101-8
Моисеева В.С., Мотовилов К.А., Лобышева Н.В. и др. // Докл. РАН. 2011. Т. 438.
Teschke O., Ceotto G., de Souza E.F. // Phys. Rev. E. 2001. V. 64. P. 011605. https://doi.org/10.1103/PhysRevE.64.011605
Prats M., Tocanne J.F., Teissié J. // Eur. J. Biochem. 1985. V. 149. P. 663. https://doi.org/10.1111/j.1432-1033.1985.tb08975.x
Krasinskaya I.P., Lapin M.V., Yaguzhinsky L.S. // FEBS Lett. 1998. V. 440. P. 223.
Еремеев С.А., Ягужинский Л.С. // Биохимия. 2015. V. 80. P. 682. https://doi.org/10.1134/S0006297915050089
Hyman A.A., Weber C.A., Jülicher F. // Annu. Rev. Cell Dev. Biol. 2014. V. 30. P. 39. https://doi.org/10.1146/annurev-cellbio-100913-013325
Turoverov K.K., Kuznetsova I.M., Fonin A.V. et al. // Trends Biochem. Sci. 2019. V. 44. P. 716. https://doi.org/10.1016/j.tibs.2019.03.005
Lepeshkin V.V. // Kolloidchemie des Protoplasmas. Berlin; Heidelberg: Springer-Verlag, 1924. https://doi.org/10.1007/978-3-662-02090-6
Wilson E.B. // Science. 1899. V. 10. P. 33. https://doi.org/10.1126/science.10.237.33
Brangwynne C.P., Eckmann C.R., Courson D.S. et al. // Science. 2009. V. 324. P. 1729. https://doi.org/10.1126/science.1172046
Zaslavsky B.Y., Uversky V.N. // Biochemistry. 2018. V. 57. P. 2437. https://doi.org/10.1021/acs.biochem.7b01215
Nesterov S.V., Ilyinsky N.S., Uversky V.N. // Biochim. Biophys. Acta. Mol. Cell Res. 2021. V. 1868. P. 119102. https://doi.org/10.1016/j.bbamcr.2021.119102
Nesterov S., Chesnokov Y., Kamyshinsky R. et al. // Int. J. Mol. Sci. 2021. V. 22. https://doi.org/10.3390/ijms22031462
Козлова М.В., Грамадский К.Б., Солодовникова И.М. и др. // Биофизика. 2003. Т. 48. С. 44.
Polya G.M., Jagendorf A.T. // Biochem. Biophys. Res. Commun. 1969. V. 36. P. 696. https://doi.org/10.1016/0006-291X(69)90362-3
Zolotareva E.K., Opanasenko V.K., Zakharov S.D., Kuzmina V.P. // FEBS Lett. 1986. V. 197. P. 125. https://doi.org/10.1016/0014-5793(86)80311-8
Золотарева Е.К., Гаспарян М.Э., Ягужинский Л.С. // Биологические мембраны. 1989. Т. 6. С. 819.
Гаспарян М.Э., Золотарева Е.К., Ягужинский Л.С. // Биологические мембраны. 1989. Т. 6. С. 814.
Zolotareva E.K., Gasparyan M.E., Yaguzhinsky L.S. // FEBS Lett. 1990. V. 272. P. 184. https://doi.org/10.1016/0014-5793(90)80479-3
Ponomarenko S., Volfson I., Strotmann H. // FEBS Lett. 1999. V. 443. P. 136. https://doi.org/10.1016/S0014-5793(98)01681-0
Опанасенко В.К. // Дис. “Роль ионогенных групп белков в структурно-функциональной организации тилакоидных мембран хлоропластов”… доктора наук. Институт почвоведения и фотосинтеза РАН. 1996.
Zhou A., Rohou A., Schep D.G. et al. // eLife. 2015. V. 4. P. E10180. https://doi.org/10.7554/eLife.10180
Wikström M., Sharma V. // Biochim. Biophys. Acta. Bioenerg. 2018. V. 1859. P. 692. https://doi.org/10.1016/j.bbabio.2018.03.009
Rich P.R., Maréchal A. // J. R. Soc. Interface. 2013. V. 10. P. 20130183. https://doi.org/10.1098/rsif.2013.0183
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии