Российские нанотехнологии, 2023, T. 18, № 1, стр. 33-37
СТАБИЛЬНАЯ РАБОТА БЕЗМЕМБРАННОГО МИКРОБНОГО ТОПЛИВНОГО ЭЛЕМЕНТА В ТЕЧЕНИЕ БОЛЕЕ ЧЕМ СТА ДНЕЙ
М. В. Вишневская 1, *, Ю. М. Парунова 1, А. Н. Решетилов 2, Ю. В. Плеханова 2, С. Е. Тарасов 2, Р. Г. Василов 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина, ФИЦ “Пущинский научный центр биологических исследований РАН”
Пущино, Россия
* E-mail: Vishnevskaya_MV@nrcki.ru
Поступила в редакцию 05.10.2022
После доработки 14.12.2022
Принята к публикации 14.12.2022
Аннотация
Развитие альтернативных источников энергии является одним из наиболее важных направлений современной науки. Изучены процессы генерации энергии в безмембранном безмедиаторном микробном топливном элементе (МТЭ), работающем на микроорганизме Gluconobacter oxydans с использованием искусственных сточных вод, с фототрофными микроводорослями Chlorella vulgaris в катодной камере. Сравнивалась работа топливного элемента с разными католитами, среди которых микроводоросли с освещением и без, питательная среда для выращивания микроводорослей и K‑фосфатный буфер для сравнения. За время наблюдения (113 сут) выходная мощность МТЭ была высокостабильной; ее снижение составило ~30% от начального. Можно допустить, что высокая стабильность обусловлена образованием на поверхности анода биопленки, поддерживающей стабильное состояние микроорганизмов. Образование пленки подтверждается снимками сканирующего электронного микроскопа. Исследуемый МТЭ является эффективной моделью для дальнейшего изучения его применения в тематике очистки сточных вод.
ВВЕДЕНИЕ
В современном мире актуальной и широко изучаемой проблемой является поиск альтернативных источников энергии. Технология топливных элементов позволяет получать из химической энергии электрическую за счет работы биокатализаторов. В микробном топливном элементе (МТЭ) таким катализатором являются микроорганизмы, как целые клетки, так и их фрагменты. Преимуществом МТЭ относительно ферментных является их вариативность к различным субстратам, что является плюсом для применения МТЭ в сфере утилизации органических отходов с выработкой электричества [1]. Преимуществом является и финансовая составляющая, так как стоимость биокатализаторов на основе микроорганизмов значительно ниже, чем стоимость выделения отдельных ферментов. Кроме того, при многоступенчатости окисления субстратов электрохимический отклик целых клеток микроорганизмов будет выше, чем у ферментов [2].
Классическая схема МТЭ выглядит следующим образом: анодная и катодная камеры разделены протонообменной мембраной, через которую протоны переходят из анодной камеры в катодную. Также мембрана задерживает диффузию кислорода в обратном направлении. Микроорганизмы в анодной камере окисляют субстрат, передавая электроны на анод. Из-за возникающей разности потенциалов между анодом и катодом между ними протекает электрический ток, значение которого является показателем работы МТЭ. Протонообменные мембраны, несмотря на возможность получения более высоких мощностей от топливного элемента по сравнению с безмембранными, являются дорогостоящими [3, 4]. Из-за этого возникают трудности в использовании МТЭ в крупных масштабах для очистных сооружений [5]. Поэтому в данном исследовании изучалась работа безмембранного МТЭ.
При конструировании МТЭ важен выбор материала электрода. Он должен соответствовать таким параметрам, как выcокая электропроводимость, биосовместимость с микроорганизмами, высокая удельная поверхность и небольшая стоимость [6, 7]. Наиболее перспективными являются различные углеродные материалы: углеродная бумага, ткань, сетка, войлок, щетки, нанотрубки, графитовые стержни, гранулы и т.п. [8].
В настоящее время появляются исследования по МТЭ с использованием фототрофных микроорганизмов [9–12]. Такие фотобиотопливные элементы (ФБТЭ) могут найти применение в очистке сточных вод как поверхностного, так и бытового назначения. Интеграция фототрофов в катодную камеру топливного элемента позволяет насыщать ее кислородом при освещении, что положительно сказывается на эффективности МТЭ в целом.
МТЭ являются одним из перспективных направлений альтернативной энергетики [4]. Каталитическая активность микроорганизмов используется для производства электроэнергии за счет окисления органических, иногда и неорганических субстратов, присутствующих в городских сточных водах [13, 14]. Также МТЭ активно применяются в качестве биосенсоров для анализа различных соединений [15, 16]. Разработка МТЭ является многообещающей технологией, которая будет все больше применяться на практике в будущем и обеспечивать генерацию экономически и экологически выгодной энергии.
Цель настоящей работы – создание безмембранного безмедиаторного фотобиотопливного элемента с микроводрослями Chlorella vulgaris в катодной камере c разработкой анода на основе бактерий Gluconobacter oxydans, способного работать продолжительное время.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение биомассы микроорганизмов Gluconobacter oxydans. В работе использовали штамм Gluconobacter oxydans ВКМ B-1280 (Всероссийская коллекция микроорганизмов). Выращивание проводили в два этапа. Сначала в течение 24 ч в 50 мл колбах Эрленмейера с 5 мл питательной среды, засеянной G. oxydans. Состав питательной среды (стерильная) для выращивания G. oxydans (%): D-сорбит (10), дрожжевой экстракт (1) (Диа-М), дистиллированная вода [17]. Перемешивание происходило в шейкере-инкубаторе Certomat BS-1 Sartorius (150 об./мин, 28°C). Затем в 500 мл колбах Эрленмейера с 50 мл среды. Выделение биомассы проводили через 20 ч культивирования на втором этапе на стадии перехода бактериальной культуры из стационарной фазы роста в начало замедления роста [18] путем тройного центрифугирования на центрифуге ThermoFisher Scientific SL 40R (10 000 g, 15 мин). Осадок очищали от питательной среды прохладным стерильным отмывочным NC-раствором (0.9% NaCl, 2 мM CaCl2) [19], и ресуспендировали его в 100 мкл. Хранили в холодильнике (+4°С) до момента использования. Культуру поддерживали в чашках Петри с агаризованной средой состава (%) [19]: глюкоза (10), дрожжевой экстракт (1), CaCO3 (2), агар (2), дистиллированная вода.
Культивирование микроводорослей Chlorella vulgaris. Микроводоросли Chlorella vulgaris GKV1 (коллекция НИЦ ”Курчатовский институт”) были выращены на питательной среде BBM (pH 7.0) (стерильно) состава (г/л) [20]: CaCl2 (0.0835), KNO3 (1.25), MgSO4·7H2O (1), KH2PO4 (1.25), FeSO4·7H2O (0.0498), EDTA2Na (0.5), H3BO3 (0.1142), MnCl2·4H2O (0.0144), ZnSO4·7H2O (0.0882), MoO3 (0.0071), CuSO4·5H2O (0.0157), Co(NO3)2·6H2O (0.0049), дистиллированная вода. Культивирование проходило в конических колбах Эрленмейера объемом 1000 мл с дополнительным освещением 1200 лк и барботированием за счет компрессора Miniboost 100 (Aquael, максимальная пропускная способность 100 л/ч).
Приготовление среды, имитирующей сточные воды. Среда, имитирующая сточные воды “Искусственные сточные воды” (ИСВ) (стерильная), имела состав (мг/л) [21]: глюкоза (1000), NH4Cl (95.5), мочевина (56.3), KH2PO4 (22.6), FeSO4·7H2O (12.6), NaHCO3 (309), дрожжевой экстракт (35), дистиллированная вода.
Подготовка электродов. Материалом электродов являлась графитированная ткань ТГН-2МК (толщина ~0.5 мм, АО “НИИграфит”). Анод и катод имели одинаковые размеры 26 × 120 мм2. На анод в качестве рабочей смеси наносили суспензию из микроорганизмов G. oxydans, высокопроводящего полимера поли(3,4-этилендиокситиофен)а, легированного полистиролсульфонатом (PEDOT:PSS), и поли(этиленгликоль)диглицидилового эфира (PEGDE) для закрепления биокатализатора на материале электрода. Указанные вещества и бактериальные клетки использовали в соотношении: G. oxydans–PEDOT:PSS–PEGDE 4 : 1 : 1 в количестве 250 : 62.5 : 62.5 мкл соответственно. Суспензию наносили постепенно, давая подсохнуть каждому слою. Окончательно анод высушивали в суховоздушном термостате Binder BD115 на протяжении одних суток. Рабочая площадь анода составила 2.04 см2.
Формирование ячейки МТЭ. Исследования проводили на МТЭ с раздельными анодной и катодной камерами (химические стаканы объемом 50 мл), электрохимически соединенными солевым мостиком. Анолитом выступала среда ИСВ. В качестве католита использовали четыре варианта растворов: K-фосфатный буфер (pH 6.5), питательная среда BBM, C. vulgaris с дополнительным освещением, C. vulgaris без освещения. В последнем варианте ячейку плотно укрывали фольгой, играющей роль светозащиты, и до начала измерений выжидали 40–50 мин [22]. Для соблюдения равных условий использовали C. vulgaris с одинаковой оптической плотностью ~0.1 (при длине волны A = 750 нм) для каждого эксперимента в серии.
Процесс окисления органических субстратов микробами проходит в анодном отделении и приводит к образованию углекислого газа, протонов и электронов [23]. Электроны, образующиеся в процессе окисления субстратов, по внешней цепи поступают на катод и там соединяются с протонами, попадающими через протонпроницаемую мембрану из анодного отделения, и кислородом, что приводит к генерации электрического тока [24]. Как правило, кюветы анод–катод разделяют протонселективной мембраной МФ-4СК (“Пластполимер”, Санкт-Петербург, Россия), являющейся аналогом мембраны Nafion 117 в протонированной форме [25]. Однако такие мембраны отличаются высокой стоимостью для массового практического применения, в связи с чем использовали солевой мостик.
Изготовление солевого мостика. В качестве солевого мостика использовали перевернутую U‑образную стеклянную трубку, которая была заполнена агаризованным насыщенным раствором KCl [26]. К 100 мл нагретого насыщенного раствора KCl добавляли небольшими порциями 4 г агара, следя за тем, чтобы раствор не вскипал. Суспензию выдерживали при 100°С до тех пор, пока весь агар не перейдет в раствор [27].
Электрохимические измерения. На потенциостате-гальваностате Autolab PGSTAT204 (Mertohm) (ПО NOVA 2.0) проводили измерения вольт-амперных характеристик (ВАХ). Функционирование МТЭ оценивали по данным метода потенциостатической вольтамперометрии с линейной разверткой (скорость линейной развертки 5 мВ/с) и циклической потенциостатической вольтамперометрии. Диапазон задаваемой разности потенциалов для ВАХ составлял –0.3…+0.3 В; данный диапазон охватывает ожидаемые окислительно-восстановительные процессы системы. Измерения проводили при комнатной температуре (25 ± 1°С).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
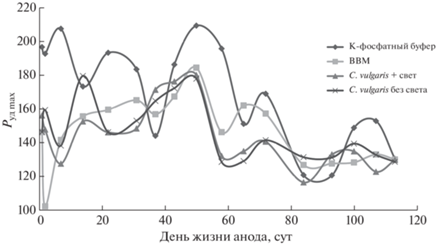
Для оценки результатов работы ячейки МТЭ был применен метод потенциостатической вольтамперометрии с линейной разверткой в интервале потенциалов от –0.3 до +0.3 В. По результатам измерений были рассчитаны максимальные удельные мощности для каждого варианта МТЭ с разными католитами и для каждой повторности (рис. 1) при общем числе повторностей 17. В указанном режиме измерения продолжались 113 сут. В первые сутки измерений максимальная удельная мощность Pуд max для ячейки с K-фосфатным буфером составила 196.0 мВт/м2; в последние сутки – 130.79 мВт/м2. Таким образом, снижение мощности составило ~30%. Аналогичное снижение мощности, по величине и характеру ее падения, наблюдали для остальных вариантов католитов. Так, для среды ВВМ мощность изменялась от 146.64 до 130.49 мВт/м2, для среды с C. vulgaris при дополнительном освещении изменения составили (приведены начальное и конечное значения) 156.48–130.16 мВт/м2, для среды с C. vulgaris без какого-либо освещения Pуд max уменьшилась от 146.64 до 129.07 мВт/м2; результаты представлены в табл. 1.
Таблица 1.
Выходные данные максимальной удельной мощности и максимальной удельной емкости для первых и 113-х суток
| Pуд max, мВт/м2 | Cуд max, мкФ/см2 | |||
|---|---|---|---|---|
| Первые сутки | 113-е сутки | Первые сутки | 113-е сутки | |
| К-фосфатный буфер | 196.97 | 130.79 | 187.36 | 143.27 |
| BBM | 146.64 | 130.49 | 170.73 | 133.36 |
| C. vulgaris + свет | 156.48 | 130.16 | 269.28 | 205.20 |
| C. vulgaris без света | 146.64 | 129.07 | 160.75 | 132.90 |
Емкость ячейки МТЭ определяли исходя из данных, полученных из измерений методом потенциостатической циклической вольтамперометрии. Измерения проводили в диапазоне потенциала от –0.3 до +0.3 В при росте и падении потенциала. В первые сутки эксперимента максимальная удельная емкость Cуд max для ячейки с K‑фосфатным буфером составляла 187.36 мкФ/см2, на 113-е сутки экспериментов Cуд max уменьшалась до 143.27 мкФ/см2. Соответственно, для среды ВВМ изменения составляли 170.73–133.36 мкФ/см2, для среды с C. vulgaris при дополнительном освещении – 269.28–205.20 мкФ/см2, для среды с C. vulgaris без какого-либо освещения – 160.75–132.90 мкФ/см2 (табл. 1).
Из данных по величине емкости видно, что использование в качестве католита среды с микроводорослями C. vulgaris с дополнительным освещением приводит к лучшему результату. Отметим, что в течение длительного времени эксплуатации МТЭ величины емкости каждого варианта ячейки уменьшались на максимальную величину ~23%; в варианте, в котором применяли католит из микроводорослей C. vulgaris без освещения, минимальные изменения составили ~17%.
Стабильные параметры работы МТЭ в течение всего периода, по-видимому, являются результатом образования биопленки на поверхности анода. Это предположение подтверждается фотографиями, полученными на сканирующем электронном микроскопе (СЭМ) (рис. 2). На них видны спаечные образования и колонии, которые оказались зафиксированными на материале анода. Длительный период работы МТЭ говорит о стабильном существовании биопленок на электроде. В то же время динамика состава биопленок требует дальнейшего исследования, так как необходимо установить, остается ли биопленка монокультурой G. oxydans или имеет место контаминация электрода другими микроорганизмами, также способными участвовать во взаимодействиях с электродом.
Рис. 2.
СЭМ-изображения поверхности анода после завершения всех экспериментов с увеличением ×1000 (а) и ×2000 (б).

Интересный эффект, связанный с изменяющейся активностью МТЭ, можно наблюдать для иммобилизованных бактериальных клеток G. oxydans на носителе типа углеродных стержней. Этот эффект проявляется в виде нарастающей активности микробных клеток со временем; время нарастания исчисляется двумя–четырьмя сутками. После такого периода роста наблюдается стабилизация амплитуды тока, которая затем переходит в фазу естественной активности и снижается в процессе функционирования МТЭ. Отметим, что данный эффект наблюдали неоднократно; он описан в [28]. Не исключено, что такой кратковременный рост активности бактериальных клеток также может быть связан с адаптацией бактерий и образованием биопленки. Зависимость тока от фазы жизни биопленки является важным направлением для дальнейших исследований МТЭ, ориентированных на практическое применение.
Таким образом, изученные вариации МТЭ функционировали, выдавая высокие мощности, и показали стабильную работу в течение длительного времени.
ЗАКЛЮЧЕНИЕ
Изучена работа безмембранного безмедиаторного МТЭ с фотокатодом с микроводорослями Chlorella vulgaris с использованием бактерий Gluconobacter oxydans в качестве биокатализатора. Электрохимические измерения показали, что данные варианты МТЭ демонстрируют работоспособность в течение долгого времени эксплуатации (113 дней). Данные СЭМ подтверждают образование биопленок на поверхности анода, что объясняет стабильный результат. Разница мощностных характеристик не сильно заметна для католита с Chlorella vulgaris с освещением и без, возможно, из-за непродолжительности темновой фазы. Дальнейшие исследования будут направлены на увеличение времени темновой фазы и улучшение конструкции топливной ячейки с целью совершенствования работы МТЭ.
Авторы выражают благодарность ресурсному центру электронной и зондовой микроскопии НИЦ “Курчатовский институт”.
Работа выполнена в рамках тематического плана НИЦ “Курчатовский институт” 1.11. “Разработка природоподобных биоэнергетических и гибридных источников энергии для различных областей применения”.
Список литературы
Василов Р.Г., Решетилов А.Н., Шестаков А.И. // Природа. 2013. № 12. С. 65.
Кузьмичева Е.В., Решетов В.А., Казаринов И.А., Игнатов О.В. // Электрохимическая энергетика. 2007. Т. 7. № 1. С. 33.
Ghasemi M., Wan Daud W.R., Ismail M. et al. // Int. J. Hydrogen Energy. 2012. V. 38. P. 5480. https://doi.org/10.1016/j.ijhydene.2012.09.148
Бархатова О.А., Журавлев П.А., Жданова Г.О. и др. // Тез. докл. конф. “Современные тенденции и перспективы развития гидрометеорологии в России” Иркутск: Изд-во ИГУ, 2018. С. 226.
Tardast A., Rahimnejad M., Najafpour G. et al. // Int. J. Environ. Eng. 2012. V. 3. P. 1. https://doi.org/10.5829/idosi.ijee.2012.03.05.01
Plekhanova Y.V., Tarasov S.E., Bykov A.G. et al. // Nanotechnologies in Russia. 2018. V. 13. P. 531. https://doi.org/10.1134/S1995078018050117
Reshetilov A.N., Plekhanova Yu.V., Tarasov S.E. et al. // Appl. Biochem. Microbiol. 2017. V. 53. P. 123. https://doi.org/10.1134/S0003683817010161
Yaqoob A.A., Ibrahim M.N.M., Rafatullah M. et al. // Materials. 2020. V. 13. № 9. P. 2078. https://doi.org/10.3390/ma13092078
Jaiswal K.K., Kumar V., Vlaskin M.S. et al. // J. Water Process. Eng. 2020. V. 38. P. 101549. https://doi.org/10.1016/j.jwpe.2020.101549
Вишневская М.В., Парунова Ю.М., Готовцев П.М., Василов Р.Г. // Вестник биотехнологии и физико-химической биологии имени Ю.А. Овчинникова. 2019. Т. 15. № 4. С. 17.
Fischer F. // Renew. Sust. Energ. Rev. 2018. V. 90. P. 16. https://doi.org/10.1016/j.rser.2018.03.053
Antolini E. // J. Environ. Chem. Eng. 2019. V. 7. P. 103241. https://doi.org/10.1016/j.jece.2019.103241
Taha Amen M., Yasin A.S., Hegazy M.I. et al. // R. Soc. Open Sci. 2021. V. 8. P. 210996. https://doi.org/10.6084/m9.figshare.c.5707013
Gude V.G. // J. Clean. Prod. 2016. V. 122. P. 287. https://doi.org/10.1016/j.jclepro.2016.02.022
Понаморева О.Н. // Естеств. науки. 2009. Т. 1. С. 138.
Somov A., Gotovtsev P., Dyakov A. et al. // 2018 IEEE 4th World Forum on Internet of Things (WF-IoT). (IEEE). 2018. P. 802. https://doi.org/10.1109/WF-IoT.2018.8355172
Решетилов А.Н., Плеханова Ю.В., Тарасов С.В. и др. // Прикладная биохимия и биотехнология. 2017. Т. 53. № 1. С. 115. https://doi.org/10.7868/S0555109917010160
Алферов С.В., Минайчева П.Р., Арляпов В.А. и др. // Прикладная биохимия и микробиология. 2014. Т. 50. № 6. С. 570. https://doi.org/10.7868/S0555109914060026
Vostiar I., Ferapontova E., Gorton L. // Electrochem Commun. 2004. V. 6. P. 621. https://doi.org/10.1016/j.elecom.2004.04.017
Yeh K.-L., Chang J.-Sh. // Bioresour. Technol. 2012. V. 105. P. 120. https://doi.org/10.1016/j.biortech.2011.11.103
Salgueiro J., Pe’rez L., Maceiras R. et al. // Int. J. Environ. Res. 2018. V. 12. P. 765. https://doi.org/10.1007/s41742-018-0129-4
Коновалов М.С., Коновалова Е.Ю., Егорова И.Н. и др. // Изв. вузов. Прикладная химия и биотехнология. 2021. Т 11. № 3. С. 358. https://doi.org/10.21285/2227-2925-2021-11-3-358-371
Oon Y.S., Ong S.A., Ho L.N. et al. // Chem. Eng. J. 2018. V. 344. P. 236. https://doi.org/10.1016/j.cej.2018.03.060
Nawaz A., ul Haq I., Qaisar K. et al. // Process Saf Environ Prot. 2022. V. 161. P. 357. https://doi.org/10.1016/j.psep.2022.03.039
Tarasov S.E., Plekhanova, Yu.V., Kashin V.V. et al. // Biosens. 2022. V. 12. № 9. P. 699. https://doi.org/10.3390/bios12090699
ГОСТ Р 53359-2009. Молоко и продукты переработки молока. Метод определения pH. М.: Стандартинформ, 2009. 3 с.
Девис С., Джеймс А. // Электрохимический словарь. М.: Мир, 1979. С. 184.
Passos V.F., Aquino Neto S., Andrade A.R., Reginatto V. // Sci. Agric. 2016. V. 73. № 5. P. 424. https://doi.org/10.1590/0103-9016-2015-0194
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии