Российские нанотехнологии, 2023, T. 18, № 2, стр. 147-159
Смогут ли наночастицы стать альтернативой антибиотикам
О. И. Большакова 1, Е. А. Михайлова 2, О. О. Жеребятьева 2, И. В. Мирошниченко 2, С. В. Саранцева 1, *
1 Петербургский институт ядерной физики им. Б.П. Константинова НИЦ “Курчатовский институт”
Гатчина, Россия
2 Оренбургский государственный медицинский университет Министерства здравоохранения Российской Федерации
Оренбург, Россия
* E-mail: Sarantseva_SV@pnpi.nrcki.ru
Поступила в редакцию 15.04.2022
После доработки 15.04.2022
Принята к публикации 02.06.2022
Аннотация
Стремительный рост числа возбудителей инфекционных заболеваний, имеющих множественную лекарственную резистентность, в том числе за счет способности бактерий образовывать биопленки, сильно затрудняет лечение целого ряда хронических инфекционных заболеваний и борьбу с внутрибольничными инфекциями. Поэтому особенно актуальным становится поиск новых, альтернативных, ранее не используемых, избирательно действующих препаратов, обладающих достаточной эффективностью против патогенных микроорганизмов и одновременно низкой токсичностью для организма человека. С этой точки зрения наночастицы, в частности углеродные наночастицы, могут стать основой для создания таких препаратов. В обзоре представлен анализ литературных данных о влиянии углеродных наночастиц на бактерии и грибы. Обозначена роль направленной функционализации углеродных наночастиц, которая призвана придать им свойство избирательности с учетом предполагаемых механизмов воздействия на различные микроорганизмы. Рассмотрены некоторые области применения обсуждаемых соединений, в которых они уже сейчас могут конкурировать с антибиотиками.
ОГЛАВЛЕНИЕ
Введение
1. Антимикробная активность углеродных наночастиц. Возможные механизмы
2. Функционализация углеродных наночастиц для усиления антимикробных эффектов
3. Подавление углеродными наночастицами образования биопленок
4. Курация кожных и раневых инфекций с использованием наночастиц углеродной природы
5. Углеродные наночастицы и фотодинамическая терапия в борьбе с патогенными микроорганизмами
Заключение
ВВЕДЕНИЕ
С момента открытия и до сегодняшнего дня углеродные наноматериалы (УНМ) все активнее исследуются для различных биомедицинских целей, таких как визуализация, доставка лекарств, диагностика и лечение заболеваний, в том числе инфекционных. В то же время большой мировой проблемой является возрастающая устойчивость патогенов к антимикробным препаратам, что делает необходимым поиск новых классов соединений, обладающих свойствами антибиотиков. Перспективной стратегией представляется использование наноматериалов (НМ) с антибактериальным характером и наноструктур, проявляющих антиадгезионную активность в отношении биопленок [1]. Уникальные физические и химические свойства НМ обеспечивают их дополнительные преимущества на этом пути. Например, малый размер (1–100 нм) позволяет преодолевать большинство физиологических барьеров и достигать намеченных целей; высокое соотношение площади поверхности к объему увеличивает потенциал взаимодействия с мембранами и клеточными стенками патогенных микроорганизмов [2]. Наиболее широко исследованы антимикробные свойства наночастиц (НЧ) металлов [3–8]. Они могут накапливаться в мембране микроорганизмов, что приводит к изменению ее проницаемости [9], проникать через клеточную стенку и повреждать ДНК и белки [10]. Ионы металлов способны высвобождаться в среду с бактериями [11], индуцировать генерацию активных форм кислорода (АФК), влияющих на жизнеспособность микроорганизмов [12].
При этом НМ на основе углерода: фуллерены, нанотрубки, наноалмазы (НА), графен, оксид графена (ОГ), углеродные точки (УТ), также обладают большими перспективами. Они подавляют рост бактерий и разрушают клетки с помощью сложных механизмов, затрудняя развитие у бактерий лекарственной устойчивости [13]. Углеродные наночастицы (УНЧ) легко прикрепляются к микробным клеткам и влияют на целостность их мембран, метаболизм и структуру [14]. При этом антибактериальные свойства НЧ регулируются модификацией их поверхности. Использование УНЧ при конструировании различных имплантатов, катетеров, протезов, вспомогательных устройств, подверженных риску колонизации микробами, может помочь в борьбе с нозокомиальными инфекциями. Кроме того, НЧ могут применяться в диагностике инфекционных заболеваний и даже как усилители вакцин [15].
Таким образом, исследование УНЧ с позиций применения их антимикробных свойств в биологии и медицине представляет огромный интерес наряду с анализом других их биологических характеристик, таких как антиамилоидогенная, нейропротекторная и противоопухолевая активность [16].
1. АНТИМИКРОБНАЯ АКТИВНОСТЬ УГЛЕРОДНЫХ НАНОЧАСТИЦ. ВОЗМОЖНЫЕ МЕХАНИЗМЫ
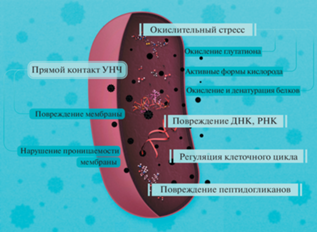
Анализ работ, посвященных антимикробной активности УНМ, свидетельствует о влиянии на этот показатель множества факторов, связанных с размером частиц, их агрегацией, функциональными группами на поверхности (рис. 1), т.е. тех же факторов, с которыми связана токсичность в отношении клеток млекопитающих [17]. Показано, что практически все УНМ способны проявлять антибактериальные свойства, однако их активность сильно зависит от химии поверхности, определяющей такие критические факторы, как гидрофобность или степень окисления [18]. Ингибирование роста бактерий может быть связано с тем, что НЧ беспрепятственно проникают через поры клеточной мембраны, так как их размеры сопоставимы [19]. Например, показано, что токсичность одностенных углеродных нанотрубок (ОСУНТ) в отношении микроорганизмов зависит от размера: при одинаковых концентрациях более длинные из них (больше 5 мкм) эффективно агрегировали с бактериальными клетками и проявляли антимикробную активность сильнее, чем короткие (1–5 мкм) [20]. В [21] продемонстрирована зависимость антибактериального эффекта углеродных нанотрубок (УНТ) от диаметра. ОСУНТ оказались намного более токсичны для Escherichia coli, чем многостенные УНТ (МСУНТ), и этот факт связали с меньшим диаметром первых, поскольку это облегчает их проникновение через клеточную стенку бактерий. В 2007 г. было впервые показано, что механизмом цитотоксичности УНТ является прямое повреждение клеточной мембраны – “прямой контакт” [22], и в настоящее время им объясняют антимикробные эффекты функционализированных различными молекулами УНТ. Например, в [23] сравнивали, как взаимодействуют E. coli с тремя разновидностями МСУНТ. Первые содержали никель, вторые были от него очищены, а третьи после удаления никеля функционализировали молекулами серебра. Наиболее эффективно подавляли рост бактерий последние (на 99.8% за 120 мин), в то время как первые были наименее эффективны. В результате было сделано предположение, что никель препятствует хорошему контакту между бактериями и УНТ, что согласуется с гипотезой прямого контакта. В [24] исследованы ОСУНТ и МСУНТ с различными химическими группами на поверхности и показано, что в отличие от многостенных ОСУНТ с группами –OH, ‒COOH и –NH2 проявляют антимикробную активность как к грамположительным, так и к грамотрицательным бактериальным клеткам. Эта активность возрастала от концентрации препарата (от 50 до 200–250 мкг/мл) и зависела от буфера, в котором его растворяли (активность присутствовала в воде и 0.9%-ном растворе NaCl, но отсутствовала в фосфатно-солевом буфере), и времени воздействия. Таким образом, зарядовый эффект функциональных групп на поверхности УНТ не являлся критическим фактором. В [25] показано, что решающим фактором антибактериального эффекта УНТ является концентрация. Вместе с тем в [26] предложены три основных механизма антимикробной активности УНТ, действующих поэтапно и приводящих к гибели клеток: физическое повреждение мембраны и высвобождение клеточных компонентов, генерация АФК и окислительный стресс (ОС), а также нарушение метаболических путей. Сделано предположение, что на эти процессы влияют факторы, относящиеся к характеристике самих УНТ: диаметр, длина, остатки растворителя, электронная структура, присоединенные функциональные группы, химия поверхности, а также параметры, характеризующие микроорганизмы: тип и морфология, механические свойства поверхности, условия роста.
Фуллерены также рассматриваются как антибактериальные агенты. Большинство биологических эффектов фуллеренов и их производных связаны с уникальными физическими свойствами: формой, размером, способностью сенсибилизировать образование синглетного кислорода после облучения светом [27, 28], а также антиоксидантной активностью. В исследовании [29], проведенном на Salmonella typhi, при помощи компьютерного прогнозирования и молекулярного докинга были определены мишени для лекарственного воздействия и показано, что фуллерен C60 проявил лучшую аффинность к сальмонеллам – мишеням по сравнению с НЧ металлов (ZnO и CuO). Предварительные эксперименты in vitro продемонстрировали, что фуллерен C60 в концентрации 100 мкг/л обладает значительной ингибирующей активностью. Лекарственная устойчивость к этой НЧ отсутствовала.
Между тем данные о противомикробных эффектах фуллеренов противоречивы. Например, в [30] оценивали влияние нативного С60 и его водного раствора на микробные сообщества почвы и показали отсутствие эффекта в обоих случаях. В [31] хорошо очищенные от растворителя водные растворы С60 не ингибировали рост микробов: бактерий и грибов. Однако есть данные о том, что С60 проявляет высокую антимикробную активность против E. coli и Bacillus subtilis в среде с низким содержанием солей, но при этом увеличение концентрации солей в среде привело к снижению этого показателя, так как в таких средах частицы С60 агрегируют и выпадают в осадок [32]. В [33] проанализированы in vitro антимикробные свойства УНЧ, полученных из дымовой сажи и содержащих фуллерен С60. Различные грамположительные (Staphylococcus aureus и Streptococcus pyogenes) и грамотрицательные бактерии (E. coli, Klebsiella pneumonia и Proteus mirabilis) культивировали в питательном бульоне и обрабатывали УНЧ. Показана антибактериальная активность УНЧ для всех этих штаммов, а P. mirabilis ингибировался сильнее, чем стандартным антибиотиком тетрациклином.
Как известно, все УНЧ агрегируют в растворах, и считается, что низкая степень агрегации увеличивает площадь поверхности частиц и облегчает их проникновение в мембрану. В [34] показано, что С60 образует в растворах стабильные агрегаты, на размер которых могут влиять различные параметры, например pН. Отметим, что даже в низких концентрациях С60 оказывал ингибирующее воздействие на прокариотические клетки. В [35] проанализированы четыре стабильные водные суспензии С60, изготовленные разными способами. Агрегаты в каждой из них разделяли по размеру с помощью дифференциального центрифугирования и тестировали на антибактериальную активность с использованием B. subtilis. Все суспензии были токсичны для бактерий, причем в большей степени фракции, содержащие более мелкие агрегаты. При этом увеличение токсичности было непропорционально выше, чем связанное с этим увеличение предполагаемой площади поверхности. В дальнейшем при исследовании возможных механизмов антимикробной активности водных суспензий показано, что у бактерий, подвергнутых их воздействию, не обнаружено продукции АФК и вызванных ими повреждений. Был сделан вывод, что суспензии С60 вызывают у бактерий независимый от АФК окислительный стресс, о котором свидетельствуют окисление белков, нарушение потенциала клеточной мембраны и клеточного дыхания [36, 37]. Важной мишенью для антимикробных препаратов на основе фуллеренов является липидная мембрана патогена. Благодаря высокому сродству к ее внутренней гидрофобной части фуллерены могут накапливаться в липидном бислое и нарушать метаболические процессы, ассоциированные с мембранами [38, 39]. Есть данные о том, что антибактериальные эффекты фуллеренов различны для грамотрицательных и грамположительных бактерий. У первых он связан с уменьшением доли ненасыщенных жирных кислот и увеличением доли циклопропановых жирных кислот в стенке бактериальной клетки. У вторых – с разрушением клеточной стенки, а также изменениями в структуре фосфолипидов и повышенной проницаемостью клеточной мембраны [14]. Еще одним фактором антибактериальной активности является электростатическая сила [14]. Противомикробное действие фуллеренов и их производных усиливается при одновременном облучении видимым и УФ-светом, что обусловлено способностью фуллеренов генерировать АФК под воздействием света.
Сильной цитотоксичностью по отношению к бактериям обладают графен и его производные [40–42]. При исследовании антибактериальной активности четырех типов материалов на основе графена (графита, оксида графита, ОГ и восстановленного ОГ) было обнаружено, что наибольшую антибактериальную активность в отношении кишечной палочки показал ОГ, агрегаты которого имели наименьший средний размер в сравнении с остальными материалами. Кроме того, показано, что к гибели бактерий приводит прямой контакт наноматериала с клеточной стенкой микроба, а также ОС, возникающий, в частности, за счет окисления глутатиона, который служит медиатором окислительно-восстановительного состояния у бактерий [43]. Согласно [44] кроме прямого повреждения мембраны в антибактериальном эффекте графена могут участвовать деструктивная экстракция молекул липидов и химическое повреждение, вызванное ОС с образованием АФК и переносом заряда. Графен часто используется в разработках, связанных с поиском новых материалов и гибридных покрытий для различных биомедицинских устройств. Его применение уменьшает риски развития инфекций, чему способствуют такие характеристики графена, как большая площадь поверхности, высокая стабильность в физиологической среде, хорошая биосовместимость, простота модификации. Механизм антимикробного эффекта этого НМ определяется повреждением мембран бактерий при физико-химическом взаимодействии [45].
Наноалмазы также обладают бактерицидной активностью. Их антибактериальные свойства наименее изучены по сравнению с другими УНЧ, однако исследования активно продолжаются. Например, в [46] оценивали антибактериальный потенциал детонационных наноалмазов (ДНА) в отношении грамотрицательных (E. сoli) и грамположительных (B. Subtilis) прокариотов. Были исследованы ДНА размером 5, 18, 25 и 50 нм в концентрациях от 20 до 5000 мкг/мл. Показано, что антибактериальная активность зависит не только от концентрации, но и от размера и формы частиц. Наиболее сильный (100%) ингибирующий эффект против E. coli проявляли неизмененные 5 нм НА в конечной концентрации 100 мкг/мл, а более крупные НА даже в высоких концентрациях действовали значительно слабее. Реакция грамположительных бактерий B. subtilis была иной: более эффективными против них оказались НА размером 18, 25 и 50 нм и окисленные НА размером 5 нм. Эти различия предположительно связаны с разной морфологией клеточных стенок у грамположительных и грамотрицательных бактерий. В случае грамположительных клеток крупные кластеры НА нарушают проницаемость плотного пептидогликанового слоя гидрофобной и отрицательно заряженной поверхности бактерий, а соответственно, и транспорт питательных веществ через него. Напротив, у грамотрицательных бактерий с НА взаимодействует липополисахаридная часть наружной мембраны, что позволяет проникать в периплазму более мелким частицам. При этом в работе не нашел объяснения факт уменьшения размера колоний B. subtilis при воздействии частиц всех размеров. Для исследования механизмов антибактериального эффекта НА размером 5 нм в отношении E. coli в [47] использовали УФ-спектроскопию и спектроскопию комбинационного рассеяния, а также сканирующую электронную микроскопию. Показано, что НА прикрепляются к клеточной стенке и разрушают ее. Предполагается, что в этом случае разрушается липополисахаридный защитный слой, предохраняющий бактерии от осмотических перепадов, в клетку поступает избыток воды, и она гибнет. Отметим, что именно внешняя мембрана грамотрицательных бактерий делает их устойчивыми к антибиотикам и некоторым антимикробным средствам. В то же время в [48] не наблюдали никаких повреждений мембраны бактерий при взаимодействии с НА, но обнаружили уменьшение количества колоний. Предположили, что эффект связан с бактериостатическими свойствами и агрегационным поведением НА и предложили следующий механизм: если НА прикрепляются к стенке бактерии в достаточной концентрации, то они препятствуют размножению клеток в колониях, но в то же время сами НА способствуют формированию более крупных кластеров бактерий, в результате чего число бактерий, способных формировать отдельные колонии, уменьшается. В [49] исследовали способность НА убивать уропатогенную кишечную палочку не напрямую, а в инфицированных ею клетках мочевого пузыря in vitro (линия Т24). Показано, что НА диаметром 6 нм при концентрации 200 мкг/мл проявляют в таком эксперименте высокую антибактериальную активность. Меченые FITC частицы через 2 ч после введения в культуру были обнаружены внутри клеток, в частности в эндоцитарных везикулах. Количество бактерий внутри клеток снижалось. Предполагается, что “интернализованные 6 нм НА могут вызывать сигнальные и генные изменения, такие как ОС, регуляция клеточного цикла и воспаление для ингибирования выживания кишечной палочки в эндосомах и при ее попадании в цитозоль” [49]. В [15] представлены многочисленные факты бактерицидной активности НА и возможные механизмы этого явления: деформация бактериальной стенки вследствие поглощения большого количества наноалмазов и ОС, связанный с тем, что НА содержат частично окисленные поверхности. Кроме того, представлены данные о том, что бактерицидные свойства НА, как и других УНЧ, зависят от типа бактерий, концентрации, времени воздействия и других факторов.
Описана антибактериальная активность и других УНМ. Показано, что углеродные наносферы эффективно убивают грамположительные бактерии в минимальной ингибирующей концентрации 2.0–5.0 мкг/мл. Кроме того, в инфицированных макрофагах эти частицы избирательно инактивировали бактерии, в то время как макрофаги оставались нетронутыми [50]. Углеродные точки, которые характеризуются простотой производства и функционализации, а также высокой диспергируемостью в водных растворах и хорошей биосовместимостью, тоже проявляют антимикробную активность [13]. Общая схема механизмов антимикробной активности УНЧ представлена на рис. 2.
Большой интерес вызывают фунгицидные свойства УНЧ как с точки зрения борьбы с грибковыми инфекциями, так и с точки зрения экологической опасности, ведь УНМ получают все большее распространение. В [51] протестированы МСУНТ, фуллерен С60 и восстановленный ОГ на противогрибковую активность против серой плесени (Botrytis cinerea) растений. Все НЧ обладали свойствами фунгицидов. В статье приведены другие примеры фунгицидной активности восстановленного ОГ, УНТ и фуллерена С60, а также описаны возможные механизмы этого явления: прямое воздействие на мембрану клеток или накопление АФК в клетках грибов за счет нарушения антиоксидантной защиты. В [52] изучали влияние нативного фуллерена С60 и карбоксилированного С60–СООН в отношении грибка белой гнили Phanerochaete chrysosporium. Было показано, что ни C60, ни C60–COOH не влияли на свежую массу гриба. При этом оба препарата нарушали структуру его мицелия: он становился короче и толще. Однако это наблюдалось только при использовании низких доз препаратов. Кроме того, С60–СООН блокировал ферментативную активность гриба, т.е. функционализированный фуллерен был более токсичным. При этом механизмы токсичности были различны: если агрегаты С60 прикреплялись к клеткам гриба и наблюдалось отслоение клеточной стенки, то С60–СООН не повреждал ее, но увеличивал неселективную проницаемость мембран, и внутри цитоплазмы наблюдались везикулы, содержащие мелкие частицы. Нарушение ферментативной активности связывают с тем, что взаимодействие белок–фуллерен, которое зависит от функционализаци последнего, приводит к конформационным изменениям и потере активности фермента. Оксид графена воздействует на P. chrysosporium несколько иначе: низкие концентрации стимулируют рост гриба, а высокие приводят к разрушению волокон мицелия и потере его ферментативной активности [53]. В [54] было проанализировано влияние фуллерола C60(OH)24 в концентрациях 10, 100 и 1000 нг/мл на рост мицелия, продукцию афлатоксина и модуляцию ОС у штамма Aspergillus flavus (NRRL 3251), продуцирующего афлатоксин. Фуллеренол немного снижал массу мицелия, но значительно уменьшал концентрацию афлатоксина в среде за счет подавления в клетках грибов ОС, способствующего продукции микотоксинов.
Вместе с тем есть данные о том, что УНЧ могут оказывать негативное воздействие, снижая, например, антибактериальные и противовирусные функции пептида LL-37, который активируется в местах инфекции и воспаления и рассматривается как одна из основных врожденных защитных молекул против бактериальной и вирусной инфекции [55]. Было показано, что взаимодействие пептида с НЧ сажи ведет к значительному изменению его структуры.
Таким образом, знание закономерностей взаимодействия НЧ с биомолекулами, клетками и микроорганизмами при их накоплении в межклеточном пространстве, на поверхности и внутри клеток даст возможность модернизировать их так, чтобы НЧ оказалась наиболее токсичной для выбранной группы микроорганизмов и наименее токсичной для окружающих тканей, т.е. приобрела свойство избирательности. Это приведет к возможности создавать на основе УНЧ противомикробные препараты, способные модифицировать биологические свойства микроорганизмов, в том числе их способность к биопленкообразованию и экспрессии факторов вирулентности и персистенции.
2. ФУНКЦИОНАЛИЗАЦИЯ УГЛЕРОДНЫХ НАНОЧАСТИЦ ДЛЯ УСИЛЕНИЯ АНТИМИКРОБНОГО ЭФФЕКТА
Функционализация УНЧ необходима для создания на их основе действительно эффективных антимикробных препаратов, способных конкурировать с современными антибиотиками и не обладающих их недостатками. “Разработка бактерицидных наночастиц требует рационального дизайна частиц, эффективного синтетического подхода и понимания их биосовместимости и токсичности” [56]. Для усиления антимикробных свойств УНЧ функционализируют с помощью различных химических групп, конъюгируют с углеводами, белками, пептидами и антибиотиками, создают сложные комплексы с полимерами.
Например, в [57] продемонстрировано, что эффективность НА в отношении грамположительных и грамотрицательных бактерий сильно зависит от состава поверхности НЧ и ее заряда. Комплекс С60 с поли-N-винилпирролидоном был более эффективен в генерации синглетного кислорода (1O2) и супероксида (${\text{O}}_{2}^{ - }$), чем водная суспензия фуллерена. Его антибактериальная активность, связанная с генерацией АФК, была выше [58]. Конъюгированные с различными полимерами УНТ проявляют не только сильную антимикробную, но и антиадгезивную активность. При этом токсичность таких комплексов в отношении микроорганизмов сохраняется, но в то же время они защищают клетки от неспецифической адсорбции белка [26]. Кроме того, функционализация поверхности НЧ может препятствовать их агрегации, т.е. увеличивать бактерицидные свойства. Так, с помощью функционализации НА катионными полимерами удалось не только добиться хорошей дисперсионной стабильности, но и придать им антибактериальные свойства. На изображениях, полученных с помощью электронного микроскопа, было видно, что частицы функционализированных НА прикрепляются к клеточной стенке E. сoli и разрушают ее вследствие образования наноотверстий [59]. Впоследствии было предложено использовать функционализированные поликатионами НА в качестве наполнителя для стоматологических смол. Твердость, прочность и упругость у вновь полученных образцов были выше, чем у контрольных. Они обладали низкой цитотоксичностью по отношению к макрофагам, при этом высокой антибактериальной активностью против Streptococcus mutans и антиадгезивными свойствами [60]. В [26] приводятся примеры функционализации УНТ, при которой усиление взаимодействия с микроорганизмами приводит к лучшим антибактериальным эффектам.
В [61] описано несколько стратегий превращения НЧ в терапевтические агенты. Во-первых, это функционализация небольшими молекулами с определенным зарядом, позволяющими прикрепляться к клеточной стенке бактерий и избирательно инактивировать их. Во-вторых, стабилизация полимерами, в частности катионными полимерами, которые, связываясь с отрицательно заряженной поверхностью бактерий, разрушают ее. В-третьих, объединение с биомолекулами и антимикробными пептидами.
Функционализация УНЧ биоактивными молекулами увеличивает биосовместимость с макроорганизмом. При этом сохраняется их антимикробная эффективность. Например, функционализированные пиперазином или дофамином МСУНТ показали значительную антибактериальную активность против таких штаммов, как S. aureus и Micrococcus luteus [62]. Биосовместимость НЧ наряду с их антимикробными эффектами может быть обеспечена покрывающими их поверхность белками [57].
Важными компонентами живых организмов являются углеводы. Они играют заметную роль в таких биологических процессах, как межклеточная коммуникация, вирусные и бактериальные инфекции, воспаление и иммунные реакции. Поэтому большими перспективами для борьбы с патогенными микроорганизмами обладают наноструктуры, модифицированные гликаном. Гликоконъюгаты фуллерена и глико/НА показали в экспериментах хорошую антибактериальную активность [1].
Ионы металлов благодаря неспецифическому механизму действия проявляют высокую антимикробную активность и могут быть использованы для функционализации УНЧ [63, 64]. В [65] проведен анализ бактерицидных свойств нанокомпозитов, состоящих из ОСУНТ и оксида меди (CuO), с использованием стандартных методов анализа и показано, что нанокомпозиты CuO–ОСУНТ обладают лучшими антимикробными характеристиками, чем чистый CuO в отношении S. aureus и E. сoli. Еще одним примером может быть работа [66], в которой сравниваются антимикробные свойства МУНТ, обработанных кислотой (МУНТ–COOH) и функционализированных серебром и медью (Ag–МУНТ, Cu–МУНТ) в отношении E. coli. Последние были более эффективны (97 и 75% погибших клеток соответственно против 20% для МУНТ–COOH). В [67] был исследован эффект включения наночастиц ZnO в твердые покрытия из алмазоподобного углерода (АУ) и его зависимость от pН. Сам АУ биосовместим и не токсичен. Основной вопрос этой работы сформулирован так: “Могут ли эти функционализированные поверхности разумно реагировать на инфекции, выделяя ионы цинка в зависимости от фактической потребности”. Было показано, что по сравнению с контролем, представленным только для АУ, покрытие ZnO алмазоподобного углерода сильно снижало бактериальную адгезию. Антимикробная активность зависела от pН. В обзоре [14] отмечено, что при функционализации очень важен синергический эффект и приводятся примеры работ, где он продемонстрирован. Большая часть из них – это исследование комплексов УНЧ с металлами. Важно, что гибридизация УНЧ с металлами может быть использована не только для прямого усиления антимикробного эффекта, но и для фотодинамической терапии (ФДТ), а также визуализации [68, 69]. Однако ионы металлов могут быть токсичны для эукариотических клеток. Поэтому необходимо создавать такие комплексы, в которых их вредное воздействие будет снижено, а бактерицидные свойства сохранятся.
Очень эффективными могут быть комплексы УНЧ с антимикробными препаратами, в которых наблюдается синергический эффект, позволяющий бороться со множественной лекарственной устойчивостью [70].
Таким образом, направленная функционализация имеет огромное значение для обеспечения хорошей селективности в отношении прокариотических клеток и придания НЧ свойства избирательности.
3. ПОДАВЛЕНИЕ УГЛЕРОДНЫМИ НАНОЧАСТИЦАМИ ОБРАЗОВАНИЯ БИОПЛЕНОК
Образование микроорганизмами биопленок является огромной проблемой, так как они демонстрируют повышенную устойчивость к классическим антибиотикам и другим антимикробным агентам [71]. Биопленки – это многоклеточные агрегаты, объединенные внеклеточным матриксом, состоящим из вырабатываемых самими микроорганизмами биополимеров. Он представляет собой сложную трехмерную структуру, в которой присутствуют экзополисахариды, белки, нуклеиновые кислоты, и необходим, в первую очередь, для защиты клеток от механических нагрузок. В процессе развития меняются состав биопленки, соотношение клеток к матрице и соотношение компонентов матрикса. В зрелых биопленках клетки или кластеры клеток отделяются от нее и колонизируют другие доступные поверхности [72]. Клетки, входящие в состав биопленки, из-за измененной физиологии в 1000 раз менее чувствительны к антибиотикам, чем их планктонные аналоги. Кроме того, матрикс биопленки является диффузионным барьером для антибиотиков, а кислая внутренняя среда может инактивировать лекарства, снижая их эффективность [73]. Бактерии адаптируются к жизни на границе раздела твердое тело–жидкость благодаря их способности использовать жгутики, пили, экзополисахариды и другие скрепляющие компоненты. Поэтому разрушение матрикса, который может составлять до 90% биопленок, является одним из подходов для борьбы с ними [74]. В цитируемой работе считают, что преимущество НЧ в этой борьбе определяется присущим им высоким соотношением площади поверхности к объему и предлагают следующую цепочку взаимодействия НЧ с биопленками: транспорт к границе раздела биопленка–жидкость, прикрепление к поверхности биопленки, миграция внутрь биопленки. В работе подробно описано, как взаимодействуют НЧ с компонентами биопленки, образуя белковую корону на своей поверхности, и перечислены основные физико-химические факторы, определяющие взаимодействие НЧ с биопленкой: электростатические, гидрофобные и стерические. Согласно [71], агенты для борьбы с биопленками должны обладать способностью влиять на целый ряд факторов, таких как адгезия, межклеточные взаимодействия, агрегация бактерий, их уничтожение, модуляция иммунного ответа хозяина. Все это могут осуществлять УНЧ (рис. 3).
Рис. 3.
Основные механизмы взаимодействия УНЧ с биопленкой, приводящие к ее гибели: а – механизмы воздействия, б – этапы формирования биопленки.
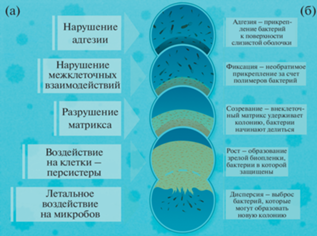
Считается, что НЧ попадают в биопленку посредством диффузии, однако на этот процесс оказывают влияние их размер и химический состав поверхности. Например, показано, что присутствие карбоксилатных или сульфатных групп может вызывать общий отрицательный заряд биопленок. В [75] приводятся данные о том, что и отрицательно, и положительно заряженные НЧ могут проникать в биопленку. Но если отрицательно заряженные частицы направляются к кластерам бактериальных клеток, то положительно заряженные взаимодействуют с внеклеточными ДНК-подобными структурами в биопленке. Однако точной картины того, каким образом НЧ взаимодействуют с биопленкой, до сих пор нет. Между тем эспериментальные данные свидетельствуют о перспективности использования УНЧ в этом направлении. В [76] была исследована активность функционализированных серой НЧ фуллерена против биопленок Pseudomonas aeruginosa, а также их влияние на экспрессию гена экзотоксина A. Показано, что подавление образования биопленок происходит при концентрации препарата 1 мг/мл, а уничтожение уже сформированных – при концентрациях в 2 и 4 мг/мл, что подтверждено данными сканирующей электронной микроскопии. Экспрессия экзотоксина A также подавлялась в присутствии препарата. В [77] показана роль НА в подавлении роста биопленок, а также разрушении уже сформированных грибами (C. albicans и C. glabrata) и бактериями (S. mutans и P. gingivalis), которые, как известно, вызывают заболевания полости рта у человека. Кроме того, была исследована роль НА в регуляции экспрессии генов, ответственных за адгезию и формирование биопленки, и показано, что эти НЧ предотвращают образование биопленки, в том числе, путем подавления экспрессии генов. Таким образом, в этом случае работает комбинация электростатического отталкивания и регуляции экспрессии генов, а не летальное воздействие на микробные клетки. Уже сформированные биопленки оказались чрезвычайно устойчивы. Например, обработка C. albicans НА в концентрации, в 3 раза превышающей ингибирующую для планктонной культуры, уничтожила лишь ~50% биомассы пленки. При этом кратковременное воздействие НА (1 ч) показало повышенную гибель и снижение биомассы биопленки, чем продолжительное (24 ч). Этот парадоксальный эффект связали с тем, что клетки-персистеры, оставшиеся после часовой обработки, могут повторно заселять биопленку. В [78] описаны графеновые покрытия, действующие как носители, способные к замедленному высвобождению усниновой кислоты и таким образом обеспечивающие долгосрочную защиту от колонизации бактериальными патогенами S. aureus и S. epidermidis и от образования биопленки. Альтернативной антибиотикам стратегией снижения инфекций, связанных с кишечной палочкой, является ингибирование адгезии, опосредованной фактором адгезии FimH [79]. Показано, что частицы НА, модифицированные фрагментами маннозы, могут эффективно ингибировать опосредованную FimH адгезию E. coli к эукариотическим клеткам. Кроме того, модифицированные НА уменьшали образование биопленок E. сoli. Комплексы НА с маннозой использовали и в работе [80], где обнаружили эффективность разрушения биопленки при помощи НА, конъюгированных с тритиоманнозидным кластером. Кроме того, такие комплексы ингибировали адгезию E. coli к дрожжевым клеткам и клеткам мочевого пузыря Т24. В обзоре [1] приведены и другие примеры антимикробной активности НА, модифицированных сахарами. Метод, с помощью которого антибиотики амоксициллин и ампициллин были загружены на поверхность НА, предложен в [81]. Затем такие НЧ иммобилизировали в слое оксида титана, и после обработки титановые поверхности проявляли сильную антимикробную активность по отношению к E. сoli. Наночастицы обладают способностью усиливать проникновение противомикробных агентов в более глубокие области биопленки, поэтому они могут быть использованы в комплексе с традиционными антибиотиками для повышения эффективности последних, обеспечивая адресную доставку к клеткам бактерий и увеличивая локальную концентрацию препарата вокруг них [74, 82].
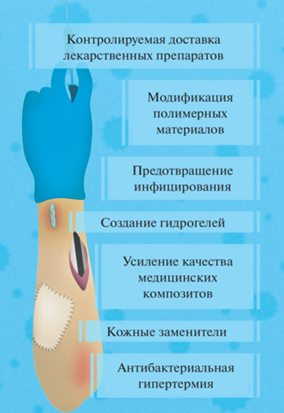
4. КУРАЦИЯ КОЖНЫХ И РАНЕВЫХ ИНФЕКЦИЙ С ИСПОЛЬЗОВАНИЕМ НАНОЧАСТИЦ УГЛЕРОДНОЙ ПРИРОДЫ
Хронические раневые инфекции напрямую связаны с образованием микробных биопленок. Согласно имеющимся данным именно образование биопленки служит их началом. Основными факультативно-аэробными возбудителями кожно-раневых инфекций являются золотистый стафилококк (S. aureus), синегнойная палочка (P. aeruginosa), эпидермальный стафилококк (S. epidermidis), Enterococcus spp. При нормальных условиях с ними успешно борется иммунная система хозяина. Однако при неблагоприятных обстоятельствах на поверхности раны развивается биопленка, которая препятствует фагоцитарной активности макрофагов и нейтрофилов, стимулируя производство веществ, инактивирующих лейкоциты [75]. Существуют различные стратегии использования НЧ в борьбе с такими инфекциями (рис. 4). Это и контролируемая доставка лекарственных препаратов, связанная с улучшением проникновения их через пленку, и применение антибактериальной гипертермиии, основной принцип которой – вызвать необратимые повреждения клеток микроорганизмов с помощью тепловой энергии, полученной от активации НЧ внешним источником энергии [75]. Заживлению ран может способствовать использование кожных заменителей, представляющих собой фибробласты, выращенные на специальных подложках. Для этих целей могут быть использованы УНТ, представляющие собой хорошую платформу для роста клеток и обладающие антибактериальной активностью. Модификация их, например, коллагеном или оксидом железа усиливает эти свойства [63]. Наноалмазы также можно использовать для создания платформ для размножения клеток. Например, был сконструирован нановолоконный каркас на основе поли-(ε-капролактона) с диспергированными в нем НА, который не проявлял токсичности к клеткам яичников китайского хомячка, а напротив, увеличивал их пролиферацию. В то же время S. aureus продемонстрировал значительно меньшее сродство к поверхности каркаса. Предполагается, что подобные каркасы можно использовать в комплексной терапии ран [83]. При лечении ран и различных кожных заболеваний НА могут усилить как качество, так и активность применяемых в этих случаях композитов, так как они способны улучшать транспорт и эффективность лекарственных средств. Такие гибридные материалы могут включать в себя также биополимеры, такие как полиэтиленгликоль, хитозан или бактериальную целлюлозу. Композиты НЧ/полимеры представляют собой альтернативу антибиотикам, поскольку обладают лучшими антиадгезионными свойствами против бактерий и их защитных барьеров, таких как биопленки [84]. В этой же работе приводятся примеры исследований, демонстрирующих, что комплексы, в состав которых помимо антимикробных препаратов входят НА и различные полимеры, обеспечивают более длительное высвобождение лекарства, т.е. продолжительное бактерицидное действие, уменьшая при этом цитотоксичность. В [85] показано, что ОГ в составе комплекса с полиэтиленгликолем и антимикробным пептидом способствовал ускоренному заживлению кожных ран и уменьшению количества S. aureus в них по сравнению с контролем. В то же время известно, что полимеры, которые используются для изготовления различных имплантов и биомедицинских устройств, способствуют развитию бактериальных инфекций, при этом снижается восприимчивость бактерий к фармакологическим средствам [86]. Одной из стратегий борьбы с кожно-раневыми инфекциями могут быть предупреждение и предотвращение инфицирования раны. Известно, что на адгезию бактерий влияют свойства полимерной поверхности: шероховатость, химический состав. Модификация полимерных материалов, используемых в лечении ран, с помощью УНЧ может придать им бактерицидные свойства. В частности, в обзоре [14] приведены многочисленные примеры нанокомпозитов полимеров и УНЧ, обладающих антимикробными свойствами. Так, пленка фуллерен/полистирол в отличие от чистого полистирола показала бактериостатический эффект в отношении S. aureus, E. coli и C. albicans. Нанокомпозит ОГ/CuO/поли-L-лизин проявил бактерицидные свойства против E. coli и S. aureus, обеспечив уровень летальности 99.9% наряду с длительной антибактериальной активностью. Высокие бактериостатические свойства имели композиты полиуретан/ОГ/полиэтиленамин, ОГ/поливинил-N-карбазол и УНТ/полилизин. Различные композиты УНЧ с хитозаном, циклодекстрином, лизоцимом сдерживали рост бактерий и грибов. В приведенной работе можно ознакомиться с исследованиями антимикробных свойств гидрогелей, содержащих УНЧ, которые также могут успешно применяться для лечения заболеваний кожи.
5. УГЛЕРОДНЫЕ НАНОЧАСТИЦЫ И ФОТОДИНАМИЧЕСКАЯ ТЕРАПИЯ В БОРЬБЕ С ПАТОГЕННЫМИ МИКРООРГАНИЗМАМИ
Такие свойства НЧ, как фото- и магнитная активация, предоставляют им преимущества перед традиционными антибиотиками. При многих локализованных инфекциях пероральные или системно доставляемые антибиотики не особенно эффективны либо потому, что бактерии заражают ткань, которая недостаточно перфузирована, либо потому, что бактерии присутствуют в ткани в виде биопленки и их восприимчивость к антибиотикам резко снижена [87]. В этом случае эффективным может быть ФДТ-метод, в котором сочетание нетоксичного фотосенсибилизатора (ФС) и видимого света приводит в присутствии кислорода к образованию цитотоксических веществ. ФДТ может быть эффективным методом лечения локализованных инфекций. Преимуществами этого метода инактивации многих известных классов микроорганизмов являются избирательность и минимальная инвазивность, низкий риск возникновения побочных эффектов, а также возможность многократного повторного применения. Поскольку механизм действия основан на неспецифических окислительных повреждениях биомолекул (липидов, белков и нуклеиновых кислот) в клеточной мембране или внутри клеток активными формами кислорода, ФДТ не вызывает развития устойчивости со стороны целевых микроорганизмов и эффективна для любых штаммов патогенов, в том числе характеризующихся множественной антибиотикорезистентностью [88, 89]. Селективность по отношению к окружающим клеткам млекопитающих зависит от структуры ФС и от светового интервала, поскольку поглощение света в клетках млекопитающих происходит медленнее относительно бактерий [90]. Однако проблемой ФДТ является то, что существует фундаментальная разница в восприимчивости к ней между грамположительными и грамотрицательными бактериями. Показано, что большинство известных ФС более эффективно в отношении грамположительных бактерий [87]. Поиск новых веществ, эффективных для использования в ФДТ, ведется постоянно. Потенциально для этих целей можно рассматривать практически все УНЧ: нанотрубки, фуллерены, графены и другие. Установлено, что фуллерены способны под воздействием света генерировать АФК, вызывающие пероксидное окисление липидов биологических мембран. Это делает перспективным использование данных наночастиц в ФДТ, в том числе для борьбы с патогенными микроорганизмами [91]. На нескольких экспериментальных модельных системах in vitro было показано, что C60 и его производные могут специфически расщеплять ДНК или просто быть высокотоксичными при УФ-облучении [27]. Наиболее интересен в этом плане разработанный не так давно наноматериал – углеродные точки – благодаря своей светостойкости, нетоксичности не только in vitro, но и in vivo, а также простоте производства и функционализации поверхности [89]. Углеродные точки представляют собой небольшие УНЧ со средним диаметром 10 нм, функционализированные органическими молекулами, которые легко активируются видимым светом. При этом совместное их применение с известными ФС, например метиленовым синим или толуидиновым синим, дает синергический эффект, что может быть связано как с фотодинамическими эффектами, так и с образованием АФК [92]. На клетках E. coli показано, что обработка УТ в сочетании с облучением видимым светом снижает их жизнеспособность [93].
Было обнаружено, что включение ДНА в комплекс с металлофталоцианинами, содержащими цинк или индий, способствовало не только улучшению растворимости наноконъюгатов, но и большей эффективности антимикробной ФДТ против S. aureus, так как присутствующие на поверхности ДНА функциональные группы улучшали связь комплекса с бактериальной клеткой [94]. Наноконъюгаты таких комплексов с хитозаном и серебром вызвали еще более эффективное уничтожение как планктонных клеток, так и биопленок S. аureus [95]. В [96] конъюгация с ДНА и НЧ серебра увеличивала антибактериальный и антипленочный эффект порфиринов (облучение в течение 30 мин при длине волны возбуждения 415 нм) в отношении S. aureus со множественной лекарственной устойчивостью. Кроме того, в комплексах с УНЧ улучшаются растворимость ФС, их дисперсное состояние и стабильность [82].
Традиционная ФДТ может применяться для лечения раневых инфекций, однако ее эффективность в биопленке сильно снижена по сравнению с планктонными бактериями [76]. Считается, что активность ФДТ в отношении биопленок связана с ингибированием способности микроорганизмов прилипать к поверхностям, разрушением структур биопленок, повреждением некоторых органелл и индукцией секреции факторов вирулентности [85]. Описанные ранее свойства УНЧ позволяют повысить эффективность ФДТ. Наночастицы могут служить векторами для доставки ФС внутрь биопленки, при этом участвовать в разрушении матрикса. Они способны обеспечить селективность ФС, предотвращая повреждение клеток хозяина, необходимую скорость высвобождения препарата и правильную дозиметрию света [75].
ЗАКЛЮЧЕНИЕ
Использование УНЧ открывает новые возможности для противомикробной терапии. Однако не следует забывать, что нет единого мнения об их токсичности и не в полной мере исследован метаболизм в макроорганизме. Известно, например, что наночастицы удаляются из ткани преимущественно фагоцитарной системой, но процесс их взаимодействия с клетками, в том числе иммунными, изучен недостаточно. Существуют и ограничения, связанные с производством УНЧ, в том числе экономические. При этом применение антибиотиков также несет в себе риски и его трудно назвать безопасным. К тому же в отличие от антибиотиков к УНЧ, согласно исследованиям, не вырабатывается резистентность. В настоящее время уже существуют области, где использование УНЧ представляется целесообразным и при рациональном применении практически безопасным. Это курация кожных заболеваний, раневых и ожоговых инфекций, производство различных имплантов, катетеров, перевязочных и упаковочных материалов, стерилизация поверхностей и др. В этих случаях УНЧ могут принести ощутимую пользу и имеют преимущества перед традиционными антибиотиками. Новые исследования способствуют расширению этих перспектив.
Авторы выражают благодарность А.М. Павлову за помощь в создании иллюстраций.
Работа выполнена в рамках государственного задания по теме “Изучение молекулярных и клеточных компонентов патогенеза социально-значимых заболеваний для разработки методов ранней диагностики и лечения” (регистрационный номер № 121060200125-2) и при частичной поддержке Российского фонда фундаментальных исследований (грант № 18-29-19008).
Список литературы
Szunerits S., Barras A., Boukherroub R. // Int. J. Environ. Res. Public Health. 2016. V. 13. № 4. P. 413. https://doi.org/10.3390/ijerph13040413
Blecher K., Nasir A., Friedman A. // Virulence. 2011. V. 2. № 5. P. 395. https://doi.org/10.4161/viru.2.5.17035
Wang C., Singh P., Kim Y.J. et al. // Artif. Cells Nanomed. Biotechnol. 2016. V. 44. № 7. P. 1714. https://doi.org/10.3109/21691401.2015.1089253
Khashan K.S., Sulaiman G.M., Abdul Ameer F.A., Napolitano G. // Pak. J. Pharm. Sci. 2016. V. 29. № 2. P. 541.
Khashan K.S., Sulaiman G.M., Abdulameer F.A., Napolitano G. // Arab. J. Sci. Eng. 2016. V. 41. № 1. P. 301.
Михайлова Е.А., Миронов А.Ю., Фомина М.В. и др. // Клиническая лабораторная диагностика. 2017. Т. 62. № 6. C 381. https://doi.org/10.18821/0869-2084-2017-62-6-381-384
Gharpure S., Ankamwar B. // J. Nanosci. Nanotechnol. 2020. V. 20. № 10. P. 5977. https://doi.org/10.1166/jnn.2020.18707
Gharpure S., Akash A., Ankamwar B. // J. Nanosci. Nanotechnol. 2020. V. 20. № 6. P. 3303. https://doi.org/10.1166/jnn.2020.17677
Díaz-Visurraga J., Gutiérrez C., Plessing C., Garcia A. // Science against microbial pathogens: communicating current research and technological advances. Badajoz: Editora Formatex Research Center, 2011. P. 210.
Huang Z., Zheng X., Yan D. et al. // Langmuir. 2008. V. 24. № 8. P. 4140. https://doi.org/10.1021/la7035949
Kasemets K., Ivask A., Dubourguier H.-C. et al. // Toxicol. In Vitro. 2009. V. 23. № 6. P. 1116. https://doi.org/10.1016/j.tiv.2009.05.015
Kashan K., Saleem J. // Curr. Pharm. Biotechnol. 2018. V. 19. № 7. P. 523. https://doi.org/10.2174/1389201019666180731121401
Anand A., Unnikrishnan B., Wei S.-C. et al. // Nanoscale Horiz. 2018. V. 4. № 1. P. 117. https://doi.org/10.1039/c8nh00174j
Azizi-Lalabadi M., Hashemi H., Feng J., Jafari S.M. // Adv. Colloid Interface Sci. 2020. V. 284. https://doi.org/10.1016/j.cis.2020.102250
Torres Sangiao E., Holban A.M., Gestal M.C., Gestal M.C. // Materials. 2019. V. 12. № 10. P. 1639. https://doi.org/10.3390/ma12101639
Большакова О.И., Слободина А.Д., Саранцева С.В. // Российские нанотехнологии. 2022. Т. 17. № 2. С. 148.
Большакова О.И., Слободина А.Д., Саранцева С.В. // Российские нанотехнологии. 2022. Т. 17. № 2. 158.
Maas M. // Materials. 2016. V. 9. № 8. P. 617. https://doi.org/10.3390/ma9080617
Dadi R., Azouani R., Traore M. et al. // Mater. Sci. Eng. C. 2019. V. 104. P. 109968. https://doi.org/10.1016/j.msec.2019.109968
Yang C., Mamouni J., Tang Y., Yang L. // Langmuir. 2010. V. 26. № 20. P. 16013. https://doi.org/10.1021/la103110g
Kang S., Herzberg M., Rodrigues D.F., Elimelech M. // Langmuir. 2008. V. 24. № 13. P. 6409. https://doi.org/10.1021/la800951v
Kang S., Pinault M., Pfefferle L.D., Elimelech M. // Langmuir. 2007. V. 23. № 17. P. 8670. https://doi.org/10.1021/la701067r
Akhavan O., Abdolahad M., Abdi Y., Mohajerzadeh S. // J. Mater. Chem. 2010. V. 21. № 2. P. 387. https://doi.org/10.1039/C0JM02395G
Arias L.R., Yang L. // Langmuir. 2009. V. 25. № 5. P. 3003. https://doi.org/10.1021/la802769m
Dong L., Henderson A., Field C. // J. Nanotechnol. 2011. V. 2012. P. e928924. https://doi.org/10.1155/2012/928924
Teixeira-Santos R., Gomes M., Gomes L.C., Mergulhão F.J. // iScience. 2021. V. 24. № 1. P. 102001. https://doi.org/10.1016/j.isci.2020.102001
Moussa F. // [60] Fullerene and derivatives for biomedical applications Nanobiomaterials Nanostructured Materials for Biomedical Applications / Ed. Narayan R. Woodhead Publishing, 2018. P. 113. https://doi.org/10.1016/B978-0-08-100716-7.00005-2
Bosi S., Da Ros T., Spalluto G., Prato M. // Eur. J. Med. Chem. 2003. V. 38. № 11. P. 913. https://doi.org/10.1016/j.ejmech.2003.09.005
Skariyachan S., Parveen A., Garka S. // J. Biomol. Struct. Dyn. 2017. V. 35. № 16. P. 3449. https://doi.org/10.1080/07391102.2016.1257441
Tong Z., Bischoff M., Nies L. et al. // Environ. Sci. Technol. 2007. V. 41. № 8. P. 2985. https://doi.org/10.1021/es061953l
Hadduck A.N., Hindagolla V., Contreras A.E. et al. // Appl. Environ. Microbiol. 2010. V. 76. № 24. P. 8239. https://doi.org/10.1128/AEM.01925-10
Lyon D.Y., Fortner J.D., Sayes C.M. et al. // Environ. Toxicol. Chem. 2005. V. 24. № 11. P. 2757. https://doi.org/10.1897/04-649r.1
Aloysius C., Varghese A.A., Pattekkal Ali S. et al. // IET Nanobiotechnol. 2019. V. 13. № 3. P. 316. https://doi.org/10.1049/iet-nbt.2018.5183
Fortner J.D., Lyon D.Y., Sayes C.M. et al. // Environ. Sci. Technol. 2005. V. 39. № 11. P. 4307. https://doi.org/10.1021/es048099n
Lyon D.Y., Adams L.K., Falkner J.C. et al. // Environ. Sci. Technol. 2006. V. 40. № 14. P. 4360. https://doi.org/10.1021/es0603655
Lyon D.Y., Alvarez P.J.J. // Environ. Sci. Technol. 2008. V. 42. № 21. P. 8127. https://doi.org/10.1021/es801869m
Lyon D.Y., Brunet L., Hinkal G.W. et al. // Nano Lett. 2008. V. 8. № 5. P. 1539. https://doi.org/10.1021/nl0726398
Сироткин А.К., Пиотровский Л.Б., Познякова Л.Н., Киселев О.И. // Вопросы биологической, медицинской и фармацевтической химии. 2005. № 3. С. 21.
Tsao N., Luh T.-Y., Chou C.-K. et al. // J. Antimicrobial Chemother. 2002. V. 49. № 4. P. 641. https://doi.org/10.1093/jac/49.4.641
Akhavan O., Ghaderi E. // ACS Nano. 2010. V. 4. № 10. P. 5731. https://doi.org/10.1021/nn101390x
Hu W., Peng C., Luo W. et al. // ACS Nano. 2010. V. 4. № 7. P. 4317. https://doi.org/10.1021/nn101097v
Li J., Wang G., Zhu H. et al. // Sci Rep. 2014. V. 4. № 1. P. 4359. https://doi.org/10.1038/srep04359
Liu S., Zeng T.H., Hofmann M. et al. // ACS Nano. 2011. V. 5. № 9. P. 6971. https://doi.org/10.1021/nn202451x
Ji H., Sun H., Qu X. // Adv. Drug Deliv. Rev. 2016. V. 105. P. 176. https://doi.org/10.1016/j.addr.2016.04.009
Pandit S., Gaska K., Kádár R., Mijakovic I. // Chem. Phys. Chem. 2021. V. 22. № 3. P. 250. https://doi.org/10.1002/cphc.202000769
Beranová J., Seydlová G., Kozak H. et al. // FEMS Microbiol. Lett. 2014. V. 351. № 2. P. 179. https://doi.org/10.1111/1574-6968.12373
Chatterjee A., Perevedentseva E., Jani M. et al. // J. Biomed. Opt. 2014. V. 20. № 5. P. 051014. https://doi.org/10.1117/1.JBO.20.5.051014
Norouzi N., Ong Y., Damle V.G. et al. // Mater. Sci. Eng. C. 2020. V. 112. P. 110930. https://doi.org/10.1016/j.msec.2020.110930
Iyer J.K., Dickey A., Rouhani P. et al. // PLoS One. 2018. V. 13. № 1. P. e0191020. https://doi.org/10.1371/journal.pone.0191020
Jiang Y.-W., Gao G., Zhang X. et al. // Nanoscale. 2017. V. 9. № 41. P. 15786. https://doi.org/10.1039/c7nr04679k
Hao Y., Cao X., Ma C. et al. // Front. Plant. Sci. 2017. V. 8. P. 1332. https://doi.org/10.3389/fpls.2017.01332
Ming Z., Feng S., Yilihamu A. et al. // Nanomaterials (Basel). 2018. V. 8. № 2. P. 120. https://doi.org/10.3390/nano8020120
Xie J., Ming Z., Li H. et al. // Chemosphere. 2016. V. 151. P. 324. https://doi.org/10.1016/j.chemosphere.2016.02.097
Kovač T., Šarkanj B., Klapec T. et al. // Environ. Sci. Pollut. Res. 2017. V. 24. № 20. P. 16673. https://doi.org/10.1007/s11356-017-9214-z
Findlay F., Pohl J., Svoboda P. et al. // J. Immunol. 2017. V. 199. № 7. P. 2483. https://doi.org/10.4049/jimmunol.1700706
Turcheniuk K., Mochalin V.N. // Nanotechnology. 2017. V. 28. № 25. P. 252001. https://doi.org/10.1088/1361-6528/aa6ae4
Wehling J., Dringen R., Zare R.N. et al. // ACS Nano. 2014. V. 8. № 6. P. 6475. https://doi.org/10.1021/nn502230m
Brunet L., Lyon D.Y., Hotze E.M. et al. // Environ. Sci. Technol. 2009. V. 43. № 12. P. 4355. https://doi.org/10.1021/es803093t
Cao W., Peng X., Chen X. et al. // J. Mater. Sci. 2016. V. 4. № 52. P. 1856. https://doi.org/10.1007/s10853-016-0475-6
Cao W., Zhang Y., Wang X. et al. // J. Mater. Sci.: Mater Med. 2018. V. 29. № 10. P. 162. https://doi.org/10.1007/s10856-018-6172-z
Gupta A., Mumtaz S., Li C.-H. et al. // Chem. Soc. Rev. 2019. V. 48. № 2. P. 415. https://doi.org/10.1039/c7cs00748e
Hussain S., Mahmood Ansari T., Sahar H. et al. // Micro Nano Lett. 2020. V. 15. № 15. P. 1105. https://doi.org/10.1049/mnl.2020.0114
Khashan K.S., Sulaiman G.M., Mahdi R. // Artif. Cells. Nanomed. Biotechnol. 2017. V. 45. № 8. P. 1699. https://doi.org/10.1080/21691401.2017.1282498
Khashan K.S., Jabir M.S., Abdulameer F.A. // Mater. Res. Express. 2018. V. 5. № 3. P. 035003. https://doi.org/10.1088/2053-1591/aab0ed
Sapkota K.P., Hassan Md.M., Shrestha S. et al. // Int. J. Pharm. 2020. V. 590. P. 119937. https://doi.org/10.1016/j.ijpharm.2020.119937
Mohan R., Shanmugharaj A.M., Sung Hun R. // J. Biomed. Mater. Res. B: Appl. Biomater. 2011. V. 96B. № 1. P. 119. https://doi.org/10.1002/jbm.b.31747
Buchegger S., Kamenac A., Fuchs S. et al. // Sci. Rep. 2019. V. 9. № 1. P. 17246. https://doi.org/10.1038/s41598-019-53521-7
Lebedev V.T., Kulvelis Yu.V., Peters G.S. et al. // Fuller. Nanotub. Carbon Nanostructures. 2021. https://doi.org/10.1080/1536383X.2021.1993443
Lebedev V.T., Török G., Kulvelis Yu.V. et al. // Soft Mater. 2021. https://doi.org/10.1080/1539445X.2021.1992425
Munir M.U., Ahmed A., Usman M., Salman S. // Int. J. Nanomed. 2020. V. 15. P. 7329. https://doi.org/10.2147/IJN.S265934
Hemmati F., Rezaee M.A., Ebrahimzadeh S. et al. // Mol. Biotechnol. 2021. V. 63. № 7. P. 569. https://doi.org/10.1007/s12033-021-00325-8
Pandit S., Fazilati M., Gaska K. et al. // Int. J. Mol. Sci. 2020. V. 21. № 18. P. 6755. https://doi.org/10.3390/ijms21186755
Fulaz S., Devlin H., Vitale S. et al. // Int. J. Nanomed. 2020. V. 15. P. 4779. https://doi.org/10.2147/IJN.S256227
Fulaz S., Vitale S., Quinn L., Casey E. // Trends Microbiol. 2019. V. 27. № 11. P. 915. https://doi.org/10.1016/j.tim.2019.07.004
Kim M.-H. // IEEE Trans. Nanobiosci. 2016. V. 15. № 3. P. 294. https://doi.org/10.1109/TNB.2016.2527600
Darabpour E., Doroodmand M.M., Halabian R., Fooladi A.A.I. // Microb. Drug Resist. 2019. V. 25. № 4. P. 594. https://doi.org/10.1089/mdr.2018.0008
Zhang T., Kalimuthu S., Rajasekar V. et al. // Biomater. Sci. 2021. V. 9. № 15. P. 5127. https://doi.org/10.1039/d1bm00608h
Pandit S., Rahimi S., Derouiche A. et al. // Sci. Rep. 2021. V. 11. № 1. P. 9956. https://doi.org/10.1038/s41598-021-89452-5
Barras A., Martin F.A., Bande O. et al. // Nanoscale. 2013. V. 5. № 6. P. 2307. https://doi.org/10.1039/c3nr33826f
Khanal M., Larsonneur F., Raks V. et al. // Nanoscale. 2015. V. 7. № 6. P. 2325. https://doi.org/10.1039/c4nr05906a
Krok E., Balakin S., Jung J. et al. // Nanotechnology. 2020. V. 31. № 20. P. 205603. https://doi.org/10.1088/1361-6528/ab6d9b
Zhang K., Li X., Yu C., Wang Y. // Front. Cell. Infect. Microbiol. 2020. V. 10. P. 359. https://doi.org/10.3389/fcimb.2020.00359
Houshyar S., Kumar G.S., Rifai A. et al. // Mater. Sci. Eng. C. 2019. V. 100. P. 378. https://doi.org/10.1016/j.msec.2019.02.110
Bondon N., Raehm L., Charnay C. et al. // J. Mater. Chem. B. 2020. V. 8. № 48. P. 10878. https://doi.org/10.1039/d0tb02221g
Mei D., Guo X., Wang Y. et al. // Int. J. Nanomed. 2021. V. 16. P. 4769. https://doi.org/10.2147/IJN.S304702
Speranza G., Gottardi G., Pederzolli C. et al. // Biomaterials. 2004. V. 25. № 11. P. 2029. https://doi.org/10.1016/j.biomaterials.2003.08.061
Hamblin M.R., Hasan T. // Photochem. Photobiol. Sci. 2004. V. 3. № 5. P. 436. https://doi.org/10.1039/b311900a
Dai T., Tegos G.P., Zhiyentayev T. et al. // Lasers Surg. Med. 2010. V. 42. № 1. P. 38. https://doi.org/10.1002/lsm.20887
Dong X., Liang W., Meziani M.J. et al. // Theranostics. 2020. V. 10. № 2. P. 671. https://doi.org/10.7150/thno.39863
Hamblin M.R. // Expert. Rev. Anti. Infect. Ther. 2017. V. 15. № 11. P. 1059. https://doi.org/10.1080/14787210.2017.1397512
Hamblin M.R. // Curr. Opin. Microbiol. 2016. V. 33. P. 67. https://doi.org/10.1016/j.mib.2016.06.008
Dong X., Bond A.E., Pan N. et al. // Int. J. Nanomed. 2018. V. 13. P. 8025. https://doi.org/10.2147/IJN.S183086
Meziani M.J., Dong X., Zhu L. et al. // ACS Appl. Mater. Interfaces. 2016. V. 8. № 17. P. 10761. https://doi.org/10.1021/acsami.6b01765
Openda Y., Nyokong T. // Photodiagnosis Photodyn. Ther. 2020. V. 32. https://doi.org/10.1016/j.pdpdt.2020.102072
Openda Y.I., Matshitse R., Nyokong T. // Photochem. Photobiol. Sci. 2020. V. 19. № 10. P. 1442. https://doi.org/10.1039/d0pp00075b
Openda Y.I., Ngoy B.P., Nyokong T. // Front. Chem. 2021. V. 9. P. 97. https://doi.org/10.3389/fchem.2021.628316
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии