Российские нанотехнологии, 2023, T. 18, № 2, стр. 160-185
Наночастицы на основе металлов для диагностики, терапии и профилактики вирусных инфекций
О. В. Захарова 1, 2, 3, И. А. Васюкова 1, А. А. Гусев 1, 2, 3, *
1 Тамбовский государственный университет им. Г.Р. Державина
Тамбов, Россия
2 Национальный исследовательский технологический университет “МИСИС”
Москва, Россия
3 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
* E-mail: nanosecurity@mail.ru
Поступила в редакцию 25.05.2022
После доработки 25.05.2022
Принята к публикации 06.06.2022
Аннотация
Вирусные инфекции ежегодно являются причиной смерти нескольких миллионов человек и наносят значительный ущерб мировой экономике. Существующие методы диагностики и борьбы с вирусами не всегда эффективны, поэтому перспективнвна разработка новых методов, основанных на последних научных достижениях. Рассмотрены потенциальные возможности применения нанотехнологических подходов в обнаружении и терапии вирусных инфекций, а также для антивирусной вакцинации. Наиболее часто используемыми в этом направлении являются наночастицы (НЧ) золота, серебра, оксида цинка, диоксида титана, магнитные НЧ на основе оксида железа, а также НЧ, содержащие медь, олово, индий, никель и платину. При этом активно используются уникальные оптические, электрические, фотокаталитические и магнитные свойства НЧ. Высокая проникающая способность и поверхностная активность, облегчающая функционализацию, являются ключевыми преимуществами НЧ для использования в качестве основы для систем адресной доставки противовирусных препаратов и вакцин. Наконец, размер НЧ идентичен размеру вирусов, что позволяет использовать их для прямого ваимодействия с вирусными частицами, включая конкурентное осаждение вирусов на поверхности частиц особой формы и селективный захват вирусов магнитными частицами. Представлен анализ результатов новых исследований, направленных на оценку потенциала применения НЧ, включая золото, серебро и оксиды железа, для диагностики и борьбы с вирусом SARS-CoV-2, вызвавшего пандемию COVID-19. Приведены многочисленные примеры эффективного использования НЧ на основе благородных и переходных металлов в условиях лабораторных экспериментов для диагностики и терапии, а также для разработки вакцинацин против вирусных инфекций, что указывает на перспективность использования нанотехнологических подходов в этих сферах. Однако следует принимать во внимание потенциальные риски, связанные с использованием НЧ и наноматериалов в непосредственном контакте с организмом человека.
ОГЛАВЛЕНИЕ
Введение
1. Диагностика вирусов
2. Противовирусная активность
3. Вакцины
4. Металлические наночастицы для диагностики и терапии COVID-19
Заключение
ВВЕДЕНИЕ
Согласно данным ВОЗ ежегодно от вирусных инфекций умирает несколько миллионов человек [1–3]. Расчетные данные ВОЗ показывают, что число случаев смерти, прямо или косвенно связанных с пандемией COVID-19 (описанных как “избыточная смертность”) в период с 1 января 2020 г. по 31 декабря 2021 г., составило ~14.9 миллиона [4].
Вирус – неклеточный инфекционный агент, не способный размножаться вне клетки-хозяина. Вирусы делятся на ДНК-вирусы и РНК-вирусы, в зависимости от того, используют они ДНК или РНК для репликации, хотя некоторые, например мимивирусы, имеют оба типа молекул [5]. Обычно инфицированная клетка погибает, но есть вирусы, которые не убивают клетки, а изменяют их функции. Присутствие вирусных генов вызывает неконтролируемую пролиферацию, и клетка становится раковой [6].
Вирусы вызывают как привычные инфекционные заболевания (грипп, аденовирусные инфекции, энтеровирусные инфекции и др.), так и тяжелые заболевания, такие как ВИЧ/СПИД, оспа и Эбола. Некоторые вирусы, например гепатиты В и С, могут вызывать хронические инфекции [7, 8].
Диагностика вирусов осуществляется различными способами. Распространенные вирусные инфекции, такие как ветряная оспа, краснуха или корь, могут быть диагностированы по специфическим симптомам. В случае инфекций, возникающих при эпидемиях, необходим лабораторный анализ для идентификации различных вирусов, вызывающих сходные симптомы, таких как COVID-19 (SARS-CoV2) и грипп. Могут быть сделаны анализы крови на наличие антител или антигенов. Кроме того, вирусы из образцов крови и других биологических жидкостей или иных материалов могут быть выращены в клеточной культуре [9]. Также для идентификации вирусов используются методы полимеразной цепной реакции (ПЦР) [10, 11]. Еще одним методом анализа биологических образцов на наличие вируса является метод электронной микроскопии [12, 13].
Для многих вирусных инфекций нет специальных методов лечения, однако имеются препараты для борьбы с вирусом гриппа, герпесвирусами, а также значительное количество новых противовирусных средств для терапии ВИЧ, гепатитов С, В и вируса Эбола [14–16]. Многие противовирусные препараты работают, препятствуя репликации вирусов. Поскольку вирусы реплицируются внутри клеток, используя их метаболические функции, существует ограниченное количество таких функций, на которые могут нацеливаться противовирусные препараты. Кроме того, большинство противовирусных препаратов обычно эффективно против только одного или очень немногих вирусов. Противовирусные препараты могут быть токсичными для клеток человека, а вирусы могут развить устойчивость к противовирусным препаратам [17–20].
Вакцинация является эффективным методом ликвидации вирусных инфекций, приводящих к эпидемиям. Однако вакцины могут стать неэффективными, когда вирус мутирует, поэтому решение этой проблемы является приоритетной задачей для исследователей.
Среди различных стратегий борьбы с инфекционными заболеваниями нанотехнологии имеют значительный потенциал, подтверждаемый большим числом исследований, показывающих высокую эффективность наночастиц (НЧ) против бактерий [21–26], вирусов [27–33] и грибов [34–36].
НЧ обладают уникальными физическими свойствами, с которыми связана их противовирусная эффективность. Прежде всего это маленький размер, который влияет на биодоступность, большое отношение площади поверхности к объему, что обеспечивает эффективную функционализацию терапевтическими препаратами, а также переменный поверхностный заряд, облегчающий проникновение через отрицательно заряженную клеточную мембрану [37–40]. Более того, НЧ могут проявлять биомиметические свойства, приводящие к собственным противовирусным эффектам [41].
Помимо изучения противовирусной активности НЧ имеется значительное число работ, показывающих перспективность наноматериалов для диагностики вирусных инфекций [42–44].
В данном обзоре рассмотрены потенциальные возможности применения нанотехнологических подходов в диагностике и терапии вирусных инфекций, а также для антивирусной вакцинации.
1. ДИАГНОСТИКА ВИРУСОВ
Благодаря последним достижениям нанотехнологий наноматериалы вызвали большой интерес в области обнаружения вирусов, что привело к созданию различных биосенсоров и тест-систем на основе новых функциональных НЧ [45–52].
В биосенсорах, используемых для диагностики вируса, наноматериалы отвечают за иммобилизацию целевых биомолекул, катализ электрохимических реакций, усиление переноса электронов, а также маркировку биомолекул или реагентов [53].
Наночастицы золота. Первые сообщения о применении наноматериалов для обнаружения вирусов датируются концом 1990-х гг. [54] – НЧ Au были применены для обнаружения вируса папилломы человека (ВПЧ) в клетках рака шейки матки. Отметим, что НЧ Au легко визуализируются, образуют стабильные и высокоактивные конъюгаты с молекулами-мишенями, такими как ДНК и белки, что позволяет применять их в качестве маркирующих агентов в клинической диагностике [55, 56]. Одно из первых исследований в XXI веке, посвященное обнаружению вирусов гепатита В и С с помощью НЧ, было проведено в Уханьском университете Китая [57]. В работе использовалась модель сэндвич-гибридизации на основе НЧ Au для обнаружения ДНК-мишени в сыворотках крови пациентов с использованием “генных чипов”. В случае детекции вирусов НЧ Au используются преимущественно для оптической передачи сигнала при обнаружении вируса: усилении цвета [58, 59], резонансном светорассеянии [60–62] и усилении или подавлении флуоресценции [63–65].
В [66] предложен метод сверхчувствительного колориметрического иммуноанализа для выявления вирусов гриппа с использованием НЧ Au. Показана возможность обнаружения вируса гриппа A (H1N1) и клинически изолированного вируса гриппа A (H3N2). Чувствительность предлагаемого способа не снижалась даже в сложных биологических средах по сравнению с обычным иммуноферментным анализом (ИФА). Также были получены наногибриды Au CNT, состоящие из НЧ Au и углеродных нанотрубок (УНТ), обладающие повышенной пероксидазоподобной активностью, что позволяет использовать их в качестве части высокочувствительного колориметрического теста на вирус гриппа A (H3N2). При наличии вируса гриппа A в тест-системе, содержащей специфические конъюгированные с антителами наногибриды Au CNT Au–TMB–H2O2, наблюдается темно-синий цвет, оптическая плотность которого зависит от концентрации вируса [67]. Схожий метод детекции был продемонстрирован для норовирусоподобных частиц в сыворотке человека [68], однако в данном случае, в наногибридную систему входил графен вместо нанотрубок.
Метод, основанный на агрегации зондов из НЧ Au, функционализированных гликаном на вирусной поверхности, которая обеспечивается связыванием вируса со специфическими гликанами, позволяет дифференцировать штаммы вируса гриппа, включая основные подтипы, циркулирующие в популяциях человека и птиц [69, 70].
В [71] была разработана платформа для сэндвич-анализа, включающая в себя комплекс аптамер–белок–антитело, сформированный на поверхности, для получения высокоселективного и чувствительного амперометрического определения вирусных белков H5N1 с использованием модифицированного электрода из НЧ Au.
В [72] предложен безлигандный способ обнаружения вируса с использованием НЧ Au. Обнаружено, что маннитол может агрегировать преимущественно вирус, оставляя белки в растворе. Парвовирус свиней инкубировали с НЧ Au, агрегацию комплекса парвовирус-Au с маннитолом определяли с помощью динамического рассеяния света (ДРС). Самая низкая определяемая концентрация парвовируса составила 106 МТТ50 на мл, что ниже, чем при стандартных анализах на антитела.
В [73] предложена система латерального проточного иммуноанализа на основе НЧ Au различных размеров (рис. 1), которая позволила обнаружить 500 нг/мл антигена гепатита B (HBsAg) в цельной крови, что было сопоставимо с коммерчески доступным тестом HBsAg.
Рис. 1.
Схема иммунохроматографической тест-системы для выявления антигена HBsAg и фотографии результатов испытаний тест-сисем на основе НЧ Au различного размера (адаптировано из [73]).

Для количественной оценки поверхностного HBsAg в крови использовался биосенсор из золотых наностержней, основанный на явлении локализованного поверхностного плазмонного резонанса. В [74] удалось обнаружить концентрации HBsAg – 0.1 МЕ/мл.
Таким образом, НЧ Au являются самым распространенным агентом для систем обнаружения вирусов. Однако в перспективе не исключается использование других НЧ [75].
Наночастицы серебра. НЧ Ag пластинчатой формы, обладающие различными цветовыми характеристиками (30 нм – оранжевые, 41 нм – красные и 47 нм – зеленые), были конъюгированы с антителами для распознавания белка NS вируса денге, белка NS1 вируса желтой лихорадки и гликопротеина вируса Заира Эбола [76]. Предел обнаружения для биомаркеров каждого вируса составил 150 нг/мл в одном канале.
Иммуносенсор с пределом обнаружения 1 × × 10–13 г/мл был сконструирован для вируса гриппа A (H1N1) на основе антител, меченных НЧ Ag с непрямой флуоресценцией [77]. Маркировку антител осуществляли путем ковалентного связывания Ag–S. Вирус гриппа A (H1N1) действовал как антиген-мишень при использовании ИФА сэндвич-типа. Меченые антителами Ag-агенты высвобождались кислотой для получения ионов серебра Ag+, которые катализировали окисление о-фенилендиамина, в результате чего детектор регистрировал флуоресценцию.
В [78] описан колориметрический тест на бумажном носителе для обнаружения вирусной ДНК, основанный на агрегации НЧ Ag, индуцированной пирролидинилпептидной нуклеиновой кислотой (acpcPNA). Образование анионного дуплекса ДНК–acpcPNA в присутствии ДНК-мишени приводит к диспергированию наносеребра в результате электростатического отталкивания, вызывая детектируемое изменение цвета. Предел обнаружения теста для коронавируса MERS-CoV составил 1.53 нM, для ВПЧ – 1.03 нM.
Магнитные наночастицы (МНЧ). НЧ, обладающие магнитными свойствами, представляют большой интерес при разработке методов диагностики вирусных инфекций, что подтверждается значительным количеством публикаций [79–91]. Разрабатываемые сенсоры показывают высокую специфичность и пределы обнаружения. Так, диагностическая платформа, основанная на конъюгации спейсеров с МНЧ, показала предел обнаружения 0.5 пМ для вируса гепатита В [79]. Электрически активные МНЧ, состоящие из мономера анилина, полимеризованного вокруг ядер γ-Fe2O3, стали основой биосенсора для обнаружения поверхностного гликопротеинового гемагглютинина вируса гриппа А H5N1 [83]. Экспериментально установлено, что сенсор способен обнаруживать рекомбинантный гемагглютинин в концентрации 1.4 мкМ.
Детекция вируса простого герпеса (ВПГ) 1 с использованием суперпарамагнитных шариков, покрытых антигенными пептидами, показала селективное обнаружение вируса при концентрациях до 200 вирусных частиц на миллилитр менее чем за 30 мин [84]. Разработан метод, позволяющий специфически выявлять аденовирус-5 и ВПГ-1 в концентрациях пять вирусных частиц на 10 мкл [85]. Суть метода заключается в способности монодисперсных МНЧ, конъюгированных со специфичными антителами, самоорганизовываться в присутствии вирусных частиц, создавая супрамолекулярные структуры с улучшенными магнитными свойствами (рис. 2).
Рис. 2.
Самоорганизация МНЧ в присутствии специфических вирусных частиц и количественная оценка содержания вирусных частиц в аналите (адаптировано из [85]).

Чувствительные к магнитной релаксации НЧ использовались для изучения и количественного определения взаимодействий клетки-хозяина с вирусом Зика [86]. Показано, что наибольшим сродством к белку оболочки вируса обладает рецептор AXL, при этом рецепторы HSP70, TIM-1 и фосфатидилсерин также могут играть активную роль в тропизме к вирусу Зика, что, по-видимому, дает потенциальное объяснение разнообразию ассоциированных с ним симптомов.
МНЧ Fe3O4 функционализировали вирусными антителами H5N2, нацеленными на белок гемагглютинин, и покрывали метил-концевым этиленгликолем для подавления неспецифического связывания [87]. Конъюгированные МНЧ обладали высокой специфичностью к вирусу H5N2 без перекрестной реактивности с рекомбинантными вирусами H5N1. Однозначная идентификация захваченного гемагглютинина на МНЧ была проведена с помощью электрофореза белков по Лэммли (SDS-PAGE) и идентификации пептидной последовательности с использованием жидкостной хроматографии с тандемной масс-спектрометрией.
В [88] были разработаны тесты для обнаружения взаимодействия между онкогеном E6-ВПЧ 16 (вовлечен в механизмы канцерогенеза ВПЧ) и МНЧ. Сравнивали выходы ПЦР-амплификации онкогена Е6-ВПЧ 16, сорбированного на МНЧ после элюирования с частиц. Больший выход ДНК Е6-ВПЧ 16 был получен с МНЧ за счет уменьшения интерферентов по сравнению со стандартным методом ПЦР. Таким образом, биосенсор, основанный на выделении онкогена Е6-ВПЧ 16 при помощи МНЧ с последующим его электрохимическим обнаружением, может быть очень эффективным методом идентификации ВПЧ. В [89] использовали МНЧ в качестве носителей HBsAg для быстрой магнитной сепарации. Полученный сенсор хорошо работал даже в присутствии мешающих веществ, обладал высокой специфичностью и пределом обнаружения на 0.1 нг/мл ниже, чем предел 0.5 нг/мл для ИФА. В [90] использовали парамагнитные НЧ для захвата амплифицированной ДНК вируса гепатита В и последующего обнаружения присутствия или отсутствия ДНК с помощью катодной стриппинг-вольтамперометрии. Использование парамагнитных частиц позволило снизить неспецифические взаимодействия и повысить чувствительность методики.
Сенсорная платформа, включающая в себя сразу два типа наночастиц (МНЧ и НЧ Au), показала более низкий предел обраружения целевой ДНК вируса гепатита В (3.1 ± 0.1 × 10–13 М) по сравнению с пределом обнаружения, показанным только для НЧ золота или МНЧ [91].
Другие наночастицы. В [92] обсуждалась роль НЧ оксида церия и функционализированного платиной оксида церия в обнаружении вируса гриппа, а также сообщалось об усиленном электрохимическом иммуносенсоре на основе 1-нафтола и платины/оксида церия/оксида графена. Использование НЧ европия в платформе микрочипов для обнаружения антигена p24 ВИЧ 1 позволило добиться предела обнаружения 5 пг/мл при соотношении сигнал/пустой сигнал – 1.5 [93].
В [94] обсуждалось обнаружение ВИЧ 1 и вирусоподобных частиц в диапазоне от 600 фг/мл до 375 пг/мл с использованием стеклянного электрода, покрытого оксидом индия и олова, модифицированного НЧ Au. В [95] был изготовлен полевой транзисторный ДНК-сенсор для обнаружения вируса гепатита В на основе нанопроволок из оксида индия и олова. Биосенсор показал высокую степень специфичности для дифференциации комплементарных последовательностей от некомплементарных и несовпадающих олигонуклеотидов. В [96] описано включение композита состава кремниевые нанопроволоки/НЧ Au в качестве чувствительного материала для обнаружения ДНК на предметном стекле с покрытием из оксида индия и олова. Нанокомпозит был дополнительно исследован в качестве матрицы для иммобилизации зонда ДНК при обнаружении вируса денге. Изготовленный биосенсор был чувствителен к ДНК-мишени, связанной с вирусом денге, в диапазоне 9.0–178.0 нг/мл с пределом обнаружения 3.5 нг/мл.
Таким образом, имеется значительное число работ, где описываются диагностические системы, основанные на НЧ металлов или оксидов металлов. Так, успешно используются НЧ золота, серебра, МНЧ оксида железа, оксида индия и олова, оксида церия, платины. Описанные диагностические системы показывают высокую чувствительность и хорошие характеристики сигнал/шум в ходе детекции таких вирусов, как ВПЧ, гепатита В и С, гриппа (H5N1, H5N2, H3N2), эболавирус, вирус желтой лихорадки, MERS-CoV, ВИЧ 1, аденовирус 5, ВПГ 1, вирус Зика, вирус денге. Принцип работы наносенсоров основан либо на детекции нуклеиновых кислот вируса, либо на реакции связывания вирусных антигенов с антителами, конъюгированными с НЧ. В обоих типах сенсоров НЧ отвечают за дальнейшую передачу информации об аналите, которая распространяется по оптическому, электрическому или магнитному каналу.
В табл. 1 приведен перечень проанализированных наноустройств и даны их важнейшие характеристики.
Таблица 1.
Сравнительная эффективность наноструктурных вирусных сенсоров
| Состав сенсора | Детектируемый вирус | Принцип работы | Предел обнаружения | Литера-тура |
|---|---|---|---|---|
| НЧ Au–УНТ, модифицированные антителами к вирусам | Вирусы гриппа A (H1N1) и клинически изолированного (H3N2) | Колориметрическое обнаружение, ИФА | 10 пг/мл для H1N1 и 10 бляшкообразующих единиц (БОЕ)/мл для H3N2 | [66] |
| НЧ Au–УНТ, модифицированные антителами к вирусу гриппа A | Вирус гриппа A (H3N2) | Колориметрическое обнаружение, ИФА | 3.4 БОЕ/мл | [67] |
| Графен–НЧ Au, модифицированные антителами к норовирусу | Норовирусоподобные частицы (NoV-LP) | Колориметрическое обнаружение, ИФА | 92.7 пг/мл | [68] |
| НЧ Au–аптамер/ белок H5N1/антитело H5N1-ALP | Вирус гриппа A (H5N1) | Амперометрическое обнаружение, ИФА | 100 фмоль | [71] |
| НЧ Au в среде, содержащей маннитол | Парвовирус свиней, вирус-возбудитель вирусной диареи крупного рогатого скота | Безлигандное обнаружение вируса с использованием агрегации НЧ Au методом ДРС | 106 и 104 ЦПД50 (MTT50)/мл | [72] |
| НЧ Au, модифицированные антителами к вирусу гепатита В | Вирус гепатита В | Латеральный проточный иммуноанализ | 100 нг/мл | [73] |
| Наностержни Au, модифицированные моноклональным поверхностным антителом | Вирус гепатита В | Электрохимическое обнаружение, ИФА | 0.01–1 МЕ/мл | [74] |
| НЧ Ag, модифицированные антителами | Вирус денге, вирус желтой лихорадки и вирус Эбола | Латеральный проточный иммуноанализ | 150 нг/мл | [76] |
| НЧ Ag, модифицированные антителами | Вирус гриппа A (H1N1) | Хемилюминесцентное обнаружение, ИФА | 1.0 × 10–13 г/мл | [77] |
| НЧ Ag, модифицированные ДНК-зондами | Коронавирус ближневосточного респираторного синдрома (MERS-CoV), ВПЧ | Колориметрическое обнаружение, ДНК-анализ | 1.53 нмоль (MERS-CoV) и 1.03 нмоль (ВПЧ) | [78] |
| Карбоксиметилированный глюкан–МНЧ, модифицированные ДНК-зондами | Вирус гепатита В | Хемилюминесцентное обнаружение, ДНК-анализ | 0.5 пмоль | [79] |
| НЧ Fe2O3, покрытые анилиновым мономером, модифицированные антителами | Вирус гриппа A (H5N1) | Циклическая вольтамперометрия, ИФА | 1.4 мкмоль | [83] |
| МНЧ, модифицированные антителами к вирусам | Аденовирус 5 и ВПГ 1 | ЯМР-обнаружение, ИФА | 5 вирусных частиц/10 мкл | [85] |
| МНЧ, модифицированные антителами | Вирус гриппа A (H5N1) | Жидкостная хроматография с тандемной масс-спектрометрией, ИФА | 103 ЭИД50/мл | [87] |
| МНЧ, функционализированные аптамерами ДНК против поверхностного антигена гепатита B | Вирус гепатита В | Хемилюминесцентное обнаружение, магнитная сепарация, ДНК-анализ | 0.1 нг/мл | [89] |
| МНЧ НЧ Au, функционализированные ДНК-зондами | Вирус гепатита В | Импедансометрическое обнаружение, ДНК-анализ | 3.1 ± 0.1 × 10–13 моль | [91] |
| Нанокомпозит Pt/GO/CeO2, модифицированный антителами | Вирус гриппа | Электрохимичесое обнаружение, ИФА | 0.43 мкг/л | [92] |
| Электрод, покрытый оксидом индия и олова и НЧ Au, модифицированных антителами | ВИЧ | Электрохимическое обнаружение, ИФА | 600 фг/мл–375 пг/мл | [94] |
| Нанопроволоки из In2O3 и Sn, модифицированные ДНК-зондами | Вирус гепатита В | Электрохимическое обнаружение, ДНК-анализ | 1 фмоль | 95 |
2. ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ
Этапы репликации, которые являются уникальными для вирусов, являются потенциальными целевыми точками для антивирусных агентов. К числу этих уникальных процессов относятся адсорбция на мембране клетки, проникновение в клетку, снятие оболочки (депротеинизация), РНК-направленный синтез ДНК или РНК-направленный синтез РНК (РНК-вирусы), а также сборка и высвобождение дочернего вириона [97]. Поскольку вирусные инфекции легко развивают резистентность к имеющимся лекарственным средствам, существует постоянная потребность в открытии новых и в улучшении состава существующих противовирусных перпаратов. Важно отметить, что антивирусные агенты, используемые против вирусов, вызывающих хронические инфекции, такие как ВПГ и ВИЧ, работают только в остром периоде заболевания, не оказывая влияния на вирусы в латентной фазе, в связи с чем такие инфекции с периодами реактивации вируса и рецидивами заболевания требуют пожизненной поддерживающей терапии. Кроме того, в связи с ограниченной растворимостью в водных средах, коротким периодом полувыведения и недостаточным проникновением в целевые компартменты использование большинства противовирусных лекарственных средств является ограниченным. Поскольку наноматериалы обладают уникальными физико-химическими свойствами, высоким отношением площади поверхности к объему и повышенной реакционной способностью, новые подходы к противовирусной терапии включают в себя комбинации наноматериалов и современных противовирусных агентов.
Наночастицы серебра. Среди большого количества наноматериалов наиболее изучено противовирусное действие НЧ Ag [98–100].
Показано, что НЧ Ag являются эффективным средством против вируса гепатита B [101], ВИЧ 1 [102], ВПГ 1 [103, 104], респираторно-синцитиального вируса [105] и др. [99, 106].
Наночастицы и нанопроволоки серебра значительно снижали инфекционность трансмиссивного вируса гастроэнтерита в клетках яичка свиньи, а также уменьшали количество апоптотических клеток, индуцированных вирусом, посредством регуляции клеточного сигнального пути p38/митохондрии–каспаза-3 [107]. Наночастицы серебра размером 30–40 нм в концентрации 100 мкг/мл ингибировали репликацию ВПГ 2, при этом не оказывали токсического действия на клетки Vero [108]. В [109] показана зависимая от дозы и размера НЧ Ag, модифицированных дубильной кислотой, эффективность против ВПГ 2 в экспериментах in vitro и in vivo. Наночастицы блокировали прикрепление вируса, проникновение и его дальнейшее распространение. Частицы меньшего размера индуцировали выработку цитокинов и хемокинов, важных для противовирусного ответа.
Сравнительный анализ противовирусной активности оксида графена (GO) и композита GO–Ag показал, что эффективность ингибирования для GО–Ag составила 25% по отношению к коронавирусу кошек и 23% по отношению к вирусу инфекционной бурсальной болезни, тогда как GO не проявил антивирусной активности против бурсальной болезни, а показатель эффективности для коронавируса составил только 16% [110].
Установлено, что наносеребро проявляет анти-ВИЧ-активность на ранней стадии репликации вируса [111]. Связываясь с гликопротеином gp120, НЧ Ag предотвращают CD4-зависимое вирионное связывание, слияние и инфекционность, выступая в качестве эффективного вирулицидного агента против бесклеточного (лабораторные штаммы, клинические изоляты, тропические штаммы T и M и устойчивые штаммы) и клеточного вирусов. Кроме того, НЧ Ag ингибируют последующие стадии жизненного цикла ВИЧ-1.
Подтверждение ингибирования репликации вируса чумы мелких жвачных нансеребром показано в [112]. Установлено, что НЧ Ag размером 5–30 нм, полученные путем биологического синтеза из нитрата с использованием Argemone maxicana в качестве восстановителя, значительно ингибировали репликацию вируса in vitro. Просвечивающая электронная микроскопия (ПЭМ) показала, что НЧ взаимодействуют с поверхностью и ядром вириона, однако это взаимодействие не дает прямого вирулицидного эффекта, а оказывает блокирующее воздействие на проникновение вируса в клетки-мишени.
В [113] сообщается, что НЧ Ag избирательно разрушают морфологическую структуру вируса гриппа H3N2, не оказывая цитотоксического действия на зараженные клеточные линии.
Сравнительные эксперименты показали, что НЧ Ag обладают более высокой противовирусной активностью, чем соли серебра. Это связано с тем, что при растворении НЧ выделяется атомарное (Ag0) и ионное (Ag+) серебро, тогда как соли серебра выделяют только Ag+ [114].
Хотя механизм, лежащий в основе их вирус-ингибирующей активности, еще не до конца понятен, НЧ Ag можно рассматривать как агент широкого спектра действия против различных вирусных штаммов.
Наночастицы золота. НЧ Au, обладая превосходной проводимостью, биосовместимостью и способностью легко связываться с сульфатированными биологическими лигандами, также являются перспективными агентами для противовирусных препаратов [115]. В связи с этим в [116] была разработана антиретровирусная платформа на основе НЧ Au, покрытых глюкозой толщиной ~3 нм, загруженных абакавиром и ламивудином. Препараты высвобождались из гликонаночастиц в кислых условиях и были способны ингибировать репликацию вируса со значениями IC50, аналогичными свободным лекарственным средствам (менее 10 мкМ). Также сообщалось об использовании других высокоэффективных противовирусных конъюгатов НЧ Au и гликанов [117, 118]. Предполагается, что НЧ Au, покрытые гликаном, подвергаются эндоцитозу как рецептор (DC-SIGN) зависимыми, так и независимыми путями, часть из них колокализуется с DC-SIGN в ранних эндосомах. Блокирование и секвестрация рецепторов DC-SIGN конъюгированными НЧ могут объяснить их способность ингибировать трансинфекцию ВИЧ 1 Т-клеток человека in vitro [117]. В эксперименте с клетками HeLa-CD4-LTR-B-gal [119] установлено, что НЧ Au ингибируют проникновение ВИЧ 1 путем связывания с гликопротеином gp120 и предотвращают прикрепление через CD4 – основной клеточный рецептор, к которому имеет сродство ВИЧ.
Оценка активности НЧ Au, синтезированных с использованием экстракта чеснока (Allium sativa) в качестве восстановителя, против вируса кори [120] показала, что НЧ активно ингибируют репликацию вируса в клетках Vero при эффективной концентрации ЕС50 – 8.829 г/мл.
В [121] сообщалось о лечении вируса гепатита С с помощью комплекса “гиалуроновая кислота–НЧ Au/интерферон α”. В ходе сравнения эффективности предлагаемого подхода со стандартной системой лечения интерфероном α, модифицированным полиэтиленгликолем (ПЭГ), обнаружили, что НЧ обладают биологической активностью с повышенной стабильностью в сыворотке человека.
В [122] предложено применение НЧ Au, покрытых меркаптоэтансульфонатом (Au-MES), в качестве эффективных ингибиторов ВПГ 1 на основе их способности имитировать гепарансульфат рецептора (гепарансульфат протеогликана (HSPG)) на поверхности клетки. Исследования показали, что Au-MES препятствует прикреплению, проникновению и межклеточному распространению вируса.
Существенное снижение вирусной инфекционности при повышенных показателях жизнеспособности клеток было продемонстрировано в [123] под действием пористых НЧ Au. Количественное определение внутриклеточной вирусной РНК с помощью метода ПЦР в реальном времени подтвердило, что НЧ успешно блокируют процесс проникновения вируса в клетку посредством конформационной деформации гемагглютинина – высококонсервативного поверхностного белка во многих штаммах вируса гриппа (рис. 3).
Рис. 3.
Схема инактивации вируса гриппа A, обработанного пористыми НЧ Au (PoGNP). PoGNP взаимодействует с поверхностными белками вируса гриппа и расщепляет их дисульфидные связи. Инактивированные вирусы проявляют меньшую инфекционность к клеткам (адаптировано из [123]).

Согласно [124] катионные комплексы, состоящие из НЧ Au и интерферирующей РНК (AuNP-siRNA), могут проникать в клетки Vero и значительно снижать репликацию вируса денге серотипа 2 и выделение инфекционного вириона как до, так и после инфекции. Кроме того, после обработки комплексов AuNP-siRNA РНКазой они продолжали ингибировать репликацию вируса. По-видимому, НЧ Au сохраняют стабильность интерферирующей РНК.
Таким образом, результаты изучения влияния НЧ Au на вирусы показывают, что основными механизмами противовирусной активности являются способность частиц ингибировать репликацию вирусов и блокировать проникновение вируса в клетку.
Магнитные наночастицы. Магнитная гипертермия была предложена в качестве стратегии уничтожения ВИЧ-инфицированных клеток in vitro [125]. В работе исследовались токсичность и поглощение цитотоксическими Т-лимфоцитами (ЦТЛ) суперпарамагнитных наночастиц оксида железа FeraSpin R для усиления цитотоксического потенциала ВИЧ-специфических ЦТЛ на ВИЧ-инфицированные клетки. НЧ FeraSpin R прикреплялись к поверхности и поглощались ЦТЛ, незначительно влияя на их функции. Т‑лимфоциты, нагруженные НЧ, эффективно уничтожались с помощью магнитоиндуцированной гипертермии. Данный подход рассматривался в качестве дополнительной терапии при ликвидации латентно инфицированных ВИЧ-позитивных клеток.
В [126] анти-ВИЧ-препарат – это тенофовир и агент, снижающий латентность, – вориностат, они послойно были нанесены на поверхность МНЧ Fe3O4 размером 10 ± 3 нм. Для достижения замедленного высвобождения использовался метод “layer-by-layer”. Нанесение сразу двух бислоев позволило увеличить загрузку тенофовира в 2.8 раза и увеличило период высвобождения перпарата в 30 раз при 100%-ном высвобождении препарата в течение пяти дней с одновременной стимуляцией латентной экспрессии ВИЧ. Полученные капсулы показали способность к проникновению через гематоэнцефалический барьер, а также высокую противовирусную активность in vitro при низкой цитотоксичности.
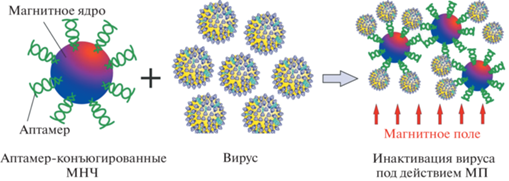
Другая концепция применения МНЧ предложена в [127]. Описана методика селективного захвата частиц вируса гепатита С из образцов плазмы человека с использованием аптамер-конъюгированных МНЧ. Аптамеры были специфичны для связывания с E1E2 гликопротеином вируса гепатита. С помощью ПЭМ выявлен эффективный захват наноконъюгатов с использованием магнитного поля (рис. 4). Кроме того, количественное измерение вирусных частиц в образцах плазмы человека методом ПЦР в реальном времени подтвердило эффективное устранение вирусной нагрузки.
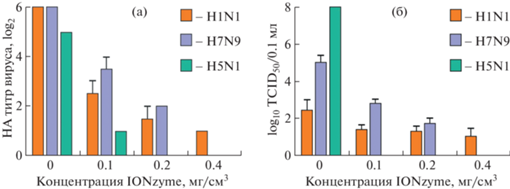
Разработана противовирусная стратегия с использованием нанозимов оксида железа (IONzymes) для нацеливания на липидную оболочку вируса гриппа [128]. Показано, что IONzymes вызывают перекисное окисление липидов оболочки и разрушают целостность соседних белков, включая гемагглютинин, нейраминидазу и матриксный белок 1. Кроме того, установлено, что полученные нанозимы обладают противовирусной активностью против широкого спектра подтипов вируса гриппа А (H1–H12), а нанесение IONzymes на гигиеническую маску повышают защиту от трех важных подтипов вируса гриппа (H1N1, H5N1, H7N9) (рис. 5).
Рис. 5.
Инактивация вирусов H1N1, H7N9 и H5N1 при инкубации в течение 30 мин на поверхности защитной маски для лица, функционализованной IONzyme различной концентрации. HA – гемагглютинирующий титр вируса, TCID50 – количество вируса, которое производит цитопатический эффект в 50% зараженных культур (адаптировано из [128]).
Представленные работы показывают, что МНЧ являются очень гибким инструментом, позволяющим использовать различные стратегии борьбы с вирусами – от прямого разрушения инфицированных клеток с помощью магнитной гипертермии до инактивации вирусных частиц с помощью перекисного оксисления липидов, адресной доставки противовирусных препаратов и селективного захвата вирусов в биологическом окружении.
Диоксид титана. В [129] было показано, что НЧ TiO2 в фазе анатаза ингибируют вирус птичьего гриппа H9N2. Интересно отметить, что при УФ-облучении (365 нм) НЧ проявляли большую ингибирующую активность – инактивация вируса достигла 100%. Также показана инактивация вируса гриппа посредством фотокатализа с использованием НЧ TiO2, иммобилизованных на стеклянной пластинке [130]. Титры вируса были резко снижены фотокаталитической реакцией даже при низкой интенсивности УФ-А (0.01 мВт/см2) ≈ на 4-log10. Кинетика вирусной инактивации была связана со временем воздействия, интенсивностью УФ-излучения и концентрацией бычьего сывороточного альбумина в вирусных суспензиях. В то же время в [131] показано зависимое от концентрации, но не зависимое от освещения противовирусное действие НЧ TiO2 против вируса гриппа (H3N2). Предполагается, что инактивирующие вирус свойства TiO2 основаны главным образом на прямом контакте наночастиц и вирусных частиц.
В [132] показано, что нанокомпозиты TiO2–полилизин–ДНК (v3'), содержащие фрагменты ДНК, нацеленные на различные консервативные области (–) РНК и (+) РНК сегмента 5 вируса гриппа A (H3N2), специфически ингибировали размножение вируса с эффективностью 99.8 и 99.9% (или в ~400 и 1000 раз) при концентрации 0.1 и 0.2 мкМ ДНК в нанокомпозите. В дальнейших исследованиях наблюдалась сходная активность ДНК-меченых НЧ TiO2 против вирусов H5N1 и H1N1 [133, 134] и композитов TiO2–полилизин–ДНК/РНК против вируса гриппа A (H3N2) [135].
Таким образом, среди мехнизмов противовирусного действия НЧ титана можно выделить фотокаталитическую активность, эффективную против широкого спектра микроорганизмов.
Диоксид цинка. Как упоминалось ранее, проникновение вируса в клетку-мишень происходит за счет взаимодействий между гликопротеинами оболочки вируса и гепарансульфатом клеточной мембраны. В связи с этим были получены различные микро- и наноструктуры оксида цинка, покрытые множественными наноразмерными шипами, имитирующими филоподии [136]. Предполагалось, что эти шипы будут конкурировать за связывание вируса с клеточным гепарансульфатом через их отрицательно заряженные кислородные вакансии. Результаты показывают, что частично отрицательно заряженные частицы ZnO эффективно захватывают вирионы, делая их неспособными проникать в фибробласты роговицы человека – естественную клетку-мишень для ВПГ 1. Позже было предложено использовать тетраподы ZnO для профилактики и терапии ВПГ 2 [137]. На клетках вагинального эпителия и клетках HeLa показана пониженная инфицированность вирионами ВПГ 2, предварительно инкубированными с ZnO. Использование флуоресцентно меченных ZnO и GFP-экспрессирующих вирионов ВПГ 2 позволило продемонстрировать связывание ZnO с ВПГ 2 (рис. 6). Кроме того, установлено, что связывание и, следовательно, противовирусные эффекты ZnO могут быть усилены путем освещения наночастиц УФ-светом [136, 137]. В 2017 г. было показано, что нано- и микроструктуры ZnO в форме тетраподов могут ингибировать инфекцию ВПГ в культурах клеток и тканей роговиц глаза [138].
Рис. 6.
Схема процесса инфицирования в присутствии и в отсутствие тетраподов ZnO и УФ-излучения (по [137]).
Эксперименты in vitro показали, что НЧ ZnO обладают ингибирующими свойствами в отношении вируса гриппа H1N1 только после проникновения вируса в клетки [139]. Установлено, что пегилированные ZnO обладают более высокой противогриппозной активностью наряду с более низкой цитотоксичностью по сравнению с чистыми ZnO – коэффициенты ингибирования 94.6 и 52.2% соответственно. Высокая противовирусная активность пегилированных НЧ ZnO показана также в экспериментах с ВПГ 1 [140].
В [141] показано 10-кратное снижение вируса чикунгуньи под действием НЧ ZnO, определенное по изменению транскриптов вирусной РНК в течение 24 ч после заражения вирусом.
Обобщение проанализированных результатов позволяет выделить основной механизм антивирусного действия, основанный на ингибировании проникновения вируса в клетки, усиливаемый УФ-облучением.
Наночастицы меди. Методом титрования бляшек показана противовирусная активность НЧ йодида меди (160 нм) против вируса гриппа А (H1N1) [142]. Титр вируса уменьшался в зависимости от концентрации частиц CuI, при этом эффективная концентрация ЕС50 составила ~17 мкг/мл после часового воздействия.
С использованием норовирусных вирусоподобных частиц (VLPs) в качестве модельной вирусной системы проведен анализ антивирусной активности НЧ ядра/оболочки Au/CuS [143]. Методом ИФА установлено, что обработка 0.083 мкМ наночастиц в течение 10 мин инактивировала ~50% VLP, а при 0.83 мкМ наблюдалось полное ингибирование тест-объекта.
НЧ CuO в исследовании воздействия на вирус гепатита С (HCV) в системе культивирования клеток HCVcc/Huh7.5.1 значительно ингибировали инфекционность вируса в нецитотоксической концентрации [144]. Кроме того, при отсутсвии влияния на репликацию НЧ препятствовали проникновению псевдочастиц вируса гепатита С (HCVpp), включая генотипы 1a, 1b и 2a. При дальнейшем увеличении времени экспозиции установлено, что НЧ Cu блокировали инфекцию HCV как на стадии прикрепления, так и на стадии проникновения.
Изучение влияния НЧ Cu на ВПГ 1 [145] показало снижение титра вируса на 2.8 log10 TCID50 (Median Tissue Culture Infectious Dose) по сравнению с контролем при максимальной концентрации 100 мкг/мл, коэффициент ингибирования составил 83.3%. ВПГ 1 приводил к отчетливым цитопатическим эффектам, характеризующимся округлением клеток, рефракцией и образованием синцитий. Обработка НЧ CuO снижала цитопатические эффекты в инфицированных клетках Vero. Анализ влияния CuO на экспрессию антигенов ВПГ 1 на поверхности клеток Vero показал значительное уменьшение количества очагов в ВПГ 1-инфицированных клетках, инкубированных с CuO, по сравнению с контролем, что указывает на высокую антивирусную активность CuO в отношении экспрессии антигенов ВПГ 1.
Можно сделать вывод, что НЧ на основе меди, как и прочие, описаные выше, проявляют выраженные противовирусные эффекты. При этом подобные исследования остаются немногочисленными, а механизмы воздействия до конца не ясны.
Таким образом, в ходе анализа работ по применению металлических НЧ в качестве противовирусных агентов по отношению к таким вирусам, как вирус гепатита B, герпеса 1 и 2 типов, гриппа, кори, денге, ВИЧ, респираторно-синцитиального вируса, трансмиссивного вируса гастроэнтерита, коронавируса кошек, вируса инфекционной бурсальной болезни, морбилливируса и др., можно выделить ряд перспективных материалов, а также предположительных механизмов их воздействия. Наиболее изученными являются НЧ серебра и золота, для которых характерно ингибирование процесса репликации вирусов, а также блокирование проникновения вируса в клетку. При этом НЧ Au часто выступают в качестве платформы для доставки противовирусных препаратов. Фотокаталитические частицы диоксида титана и оксида цинка предотвращают проникновение вируса в клетку, причем УФ-облучение в большинстве случаев усиливает эффект. Отметим, что в качестве одного из механизмов, блокирующего проникновение вируса, для НЧ ZnO определенной формы предлагается конкурентное сцепление вируса с поверхностью частиц. Схожий эффект был отмечен для нанопроволок оксида олова [146], которые, выступая в качестве носителя отрицательного заряда, блокировали прикрепление ВПГ 1 к клеточно-связанному гепарансульфату, тем самым препятствуя проникновению и последующему межклеточному распространению вируса. МНЧ имеют широкий спектр возможных применений для борьбы с вирусными инфекциями, включая магнитную гипертермию пораженных клеток, адресную доставку противовирусных препаратов, селективный захват вирусных частиц, разрушение липидной оболочки вируса. НЧ на основе меди блокируют вирусную инфекцию как на стадии прикрепления, так и на стадии репликации вирусных частиц, так же как и остальные описанные типы НЧ, проявляя выраженную противовирусную активность.
Еще одним важным аспектом практического применения НЧ на основе металлов может стать создание противовирусных поверхностей (покрытий, пленок), масок и фильтрующих элементов для самого широкого использования. Такие технологии смогут существенно ограничить распространение вирусов в окружающей среде. Подобные исследования проводились [128, 130], но их число пока невелико.
В табл. 2 представлены примеры противовирусного действия НЧ на основе металлов, описанные в анализируемых источниках.
Таблица 2.
Противовирусное действие наночастиц на основе металлов
| НЧ, форма использования, концентрация | Вирус | Наблюдаемый эффект | Предполагаемый механизм | Литера-тура |
|---|---|---|---|---|
| НЧ Ag 10 нм, молярное соотношение ДНК: Ag 1 : 50 | Вирус гепатита В | Ингибирование репликации | Ингибирование образования внутриклеточной РНК, связывание ДНК вируса | [101] |
| НЧ Ag, покрытые меркаптоэтансульфонатом | ВПГ 1 | Блокирование проникновения вируса в клетку | НЧ конкурируют с вирусом за связывание с клеточным HS | [103] |
| Микосинтезированные НЧ Ag, размеры 46, 20, 30, 50, 40 нм, концентрации 0.1, 0.5, 1, 5 и 10 мкг/мл | ВПГ 1 и 2, порагрипп человека 3 | Размерозависимое снижение инфекционности вируса | Предполагается блокирование взаимодействия вируса с клеткой | [104] |
| НЧ Ag 100 мкг/мл | ВПГ 2 | Ингибирование репликации | [108] | |
| НЧ Ag, модифицированные дубильной кислотой, размеры 13, 33, 46 нм | ВПГ 2 | Размерозависимое снижение инфекционности вируса in vitro и in vivo | При прямом взаимодействии НЧ блокировали прикрепление, проникновение и дальнейшее распространение вируса | [109] |
| НЧ Ag, размером 30–50 нм в концентрациях 0.44–0.91 мг/мл | ВИЧ | Подавление репликации вируса на ранней стадии | НЧ связываются с gp120 и предотвращают CD4-зависимое вирионное связывание, слияние и инфекционность | [111] |
| НЧ Ag 9.5 нм 12.5, 25 и 50 мкг/мл | Вирус гриппа A (H3N2) | Дозазависимое ингибирование роста вируса гриппа в клетках почек собаки Madin-Darby | Разрушение вирусных структур | [113] |
| НЧ Au, покрытые олигоманнозидом толщиной 1.8 нм | ВИЧ 1 | Ингибирование транс-инфекции ВИЧ-1 | Блокирование и секвестрация DC-SIGN | [117] |
| НЧ Au, стабилизированные ПЭГ | ВИЧ 1 | Ингибирование проникновения вируса | НЧ ингибируют проникновение вируса путем связывания с gp120 и предотвращают прикрепление CD4 | [119] |
| НЧ Au, синтезированные с использованием экстракта чеснока в качестве восстановителя. ЕС50 – 8.829 мкг/мл | Вирус кори | Ингибирование вирусной инфекции | Предполагается, что НЧ блокируют вирусные частицы | [120] |
| Комплекс гиалоурановая кислота–НЧ Au/IFN α | Вирус гепатита С | Комплекс значительно усиливал экспрессию 2', 5'-олигоаденилатсинтетазы 1 для врожденных иммунных реакций на вирусную инфекцию в ткани печени | [121] | |
| НЧ Au, покрытые меркаптоэтансульфонатом (Au-MES NPs) | ВПГ 1 | Препятствие прикреплению, проникновению и межклеточному распространению вируса | Механизм основан на способности Au-MES NPs имитировать гепарансульфат рецептора на поверхности клетки | [122] |
| Пористые НЧ Au, полученные методом эмульсии, размером 150 нм, в концентрации 2 × 10–1 мг/мл |
Вирусы гриппа А (H1N1, H3N2, H9N2) | Снижение вирусной инфекционности | Механизм основан на связывании гемагглютинина – высококонсервативного поверхностного белка вирусов гриппа, с НЧ Au, что препятсвует слияние вирусной мембраны с клеткой, блокируя процесс проник-новения вируса посредством конформационной деформации | [123] |
| Катионные комплексы, состоящие из НЧ Au и интерферирующей РНК | Вирус денге 2 | Снижение репликации и выделение инфекционного вириона как до, так и после инфекции | НЧ улучшают доставку миРНК в клетки и контролировать инфекцию in vitro | [124] |
| МНЧ, послойно инкапсулированные тенофовиром и вориностатом, 10 ± 3 нм | ВИЧ | Трансмиграция через гематоэнцефалический барьер (37.95 ± 1.5%), высокая противовирусная активность in vitro ~33% снижение уровня р24 | [126] | |
| Аптамер-конъюгированные МНЧ размером 100 нм, в концентрациях 5 × 10–1, 5 × 10–2, 5 × 10–3, 5 × 10–4 и 5 × 10–5 мкг/мл | Вирус гепатита С | Дозазависимое снижение вирусной нагрузки – при 5 × 10–5 мкг/мл эффективность более 91% | Эффект связан с селективным захватом НЧ частиц вируса гепатита С из образцов плазмы человека с последующим захватом наноконъюгатов при помощи магнитного поля | [127] |
| Нанозимы оксида железа (IONzymes) | Вирусы гриппа А | Противовирусная активность широкого спектра на 12 подтипах вируса гриппа А (H1-H12) | IONzymes вызывают перекисное окисление липидов оболочки и разрушают целостность соседних белков, включая гемагглютинин, нейраминидазу и матриксный белок 1, вызывая инактивацию вирусов гриппа A | [128] |
| НЧ TiO2 50 нм, фаза анатаза | Вирус птичьего гриппа | 100%-ная инактивация вируса при УФ-облучении 365 нм | [129] | |
| НЧ TiO2, размером 4–10 нм, в концентрациях 0.2, 2 и 7 мг/мл | Вирус гриппа A (H3N2) | Концентрационно зависимое противовирусное действие | Предполагается, что инактивирующие вирус свойства TiO2 основаны главным образом на прямом контакте наночастиц и вирусных частиц | [131] |
| Нанобиокомпозит TiO2/PL/DNA/PNA Концентрации фрагмента РНК в нанокомпозите составляли 2, 1, 0.2, 0.05, 0.01 мкМ, что соответствует 100, 50, 10, 5, 1 мкг мл для НЧ TiO2 | Вирус гриппа A (H3N2) | Ингибирование размножения вируса с эффективностью 99.8% | [135] | |
| Микро-наноструктуры ZnO (ZnO MNSs), ширина от 100 до 500 нм, длина от 1 до 5 мкм | ВПГ 1 | Блокирование проникновения вируса в клетку Антивирусная активность ZnO MNSs резко повышалась после создания дополнительных кислородных вакансий при освещении ультрафиолетом | Структуры ZnO, покрытые множественными наноскопическими шипами, имитирующими клеточные филоподии захватывают вирусные частицы, предотвращая проникновение в клетку | [136] |
| Тетраподы ZnO | ВПГ 2 | Блокирование проникновения вируса в клетку | Конкурентное осаждение вирусных частиц на НЧ | [137] |
| НЧ ZnO, покрытые ПЭГ 16–20 нм НЧ ZnO 20–50 нм, в концентрациях 25, 75, 100 и 200 мкг/мл | Вирус гриппа А (H1N1) | Дозазависимая антивирусная активность. Максимальное ингибирование вируса: ZnO ПЭГ – 946% (200 мкг/мл) ZnO – 522% (75 мкг / мл) | ПЭГилирование НЧ усиливает противовирусную активность и снижает цитотоксичность | [139] |
| НЧ CuI, 160 нм | Вирус гриппа А (H1N1) | Снижение титра вируса, ЕС50 ~ 17 мкг/мл после воздействия в течение 60 мин | [142] | |
| НЧ CuO | Вирус гепатиа С | Ингибирование инфекционности вируса | Блокирование вируса на стадии прикрепления и на стадии проникновения | [135] |
| НЧ CuO, 100 мкг/мл | ВПГ 1 | Снижение титра вируса на 2.8 log10 TCID50 по сравнению с контролем, коэффициент ингибирования составил 83.3% Снижение экспрессии антигенов ВПГ 1 на поверхности клеток Vero | [145] |
Имеющиеся результаты оценки противовирусной активности металлосодержащих наночастиц говорят об их перспективности в терапии вирусных инфекций, однако недостаток информации, в том числе касающейся механизмов действия и безопасности как для клеток [147–149], так и для целого организма [150–152], требует проведения более детальных исследований.
3. ВАКЦИНЫ
С быстрым развитием биотехнологий и материаловедения наноматериалы стали играть важную роль в новых рецептурах вакцин [153]. Использование НЧ в составах вакцин позволяет не только улучшить стабильность и иммуногенность антигена, но и обеспечить его направленную доставку и медленное высвобождение [154]. Усиленный гуморальный и клеточный иммунный ответ, вызываемый нановакцинами, обусловлен меньшим размером частиц, который увеличивает поглощение клетками, что впоследствии приводит к усилению реакции на антиген [155]. Модификация поверхности наноносителей с помощью целевых фрагментов (пептидов, углеводов или антител) может способствовать специфическим и селективным иммунным реакциям путем нацеливания на специфические рецепторы на поверхности иммунных клеток [156, 157, 37].
Наиболее распространенными наноматериалами, применяемыми в составе вакцин, являются синтетические полимеры [158–162], липосомы [163, 164], вирусоподобные частицы [165, 166] и др. [167–169]. Среди неорганических материалов в составе вакцин предлагается использование углеродных [170, 171], селикатных [172–175], кальцийфосфатных [176, 177] и металлических [178–183], которые рассмотрим более подробно.
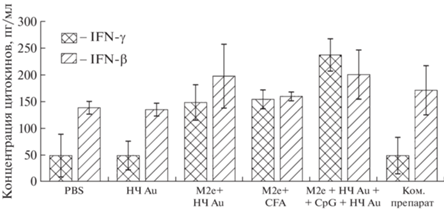
Наночастицы золота. Среди НЧ на основе металлов наиболее часто для создания противовирусных вакцин применяются НЧ Au [184–189]. Впервые НЧ Au были использованы в 1996 г. при разработке экспериментальной вакцины против клещевого энцефалита [190]. В [180] высококонсервативный белок внеклеточного матрикса 2 (M2e) вируса гриппа A посредством взаимодействий тиол–золото был присоединен к НЧ Au (12 нм) с последующим добавлением к конъюгатам M2e–золото олигонуклеотида CpG. Вакцинация модельных мышей обеспечивала полную защиту после воздействия вируса гриппа PR8-H1N1. Позже было установлено, что включение избыточного растворимого антигена M2e наряду с M2e, иммобилизованным на НЧ Au, играет важную роль для индукции высокого уровня ответа антител [191]. Кроме того, утверждается, что разработанная вакцина обеспечивает длительную защиту при заражении вирусом гриппа А. В [192] показано, что интраназальное введение той же вакцинной композиции индуцирует у мышей активацию В-клеток легких и устойчивый ответ сывороточного анти-M2e-иммуноглобулина G (IgG) со стимуляцией как подтипа IgG1, так и подтипа IgG2a. Более того, отмечено, что антитела против M2e (IgG и IgA) также стимулировались в слизистой оболочке носа и легких и распознавали гомотетрамерный белок M2 подтипов H1N1, H3N2 и H5N1. Схожие результаты были получены в [193]. В [194] показано увеличение титра анитетел у лабораторных мышей, иммунизированных одновременно двумя конъюгатами М2е + Au и CpG + Au, по сравнению с мышами, иммунизированными коммерческой вакциной. Кроме того, после вакцинации наноконъюгатами зафиксировано увеличение дыхательной активности лимфоцитов селезенки и перитонеальных макрофагов, а также производство провоспалительных цитокинов (IL-1β и IFN-γ) (рис. 7).
Анализ влияния размера и формы НЧ Au на их адъювантные свойства показал, что при введении мышам модельного антигена (BSA), связанного с НЧ Au, титры полученных антител уменьшались в последовательности наносферы 50 нм → наносферы 15 нм → нанооболочки → нанозвезды → → наностержни → нативный BSA [195]. Одновременное использование для вакцинации двух антигенов вируса гриппа H3N2 (гемагглютинина и флагеллина), связанных с НЧ Au размером 18 нм, при однократном интраназальном введении вызывало более высокие уровни продукции антител у мышей, чем смесь растворимого гемагглютинина и флагеллина [196, 197]. Также было показано, что конъюгаты способствуют созреванию дендритных клеток, стимулируют выработку цитокинов и стимулируют антигенспецифический иммунитет Т-клеток.
В экспериментах in vitro показано, что дендритные клетки человека, обработанные вакциной, состящей из золотых наностержней, конъюгированных с RSV F (защитный антиген респираторно-синцитиального вируса), индуцировали иммунные ответы в первичных Т-клетках [179].
После введения мышам НЧ Au диаметром 2, 5, 8, 12 и 17 нм, конъгированных с синтетическим пептидом, напоминающим белок вируса ящура (FMDV), обнаружено наличие антител в сыворотке крови, причем максимальное связывание антител было отмечено для НЧ диаметром 8–17 нм [181]. Наноконъюгаты вызывали трехкратное увеличение ответа антител по сравнению с ответом на введение конъюгатов FMDV–гемоцианин лимфы, используемых в качестве котроля. Анализ накопления наноконъюгатов в селезенке показал, что количество препарата в селезенке коррелировало с величиной иммунного ответа.
Для оценки иммуногенных свойств конъюгатов НЧ Au с синтетическим пептидом капсидного белка VP1 вируса ящура (с использованием или без использования полного адъюванта Фрейнда) проводили иммунизацию морских свинок [198]. В качестве контроля использовали коммерческую вакцину и нативный пептид. Титр и чувствительность антител были максимальными для комбинации, включающей в себя конъюгат наночастица–пептид и полный адъювант Фрейнда. Биосинтез антител сопровождался повышением продукции провоспалительных цитокинов (особенно IFN-γ) и стимуляцией дыхательной активности перитонеальных макрофагов. Использование НЧ Au в качестве носителя гаптена усиливало иммунный ответ, даже когда полный адъювант Фрейнда не использовался. В [199] были показаны увеличение титра специфических и нейтрализующих антител и стимуляция пролиферации Т-лимфоцитов при однократной инъекции (50 мкг) морским свинкам конъюгатов из вирусоподобных частиц ящура и НЧ Au в форме звезд по сравнению с животными, иммунизированными антигеном в присутствии минерального масла ISA206 в качестве адъюванта.
Золотые наностержни, модифицированные PDDAC (поли (диаллидиметиламмоний) хлорид) или PEI (полиэтиленимин) с плазмидной ДНК Env ВИЧ 1, используемой в качестве антигена, могут значительно стимулировать клеточный и гуморальный иммунитет, а также пролиферацию Т-клеток посредством активации антиген-презентирующих клеток по сравнению с обработкой плазмидной ДНК Env ВИЧ 1 без наночастиц in vivo [182].
В [200] исследовались покрытые белком оболочки вируса Западного Нила сферические (20 и 40 нм), стержневые (40 × 10 нм) и кубические (40 × 40 × 40 нм) НЧ Au в качестве адъювантов. Измерение антител после инокуляции НЧ мышам показало, что сферические частицы размером 40 нм индуцировали самый высокий уровень специфических антител, тогда как стержневые НЧ индуцировали вдвое меньший иммунный ответ. Поглощение стержневых НЧ клетками происходило более эффективно, чем сферических или кубических, что свидетельствует о том, что выработка антител не зависела от эффективности поглощения нанозолота. Анализ секреции цитокинов в дендритных клетках костного мозга показал, что только клетки, обработанные стержневыми НЧ, продуцировали значительные уровни IL-1β и IL-18. Между тем сферические и кубические НЧ индуцировали продукцию воспалительных цитокинов, включая фактор некроза опухоли-α, IL-6, IL-12 и гранулоцитарно-макрофагальный колониестимулирующий фактор.
В целом можно отметить, что НЧ Au могут успешно использоваться в качестве адъюванта при разработке эффективных противовирусных вакцин, причем намаловажную роль для их эффективности играют размер и форма частиц.
Другие наночастицы с кислородными вакансиями. В [201] показано, что при интравагинальном применении в качестве микробицида НЧ тетраподов оксида цинка (ZOTEN) с кислородными вакансиями наблюдается ингибирование генитальной инфекции ВПГ 2 у самок мышей линии BALB/c. Помимо высокой захватывающей способности НЧ ZOTEN значительно уменьшали клинические проявления вагинальной инфекции и снижали смертность животных. Параллельно разработанные НЧ стимулировали предварительную сенсибилизацию связанных вирионов ВПГ 2 к антигенпрезентирующим клеткам слизистой, усиливая T-клеточные и антитело-опосредованные ответы на инфекцию и тем самым подавляя реинфекцию. Также обнаружено, что НЧ ZOTEN проявляют сильные адъювантоподобные свойства, которые сопоставимы с алюминиевыми квасцами, обычно используемыми в качестве адъюванта.
Значительные имунные ответы были получены при однократной инокуляции мышей никель-хелатирующими нанолипопротеиновыми частицами с иммобилизованной на поверхности растворимой укороченной формой белка оболочки вируса Западного Нила (trE-His) [202]. Нагруженные trE-His наночастицы обеспечивали более высокую защиту от заражения вирусом по сравнению с чистой trE-His.
Таким образом, НЧ на основе металлов, включая золото, цинк и никель, показали потенциал использования при создании противовирусных вакцин в качестве носителей вирусных белков, при этом обеспечивая улучшенную стабильность, иммуногенность, направленную доставку и медленное высвобождение. Кроме того, НЧ выступают как адъюванты, усиливающие иммунный ответ. Показана эффективность стимуляции клеточного и гуморального имунитета вакцинами, базирующимися на НЧ, по отношению к вирусам гриппа, ящура, ВИЧ 1, гепатита В, С и Е, респираторно-синцитиальному вирусу, вирусам Западного Нила, простого герпеса второго типа, клещевого энцефалита, денге, коронавирусу, вызывающему тяжелый острый респираторный синдром, птичьему коронавирусу, вирусу ньюкаслской болезни, цирковирусу свиней, вирусу классической чумы свиней, вирусу лихорадки Рифт-Валли (табл. 3).
Таблица 3.
Примеры использования наночастиц на основе металлов для создания противовирусных вакцин
| Вид НЧ, форма использования, концентрация | Вирус | Наблюдаемый эффект | Литера-тура |
|---|---|---|---|
| Наностержни Au (21 ± 2.0 нм на 57 ± 3.4 нм), конъюгированные с RSV F – защитный антиген респираторно-синцитиального вируса | Респираторно-синцитиальный вирус | Индукция иммунных ответов в первичных Т-клетках | [179] |
| НЧ Au (12 нм), конъюгированные с M2e (антигенный детерминант вируса гриппа) | Вирус гриппа А | Конъюгаты M2e-Au индуцировали M2e-специфические IgG-сывороточные антитела | [180] |
| НЧ Au (2, 5, 8, 12, 17, 37 и 50 нм), конъюгированные с синтетическим пептидом, имитирующим белок вируса ящура | Вирус ящура | Зависящие от размера иммуногенные свойства конъюгатов. Максимальное связывание антител было отмечено для наночастиц диаметром 8–17 нм | [181] |
| Наностержни Au, модифицированные цетилтриметиламмонийбромидом, поли (диаллидиметиламмонийхлорид)ом и полиэтиленимином | ВИЧ | Стимуляция клеточного и гуморального иммунитета, а также пролиферации Т-клеток посредством активации антиген-презентирующих клеток | [182] |
| НЧ Au (12 нм), конъюгированные с M2e и адьювантом CpG | Вирусы гриппа А (H1N1, H3N2 и H5N1) | Интраназальное введение Au-M2e + sCpG у мышей индуцирует активацию В-клеток легких и устойчивый ответ сывороточного анти-M2e-иммуноглобулина G (IgG) со стимуляцией как подтипов IgG1, так и IgG2a | [192] |
| НЧ Au с двумя линкерами, конъюгированные с рекомбинантным триметриком A/Aichi/2/68 (H3N2), гемагглютинином (HA) и агонистом TLR5 флагеллином (FliC) | Вирус гриппа А | При интраназальном введении индуцировали более высокие уровни ответов антител | [196] |
| НЧ Au в форме звезд, конъюгированные вирусоподобными частицами ящура | Вирусоподобные частицы ящура | При однократной инъекции (50 мкг) морским свинкам отмечено увеличение титра специфических и нейтрализующих антител и стимуляция пролиферации Т-лимфоцитов | [199] |
| Покрытые белком оболочки вируса Западного Нила сферические (20, 40 нм), стержневые (40 × 10 нм) и кубические (40 × 40 × 40 нм) НЧ Au | Вирус Западного Нила | Сферические частицы 40 нм индуцировали самый высокий уровень специфических антител, тогда как стержневые НЧ индуцировали в 2 раза меньше | [200] |
| НЧ ZnO (ZOTEN) с инженерными вакансиями кислорода | ВПГ 2 | Стимуляция предварительной сенсибилизации связанных вирионов ВПГ 2 к антигенпрезентирующим клеткам слизистой, усиление T-клеточных и Ab-опосредованных ответов на инфекцию и тем самым подавляя реинфекцию | [201] |
4. МЕТАЛЛИЧЕСКИЕ НАНОЧАСТИЦЫ ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ COVID-19
В последнее время в связи с пандемией COVID-19 появился ряд работ, направленных на оценку потенциала применения НЧ для диагностики и борьбы с вирусом SARS-CoV-2 [203–206].
НЧ Au в форме звезд были использованы при разработке электрохимического биосенсора вирусных гликопротеинов для диагностики SARS-CoV-2. Рабочий электрод разработанного сенсора активируется после покрытия слоя связанного оксида графена чувствительными химическими соединениями вместе с золотыми нанозвездами, которые могут обнаруживать следы вирусов в любых водных биологических средах посредством взаимодействия с активными функциональными группами их гликопротеинов. Метод не требует специальной пробоподготовки, идентифицикация вирусов занимает ~1 мин. Наносенсор продемонстрировал предел обнаружения 1.68 × 1022 мкгмл–1 и чувствительность 0.0048 мкА мкг мл–1 см–2 для SARS-CoV-2 в биологических средах, в том числе в ходе слепых клинических оценок [207].
В [208] двумерные золотые наноостровки, функционализированные рецепторами ДНК, использовались для чувствительного обнаружения SARS-CoV-2 посредством гибридизации нуклеиновых кислот. Фототермальный биосенсор продемонстрировал чувствительность к выбранным последовательностям SARS-CoV-2 вплоть до 0.22 пМ и позволил точно обнаруживать целевые последовательности в мультигенной смеси.
Сообщается о разработке колориметрического метода обнаружения РНК SARS-CoV-2 с помощью кэпированных специально разработанными тиол-модифицированными антисмысловыми олигонуклеотидами НЧ Au, специфичных для N-гена (нуклеокапсидный фосфопротеин) SARS-CoV-2. В присутствии целевой РНК сенсор демонстрирует изменение поверхностного плазмонного резонанса и образование осадка агломератов НЧ Au, видимого невооруженным глазом. Метод отличается избирательностью и чувствительностью на уровне 0.18 нг/мкл РНК, имеющей вирусную нагрузку SARS-CoV-2 [209]. Латеральный проточный иммунохроматографический анализ с использованием НЧ Au предложен для быстрой диагностики антител IgM к вирусу SARS-CoV-2. Результаты тестирования оказались сопоставимы с данными ПЦР-диагностики, при этом отмечались высокая селективность обнаружения IgM к вирусу SARS-CoV-2 и возможность работы с небольшими количествами биоматериала [210].
Потенциостатический биосенсор, изготовленный на основе электрода из оксида олова, легированного фтором с НЧ Au и иммобилизованного моноклональными антителами nCovid-19 (nCovid-19Ab), показал высокую чувствительность при обнаружении антигена (спайкового белка) nCovid-19Ag в диапазоне от 1 фМ до 1 мкМ [211].
Показано, что НЧ Ag диаметром ~10 нм ингибировали внеклеточный SARS-CoV-2 при концентрациях от 0.0001 до 0.001%, в то время как цитотоксический эффект наблюдался при концентрациях 0.002% и выше. Анализ проникновения псевдовируса на основе люциферазы показал, что НЧ Ag ингибируют вирус посредством нарушения целостности вирусной частицы [212].
В [213] было проведено исследование взаимодействия НЧ оксидов железа (Fe2O3 и Fe3O4) с доменом связывания рецептора спайк-белка (S1‑RBD) SARS-CoV-2, который необходим для прикрепления вируса к рецепторам клетки-хозяина. Установлено, что НЧ Fe3O4 образуют более стабильный комплекс с S1-RBD. Предполагалось, что эти взаимодействия связаны с конформационными изменениями вирусных белков и, следовательно, с инактивацией вирусов.
Нанокомпозит, содержащий НЧ Au (1 м.д.), Ag (5 м.д.), ZnO (60 м.д.) и ClO2 (42.5 м.д.), в водном растворе ингибировал шесть основных видов коронавируса (SARS-CoV-2) в концентрациях, которые можно использовать в качестве пищевых добавок [214]. Было установлено, что нанокомпозит блокирует проникновение вируса, ингибируя связывание шиповидных белков SARS-CoV-2 с рецептором ангиотензинпревращающего фермента 2 (ACE2) и препятствуя образованию синцития.
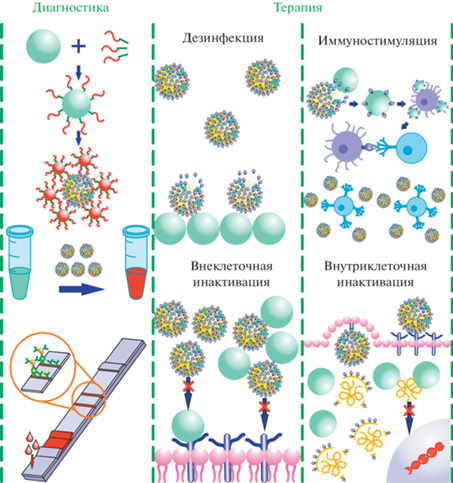
Как и в прочих противовирусных стратегиях, НЧ в борьбе с COVID-19 могут быть использованы для дезинфекции, предотвращения проникновения вируса в клетку, дезактивации его внутри клетки или стимулирования иммунитета хозяина [215].
ЗАКЛЮЧЕНИЕ
Проведенный анализ научных работ выявил значительный потенциал применения нанотехнологических подходов в обнаружении и терапии вирусных инфекций, а также для антивирусной вакцинации.
Для создания диагностических устройств успешно используются НЧ золота, серебра, оксида железа, оксида индия и олова, оксида церия, платины. Указанные системы проявили высокую чувствительность и хорошие характеристики сигнал/шум в ходе детекции вирусов папилломы человека, гепатита В и С, гриппа (H5N1, H5N2, H3N2), эболавируса, вируса желтой лихорадки, MERS-CoV, ВИЧ 1, аденовируса 5, герпеса 1, вируса Зика, вируса денге и др. Наночастицы отвечают за дальнейшую передачу информации об аналите, которая распространяется по оптическому, электрическому или магнитному каналу.
НЧ Ag и Au, ZnO, TiO2, МНЧ, а также НЧ на основе меди показали эффективность против таких вирусов, как вирус гепатита B, герпеса 1 и 2 типов, гриппа, кори, денге, ВИЧ 1, респираторно-синцитиального вируса, трансмиссивного вируса гастроэнтерита, коронавируса кошек, вируса инфекционной бурсальной болезни, морбилливируса и др., в качестве самостоятельных агентов и в качестве платформы для адресной доставки противовирусных препаратов. Механизмы действия основаны как на инактивации вирусных частиц, так и на предотвращении проникновения вируса в клетку, при этом описаны такие специфические эффекты НЧ, как фотокаталитическая активность, магнитная гипертермия, конкурентное осаждение вирусов на поверхности частиц особой формы и селективный захват вирусов магнитными частицами. Одним из перспективных подходов является создание противовирусных поверхностей, масок и фильтров на основе НЧ, предотвращающих распространение вирусов в окружающей среде, важность чего была наглядно продемонстрирована пандемией COVID-19.
НЧ на основе металлов, включая Au, Zn и Ni, показали потенциал использования при создании противовирусных вакцин в качестве носителей вирусных белков, при этом обеспечивая улучшенную стабильность, иммуногенность, направленную доставку и медленное высвобождение. Кроме того, НЧ выступают как адъюванты, усиливающие иммунный ответ. Показана эффективность стимуляции клеточного и гуморального имунитета вакцинами, базирующимися на НЧ, по отношению к вирусам гриппа, ящура, ВИЧ 1, гепатитов В, С и Е, бешенства, респираторно-синцитиальному вирусу, вирусам Западного Нила, простого герпеса второго типа, клещевого энцефалита, денге, коронавирусу, вызывающему атипичную пневмонию (SARS-CoV), и ряда других.
Важным преимуществом синтетических НЧ является их биомеметичность, поскольку они во многом схожи с вирусными частицами и типичными объектами их взаимодействия. В связи с этим форма и размеры НЧ являются очень важными факторами, зачастую определяющими эффективность противовирусного препарата.
Анализ публикаций показал исследовательскую активность в направлении оценки потенциала применения НЧ, включая золото, серебро и оксиды железа для диагностики и борьбы с вирусом SARS-CoV-2, вызвавшим пандемию COVID-19.
Таким образом, имеются многочисленные примеры эффективного использования НЧ на основе благородных и переходных металлов в условиях лабораторных экспериментов для диагностики и терапии, а также вакцинации против вирусных инфекций (рис. 8). Однако при дальнейшей практической реализации этих разработок следует принимать во внимание потенциальные риски, связанные с использованием НЧ и наноматериалов в непосредственном контакте с организмом человека.
Работа выполнена с использованием оборудования центра коллективного пользования научным оборудованием ТГУ имени Г.Р. Державина.
Список литературы
World Health Organization (WHO): Influenza (Seasonal). https://www.who.int/ru/news-room/fact-sheets/detail/influenza-%28seasonal%29
UNAIDS: Global HIV & AIDS statistics — 2020 fact sheet. https://www.unaids.org/en/resources/fact-sheet
World Health Organization (WHO): Human papillomavirus (HPV) and cervical cancer. https://www.who.int/ru/news-room/fact-sheets/detail/human-papillomavirus-(hpv)-and-cervical-cancer
World Health Organization (WHO): Coronavirus disease (COVID-19) pandemic. https://www.who.int/ru/news/item/05-05-2022-14.9-million-excess-deaths-were-associated-with-the-covid-19-pandemic-in-2020-and-2021
Koonin E.V., Senkevich T.G., Dolja V.V. // Biol. Direct. 2006. V. 1. P. 29. https://doi.org/10.1186/1745-6150-1-29
Liao J.B. // Yale J. Biol. Med. 2006. V. 79. P. 115.
Greenberg B.M. // Cerebrospinal Fluid in Clinical Practice. 2009. P. 177. https://doi.org/10.1016/B978-141602908-3.50024-8
Lee F.E.H., Treanor J.J. // Murray and Nadel’s Textbook of Respiratory Medicine (Sixth Edition). 2016. V. 1. P. 527.
Isolation, culture, and identification of viruses. Microbiology. https://courses.lumenlearning.com/microbiology/chapter/isolation-culture-and-identification-of-viruses/
Mackay I.M., Arden K.E., Nitsche A. // Nucl. Acids Res. 2002. V. 30. № 6. P. 1292. https://doi.org/10.1093/nar/30.6.1292
Stellrecht K.A. // Diagnostic Molecular Pathology. 2017. P. 123. https://doi.org/10.1016/B978-0-12-800886-7.00011-X
Roingeard Ph., Raynal P.I., Eymieux S., Blanchard E. // Rev. Med. Virol. 2019. V. 29. https://doi.org/10.1002/rmv.2019
Richert-Pöggeler K.R., Franzke K., Hipp K., Kleespies R.G. // Front. Microbiol. 2019. https://doi.org/10.3389/fmicb.2018.03255
Dibrov S.M., Parsons J., Carnevali M. et al. // J. Med. Chem. 2014. V. 57. № 5. P. 1694. https://doi.org/10.1021/jm401312n
Nitsche C., Holloway S., Schirmeister T., Klein C.D. // Chem. Rev. 2014. V. 114. P. 11348. https://doi.org/10.1021/cr500233q
Kramer L.D. Overview of viral infections (Last full review/revision Apr 2020). https://www.merckmanuals.com/home/infections/overview-of-viral-infections/overview-of-viral-infections
Kormuth K.A., Lakdawala S.S. // Nat. Microbiol. 2020. V. 5. P. 4.
Shafer R., Rhee S-Y., Pillay D. et al. // AIDS. 2007. V. 21. P. 215. https://doi.org/10.1097/QAD.0b013e328011e691
Irwin K.K., Renzette N., Kowalik T.F., Jensen J.D. // Virus Evol. 2016. V. 2. № 1. https://doi.org/10.1093/ve/vew014
Strasfeld L., Chou S. // Infect. Dis. Clin. N. Am. 2010. V. 24. № 2. P. 413. https://doi.org/10.1016/j.idc.2010.01.001
Zakharova O.V., Godymchuk A.Yu., Gusev A.A. et al. // BioMed Res. Int. 2015. V. 2015. Art. 412530. https://doi.org/10.1155/2015/412530
Krutyakov Yu., Klimov A., Violin B. et al. // Eur. J. Nanomed. 2016. V. 8. № 4. https://doi.org/10.1515/ejnm-2016-0018
Frolov G.A., Karasenkov Y.N., Gusev A.A. et al. // Nano Hybrids and Composites. 2017. V. 13. P. 239. https://doi.org/10.4028/www.scientific.net/nhc.13.239
Zakharova O.V., Gusev A.A., Altabaeva Yu.V., Perova S.Yu. // Nanotechnologies in Russia. 2018. V. 13. № 3–4. P. 173. https://doi.org/10.1134/S1995078018020180
Zakharova O., Kolesnikov E., Vishnyakova E. et al. // IOP Conf. Ser.: Earth Environ. Sci. 2019. V. 226. 012062. https://doi.org/10.1088/1755-1315/226/1/012062
Sánchez-López E., Gomes D., Esteruelas G. et al. // Nanomaterials (Basel). 2020. V. 10. № 2. P. 292. https://doi.org/10.3390/nano10020292
Chaudhuri S., Symons J.A., Deval J. // Antivir. Res. 2018. V. 155. P. 76. https://doi.org/10.1016/j.antiviral.2018.05.005
Russo E., Gaglianone N., Baldassari S. et al. // Colloids Surf. B. 2014. V. 118. P. 117. https://doi.org/10.1016/j.colsurfb.2014.03.037
Lembo D., Donalisio M., Civra A. et al. // Expert Opin. Drug Deliv. 2018. V. 15. P. 93. https://doi.org/10.1080/17425247.2017.1360863
Liu X., Zhang L., Mu Y. et al. // Angew. Chem. 2018. V. 57. № 38. P. 12499. https://doi.org/10.1002/anie.201807212
Gansukh E., Anthonydhason V., Jung S. et al. // J. Clust. Sci. 2018. V. 29. P. 933. https://doi.org/10.1007/s10876-018-1417-z
Elberry M.H., Darwish N.H.E., Mousa S.A. // Virol. J. 2017. V. 14. P. 1. https://doi.org/10.1186/s12985-017-0753-1
Lembo D., Cavalli R. // Antivir. Chem. Chemother. 2010. V. 21. P. 53. https://doi.org/10.3851/IMP1684
Zakharova O.V., Gusev A.A., Zherebin P.M. et al. // BioNanoSci. 2017. V. 7. P. 692. https://doi.org/10.1007/s12668-017-0406-2
Alsamhary Kh., Alabdullatif J.A., AL Nadhari S. // Ecotoxicol. Environ. Saf. 2021. V. 213. 112027. https://doi.org/10.1016/j.ecoenv.2021.112027
León-Buitimea A., Garza-Cervantes J.A., Gallegos-Alvarado D.Y. et al. // Pathogens. 2021. V. 10. P. 1303. https://doi.org/10.3390/pathogens10101303
Singh L., Kruger H.G., Maguire G.E.M. // Ther. Adv. Infect. Dis. 2017. V. 4. № 4. P. 105. https://doi.org/10.1177/2049936117713593
Parboosing R., Maguire G.E., Govender P. et al. // Viruses. 2012. V. 4. P. 488. https://doi.org/10.3390/v4040488
McNeil S.E. // Methods Mol. Biol. 2011. V. 697. P. 3–8. https://doi.org/10.1007/978-1-60327-198-1_1
Caron J., Reddy L.H., Lepêtre-Mouelhi S. et al. // Bioorg. Med. Chem. Lett. 2010. V. 20. P. 2761. https://doi.org/10.1016/j.bmcl.2010.03.070
Gagliardi M. // Ther. Deliv. 2017. V. 8. P. 289. https://doi.org/10.4155/tde-2017-0013
Abraham A.M., Kannangai R., Sridharan G. // Indian J. Medical Microbiol. 2008. V. 26. № 4. P. 297.
Cheng X., Chen G., Rodriguez W.R. // Anal. Bioanal. Chem. 2009. V. 393. № 2. P. 487. https://doi.org/10.1007/s00216-008-2514-x
Campos E.V.R., de Oliveira J.L., Abrantes D.C. et al. // Front. Bioeng. Biotechnol. 2020. https://doi.org/10.3389/fbioe.2020.00102
Chen L., Liang J. // Mater. Sci. Eng. C. Mater. Biol. Appl. 2020. V. 112. https://doi.org/10.1016/j.msec.2020.110924
Caygill R.L., Blair G.E., Millner P.A. // Anal. Chim. Acta. 2010. V. 681. P. 8. https://doi.org/10.1016/j.aca.2010.09.038
Chen L., Zhang X.W., Zhou G.H. et al. // Anal. Chem. 2012. V. 84. P. 3200. https://doi.org/10.1021/ac203172x
Daaboul G.G., Yurt A., Zhang X. et al. // Nano Lett. 2010. V. 10. № 11. P. 4727. https://doi.org/10.1021/nl103210p
Hill R.T. // Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol. 2015. V. 7. P. 152. https://doi.org/10.1002/wnan.1314
Lee S.H., Jun B.-H. // Int. J. Mol. Sci. 2019. V. 20. № 4. P. 865. https://doi.org/10.3390/ijms20040865
Vaculovicova M., Michalek P., Krizkova S. et al. // Anal. Methods. 2017. V. 9. P. 2375. https://doi.org/10.1039/C7AY00048K
Choi Y., Hwang J.H., Lee S.Y. // Small Methods. 2018. V. 2. https://doi.org/10.1002/smtd.201700351
Moulick A., Richtera L., Milosavljevic V. et al. // Anal. Chim. Acta. 2017. V. 983. P. 42. https://doi.org/10.1016/j.aca.2017.06.045
Zehbe I., Hacker G.W., Su H. et al. // Am. J. Pathol. 1997. V. 150. P. 1553.
Baptista P., Pereira E., Eaton P. et al. // Anal. Bioanal. Chem. 2008. V. 391. P. 943. https://doi.org/10.1007/s00216-007-1768-z
Draz M.Sh., Shafiee H. // Theranostics. 2018. V. 8. № 7. P. 1985. https://doi.org/10.7150/thno.23856
Wang Y.-F., Pang D.-W., Zhang Z.-L. et al. // J. Med. Virol. 2003. V. 70. P. 205. https://doi.org/10.1002/jmv.10379
Li X., Lu D., Sheng Z. et al. // Talanta. 2012. V. 100. https://doi.org/10.1016/j.talanta.2012.08.041
Mancuso M., Jiang L., Cesarman E., Erickson D. // Nanoscale. 2013. V. 5. P. 1678. https://doi.org/10.1039/c3nr33492a
Driskell J.D., Jones C.A., Tompkins S.M., Tripp R.A. // Analyst. 2011. V. 136. P. 3083. https://doi.org/10.1039/c1an15303j
Neng J., Harpster M.H., Wilson W.C., Johnson P.A. // Biosens. Bioelectron. 2013. V. 41. P. 316. https://doi.org/10.1016/j.bios.2012.08.048
Wang X., Li Y., Quan D. et al. // Anal. Biochem. 2012. V. 428. P. 119. https://doi.org/10.1016/j.ab.2012.06.011
Griffin J., Singh A.K., Senapati D. et al. // Chemistry. 2009. V. 15. P. 342. https://doi.org/10.1002/chem.200801812
Lu X., Dong X., Zhang K. et al. // Analyst. 2013. V. 138. P. 642. https://doi.org/10.1039/c2an36099c
Draz M.S., Fang B.A., Li L. et al. // ACS Nano. 2012. V. 6. P. 7634. https://doi.org/10.1021/nn3034056
Ahmed S.R., Kim J., Suzuki T. et al. // Biotechnol. Bioeng. 2016. V. 113. № 10. P. 2298. https://doi.org/10.1002/bit.25982
Ahmed S.R., Kim J., Suzuki T. et al. // Biosens. Bioelectron. 2016. V. 85. P. 503. https://doi.org/10.1016/j.bios.2016.05.050
Ahmed S.R., Takemeura K., Li T.C. et al. // Biosens. Bioelectron. 2017. V. 87. P. 558. https://doi.org/10.1016/j.bios.2016.08.101
Zheng L., Wei J., Lv X. et al. // Biosens. Bioelectron. 2017. V. 91. P. 46. https://doi.org/10.1016/j.bios.2016.12.037
Wei J., Zheng L., Lv X. et al. // ACS Nano. 2014. V. 8. № 5. P. 4600. https://doi.org/10.1021/nn5002485
Sharmin F., Suhee D., Hye K., Lee J. // Biosens. Bioelectron. 2015. V. 72. P. 355. https://doi.org/10.1016/j.bios.2015.05.020
Mi X., Lucier E.M., Turpeinen D.G. et al. // Analyst. 2019. V. 144. № 18. P. 5486. https://doi.org/10.1039/c9an00830f
Kim D., Kim Y., Hong S. et al. // Sensors. 2016. V. 16. P. 2154. https://doi.org/10.3390/s16122154
Wang X., Li Y., Wang H. et al. // Biosens. Bioelectron. 2010. V. 26. № 2. P. 404. https://doi.org/10.1016/j.bios.2010.07.121
Shevtsov M., Zhao L., Protzer U., van de Klundert M.A.A. // Viruses. 2017. V. 9. № 7. P. 193. https://doi.org/10.3390/v9070193
Yen C.-W., de Puig H., Tam J. et al. // Lab Chip. 2015. V. 15. P. 1638. https://doi.org/10.1039/C5LC00055F
Li Y., Hong M., Qiu B. et al. // Biosens. Bioelectron. 2014. V. 54. P. 358. https://doi.org/10.1016/j.bios.2013.10.045
Teengam P., Siangproh W., Tuantranont A. et al. // Anal. Chem. 2017. V. 89. № 10. P. 5428. https://doi.org/10.1021/acs.analchem.7b00255
Yang H., Liang W., Si J. et al. // J. Biomed. Nanotechnol. 2014. V. 10. P. 3610. https://doi.org/10.1166/jbn.2014.2047
Colino C.I., Millán C.G., Lanao J.M. // Int. J. Mol. Sci. 2018. V. 19. № 6. P. 1627. https://doi.org/10.3390/ijms19061627
Wu R., Meng B., Corredig M., Griffiths M.W. // Food Microbiol. 2022. V. 102. 10392. https://doi.org/10.1016/j.fm.2021.1039217
Carinelli S., Martí M., Alegret S., Pividori M.I. // New Biotechnol. 2015. V. 32. P. 521. https://doi.org/10.1016/j.nbt.2015.04.002
Kamikawa T.L., Mikolajczyk M.G., Kennedy M. et al. // Biosens. Bioelectron. 2010. V. 26. P. 1346. https://doi.org/10.1016/j.bios.2010.07.047
Ran Y.F., Fields C., Muzard J. et al. // Analyst. 2014. V. 139. P. 6126. https://doi.org/10.1039/C4AN00774C
Perez J.M., Simeone F.J., Saeki Y. et al. // J. Am. Chem. Soc. 2003. V. 125. № 34. P. 10192. https://doi.org/10.1021/ja036409g
Shelby T., Banerjee T., Zegar I., Santra S. // Sci. Rep. 2017. V. 7. https://doi.org/10.1038/s41598-017-07620-y
Chou T.C., Hsu W., Wang C.H. et al. // J. Nanobiotechnology. 2011. V. 9. https://doi.org/10.1186/1477-3155-9-52
Jimenez Jimenez A.M., Ruttkay-Nedecky B., Dostalova S. et al. // Int. J. Mol. Sci. 2016. V. 17. P. 585. https://doi.org/10.3390/ijms17050585
Xi Z., Huang R., Li Z. et al. // ACS Appl. Mater. Interfaces. 2015. V. 7. № 21. P. 11215. https://doi.org/10.1021/acsami.5b01180
Fatemi K., Ghourchian H., Ziaee A.A. et al. // Biotechnol. Appl. Biochem. 2009. V. 52. P. 221. https://doi.org/10.1042/BA20070199
Mashhadizadeh M.H., Talemi R.P. // Mater. Sci. Eng. C. 2016. V. 59. P. 773. https://doi.org/10.1016/j.msec.2015.10.082
Yang Z.-H., Zhuo Y., Yuan R., Chai Y.-Q. // Biosens. Bioelectron. 2015. V. 69. P. 321. https://doi.org/10.1016/j.bios.2015.01.035
Liu J., Du B., Zhang P. et al. // Biosens. Bioelectron. 2014. V. 61. P. 183. https://doi.org/10.1016/j.bios.2014.04.057
Lee J.-H., Oh B.-K., Choi J.-W. // Biosens. Bioelectron. 2013. V. 49. P. 535. https://doi.org/10.1016/j.bios.2013.06.010
Shariati M. // Biosens. Bioelectron. 2018. V. 105. P. 58. https://doi.org/10.1016/j.bios.2018.01.022
Rashid J.I., Yusof N.A., Abdullah J. et al. // Mater. Sci. Eng. C. 2014. V. 45. P. 270. https://doi.org/10.1016/j.msec.2014.09.010
Milovanovic M., Arsenijevic A., Milovanovic J. et al. // Antimicrobial Nanoarchitectonics. 2017. P. 383. https://doi.org/10.1016/B978-0-323-52733-0.00014-8
Akbarzadeh A., Kafshdooz L., Razban Z. et al. // Artif. Cells. Nanomed. Biotechnol. 2018. V. 46. № 2. P. 263. https://doi.org/10.1080/21691401.2017.1307208
Galdiero S., Falanga A., Vitiello M. et al. // Molecules. 2011. V. 16. P. 8894. https://doi.org/10.3390/molecules16108894
Ge L., Li Q., Wang M. et al. // Int. J. Nanomed. 2014. V. 9. P. 2399. https://doi.org/10.2147/IJN.S55015
Lu L., Sun R.W., Chen R. et al. // Antiviral Therapy. 2008. V. 13. № 2. P. 253. https://doi.org/10.1177/135965350801300210
Sun R.W., Chen R., Chung N.P. et al. // Chem. Commun. 2005. V. 40. P. 5059. https://doi.org/10.1039/b510984a
Baram-Pinto D., Shukla S., Perkas N. et al. // Bioconjug. Chem. 2009. V. 20. № 8. P. 1497. https://doi.org/10.1021/bc900215b
Gaikwad S., Ingle A., Gade A. et al. // Int. J. Nanomed. 2013. V. 8. P. 4303. https://doi.org/10.2147/IJN.S50070
Taylor P.L., Omotoso O., Wiskel J.B. et al. // Biomaterials. 2005. V. 26. № 35. P. 7230. https://doi.org/10.1016/j.biomaterials.2005.05.041
Rogers J.V., Parkinson C.V., Choi Y.W. et al. // Nanoscale Res. Lett. 2008. V. 3. № 4. P. 129. https://doi.org/10.1007/s11671-008-9128-2
Lv X., Wang P., Bai R. et al. // Biomaterials. 2014. V. 35. № 13. P. 4195. https://doi.org/10.1016/j.biomaterials.2014.01.054
Hu R.L., Li S.R., Kong F.J. et al. // Genet. Mol. Res. 2014. V. 13. № 3. P. 7022. https://doi.org/10.4238/2014.March.19.2
Orlowski P., Tomaszewska E., Gniadek M. et al. // PLOS One. 2014. V. 9. № 8. https://doi.org/10.1371/journal.pone.0104113
Chen Y.-N., Hsueh Y.-H., Hsieh C.-T. et al. // Int. J. Environ. Res. Public Health. 2016. V. 13. P. 430. https://doi.org/10.3390/ijerph13040430
Lara H.H., Ayala -Nuñez N.V., Ixtepan-Turrent L., Rodriguez-Padilla C. // J. Nanobiotechnol. 2010. V. 8. № 1. https://doi.org/10.1186/1477-3155-8-1
Khandelwal N., Kaur G., Chaubey K.K. et al. // Virus Res. 2014. V. 190. P. 1. https://doi.org/10.1016/j.virusres.2014.06.011
Xiang D., Zheng Y., Duan W. et al. // Int. J. Nanomed. 2013. V. 8. P. 4103. https://doi.org/10.2147/IJN.S53622
Taylor P.L., Ussher A.L., Burrell R.E. // Biomaterials. 2005. V. 26. № 35. P. 7221. https://doi.org/10.1016/j.biomaterials.2005.05.041
Yadavalli T., Shukla D. // Nanomedicine. 2017. V. 13. P. 219. https://doi.org/10.1016/j.nano.2016.08.016
Chiodo F., Marradi M., Calvo J. et al. // Beilstein J. Org. Chem. 2014. V. 10. P. 1339. https://doi.org/10.3762/bjoc.10.136
Arnáiz B., Martínez-ávila O., Falcon-Perez J.M., Penadés S. // Bioconjug. Chem. 2012. V. 23. P. 814. https://doi.org/10.1021/bc200663r
Di Gianvincenzo P., Chiodo F., Marradi M., Penadés S. // Methods Enzymol. 2012. V. 509. P. 21. https://doi.org/10.1016/B978-0-12-391858-1.00002-2
Vijayakumar S., Ganesan S. // Curr. HIV Res. 2012. V. 10. № 8. P. 643. https://doi.org/10.2174/157016212803901383
Meléndez-Villanueva M.A., Morán-Santibañez K., Martínez-Sanmiguel J.J. et al. // Viruses. 2019. V. 11. P. 1111. https://doi.org/10.3390/v11121111
Lee M.-Y., Yang J.-A., Jung H.S. et al. // ACS Nano. 2012. V. 6. P. 9522. https://doi.org/10.1021/nn302538y
Baram-Pinto D., Shukla S., Gedanken A., Sarid R. // Small. 2010. V. 6. P. 1044. https://doi.org/10.1002/smll.200902384
Kim J., Yeom M., Lee T. et al. // J. Nanobiotechnol. 2020. V. 18. P. 54. https://doi.org/10.1186/s12951-020-00611-8
Paul A.M., Shi Y., Acharya D. et al. // J. Gen. Virol. V. 95. № 8. https://doi.org/10.1099/vir.0.066084-0
Williams J.P., Southern P., Lissina A. et al. // Int. J. Nanomed. 2013. V. 8. P. 2543. https://doi.org/10.2147/IJN.S44013
Jayant R.D., Atluri V.S.R., Agudelo M. et al. // Int. J. Nanomed. 2015. V. 10. P. 1077. https://doi.org/10.2147/IJN.S76517
Delaviz N., Gill P., Ajamia A., Aarabi M. // RSC Adv. 2015. V. 5. P. 79433. https://doi.org/10.1039/C5RA12209K
Qin T., Ma R., Yin Y. et al. // Theranostics. 2019. V. 9. № 23. P. 6920. https://doi.org/10.7150/thno.35826
Cui H., Jiang J., Gu W. et al. // Photochem. Photobiol. 2010. V. 86. № 5. P. 1135. https://doi.org/10.1111/j.1751-1097.2010.00763.x
Nakano R., Ishiguro H., Yao Y. et al. // Photochem. Photobiol. Sci. 2012. V. 11. № 8. P. 1293. https://doi.org/10.1039/c2pp05414k
Mazurkova N.A., Spitsyna Yu.E., Shikina N.V. et al. // Nanotechnologies in Russia. 2010. V. 5. P. 417. https://doi.org/10.1134/S1995078010050174
Levina A.S., Repkova M.N., Ismagilov Z.R. et al. // Russ. J. Bioorg. Chem. 2014. V. 40. P. 196. https://doi.org/10.1134/s1068162014020095
Levina A.S., Repkova M.N., Mazurkova N.A. et al. // Int. J. Antimicrob. Agents. 2015. V. 46. P. 125. https://doi.org/10.1016/j.ijantimicag.2015.03.004
Levina A.S., Repkova M.N., Bessudnova E.V. et al. // Beilstein J. Nanotechnol. 2016. V. 7. P. 1166. https://doi.org/10.3762/bjnano.7.108
Amirkhanov R.N., Mazurkova N.A., Amirkhanov N.V., Zarytova V.F. // Russ. J. Bioorg. Chem 2015. V. 41. P. 162. https://doi.org/10.1134/s1068162015020028
Mishra Y.K., Adelung R., Röhl C. et al. // Antivir. Res. 2011. V. 92. № 2. P. 305. https://doi.org/10.1016/j.antiviral.2011.08.017
Antoine T.E., Mishra Y.K., Trigilio J. et al. // Antivir. Res. 2012. V. 96. P. 363. https://doi.org/10.1016/j.antiviral.2012.09.020
Duggal N., Jaishankar D., Yadavalli T. et al. // Mol. Vis. 2017. V. 26. № 23. P. 26.
Ghaffari H., Tavakoli A., Moradi A. et al. // J. Biomed. Sci. 2019. V. 23. P. 26. https://doi.org/10.1186/s12929-019-0563-4
Tavakoli A., Ataei-Pirkooh A., Sadeghi G.M.M. et al. // Nanomedicine. 2018. V. 13. № 21. P. 2675. https://doi.org/10.2217/nnm-2018-0089
Kumar R., Sahoo G., Pandey K. et al. // Int. J. Infect. Dis. 2018. V. 73. P. 368. https://doi.org/10.1016/j.ijid.2018.04.4247
Fujimori Y., Sato T., Hayata T. et al. // Appl. Environ. Microbiol. 2012. V. 78. P. 951. https://doi.org/10.1128/AEM.06284-11
Broglie J.J., Alston B., Yang C. et al. // PLOS One. 2015. V. 10. e0141050. https://doi.org/10.1371/journal.pone.0141050
Hang X., Peng H., Song H. et al. // J. Virol. Methods. 2015. V. 222. P. 150. https://doi.org/10.1016/j.jviromet.2015.06.010
Tavakoli A., Hashemzadeh M.S. // J. Virol. Methods. 2020. V. 275. 113688. https://doi.org/10.1016/j.jviromet.2019.113688
Trigilio J., Antoine T.E., Paulowicz I. et al. // PLOS One. 2012. V. 7. e48147. https://doi.org/10.1371/journal.pone.0048147
Perde-Schrepler M., Florea A., Brie I. et al. // J. Nanomater. 2019. V. 2019. Art. 6090259. https://doi.org/10.1155/2019/6090259
Bahadar H., Maqbool F., Niaz K., Abdollahi M. // Iran. Biomed. J. 2016. V. 20. № 1. https://doi.org/10.7508/ibj.2016.01.001
Hussain F.S., Abro N.Q., Ahmed N. et al., Front. Nanotechnol. V. 4. (2022), https://doi.org/10.3389/fnano.2022.1064615
Adamcakova-Dodd A., Thorne P.S., Grassian V.H. // General, Applied and Systems Toxicology. 2011. https://doi.org/10.1002/9780470744307.gat244
Kumar V., Sharma N., Maitra S.S. // Int. Nano. Lett. 2017. V. 7. P. 243. https://doi.org/10.1007/s40089-017-0221-3
Yildirimer L., Thanh N.T.K., Loizidou M., Seifalian A.M. // Nano Today. 2011. V. 6. № 6. P. 585. https://doi.org/10.1016/j.nantod.2011.10.001
Shen Y., Hao T., Ou S. et al. // Med. Chem. Commun. 2017. V. 9. № 2. P. 226. https://doi.org/10.1039/c7md00158d
Zhao L., Seth A., Wibowo N. et al. // Vaccine. 2014. V. 32. № 3. P. 327. https://doi.org/10.1016/j.vaccine.2013.11.069
Kim M-G., Park J.Y., Shon Y. et al. // Asian. J. Pharm. Sci. 2014. V. 9. № 5. P. 227. https://doi.org/10.1016/j.ajps.2014.06.002
Raghuwanshi D., Mishra V., Suresh M.R. et al. // Vaccine. 2012. V. 30. № 50. P. 7292. https://doi.org/10.1016/j.vaccine.2012.09.036
Lepenies B., Lee J., Sonkaria S. // Adv. Drug. Deliv. Rev. 2013. V. 65. P. 1271. https://doi.org/10.1016/j.addr.2013.05.007
Thomas C., Rawat A., Hope-Weeks L., Ahsan F. // Mol. Pharm. 2011. V. 8. P. 405. https://doi.org/10.1021/mp100255c
Demento S.L., Cui W., Criscione J.M. et al. // Biomaterials. 2012. V. 33. P. 4957. https://doi.org/10.1016/j.biomaterials.2012.03.041
Silva A.L., Rosalia R.A., Sazak A. et al. // Eur. J. Pharm. Biopharm. 2013. V. 83. P. 338. https://doi.org/10.1016/j.ejpb.2012.11.006
Manish M., Rahi A., Kaur M. et al. // PLOS One. 2013. V. 8. e61885. https://doi.org/10.1371/journal.pone.0061885
Akagi T., Baba M., Akashi M. // Polymers in nanomedicine. Berlin: Springer-Verlag Berlin, 2012. V. 247. P. 31. https://doi.org/10.1007/12_2011_150
Giddam A.K., Zaman M., Skwarczynski M., Toth I. // Nanomedicine. 2012. V. 7. P. 1877. https://doi.org/10.2217/nnm.12.157
Moon J.J., Suh H., Bershteyn A. et al. // Nat. Mater. 2011. V. 10. P. 243. https://doi.org/10.1038/nmat2960
Park S.B. // Nature. 2012. V. 491. P. 21. https://doi.org/10.1038/491021a
Grgacic E.V., Anderson D.A. // Methods. 2006. V. 40. P. 60. https://doi.org/10.1016/j.ymeth.2006.07.018
Kanekiyo M., Wei C.-J., Yassine H.M. et al. // Nature. 2013. V. 499. P. 102. https://doi.org/10.1038/nature12202
Champion C.I., Kickhoefer V.A., Liu G. et al. // PLOS One. 2009. V. 4. e5409. https://doi.org/10.1371/journal.pone.0005409
Shah P., Bhalodia D., Shelat P. // Syst. Rev. Pharm. 2010. V. 1. P. 24. https://doi.org/10.4103/0975-8453.59509
Wang T., Zou M., Jiang H. et al. // Eur. J. Pharm. Sci. 2011. V. 44. P. 653. https://doi.org/10.1016/j.ejps.2011.10.012
Villa C.H., Dao T., Ahearn I. et al. // ACS Nano. 2011. V. 5. P. 5300. https://doi.org/10.1021/nn200182x
Mody K.T., Popat A., Mahony D. et al. // Nanoscale. 2013. V. 5. P. 5167. https://doi.org/10.1039/c3nr00357d
Carvalho L.V., Ruiz R.D.C., Scaramuzzi K. et al. // Vaccine. 2010. V. 28. P. 7829. https://doi.org/10.1016/j.vaccine.2010.09.087
Guo H.-C., Feng X.-M., Sun S.-Q. et al. // Virol. J. 2012. V. 9. P. 108. https://doi.org/10.1186/1743-422X-9-108
Cheng K., El-Boubbou K., Landry C.C. // ACS Appl. Mater. Interfaces. 2011. V. 4. P. 235. https://doi.org/10.1021/am2013008
He Q., Mitchell A.R., Johnson S.L. et al. // Clin. Diagn. Lab. Immunol. 2000. V. 7. P. 899. https://doi.org/10.1128/cdli.7.6.899-903.2000
He Q., Mitchell A., Morcol T., Bell S.J. // Clin. Diagn. Lab. Immunol. 2002. V. 9. P. 1021. https://doi.org/10.1128/cdli.9.5.1021-1024.2002
Peek L.J., Middaugh C.R., Berkland C. // Adv. Drug. Deliv. Rev. 2008. V. 60. P. 915. https://doi.org/10.1016/j.addr.2007.05.017
Stone J.W., Thornburg N.J., Blum D.L. et al. // Nanotechnology. 2013. V. 24. 295102. https://doi.org/10.1088/0957-4484/24/29/295102
Tao W., Ziemer K.S., Gill H.S. // Nanomedicine. 2014. V. 9. № 2. P. 237. https://doi.org/10.2217/nnm.13.58
Chen Y.-S., Hung Y.-C., Lin W.-H., Huang G.S. // Nanotechnology. 2010. V. 21. № 19. 195101. https://doi.org/10.1088/0957-4484/21/19/195101
Xu L., Liu Y., Chen Z. et al. // Nano Lett. 2012. V. 12. P. 2003. https://doi.org/10.1021/nl300027p
Neto L.M.M., Kipnis A., Junqueira-Kipnis A.P. // Front. Immunol. 2017. V. 8. P. 239. https://doi.org/10.3389/fimmu.2017.00239
Dykman L.A. // Expert Rev. Vaccines. 2020. https://doi.org/10.1080/14760584.2020.1758070
Pati R., Shevtsov M., Sonawane A. // Front. Immunol. 2018. V. 9. P. 2224. https://doi.org/10.3389/fimmu.2018.02224
Gavrilova Y.K., Generalov S.V., Kireev M.N. et al. // J. Microbiol Epidemiol Immunobiol. 2019. V. 5. P. 3.
Di Gianvincenzo P., Calvo J., Perez S. et al. // Bioconjug. Chem. 2015. V. 26. № 4. P. 755. https://doi.org/10.1021/acs.bioconjchem.5b00077
Climent N., García I., Marradi M. et al. // Nanomedicine. 2018. V. 14. № 2. P. 339. https://doi.org/10.1016/j.nano.2017.11.009
Wang Y., Wang Y., Kang N. et al. // Nanoscale Res. Lett. 2016. V. 11. № 1. P. 338. https://doi.org/10.1186/s11671-016-1554-y
Demenev V.A., Shchinova M.A., Ivanov L.I. et al. // Voprosy virusologii. 1996. V. 41. № 3. P. 107. (In Russian).
Tao W., Gill H.S. // Vaccine. 2015. V. 33. № 20. P. 2307. https://doi.org/10.1016/j.vaccine.2015.03.063
Tao W., Hurst B., Shakya A.K. et al. // Antiviral Res. 2017. V. 141. P. 62. https://doi.org/10.1016/j.antiviral.2017.01.021
Bimler L., Song A.Y., Le D.T. et al. // Immun. Ageing. 2019. V. 16. № 1. P. 23. https://doi.org/10.1186/s12979-019-0162-y
Dykman L.A., Staroverov S.A., Fomin A.S. // Gold Bull. 2018. V. 51. № 4. P. 197. https://doi.org/10.1007/s13404-018-0239-y
Dykman L.A., Staroverov S.A., Fomin A.S. et al. // Int. Immunopharmacol. 2018. V. 54. P. 163. https://doi.org/10.1016/j.intimp.2017.11.008
Wang C., Zhu W., Wang B.-Z. // Int. J. Nanomed. 2017. V. 12. P. 4747. https://doi.org/10.2147/IJN.S137222
Wang C., Zhu W., Luo Y. et al. // Nanomedicine. 2018. V. 14. № 4. P. 1349. https://doi.org/10.1016/j.nano.2018.03.007
Dykman L.A., Staroverov S.A., Mezhenny P.V. et al. // Gold Bull. 2015. V. 48. P. 93. https://doi.org/10.1007/s13404-015-0165-1
Teng Z., Sun S., Chen H. et al. // Vaccine. 2018. V. 36. № 45. P. 6752. https://doi.org/10.1016/j.vaccine.2018.09.030
Niikura K., Matsunaga T., Suzuki T. et al. // ACS Nano. 2013. V. 7. № 5. P. 3926. https://doi.org/10.1021/nn3057005
Antoine T.E., Hadigal S.R., Yakoub A.M. et al. // J. Immunol. 2016. V. 196. P. 4566. https://doi.org/10.4049/jimmunol.1502373
Fischer N.O., Infante E., Ishikawa T. et al. // Bioconjug. Chem. 2010. V. 21. P. 1018. https://doi.org/10.1021/bc100083d
Chue-Gonçalves M., Pereira G.N., Faccin-Galhardi L.C. et al. // Nanomaterials. 2021. V. 11. № 11. P. 3118. https://doi.org/10.3390/nano11113118
Ibrahim Fouad G. // Bull. Natl. Res. Cent. 2021. V. 45. https://doi.org/10.1186/s42269-021-00487-0
Allawadhi P., Singh V., Khurana A. et al. // Sens. Int. 2021. V. 2. 100101. https://doi.org/10.1016/j.sintl.2021.100101
Debnath S.K., Srivastava R. // Front. Nanotechnol. 2022. https://doi.org/10.3389/fnano.2021.813847
Hashemi S.A., Behbahan N.G.G., Bahrani S. et al. // Biosens. Bioelectron. 2021. V. 171. 112731. https://doi.org/10.1016/j.bios.2020.112731
Qiu G., Gai Z., Tao Y. et al. // ACS Nano. 2020. V. 14. P. 5268. https://doi.org/10.1021/acsnano.0c02439?ref=pdf
Moitra P., Alafeef M., Dighe K. et al. // ACS Nano. 2020. V. 14. P. 7617. https://doi.org/10.1021/acsnano.0c03822
Huang C., Wen T., Shi F.-J. et al. // ACS Omega. 2020. V. 5. P. 12550. https://doi.org/10.1021/acsomega.0c01554?ref=pdf
Mahari S., Roberts A., Shahdeo D., Gandhi S. // bioRxiv. 2020. https://doi.org/10.1101/2020.04.24.059204
Jeremiah S.S., Miyakawa K., Morita T. et al. // Biochem. Biophys. Res. Commun. 2020. V. 533. № 1. P. 195. https://doi.org/10.1016/j.bbrc.2020.09.018
Abo-zeid Y., Ismail N.S.M., McLeanc G.R., Hamdy N.M. // Eur. J. Pharm. Sci. 2020. V. 153. 105465. https://doi.org/10.1016/j.ejps.2020.105465
Chang S.Y., Huang K.Y., Chao T.L. et al. // Sci. Rep. 2021. V. 11. P. 8692. https://doi.org/10.1038/s41598-021-87254-3
Reina G., Peng S., Jacquemin L. et al. // ACS Nano. 2020. V. 14. P. 9364. https://doi.org/10.1021/acsnano.0c04117?ref=pdf
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии