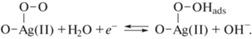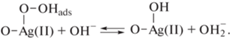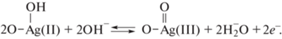Российские нанотехнологии, 2023, T. 18, № 2, стр. 218-224
Особенности электрохимических сенсоров на основе наночастиц серебра. влияние формы и размера
Д. О. Перевезенцева 1, *, Э. В. Горчаков 2, Е. А. Вайтулевич 1
1 Национальный исследовательский Томский политехнический университет
Томск, Россия
2 Ставропольский краевой институт развития образования, повышения квалификации
и переподготовки работников образования
Ставрополь, Россия
* E-mail: dop@tpu.ru
Поступила в редакцию 06.02.2022
После доработки 22.09.2022
Принята к публикации 26.09.2022
Аннотация
Рассмотрено влияние формы и размера наночастиц серебра (AgНЧ) на электрохимические характеристики сенсоров на их основе на примере определения пероксида водорода (Н2O2). Электрохимический сенсор на основе боргидрида натрия (БГ) позволяет получить однократное увеличение аналитического сигнала при добавлении Н2О2 концентрацией 1 × 10–7 М. Сенсор на основе сферических AgНЧ наименьшего размера (0.5–17.5 нм), полученных с использованием одновременно двух восстановителей БГ и цитрата натрия (Ц), позволяет повысить чувствительность определения H2O2 на 6 порядков (предел обнаружения равен 0.16 × 10–13 М). Диапазон определяемых концентраций Н2О2 изменяется внутри половины порядка и составляет (0.8–3.0) × 10–13 М. Сенсор на основе AgНЧ различной формы размером 10–55 нм, полученных с использованием Ц, также приводит к повышению чувствительности определения Н2О2 на 6 порядков (предел обнаружения равен 0.74 × 10–13 М). Данный сенсор имеет диапазон определяемых концентраций Н2O2 в пределах одного порядка (1–10) × 10–13 М. Обсуждаются причины различия чувствительности и диапазона определяемых концентраций Н2О2 на электрохимических сенсорах в зависимости от размера и формы AgНЧ. Предложен механизм взаимодействия адсорбированного кислорода с AgНЧ на поверхности сенсора.
ВВЕДЕНИЕ
Пероксид водорода является окислителем, восстановителем, а также источником атомарного кислорода. При значительных концентрациях Н2О2 является токсически опасным веществом для живых организмов. В связи с этим необходимо контролировать его содержание в биоорганических объектах. Традиционно для определения Н2O2 используют титриметрию [1], колориметрию [2], спектрофотомерию [3], хемилюминесценцию [4], флуориметрию [5], хроматографию [6]. Недостатками этих методов являются длительная процедура определения, высокая стоимость реактивов и оборудования, низкая воспроизводимость и чувствительность методик. Данные недостатки исключены в одном из направлений электрохимии – вольтамперометрия с электродами, модифицированными наночастицами (НЧ) металлов [7]. В табл. 1 проведено сравнение некоторых сенсоров, применяемых в вольтамперометрии.
Таблица 1.
Cравнение характеристик некоторых сенсоров для определения Н2O2
| Электрод | Модификатор | pH | Предел обнаружения, мкм | Диапазон определяемых концентраций, мкм | Литература |
|---|---|---|---|---|---|
| Серебряный электрод | 78 | 87–3.5 × 103 | [8] | ||
| Угольно-пастовый электрод | Нанокомпозит на основе кремния и серебра | 7.38, ФБ | 0.45 | 1.65–5.0 | [9] |
| Pt-электрод | 7.38, ФБ | 0.45 | 1.65–5.0 | [10] | |
| Стекло-графитовый | Композит гибридное серебро/фосфомолибдат/полианилин | 1 М Н2SO4 | 0.75 | 2–20 | [11] |
| Стекло-графитовый | НЧ Pd | 7.38, ФБ | 0.33 | 1–7 | [12] |
| 6.79 | 1–14 | ||||
| Au-электрод | НЧ Au | 7.38, ФБ | 0.5 | 1–8 | [13] |
| Графит-восковый композитный | Прусская голубая пленка, модифицированная НЧ Au | 7.38 ФБ | 0.014 | 4.8 × 10−2–7.4 × 10−2 | [14] |
Предел обнаружения на электрохимическом сенсоре на основе компактного серебра составляет 78 мкм [8]. При этом использование НЧ металлов для изготовления сенсоров позволяет снизить пределы обнаружения от одного до нескольких порядков (<мкм) и расширить диапазон определяемых концентраций [9–14]. Причины повышения чувствительности определения Н2O2 с использованием сенсоров на основе НЧ металлов обусловлены их уникальными физическими и химическими свойствами и величиной отношения площади к их поверхности [15].
Между тем отсутствуют данные о влиянии формы и размера НЧ на электрохимические свойства сенсоров в сравнении с оптическими методами, где сдвиг спектра и усиление аналитического сигнала зависят от формы частиц [16].
Наибольшее усиление локального электромагнитного поля наблюдается вблизи несферических наночастиц Ag (AgНЧ) за счет полей, образующихся на различных гранях (наностержни, плоские частицы, треугольники и т.п.) и остриях [17]. Наименьшее усиление наблюдается вблизи сферических агломерированных частиц, обладающих более компактным расположением за счет уменьшения расстояния между частицами вплоть до их перекрывания, что приводит к снижению образования “горячих точек”.
Поэтому представляло интерес исследовать влияние формы и размера частиц на чувствительность определения Н2О2 в вольтамперометрии на примере сенсора на основе AgНЧ как доступного и недорогого из благородных металлов, а также обладающего высокой степенью сродства к кислороду, в частности пероксида водорода. В связи с этим целью работы было изучение влияния формы и размера AgНЧ на электрохимические характеристики сенсоров, установление электрохимического механизма в присутствии Н2O2 и возможности его определения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Все химические реагенты использовали аналитической чистоты Merc (Darmstadt, Germany). Растворы Н2O2 готовили непосредственно перед экспериментальными определениями на бидистиллированной воде (Бидистиллятор БС, ХИМЛАБОРПРИБОР, Россия). Массовую концентрацию Н2O2 определяли титриметрическим методом – перманганатометрией по стандартной методике.
Условия синтеза AgНЧ. AgНЧ различных размеров и форм были синтезированы с использованием трех методов получения [18]. Во всех случаях нитрат серебра (AgNO3) использовали в качестве прекурсора.
Цитратная методика (Ц). В колбу помещали 10 мл 1 × 10–4 М AgNO3, добавляли 30 мл 10–4 М Na3C6H5O7 и 60 мл бидистиллированной воды, полученную смесь нагревали и кипятили до получения золя желтого цвета.
Боргидридцитратная методика (БГЦ). В колбу помещали 10 мл 1 × 10–4 М AgNO3, добавляли 30 мл 10–4 М Na3C6H5O7 и 60 мл бидистиллированной воды, после чего добавляли 0.03 мл 0.015 М NaBH4 по каплям до получения золя желтого цвета.
Боргидридная методика (БГ). В колбу помещали 10 мл 1 × 10–4 М AgNO3, добавляли 85 мл бидистиллированной воды, смесь перемешивали. Затем к полученному раствору добавляли 0.03 мл 0.015 М NaBH4 по каплям до появления желтой окраски золя.
Характеризация AgНЧ. Форму AgНЧ и их размер (обозначеных соответственно AgНЧ–Ц, AgНЧ–БГЦ и AgНЧ–БГ) определяли методом просвечивающей электронной микроскопии (ПЭМ) на приборе “JEM-2100F” (Япония). Образцы готовили нанесением капли реакционной системы на медные сетки с углеродной подложкой с последующей сушкой на воздухе. После получения ПЭМ-изображений проводили построение диаграммы распределения частиц по размерам согласно статистическим данным не менее чем для 1000 частиц с применением программы iTEM-Olympus (Япония).
Получение электрохимического сенсора на основе AgНЧ. Поверхность импрегнированного графитового электрода (ГЭ) (ТомьАналит, Россия) обновляли механически с помощью фильтровальной бумаги, затем проводили электрохимическую поляризацию ГЭ следующим образом: ГЭ помещали в электрохимическую ячейку, заполненную 0.1 M HNO3, и выдерживали в диапазоне потенциалов Е = 0.0–1.0 В в течение 60 с. Далее ГЭ ополаскивали бидистиллированной водой и помещали в электрохимическую ячейку, содержащую 10 мл золя серебра. AgНЧ осаждали на поверхность ГЭ при потенциале Еэл = –0.8 В в течение tэл = 300 с. Затем ГЭ сразу удаляли из золя серебра, ополаскивали бидистиллированной водой и переносили в другую электрохимическую ячейку, заполненную 0.1 M NaOH, для регистрации вольтамперных зависимостей Н2О2. Полученные ГЭ, модифицированные наночастицами AgНЧ–Ц, AgНЧ–БГЦ и AgНЧ–БГ, использовали в качестве сенсоров (ГЭ–AgНЧ–Ц, ГЭ–AgНЧ–БГЦ и ГЭ–AgНЧ–БГ соответственно) для получения циклических вольтамперных зависимостей.
Методика электрохимического определения Н2О2. Циклические вольтамперные зависимости Н2О2 регистрировали с помощью вольтамперометрического анализатора ТА-2 (Россия) с использованием трехэлектродной ячейки, состоящей из сенсора, электрода сравнения и вспомогательного электрода. В электрохимическую ячейку, заполненную 10 мл 0.1 М NaOH, помещали три электрода. Циклическую вольтамперную зависимость AgНЧ регистрировали на ГЭ–AgНЧ в области развертки потенциалов от –1.0 до +1.5 В при скорости их развертки 40 мВ/с. Затем в электрохимическую ячейку добавляли 50 мкл 1 × 10–11 М Н2О2, перемешивали раствор и регистрировали вольтамперную зависимость Н2О2 в тех же условиях. Далее в ячейку добавляли еще 50 мкл 10–11 М Н2О2, перемешивали раствор и регистрировали вольтамперную зависимость Н2О2 в тех же условиях. По высоте его максимума вычисляли концентрацию Н2О2 в растворе по методу “введено–найдено”.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
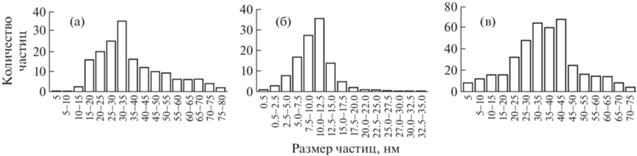
На рис. 1 приведены ПЭМ-изображения частиц, полученных по трем представленным выше методикам. Согласно результатам ПЭМ при использовании в качестве восстановителя Ц образуются неагрегированные AgНЧ параллелепипедной, призматической, пирамидальной, цилиндрической, усеченной конусообразной форм размером 10–55 нм (рис. 1а). При использовании смеси восстановителей БГ и Ц образуются малоагрегированные AgНЧ почти сферической формы (рис. 1б) размером 0.5–17.5 нм. При использовании БГ образуются AgНЧ сферической формы, агломерированные в частицы неправильной формы большего размера до 65 нм (рис. 1в).
На рис. 2 показаны диаграммы распределения по размерам AgНЧ со средними размерами 10.60 ± 3.8, 11.2 ± 7.9 и 25.3 ± 9.4 нм (рис. 2). Эти данные подтверждают, что на размеры AgHЧ и их разбросы влияет природа восстановителя.
Далее были изучены электрохимические характеристики сенсоров на основе AgНЧ, полученных с использованием восстановителей различной природы.
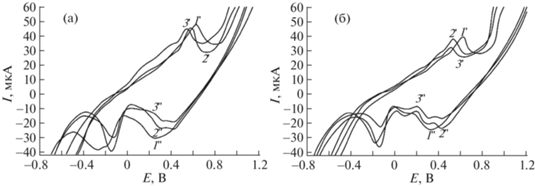
На рис. 3а представлены вольтамперные зависимости электрохимических сенcоров в фоновом электролите без добавления Н2О2, на рис. 3б – с добавлением. При сравнении циклических вольтамперныых зависимостей наблюдается появление дополнительного максимума на катодной ветви при добавлении Н2О2 в диапазоне потенциалов от 0.0 до 0.3 В. При введении первой добавки Н2О2 потенциал катодного максимума на ГЭ–AgНЧ–БГЦ при Е = 0.25 В (зависимость 1'') смещен на 110 мВ в отрицательную область по сравнению с потенциалами максимумов ГЭ–AgНЧ–Ц (зависимость 2'') и ГЭ–AgНЧ–БГ (зависимость 3''). Смещение потенциалов катодного и анодного максимумов Н2О2 на сенсорах AgНЧ–БГЦ зависит от размера частиц, обусловленного природой восстановителя [19]. Чем меньше размер частиц, тем больше сдвиг [20], что характерно для двух восстановителей и подтверждается с помощью ПЭМ (рис. 1б).
Рис. 3.
Вольтамперные зависимости сенсоров на основе AgНЧ (а) и AgНЧ + H2O2 (б) в 0.1 М NaOH, w = 40 мВ/с: 1', 1'' – AgНЧ-БГЦ; 2', 2'' – AgНЧ-Ц; 3', 3'' – AgНЧ-БГ. “'” – анодная зависимость, изменение в диапазоне потенциала от минус 0.8 до плюс 1.2 В, “''’” – катодная зависимость, изменение в диапазоне потенциала от +1.2 до –0.8 В.
Появление дополнительного максимума (рис. 3б) на катодных ветвях всех циклических зависимостей отвечает процессу восстановления Н2O2. Согласно [21, 22] этот механизм можно записать как
Известно, что процесс образования Н2О2 является сложной реакцией, протекающей в несколько стадий. На основании [8, 23] первой стадией является адсорбция ОН–-групп на поверхности AgНЧ.
Второй стадией является замещение OHадс молекулой кислорода (О2), т.е. ее адсорбция в сочетании с переносом заряда на Ag(II)-центры. С работами [8, 10, 24] согласуется схема адсорбции кислорода на поверхности AgНЧ:
Далее адсорбированные молекулы кислорода восстанавливаются по схеме
Можно предположить, что реакции адсорбции кислорода (1) и восстановления Н2О2 (2) на AgНЧ являются медленными. Затем происходит десорбция ${\text{HO}}_{2}^{ - }$ с поверхности AgНЧ согласно схеме
В стадийном процессе это можно отобразить, полагая, что восстановление O–OHадс происходит в последовательных химической и электрохимической реакциях.
Дальнейшее протонирование адсорбированного кислорода с учетом изложенного выше можно рассматривать как редокс-переход Ag(II)/Ag(III) по схеме
Схема (4) с промежуточным образованием H2O2 обусловлена активностью редокс-перехода Ag(II)/Ag(III) в виде оксидных форм в реакции восстановления кислорода до ${\text{HO}}_{2}^{ - }$.
Для подтверждения механизма генерации Н2О2 на поверхности электрохимического сенсора на основе AgНЧ рассмотрено введение Н2О2 в исследуемую систему.
На рис. 4 показаны типичные вольтамперные зависимости для фоновой кривой (1) и H2O2 при концентрации 2.0 × 10–13 М (кривая 2), 4.0 × 10–13 М (кривая 3) на ГЭ–AgНЧ–Ц. Установлено, что при Eп = +0.18 В наблюдается пропорциональное увеличение максимальной высоты в присутствии 2.0 × 10–13 М и 4.0 × 10–13 М H2O2 на ГЭ–AgНЧ–Ц. Дальнейшее увеличение концентрации H2O2 () до 10.0 × 10–13 М приводит к линейному увеличению аналитического синала от его концентрации на ГЭ–AgНЧ–Ц (рис. 5, кривая 2). Аналогичный эффект получен для ГЭ–AgНЧ–БГЦ (рис. 5, кривая 1). Линейность и предел обнаружения H2O2 представлены в табл. 2.
Рис. 4.
Вольтамперные зависимости пероксида водорода от его концентрации на сенсоре на основе AgНЧ–Ц в 0.1 М NaOH при скорости изменения потенциала 40 мB c–1, ${{C}_{{{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}$: 0.0 М (1), 2.0 × 10–13 М (2), 4.0 × 10–13 М (3).

Рис. 5.
Градуировочные зависимости ГЭ–AgНЧ–Ц (1) и ГЭ–AgНЧ–БГЦ (2): 1 – Y = 0.88 × X – 0.12 (R = = 0.99); 2: – Y = 0.83 × X + 0.32 (R = 0.97).
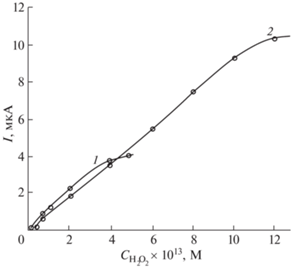
Таблица 2.
Пределы обнаружения и диапазон определяемых концентраций H2O2 на сенсорах на основе AgНЧ в модельных растворах
| Сенсор | Предел обнаружения | Интервал концентраций, лежащий в линейной области градуировочного графика |
|---|---|---|
| ГЭ–AgНЧ–Ц | (0.74 ± 0.30) × 10–13 М | (1.0–10.0) × 10–13 М |
| ГЭ–AgНЧ–БГЦ | (0.16 ± 0.12) × 10–13 М | (0.8–3.0) × 10–13 М |
| ГЭ–AgНЧ–БГ | (0.2 ± 0.1) × 10–7 М |
Как видно из табл. 2, при добавлении Н2О2 концентрацией 10–7 М на ГЭ–AgНЧ–БГ наблюдается однократное увеличение аналитического сигнала. Связано это с тем, что сферические частицы AgНЧ–БГ (рис. 1) располагаются более компактно за счет агломерации, т.е. частицы слипаются с образованием сшивок между сферами, что приводит к перекрыванию “горячих точек”. Поэтому последующее добавление Н2О2 не приводит к увеличению аналитического сигнала.
При добавлении Н2О2 на ГЭ–AgНЧ–БГЦ повышается чувствительность определения на шесть порядков и наблюдается линейный диапазон электрохимического сигнала в интервале половины порядка по сравнению с ГЭ–AgНЧ–БГ (табл. 2). Причиной увеличения чувствительности и диапазона определяемых концентраций Н2О2 является более равномерное заполнение поверхности электрода сферическими неагломерированными AgНЧ с определенным зазором между ними, где происходит образование “горячих точек”.
При использовании ГЭ–AgНЧ–Ц для определения Н2О2 в растворе происходит повышение чувствительности на 6 порядков по сравнению с ГЭ–AgНЧ–БГ и расширение диапазона определяемых концентраций Н2О2 на половину порядка по сравнению с ГЭ–AgНЧ–БГЦ (табл. 2). Это обусловлено взаимодействием Н2О2 на гранях частиц AgНЧ–Ц различной формы (треугольной, призматической, пирамидальной) и в изломах, образующихся при формировании поверхности сенсора [10, 25].
Таким образом, диапазон определяемых концентраций Н2О2 зависит от формы и размера AgНЧ, участвующих в формировании поверхности сенсора.
ЗАКЛЮЧЕНИЕ
Электрохимический сенсор на основе AgНЧ–БГ имеет низкую чувствительность (однократное увеличение аналитического сигнала при добавлении Н2О2 концентрации 10–7 М). Низкая чувствительность обусловлена агломерированием AgНЧ в момент получения в крупные частицы, сопровождаемым уменьшением количества “горячих точек” на поверхности сенсора.
При использовании электрохимического сенсора на основе смеси БГ и Ц происходит резкое повышение чувствительности по сравнению с сенсором на основе AgНЧ–БГ на 6 порядков. Предел обнаружения Н2О2 составляет 0.16 × 10–13 М, при этом линейность наблюдается в пределах половины порядка диапазона концентраций (0.8–3.0) × 10–13 М. Узкий диапазон линейности определяемой концентрации H2O2 на сенсоре ГЭ–AgНЧ–БГЦ вызван тем, что формирование “горячих точек” между мелкими сферическими неагломерированными частицами размером от 0.5 до 17.5 нм происходит в небольшом диапазоне расстояний между частицами.
При использовании электрохимического сенсора на основе AgНЧ–Ц наблюдается повышение чувствительности определения Н2О2 по сравнению с сенсором на основе AgНЧ–БГ на 6 порядков (предел обнаружения 0.74 × 10–13 М), диапазон определяемых концентраций больше одного порядка (1.0–10.0) × 10–13 М. Расширение диапазона определения Н2О2 обусловлено взаимодействием Н2О2 на гранях AgНЧ–Ц различной формы (треугольной, призматической, пирамидальной) и на изломах при формировании поверхности сенсора.
В работе предложен механизм взаимодействия адсорбированного кислорода с AgHЧ на поверхности сенсора в щелочной среде. Особенность данного процесса восстановления кислорода до ${\text{HO}}_{2}^{ - }$ обусловлена активностью редокс-перехода Ag(II)/Ag(III) в виде оксидных форм при потенциале электролиза +1.5 В.
Список литературы
Liang Cн., He B. // Chemosphere. 2018. V. 198. P. 297.
Üzer A., Durmazel S., Erc¸a˘g E., Apak R. // Sens. Actuators. B. 2017. V. 247. P. 98. https://doi.org/10.1016/j.snb.2017.03.012
Singh Sunil K., Narayana B. // Bull. Environ. Contam. Toxicol. 2008. V. 81. P. 422. https://doi.org/10.1007/s00128-008-9477-7
Vdovenko M.M., Demiyanova A.S., Kopylov K.E., Sakharov I.Y. // Talanta. 2014. V. 125. P. 361. https://doi.org/10.1016/j.talanta.2014.03.040
Amouroux D., Donard O.F.X. // Oceanologica Acta. 1995. V. 18. № 3. P. 353. https://archimer.ifremer.fr/doc/00097/20784/
Mengru Liu, Qian Zhang, Huaiyu Zhan // Bioresoursces. 2014. V. 9 (3). P. 4510. https://doi.org/10.15376/BIORES.9.3.4510-4516
Richard C. Barry, Yuehe Lin, Jun Wang // J. Expo Sci Environ. Epidemiol. 2009. V. 19 (1). P. 1. https://doi.org/10.1038/jes.2008.71
Bockris J.O’M., Otagawa T. // J. Phys. Chem. 1983. V. 87. № 15. P. 2960.
Suntivich J., Gasteiger H.A., Yabuuchi N. et al. // Nature Chem. 2011. V. 3. № 8. P. 546.
Briega-Martos V., Herrero E., Feliu J.M. // Electrochim. Acta. 2017. V. 241. P. 497. https://doi.org/10.1016/J.ELECTACTA.2017.04.162
Manivel A., Anandan S. // J. Solid State Electrochem. 2011. V. 15. P. 153. https://doi.org/10.1007/S10008-010-1080-2
Kitte S.A., Assresaaahegn B.D., Soreta T.R. // J. Serbian Chem. Soc. 2013. V. 78. № 5. P. 701.
Xu S., Peng B., Han X. // Biosens. Bioelectron. 2007. V. 22. P. 1807.
Prabhu P., Babu S., Narayanan S.S. // J. Solid State Electrochem. 2014. V. 18. № 4. P. 883.
Xia Y., Xiong Y., Lim B., Skrabalak S.E. // Chem. Int. Ed. 2009. V. 23. № 15. P. 6.
Chen S., Carroll D.L. // Nano Lett. 2002. V. 34. № 9. P. 1003.
Li Lin, Xinyuan Bi, Yuqing Gu et al. // J. Appl. Phys. 2021. V. 129. P. 191101. https://doi.org/10.1063/5.0047578
Perevezentseva D., Gorchakov E., Petrushin M. et al. // AIP Conf. Proc. 2016. V. 1772. P. 020005. https://doi.org/10.1063/1.4964527
Меретуков М.А. Золото: химия, минералогия, металлургия. М.: ИД “Руда и металлы”, 2008. 528 с.
Brainina K., Galperin L., Vikulova E., Galperin A.L. // J. Solid State Electrochem. 2012. V. 17. P. 43. https://doi.org/10.1007/s10008-012-1852-y
Perevezentseva D., Gorchakov E., Fedotova D. et al. // Key Eng. Mater. 2017. V. 743. P. 287. https://doi.org/10.4028/www.scientific.net/KEM.743.287
Кравченко Т.А., Конев Д.В., Вахнин Д.Д., Чумакова А.В. // Российские нанотехнологии. 2019. Т. 14. № 11–12. С. 15. https://doi.org/10.21517/1992-7223-2019-11-12-15-22
Wang Y., Cheng H.P. // J. Phys. Chem. C. 2013. V. 117. № 5. P. 2106.
Suntivich J., Gasteiger H.A., Yabuuchi N. et al. // Nature Chem. 2011. V. 3. № 8. P. 546.
Yuan Tianyu, Wuhan Yuan, Liping Liu, Jerry W. Shan. // J. Fluid Mech. 2021. V. 924. https://doi.org/10.1017/jfm.2021.653
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии