Российские нанотехнологии, 2023, T. 18, № 3, стр. 368-376
Наноструктурированная форма хитозана: способ получения и биологическая активность
Э. В. Попова 2, Н. С. Домнина 1, И. М. Зорин 1, *, А. А. Лезов 1, И. И. Новикова 2, И. Л. Краснобаева 2
1 Санкт-Петербургский государственный университет
Санкт-Петербург, Петергоф, Россия
2 Всероссийский научно-исследовательский институт защиты растений
Санкт-Петербург, Пушкин, Россия
* E-mail: i.zorin@spbu.ru
Поступила в редакцию 20.12.2022
После доработки 01.02.2023
Принята к публикации 01.02.2023
Аннотация
Методом дробного осаждения при рН 5.0 и 7.5 синтезированы наночастицы хитозана различной молекулярной массы. Методом атомно-силовой микроскопии показано формирование плотных частиц при рН 7.5 и рыхлых гелеобразных частиц при рН 5. Дисперсия наночастиц, полученная при рН 5, обладает повышенной фунгицидной и бактерицидной активностью в отношении Cohliobolus sativus, Alternaria solani Sorauer и Clavibacter michiganensis subsp.michiganensis (Smith) Davis et al. (штамм101) за счет более высокой доступности аминогрупп в более рыхлых наночастицах. Предлагаемая процедура получения наночастиц хитозана является экологически чистой и дает возможность получать полностью биосовместимые бактерицидные и фунгистатические средства защиты растений.
ВВЕДЕНИЕ
В последние годы значительно возрос интерес к разработкам наночастиц на основе хитозана и применению их, в частности, в сельском хозяйстве. Хитозан широко используется в медицине, пищевой промышленности, сельском хозяйстве и др. [1–6]. Он обладает комплексом ценных свойств – нетоксичность, биосовместимость, способность к биодеградации, поликатионная природа. Широкий спектр биологической активности определяет его использование в агротехнологии как основу препаратов для стимулирования роста растений, а также защиты растений от грибковых, вирусных и бактериальных поражений [1–4]. При этом успешно продолжается разработка новых препаратов на основе хитозана. Наиболее часто для усиления биологической активности в структуру полимера вводят различные функциональные молекулярные фрагменты. Это могут быть сигнальные молекулы, антиоксиданты и другие вещества с биологической активностью [2–4]. Диапазон применения хитозана мог бы быть расширен за счет повышения его растворимости при нейтральных значениях рН, что может быть реализовано путем замены части гидроксильных и аминогрупп в цепях хитозана на карбоксильные группы [7–11].
Хитозан сам по себе обладает значительной антимикробной активностью за счет большого количества аминогрупп, присоединенных к основной цепи, что придает его макромолекуле сильнокатионный характер. Поэтому привлекательна идея использования хитозана в качестве “зеленого” бактерицидного и фунгицидного реагента для защиты растений. К сожалению, хитозан растворим только в кислых средах, токсичных для растений, и это является серьезным препятствием для использования молекулярной формы хитозана в средствах защиты растений. Однако в нейтральной среде хитозан может быть получен в форме нано- или микрочастиц. Дисперсии наночастиц (НЧ) хитозана вполне стабильны в нейтральных буферных растворах и полностью биосовместимы.
Интерес к использованию НЧ различных полимеров в сельскохозяйственных препаратах сильно возрос [12–14], поскольку физические, химические и биологические свойства НЧ сильно отличаются от объемных свойств того же полимера. Это обусловлено сочетанием малых размеров и очень большой удельной поверхностью НЧ, чем меньше размер частиц, тем больше их способность проникать сквозь клеточные мембраны и возможности доставлять биологически-активные вещества в клетку [15–18].
Существует обоснованное мнение, что использование хитозана в форме НЧ может существенно повысить его эффективность и создать определенные преимущества в борьбе с различными болезнями растений. Перспективы повышения устойчивости растений к биотическим и абиотическим стрессам за счет использования нанотехнологий и наноматериалов на основе хитозана обсуждаются в ряде обзорных работ [19–21]. Известно, что хитозан повышает иммунный ответ у растений, но сконструированный в виде НЧ он вызывает усиленный ответ на биотические стрессоры за счет новых механизмов доставки питательных веществ. Например, обработка листьев Camellia sinensis НЧ хитозана вызывает более высокую активность защитных ферментов, увеличение уровней антиоксидантных ферментов, а также фенолов и флавоноидов по сравнению с опытом, где обработка проводится хитозаном [22]. Положительные результаты применения НЧ хитозана в растениеводстве для обеспечения роста растений и защиты их от болезней стимулируют расширение исследований по разработке технологий получения НЧ хитозана [23–32].
Из всего многообразия способов получения НЧ хитозана большое внимание уделяется тем методам, в которых получаемые НЧ обладают стабильностью, нетоксичностью, простотой образования, контролируемыми условиями их получения и др. [33, 34]. Метод ионотропного гелеобразования привлекателен возможностью тщательного контроля свойств НЧ, отсутствием побочных химических реакций, а также использованием нетоксичного агента триполифосфата. Этот метод был ранее использован для получения НЧ из хитозана с различной молекулярной массой. Испытания антагонистической активности в отношении тест-культур фитопатогенных бактерий и грибов показали, что дисперсии полученных НЧ имеют более высокую активность по сравнению с растворами хитозана [35]. Это означает, что хитозан в чистом виде в форме сшитых НЧ может быть перспективен для разработки антимикробных препаратов для растениеводства.
Данная работа посвящена получению дисперсий нанохитозана (НХ) методом дробного осаждения и изучению влияния молекулярной массы исходного хитозана, рН растворов на физико-химические свойства образующихся НЧ, а также оценке антимикробной активности дисперсий НХ. Метод дробного осаждения раствора хитозана щелочью выгодно отличается от ионотропного гелеобразования тем, что образующаяся при этом наноструктурированная форма хитозана (НХ) состоит только из макромолекул хитозана. Отсутствие в НЧ других компонентов кроме хитозана и методическая простота получения такого НХ делают этот способ наиболее приемлемым для использования в растениеводстве [36].
РЕАГЕНТЫ И МЕТОДЫ
В работе использовали хитозан с молекулярной массой (ММ) 150 кДа и степенью деацетилирования 85% (Биопрогресс, Россия). Образцы с ММ 60, 14 и 6.5 кДа получали методом контролируемой окислительной деструкции в кислых растворах нитрита натрия [37]. ММ определяли вискозиметрическим методом [38].
0.1 г хитозана растворяли в 100 мл 1%-ной уксусной кислоты и фильтровали через шприцевой фильтр с размером пор мембраны 0.45 мкм. К этому раствору, имеющему рН 3.4, при постоянном перемешивании и температуре 20°C прибавляли 0.1 М раствор гидроксида калия со скоростью 0.2 мл/мин с использованием шприцевого насоса “Bestran” до достижения необходимого значения рН (обозначение НХ-7 соответствует образцам, полученным в среде при рН = 7.5; обозначение НХ-5 соответствует образцам, полученным в среде при рН = 5.0). Образовавшиеся НЧ хитозана отделяли центрифугированием в течение 1 ч при 6200 об./мин, затем промывали деионизованной водой до рН 6.5. После этого ресуспендировали в деионизованной воде с добавлением неионного поверхностно-активного вещества Twin-80 на ультразвуковой установке “Сапфир” в течение 0.5 ч. Дисперсию НЧ, полученных при рН 5.0, дополнительно фильтровали через фильтр с размером пор 0.45 мкм. Итоговую концентрацию НЧ в дисперсиях определяли гравиметрическим методом. Дисперсии хранили при температуре +4°C.
Исследования методом динамического рассеяния света (ДРС) выполнены на установке Photocor Complex spectrometer при 25°C на длине волны λ0 = 445 нм.
Образцы для исследования методом атомно-силовой микроскопии (АСМ) готовили на слюде [35] с использованием дисперсий, состаренных в течение одного года. Каплю дисперсии объемом 15 мкл наносили на свежий скол слюды размером 7 × 7 мм, выдерживали 1 мин, после чего раскручивали со скоростью 3000 об./мин в течение 1 мин и окончательно высушивали в течение 24 ч в эксикаторе над концентрированной серной кислотой. АСМ-изображения получали на приборе VEECO diNanoscope V (США) в режиме tapping mode™ с использованием зондов HA_NA (NT-MDT, Россия). Для обработки изображений использовали программное обеспечение Nanoscope Analysis 1.2.
Для экспериментов из “Государственной коллекции микроорганизмов, патогенных для растений и их вредителей” Центра коллективного пользования научным оборудованием “Инновационные технологии защиты растений” ВИЗР были предоставлены следующие штаммы фитопатогенных микроорганизмов: Alternaria solani Sorauer, Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al. (штамм101), Cohliobolus sativus (S. Itod Kurib).
Оценку антибактериальной активности образцов по отношению к C. michiganensis (штамм 101, возбудитель бактериального рака томатов) и противогрибковой активности по отношению к A. solani и C. sativus (возбудители листовых пятнистостей широкого спектра сельскохозяйственных культур) проводили методом диффузии в агар (метод лунок) и методом агаровых блоков. При тестировании методом лунок в агаре Чапека, засеянного тест-культурой, стерильным пробочным сверлом вырезали лунки диаметром 7 мм и пипеткой помещали в них растворы НЧ образцов хитозана с разными концентрациями. Через 4‒5 сут выращивания в термостате при 22‒25°С измеряли диаметр зоны отсутствия роста тест-культуры вокруг лунки. При изучении прямого фунгистатического действия исследуемых образцов методом агаровых блоков [39] в теплую агаризованную среду Чапека вносили растворы НЧ определенного объема, рассчитывая конечную концентрацию в среде в зависимости от исходной концентрации НЧ. После застывания среды на поверхности среды помещали блоки десятисуточных микромицетов C. sativus и A. solani диаметром 6 мм. В качестве контроля служили чашки с агаризованной средой Чапека с блоками тест-культуры без испытуемых образцов. Чашки инкубировали в темноте при 25°C. Диаметры колоний гриба измеряли на третьи, пятые сутки совместного культивирования, после чего оценивали фунгистатическое действие испытуемых образцов по формуле Эббота. Все биологические опыты проводили в трехкратной повторности. Полученные данные обрабатывали с использованием методов описательной статистики (на основе стандартных ошибок средних ±SEM). Уровень различий между средними значениями определяли по критерию наименьшей существенной разницы на 95%-ном уровне значимости (НСР 0.05).
РЕЗУЛЬТАТЫ
Получение НХ методом дробного осаждения заключается в осаждении хитозана из его раствора за счет очень медленного приливания (прикапывания) раствора щелочи [36, 40]. Отметим, что для реализации этого метода обычно используют хитозан с ММ не выше 70 кДа [36]. В настоящей работе методом окислительной деструкции хитозана (М = 150 кДа) по методике [37] были получены образцы с ММ 6.5, 14 и 60 кДа. Получение всех трех образцов из одного исходного хитозана имело целью в дальнейшем провести сравнительное изучение биологических свойств полученного из них НХ.
Осаждение хитозана из кислого раствора (рН = 3.4) проводили раствором 0.1 N KOH. Уже при рН 5.5 начинается визуально видимый процесс выделения хитозана, а при рН = 7–8 весь полимер в виде гелеобразной массы оседает на дно. Осадок ресуспендировали в деионизированной воде с добавлением Twin-80, который в данном случае служил поверхностным модификатором НХ [40]. Параметры дисперсий НХ-7 зависели от ММ хитозана, от количества и момента добавления Twin-80 (табл. 1).
Таблица 1.
Параметры дисперсий НХ-7 в деионизованной воде
| Образец | MМ, кДа | C, г/л | Twin-80, % ** | Rh при pH = 3.4, нм | Rh НХ, нм |
|---|---|---|---|---|---|
| 1 | 6.5 | 1.0 | 0 | 6, 46 | 43, 147 |
| 2 | 14 | 0.9 | 5, a | 7, 54 | 50, 200 |
| *2ф | 0.8 | 5, a | 111 | ||
| 3 | 1.1 | 10, a | 39, 123 | ||
| 4 | 60 | 1.0 | 5, b | 7, 153 | 50, 190 |
| 5 | 0.9 | 2.5, a | 40, 250 | ||
| 6 | 1.1 | 5, c | 42, 220 | ||
| *6ф | 1.0 | 5, c | 180 |
Известно, что кислые растворы хитозана представляют собой смесь макромолекул и агрегатов из них различных размеров, что отражается в полимодальном распределении по размерам. Выбранные для синтеза хитозаны были охарактеризованы методом ДРС. Полученные данные по гидродинамическим радиусам (R) показали (табл. 1), что в распределении присутствует фракция (мода) макромолекул хитозана размером не более 10 нм и моды агрегатов макромолекул хитозана, где эти величины более 40 нм.
Из табл. 1 видно, что все полученные дисперсии НХ (дисперсии НХ-7) также являются бимодальными, т.е. в них имеются две фракции, в которых размеры частиц соответствуют образовавшейся наноструктурированной форме, но при этом отсутствует фракция макромолекул. Известно, что с помощью различных физических методов (ультразвуковой обработки, центрифугирования, фильтрации и др.) возможны разрушение агрегатов хитозана и перераспределение их по размерам.
Методика выделения образцов НХ-7 заключалась в центрифугировании дисперсии с последующим промыванием до нейтральных рН, редиспергировании в деионизированной воде (рН = 6.5) и озвучивании дисперсии в течение 30 мин. Можно заметить, что после такой обработки бимодальное распределение гидродинамических радиусов для всех образцов наблюдалось в диапазоне 40–50 и 140–220 нм. В случае дополнительного фильтрования дисперсий через фильтр с диаметром пор 0.45 мкм оказалось возможным получение дисперсий с мономодальным распределением. В табл. 1 представлены размеры частиц профильтрованных дисперсий 2-ф и 6-ф, которые показывают одну основную фракцию с размером частиц 111 и 180 нм соответственно.
Для повышения стабильности дисперсии использовали Twin-80. Его добавление в раствор хитозана перед началом процесса выделения, где он мог сразу выполнять функцию поверхностного стабилизатора [40], и в уже готовую дисперсию НХ практически не отразилось на размерах частиц (образцы 4* и 6**, табл. 1). Можно заметить слабую тенденцию к снижению размеров частиц по мере увеличения количества Twin-80 в системе (образцы 4 и 5, табл. 1). Таким образом, получены образцы НХ, диспергированные в деионизированной воде с рН = 6.5.
Как упоминалось во введении, биологическая активность хитозана во многом определяется его поликатионными свойствами, проявляющимися в кислых средах. При понижении кислотности, начиная с рН = 4.5 молекулы хитозана склонны к осаждению из раствора, но еще имеют частичный положительный заряд. Можно предположить, что если процесс дробного осаждения хитозана закончить при рН = 5, то образующаяся дисперсия будет представлять собой смесь агрегатов из макромолекул и частиц НХ. Такое сочетание наноразмерных структур может обладать синергическим эффектом, а полученные в этих условиях дисперсии (среда с рН = 5 не токсична для растений) могут стать перспективными для использования в растениеводстве.
В связи с этим проведено изучение дисперсий хитозана, образующихся при дробном осаждении его растворов до рН = 5. Хотя при данном рН дисперсии визуально еще прозрачны, но они были центрифугированы, а затем супернатанты были профильтрованы через фильтр с размером пор 0.45 мкм. В табл. 2 представлены размеры частиц дисперсий хитозана (НХ-5), определенные методом ДРС. Распределение частиц по размеру было бимодальным. Хранение фильтратов НХ-5 в течение года при +4°С не привело к расслоению дисперсий и выпадению осадка, они оставались стабильными и прозрачными. Концентрация НХ в дисперсиях составляла ~0.4 г/л. Размеры частиц в дисперсиях в результате хранения несколько увеличились, что можно связать с процессом агрегации.
Таблица 2.
Размеры частиц в свежих и состаренных при +4°С дисперсиях НХ-5
| ММ, кДа | Rh, нм | ||
|---|---|---|---|
| свежий | 3 мес | 12 мес | |
| 6.5 | 25, 125 | 37, 124 | 35, 120 |
| 14 | 23, 98 | 42, 147 | 44, 130 |
| 60 | 43, 102 | 64, 162 | 11, 88 |
АСМ-визуализация состаренных дисперсий НХ-5 показала хорошее соответствие экспериментальных данных сделанным предположениям о структуре дисперсии при рН 5. Несмотря на то что АСМ-изображения соответствуют не реальным жидким дисперсиям, а частицам, адсорбированным из дисперсии на слюду в результате краткосрочного контакта, можно предполагать, что наблюдаемые картины адсорбции частиц коррелируют с формой, размером и концентрацией таких частиц в дисперсии. Действительно, на АСМ-изображении образца НХ-5-60 кДа (рис. 1) определяются несколько типов объектов – плотные, четко очерченные частицы, имеющие высоту ~16 нм и диаметр в плоскости 60 нм. Предполагая, что адсорбция относительно плотной частицы катионного полимера на слюду приводит к ее деформации, но не к изменению объема, можно приближенно оценить объем частицы (форма адсорбированной частицы – сегмент шара), а из этих данных оценить ее радиус в дисперсии – 18 нм. Такой размер приблизительно соответствует частицам, содержащим около 200–300 макромолекул хитозана ММ 60 кДа.
Рис. 1.
АСМ-изображения образца НХ-5 (М = 60 кДа), адсорбированного на слюде: a – топография поверхности (скан 3 × 3 мкм, вертикальный диапазон цвето-яркостной шкалы от –7 до 7 нм), б – срез по линии, в – распределение частиц по высоте, вычисленное по рис. 1a, г – распределение частиц по диаметру, вычисленное по рис. 1a.
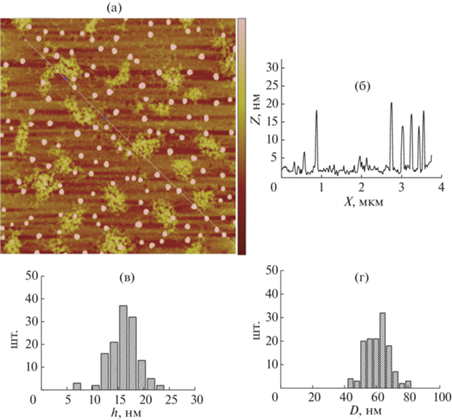
Кроме этого, на АСМ-изображении определяются объекты, имеющие относительно большой размер в плоскости (200–300 нм) и высоту от 1 до 4 нм. Эти объекты имеют кластерную структуру, построенные из частиц высотой до 4 нм и тяжей высотой 1–2 нм. Каждая из единичных субчастиц примерно соответствует молекулярным размерам, а каждый такой кластер может содержать 100–200 макромолекул. Данная картина адсорбции на слюду может соответствовать наличию в дисперсии крупных, но рыхлых ассоциатов макромолекул хитозана. Такие ассоциаты представляют собой переходную форму от молекулярно-дисперсного раствора к нанодисперсии и в целом обычны для растворов амфифильных полимеров. На изображении также видны отдельные тяжи, соответствующие одиночным макромолекулам хитозана в развернутой конформации.
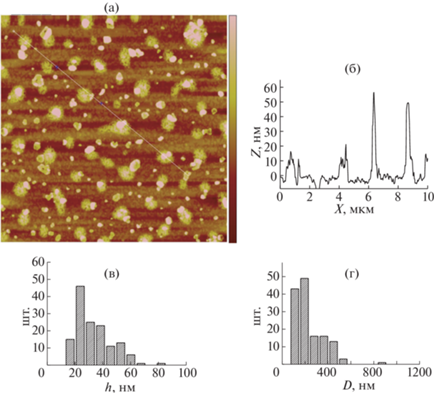
Качественно аналогичная картина наблюдается для образца хитозана с меньшей ММ (6500 Да), рН 5. На изображении (рис. 2) детектируются плотные и крупные рыхлые частицы, однако многие из плотных частиц являются многоядерными, представляют собой кластеры из двух–пяти субъединиц. За счет меньшей ММ хитозана при рН 5 каждая из макромолекул сохраняет меньшее количество катионных групп, поэтому с уменьшением ММ могут иметь место снижение стабильности некрупных частиц и их повышенная склонность к агрегации. На изображении также видна картина адсорбции слюды “неоформленного материала”, т.е. отдельных макромолекул из молекулярно-дисперсного раствора.
Рис. 2.
АСМ-изображения образца НХ-5 (М = 6.5 кДа), адсорбированного на слюде: a – топография поверхности (скан 10 × 10 мкм, вертикальный диапазон цвето-яркостной шкалы от –20 до 20 нм), б – срез по линии, в – распределение частиц по высоте, вычисленное по рис. 2a, г – распределение частиц по диаметру, вычисленное по рис. 2a.
АСМ-изображения дисперсий НХ (рис. 3), сформированных при рН 7, демонстрируют иную картину. На изображениях не наблюдается отдельных макромолекул либо рыхлых ассоциатов, присутствуют только плотные резко очерченные сферические объекты, которые можно идентифицировать как сплошные частицы. Размер этих частиц в дисперсии можно оценить, предполагая их адсорбцию без изменения объема, получаемые величины находятся в диапазоне 5–25 нм.
Рис. 3.
АСМ-изображения образца НХ-7 (М = 6.5 кДа), адсорбированного на слюде: a – топография поверхности (скан 2 × 2 мкм, вертикальный диапазон цвето-яркостной шкалы от –3 до 3 нм), б – срез по линии, в – распределение частиц по высоте, вычисленное по рис. 3a, г – распределение частиц по диаметру, вычисленное по изображению 3a.
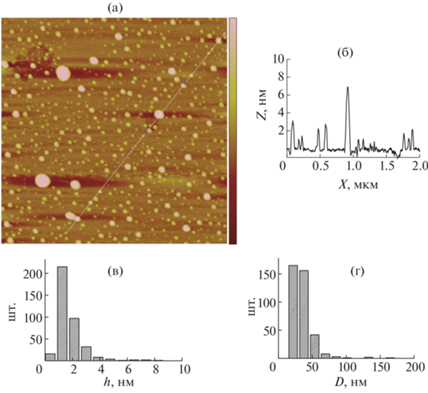
Таким образом, получены два типа дисперсий НЧ хитозана с разной ММ (дисперсия НХ-7 и дисперсия НХ-5), различающиеся значением рН среды, что обусловлено особенностями их приготовления. Дисперсия НХ содержит НЧ, выделенные из реакционной смеси и промытые до нейтральных значений рН с последующим их ресуспендированием в деионизированной воде. Дисперсия НХ-5 имеет в своем составе гелеобразные мягкие частицы диаметром ~100 нм, представляющие собой агрегаты макромолекул хитозана и частицы НХ, образовавшиеся при дробном осаждении до рН = 5. Можно предположить, что дисперсии НХ-7, приготовленные в деионизированной воде (рН = 6.5), будут обладать биологической активностью благодаря наличию НЧ с большой удельной поверхностью. Для дисперсий НХ-5, имеющих наряду с НЧ агрегаты макромолекул хитозана, которые при рН = 5 несут положительный заряд, можно ожидать усиления биологического действия.
Результаты изучения бактерицидной и фунгистатической активности дисперсий в отношении фитопатогенных микроорганизмов представлены в табл. 3–5.
Таблица 3.
Фунгистатическая активность дисперсий наночастиц хитозанов при ингибировании роста мицелия гриба A. solani (концентрация 200 мкг/мл)
| ММ, кДа | Образец | Ингибирование роста мицелия A. solani, % |
|
|---|---|---|---|
| на 3-и сутки | на 5-е сутки | ||
| 14 | НХ-7 | 17.5 | 33.3 |
| НХ-5 | 46.0 | 57.2 | |
| 60 | НХ-7 | 18.0 | 28.9 |
| НХ-5 | 47.5 | 57.7 | |
| НСР 0.05 | 3.5 | 3.0 | |
Таблица 4.
Фунгистатическая (A. solani) и бактерицидная (C. michiganensis) активность исходного хитозана (ацетатный буфер, рН = 5) и дисперсий НХ-5 (метод диффузии в агар)
| ММ, кДа | Образец | Диаметр зоны отсутствия роста, мм | |||
|---|---|---|---|---|---|
| A. solani | C. michiganensis | ||||
| На 5-е сутки | На 5-е* сутки | На 4-е сутки | На 4-е* сутки | ||
| 6.5 | Хитозан | 0 | 15.0 | ||
| НХ-5 | 22.0 | 18.0 | 20.5 | 15.0 | |
| 14 | Хитозан | 0 | 14.0 | ||
| НХ-5 | 21.0 | 17.0 | 20.0 | 14.5 | |
| 60 | Хитозан | 0 | 12.0 | ||
| НХ-5 | 20.0 | 16.5 | 18.0 | 14.0 | |
| НСР 0.05 | 1.2 | 1.1 | 0.8 | 0.9 | |
Таблица 5.
Фунгистатическая активность дисперсий НХ-5 по отношению к C. sativus и A. solani
| ММ, кДа | Концентрация, мкг/мл | Ингибирование роста мицелия, % | |||
|---|---|---|---|---|---|
| C. sativus | A. solani | ||||
| на 3-и сут | на 5-е сут | на 3-и сут | на 5-е сут | ||
| 6.5 | 50 | 27.5 | 28.6 | 25.0 | 15.0 |
| 120 | 32.5 | 47.6 | 45.0 | 54.7 | |
| 300 | 57.5 | 71.4 | 55.0 | 64.3 | |
| 14 | 50 | 15.0 | 29.8 | 33.3 | 26.7 |
| 120 | 55.0 | 45.2 | 42.5 | 52.4 | |
| 300 | 55.0 | 76.1 | 50.0 | 62.0 | |
| 60 | 50 | 17.0 | 30.9 | 30.0 | 21.1 |
| 120 | 32.5 | 44.0 | 40.0 | 51.2 | |
| 300 | 57.0 | 69.7 | 55.0 | 64.3 | |
| НСР 0.05 | 4.5 | 3.2 | 3.1 | 3.5 | |
Установлено, что дисперсии НХ-5 характеризуются более высокой фунгистатической активностью. При этом выявлено, что фунгистатические свойства дисперсий нанохитозана не зависят от ММ хитозана. Этот вывод совпадает с выводами [41, 42], где изучались активность хитозана и его НЧ в отношении различных грибов: Candida albicans, Fusarium solani, Aspergillus niger.
Методом диффузии в агар проведена оценка прямого антагонистического действия дисперсий НХ-5 по отношению к грибу A. solani, а также к бактерии C. michiganensis (табл. 4). Полученные результаты сравнивали с действием раствора исходного хитозана в ацетатном буфере (рН = 5). Сравнение диаметров лизиса тест-культур показало, что дисперсии НХ-5, независимо от ММ хитозана, обладают большей антибактериальной активностью, чем исходный хитозан. Дисперсия НХ-5 также обладала фунгистатической активностью, ингибируя рост гриба A. solani, тогда как раствор исходного хитозана показал нулевую активность. Отметим, что фунгистатическая и бактерицидная активность, оцененная для дисперсий НХ-5 после их хранения в течение трех месяцев при +4°С, практически не изменилась.
Вывод о преимуществе НЧ перед раствором хитозана в отношении различных патогенных грибов был сделан в [41–45]. Полагаем, что плазматическая мембрана является основным целевым местом действия поликатиона. Взаимодействие положительного заряда хитозана с отрицательно заряженными фосфолипидными компонентами мембраны грибков позволяет ему увеличить проницаемость мембраны и вызвать утечку клеточного содержимого, что впоследствии и приводит к гибели клеток [44]. Однако НЧ хитозана, обладающие большей площадью поверхности и наличием поверхностного заряда, могут более эффективно взаимодействовать с грибком за счет их более плотной адсорбции на поверхности клеток грибков [43, 45].
Методом агаровых блоков экспериментально подтверждена высокая фунгистатическая активность дисперсий НХ-5 по отношению к аскомицетам A. solani и C. sativus и установлена концентрационная зависимость (табл. 5).
ЗАКЛЮЧЕНИЕ
Дробное осаждение раствором щелочи позволяет получать стабильные дисперсии хитозана при рН 5 и выше. По данным АСМ дисперсии хитозана, полученные при рН 5, содержат как плотные, так и рыхлые гелеобразные частицы, в то время как дисперсии, полученные при рН 7, содержат только плотные частицы. Рыхлые частицы характеризуются большей подвижностью и доступностью функциональных групп. Дисперсии НХ, полученные в работе, проявили высокую биологическую активность, при этом дисперсии НХ-5 были существенно более активны, чем НХ-7. Причина этого в оптимальном сочетании компактизации макромолекул в частицах и доступности функциональных аминогрупп на их поверхности. Зависимости биологической активности дисперсий НХ-5 от молекулярной массы хитозана не выявлено. По-видимому, описанные дисперсии НХ могут рассматриваться в качестве эффективных натуральных антимикробных препаратов в растениеводстве. Преимущество предлагаемого метода состоит в его простоте, отсутствии различных добавок и биологически активных компонентов, кроме самого хитозана, что полностью соответствует концепции “зеленой химии”.
Список литературы
Rinaudo M. // Prog. Polym. Sci. 2006. V. 31. P. 603.
Tikhonov V.E., Stepnova E.A., Babak V.G. et al. // Carbohydr. Polym. 2006. V. 64 (1). P. 66. https://doi.org/10.1016/j.carbpol.2005.10.021
Chirkov S.N., Il’ina A.V., Surgucheva N.A. et al. // Russian J. Plant Physiology. 2001. V. 48. P. 774.
El Hadrami A., Adam L.R., El Hadrami I., Daayf F. // Marine Drugs. 2010. V. 8 (4). P. 968. https://doi.org/10.3390/md8040968
Saharan V., Pal A. Chitosan based nanomaterials in plant growth and protection. Springer: Briefs in Plant Science. 2006. 55 p.
Wang W., Meng Q., Li Q. et al. // Int. J. Mol. Sci. 2020. V. 21 (2). P. 487. https://doi.org/10.3390/ijms21020487
Prashanth H.K.V., Tharanathan R.N. // Trends Food Sci. Technol. 2007. V. 18 (1). P. 117. https://doi.org/10.1016/j.tifs.2006.10.022
Mourya V.K., Inamdar N.N. // Reactive Functional Polymers. 2008. V. 68 (6). P. 1013. https://doi.org/10.1016/j.reactfunctpolym.2008.03.002
Il’ina A.V., Zubareva A.A., Kurek D.V. et al. // Nanotechnol. Russia 2012. V. 7. P. 85.
Badawy M.E.J., Rabea E.I. // Int. J. Carbohyd. Chem. 2011. V. 29. P. 460381. https://doi.org/10.1155/2011/460381
Varlamov V.P., Il’ina A.V., Shagdarova B.T. et al. // Biochemistry Moscow 2020. V. 85. P. 154.
Nair R., Varghese S.H., Nair B.G. et al. // Plant Scie. 2010. V. 179. P. 154. https://doi.org/10.1016/j.plantsci.2010.04.012
Il’ina A.V., Varlamov V.P., Ermakov Yu.A. et al. // Doklady Chemistry 2008 V. 421. P. 165.
Sathiyabama M. Biopolymeric Nanoparticles as a Nanocide for Crop Protection // Nanoscience for Sustainable Agriculture / Eds. Pudake R. et al. Springer, 2019. 139 p. https://doi.org/10.1007/978-3-319-97852-9_6
Choudhary R.C., Kumaraswamy R.V., Kumari S. et al. Synthesis, Characterization, and Application of Chitosan Nanomaterials Loaded with Zinc and Copper for Plant Growth and Protection / Eds. Prasad R. et al. Nanotechnology. Springer Nature Singapore Pte Ltd, 2017. 227 p. https://doi.org/10.1007/978-981-10-4573-8_10
Fleischer M.A., O’Neill R.E. // Plant Physiol. 1999. V. 121. P. 829.
Navarro E., Braun A., Behra R. et al. // Ecotoxicology. 2008. V. 17. P. 372. https://doi.org/10.1007/s10646-008-0214-0
Moore M.N. // Environ. Int. 2006. V. 32. P. 967. https://doi.org/10.1016/j.envint.2006.06.014
Hendrickson C., Garett H., Bunderson L. // Agri Res. Tech.: Open Access J. 2017. V. 11 (1). P. 555803. https://doi.org/10.19080/ARTOAJ.2017.11.555803
Bandara S., Du H., Carson L. et al. // Nanomaterials. 2020. V. 10. P. 1903. https://doi.org/10.3390/nano10101903
Kumaraswamy R.V., Kumari S., Choudhary R.C. et al. // Int. J. Biol. Macromol. 2018. V. 113. P. 494. https://doi.org/10.1016/j.ijbiomac.2018.02.130
Chandra S., Chakraborty N., Dasgupta A. et al. // Sci. Rep. 2015. V. 5 (1). P. 15195. https://doi.org/10.1038/srep15195
Saharan V., Sharma G., Yadav M. et al. // Int. J. Biol. Macromol. 2015. V. 75. P. 346. https://doi.org/10.1016/j.ijbiomac.2015.01.027
Xing K., Shen X., Zhu X. et al. // Int. J. Biol. Macromol. 2016. V. 82. P. 830. https://doi.org/10.1016/j.ijbiomac.2015.09.074
Van S.N., Minh H.D., Anh D.N. // Biocatal. Agric. Biotechnol. 2013. V. 2. P. 289. https://doi.org/10.1016/j.bcab.2013.06.001
Saharan V., Mehrotra A., Khatik R. et al. // Int. J. Biol. Macromol. 2013. V. 62. P. 677. https://doi.org/10.1016/j.ijbiomac.2013.10.012
Manikandan A., Sathiyabama M. // Int. J. Biol. Macromol. 2015. V. 84. P. 58. https://doi.org/10.1016/j.ijbiomac.2015.11.083
Shukla S.K., Mishra A.K., Arotiba O.A. // Int. J. Biol. Macromol. 2013. V. 59. P. 46. https://doi.org/10.1016/j.ijbiomac.2013.04.043
Khot L.R., Sankaran S., Maja J. // Crop Protection. 2012. V. 35. P. 64. https://doi.org/10.1016/j.cropro.2012.01.007
Eshghi S., Hashemi M., Mohammadi A. et al. // Food Bioprocess Technol. 2014. V. 7 (8). P. 2397. https://doi.org/10.1007/s11947-014-1281-2
Cota-Arriola O., Cortez-Rocha M.O., Burgos-Hernández A. et al. // J. Sci. Food Agriculture 2013. V. 93 (7). P. 1525. https://doi.org/10.1002/jsfa.6060
Saharan V., Kumaraswamy R., Choudhary R.C. et al. // J. Agric Food Chem. 2016. V. 64 (31). P. 6148. https://doi.org/10.1021/acs.jafc.6b02239
Nugraheni P.S., Soeriyadi A.H., Ustadi U. et al. // J. Eng. Technol. Sci. 2019. V. 51 (3). P. 430. https://doi.org/10.5614/j.eng.technol.sci.2019.51.3.9
Rampino A., Borgogna M., Blasi P. et al. // Int. J. Pharm. 2013. V. 455. P. 219. https://doi.org/10.1016/j.ijpharm.2013.07.034
Popova E.V., Zorin I.M., Domnina N.S. et al. // Russian J. General Chem. 2020 V. 90 (7). P. 1. https://doi.org/10.1134/S1070363220070178
Kupreev N.I., Kuznetsov V.A. Patent 2428432 (Russia), 2011.
Vlasov P.S., Kiselev A.A., Domnina N.S. et al. // Russ. J. Appl. Chem. 2009. V. 82. P. 1675. https://doi.org/10.1134/S1070427209090298
Knaul J.Z., Hudson S.M., Creber K.A. //J. Appl. Polym. Sci. 1999. 72. P. 1721.https://doi.org/10.1002/(SICI)1097-4628(19990624)72:13<1721::AID-APP8>3.0.CO;2-V
Wolf C.E., Gibbons W.R. // J. Appl. Bacteriol. 1996. V. 80 (4). P. 453.
Milusheva R.Y., Rashidova S.S. // Polym. Sci. Ser. C. 2017 V. 59. P. 29. https://doi.org/10.7868/S2308114717010058
Ing L.Y., Zin N.M., Sarwar A., Katas H. // Int. J. Biomater. 2012. 632698. https://doi.org/10.1155/2012/632698
Abdeltwab W.M., Abdelaliem Y.F., Metry W.A., Eldeghedy M. // J. Adv. Laboratory Res. Biol. 2019. V. 10 (1). P. 8. https://doi.org/10.1080/19476337.2020.1772887
Melo N.F.C.B., De Mendonçasoares B.L., Diniz K.M. et al. // Postharvest Boil. Technol. 2018. V. 139. P. 56. https://doi.org/10.1016/j.postharvbio.2018.01.014
García-Rincón J., Vega-Pérez J., Guerra-Sánchez M.G. et al. // Pestic. Biochem. Physiol. 2010. V. 97 (3). P. 275. https://doi.org/10.1016/j.pestbp.2010.03.008
Qi L., Xu Z., Jiang X. et al. // Carbohydr. Res. 2004. V. 339 (16). P. 2693. https://doi.org/10.1016/j.carres.2004.09.007
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


