Российские нанотехнологии, 2023, T. 18, № 3, стр. 377-392
Генерация биогенных наночастиц металлов de novo как индикатор метаболической активности клеток
Д. А. Складнев 1, *, В. В. Сорокин 1
1 Фeдеральный исследовательский центр “Фундаментальные основы биотехнологии” РАН,
Институт микробиологии им. С.Н. Виноградского
Москва, Россия
* E-mail: skladda@gmail.com
Поступила в редакцию 13.03.2023
После доработки 14.04.2023
Принята к публикации 14.04.2023
Аннотация
Динамика генерации de novo биогенных наночастиц металлов четко отражает особенности взаимодействия исследуемых клеток с катионами. На основании этого разработан методический подход, позволяющий оценивать уровень метаболической активности клеток по результатам измерения линейных параметров биогенных наночастиц металлов, формирующихся in situ за минуты (DBNG – detection of biogenic nanoparticles generation/growth). Показаны примеры практического использования данного исследовательского подхода, дающего возможность обнаруживать контаминацию ростовых сред, оценивать физиологическое состояние чистых культур микроорганизмов в ходе их культивирования, сравнивать физиологическое состояние природных микробных сообществ в изменяющихся экологических условиях, выявлять метаболические различия при сравнении генетически близкородственных культур микроорганизмов, проводить поиск культур с повышенным уровнем целевых метаболических активностей для практического использования, дифференцировать различные типы опухолевых тканей человека.
ВВЕДЕНИЕ
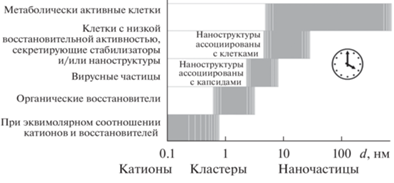
Формированием кристаллических наноразмерных структур металлов управляют межатомные силы на фоне внешних воздействий. Взаимодействие катионов (атомов с различной валентностью, которые обозначаются как Men+) с теми или иными молекулярными группировками доноров электронов приводит к восстановлению атомов металлов до нуль-валентного состояния (Me°). Отсутствие заряда у восстановленных атомов Me° запускает процесс их агглютинации. Ранними промежуточными продуктами восстановления катионов являются димеры, тримеры и тетраатомные кластеры атомов. Эти структуры имеют более высокое сродство к электрону, чем отдельные катионы (из-за делокализации орбиты), что ускоряет перенос электронов от восстановителей [1]. Постепенное укрупнение этих комплексов приводит к генерации пока еще аморфных первичных нанокластеров, включающих в себя до нескольких сотен нуль-валентных атомов (Me°NCs) размером до ~1.5 нм (рис. 1) [2, 3]. Показано, что на поверхности таких формирующихся de novo структур присутствуют невосстановленные катионы Men+ [4, 5]. Наличие катионов в составе первичных кластеров не критично для дальнейшего полного восстановления нанокристаллов до нуль-валентного состояния. Однако присутствие на поверхности положительно заряженных ионов металла допускает образование координированных связей с низкомолекулярными соединениями или сольватированными молекулами растворителя, что может тормозить процесс укрупнения нанокристаллических структур [6]. Интенсивность дальнейшего снижения поверхностного заряда аморфных кластеров восстановленных атомов металлов определяется не столько валентностью катионов, сколько уровнем присутствия в реакционной смеси молекул-доноров электронов [4, 7–9]. Продолжающийся процесс самосборки приводит к формированию все более крупных уже кристаллических структур, которые называются наночастицами (НЧ) металлов (Me°NPs). Скорость дальнейшего укрупнения НЧ определяется теми же условиями реакционной смеси, которые влияли на интенсивность процессов генерации de novo и самосборки нанокластеров восстановленных атомов Me° [3, 5, 10].
Рис. 1.
Схема динамического изменения численности генерируемых de novo наноразмерных биогенных кристаллов (Me°NCs, Me°NPs). Показана зависимость изменения числа нанокристаллов от длительности реакции восстановления (1), изменение линейных размеров нанокристаллов от времени их формирования (2) (с использованием данных [2, 5, 7]).

Многочисленные исследования межатомных и межмолекулярных взаимодействий, а также появляющиеся в печати теоретические модели отражают достаточно высокую изученность процессов самосборки наноразмерных кристаллических структур благородных металлов и оксидов металлов [11–13]. Известны модели, рассматривающие более сложные закономерности формирования биогенных НЧ металлов, где в качестве восстановителей катионов используются живые клетки и/или секретируемые ими молекулы-доноры электронов [7, 9, 14, 15]. Эти данные позволяют производить в промышленных масштабах НЧ металлов с точно заданными параметрами и свойствами [16].
В большом количестве экспериментальных работ и обзоров, появляющихся в печати ежегодно, было показано, что при получении биогенных НЧ различных металлов с использованием различных растительных экстрактов или клеток микроорганизмов (обычно при длительном инкубировании с растворами катионов) формируются мелкие НЧ размером 5–25 нм [16–18]. В условиях биотехнологически оптимизированного роста бактерий, т.е. при максимальном уровне их метаболической активности, биогенные НЧ очень быстро укрупняются до размеров в сотни нанометров [19–22]. Показано также, что при генерации НЧ металлов в присутствии биологических объектов важную роль играют секретируемые клетками низкомолекулярные соединения, способные сорбироваться на поверхность нанокристаллов и препятствовать их увеличению in situ, т.е. выступать в роли стабилизаторов формирующихся НЧ [1, 23–26].
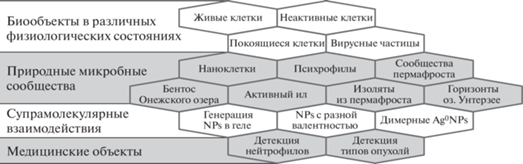
В предыдущих работах нами было постулировано и позже доказано, что информация о способности клеток формировать за фиксированное время НЧ металлов того или иного размера отражает особенности физиологического состояния культур и, следовательно, может служить индикатором для оценки метаболической активности клеток (рис. 2). В данной работе представлены примеры практического использования исследовательского подхода DBNG (detection of biogenic nanoparticles generation/growth; ранее OBNG), реализованные при оценке физиологического состояния различных чистых культур микроорганизмов, при сравнении физиологического состояния нескольких природных микробных сообществ, а также для выявления различий восстановительной способности генетически близкородственных культур микроорганизмов и некоторых типов опухолевых тканей человека.
МЕТОДЫ
Биологические объекты
В работе использовали суспензии клеток микробных культур, выращенных в оптимальных для них условиях. Культивирование проводили в стандартных ростовых средах LB для Mycobacterium smegmatis mc2155 UQM 41553 [19] и Yarrowia lipolytica Y-3603 [27], среда М9 для культивирования Methylopilus quaylei с добавлением метанола в качестве единственного источника углерода и энергии [28], а также низкоминерализованный вариант этой среды для культур психрофильных бактерий Cryobacterium unterzee UQM 41460 [21] и Rhodococcus jialingiae UQM 41348. Суспензии вирусных частиц колифага G7C получали в ростовой среде LB после лизиса клеток культуры-хозяина. Природные пробы воды отбирали стандартными инструментами асептическим способом, транспортировали и хранили при температуре не выше 5–7°С. Препараты клеток нейтрофилов человека выделяли по стандартной методике и использовали в концентрации 3.8 × 106 мл–1 в растворе Хэнкса “Thermo Scientific” (США). Фрагменты тканей из новообразований придаточного аппарата глаза, а также здоровую ткань из того же глаза в качестве контроля получали после удаления их хирургическим методом [29].
Генерация de novo биогенных наночастиц металлов
Генерацию НЧ металлов проводили in situ непосредственно в исследуемых бактериальных суспензиях или в природных водных пробах после внесения стерильного раствора источника катионов в конечной концентрации соли 0.1 мМ. Источниками катионов служили стерильные растворы HAuCl4, Na2PdCl4, реактива Толленса или AgNO3. Восстановление катионов и формирование de novo биогенных НЧ проводили в объемах реакционных смесей 50 мкл. Суспензии клеток чистых культур микроорганизмов и микробных сообществ исследовали в концентрации ~106 мл–1. Удаление клеток микроорганизмов из исследуемых суспензий для приготовления контрольных аликвот, сохраняющих все растворенные внеклеточные соединения ростовой среды, проводили центрифугированием (10 000 g, 15 мин). При получении НЧ в гидрогелях использовали агарозу с низким EEO (0.4 мас. %). Образцы тканей помещали в стерильный раствор источника катионов в асептических условиях.
Оборудование
Для визуализации клеток микроорганизмов использовали микроскоп Amplival (ГДР) с фазово-контрастным устройством. Регистрацию биогенных НЧ in situ непосредственно в клеточных суспензиях проводили с помощью спектрометра USB-2000 с интегрирующей сферой Ульбрихта “ОсеаnОptics” (США). Изображения НЧ получали с использованием просвечивающего электронного микроскопа (ПЭМ) JEM-1400 “Jeol” (Япония), оснащенного микроанализатором “Oxford Instruments” (Великобритания), при ускоряющем напряжении 80 кэВ. Для определения линейных размеров НЧ металлов применяли программу “Компас 3D-V14” и специально разработанный алгоритм расчета по электронным фотоснимкам (не менее 300 НЧ для каждого образца). Измерение интенсивности малоуглового рентгеновского рассеяния (МУРР) препаратов проводили на автоматическом дифрактометре “АМУР-К” с однокоординатным позиционно-чувствительным детектором ОД3М (в капилляре объемом 20 мкл) при фиксированной длине волны излучения λ = 0.1542 нм со временем накопления сигнала 20 мин по сертифицированной методике [30]. Обработку результатов измерения рассеяния для расчета объемной функции распределения НЧ по размерам DV(R) проводили с помощью программы MIXTURE.
Оптимизация важнейших параметров протокола метода DBNG
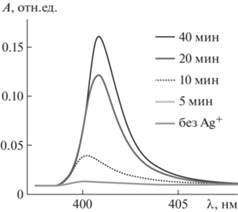
Важнейшим параметром протокола DBNG является строго ограниченная длительность проведения реакции восстановления катионов. Был определен минимальный временной интервал, позволяющий с применением спектрометрии достоверно регистрировать формирование биогенных НЧ серебра непосредственно в суспензии клеток свежей культуры грамположительных микобактерий M. smegmatis. Поскольку специфический пик НЧ серебра (при специфической для них λ = 400 нм) наблюдался уже с десятой минуты, время реакции восстановления катионов было ограничено двадцатью минутами (рис. 3). Важно подчеркнуть, что столь малое время проведения реакции восстановления не превышает протяженности нормальных метаболических ответов клеток на добавление в среду избыточных концентраций различных солей [31], что позволяет фиксировать физиологическое состояние исследуемых культур именно на момент внесения источника катионов.
Рис. 3.
Динамика генерации биогенных НЧ серебра в присутствии метаболически активных клеток Mycobacterium smegmatis.
Источники катионов вносили в исследуемые пробы в концентрации 0.1 мМ, которой при минимальном токсическом действии на клетки достаточно для формирования до 1012 НЧ, хорошо видимых в каждом поле зрения ПЭМ. Внесение низких концентраций солей сохраняет возможность использовать клеточные суспензии исследованных реакционных смесей для выделения чистых культур обнаруженных в них микроорганизмов.
РЕЗУЛЬТАТЫ
Генерация de novo наночастиц металлов клетками микроорганизмов, находящимися в различных физиологических состояниях
Фундаментальная природная способность метаболически активных клеток генерировать НЧ металлов является одной из наиболее эффективных защитных реакций, позволяющих живым микроорганизмам за считанные минуты переводить токсичные катионы в не токсичную кристаллическую твердую фазу [12, 32]. Регистрацию параметров, генерируемых биологическими объектами in situ НЧ металлов (из искусственно вносимых в клеточные суспензии источников катионов), использовали в исследованиях как индикатор для оценки общего метаболического статуса клеток (рис. 2).
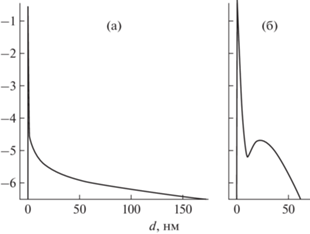
Метаболически активные клетки микроорганизмов наиболее активно генерируют НЧ металлов. Приведем четыре примера экспериментов с культурами микроорганизмов различных видов. Свежие культуры грамотрицательных бактерий M. smegmatis выращивали в богатой ростовой среде, содержащей органические ростовые факторы, многие из которых могут служить донорами электронов. С применением МУРР показано, что после внесения стерильного раствора соли Ag(NH3)2NO3 в суспензии клеток наблюдалась генерация биогенных НЧ со средним диаметром ~30 нм (рис. 4в). При аналогичных измерениях в стерильной среде LB происходило формирование только нанокластеров серебра (до 1–1.5 нм) с последующим их плавным укрупнением (рис. 4а).
Рис. 4.
Генерация нанокластеров восстановленного серебра в ростовой среде LB (а) и биогенных НЧ в присутствии растущих метаболически активных клеток Mycobacterium smegmatis (б) по данным МУРР.
Клетки психрофильных бактерий генерируют НЧ металлов при околонулевой температуре среды. Психрофильные или психротолерантные микроорганизмы привлекают внимание исследователей, проводящих поиск новых культур-продуцентов ферментов с высокой удельной активностью при низких температурах, а также из-за необходимости решения вопросов экологии приполярных зон. В серии экспериментов с психрофильными бактериями R. jialingiae (в логарифмической фазе роста) проводили генерацию биогенных НЧ серебра при двух температурных режимах – оптимальном (4°С) и неоптимальном (24°С) для психрофила. Было установлено, что клетки R. jialingiae, постоянно находившиеся при низкой температуре, уже на раннем этапе экспоненциальной фазы роста формировали НЧ серебра размером от 12 до 15 нм, на более поздней фазе роста интенсивность восстановления катионов повышалась. Если суспензии психрофильных бактерий R. jialingiae выращивали при низкой температуре, а затем за 60 мин до внесения соли серебра нагревали до комнатной температуры (24°С), формирования биогенных НЧ серебра в них не наблюдалось. Полная потеря клетками R. jialingiae восстановительной способности в неблагоприятных для них внешних условиях (при температуре среды выше ~20°С) указывает на утрату оптимального физиологического состояния культуры психрофильных бактерий. Данные эксперименты позволили постулировать возможность использования подхода DBNG для эффективного поиска в природных водных пробах из низкотемпературных зон новых психроактивных культур микроорганизмов, перспективных для целевого использования.
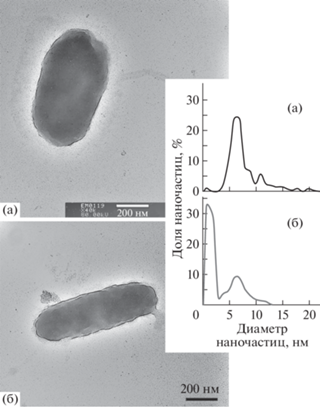
Метаболически активные фильтрующиеся бактерии способны генерировать НЧ серебра. Фильтрующиеся бактерии или наноклетки – биологический объект объемом ~0.004–0.04 мкм3 и размером 0.2–0.5 мкм, что вдвое меньше диаметра клеток E. coli [33, 34]. Интерес к наноклеткам определяется их способностью проходить сквозь стерилизующие фильтры с размером пор 0.22 мкм. Наноклетки воспринимаются как нежелательные биохимические загрязнители воды, как источники ДНК, белков и компонентов клеточных мембран. Малые размеры затрудняют детекцию наноклеток, а также освобождение от них.
Впервые показано, что присутствие в водных пробах метаболически активных фильтрующихся бактерий может быть детектировано по их способности генерировать НЧ серебра размером до 20 нм при выраженном пике 10 нм (рис. 5а). По мере старения препаратов наблюдаются падение тургора наноклеток и восстановительной способности, о чем свидетельствует формирование значительной фракции нанокластеров серебра при уменьшении доли крупных НЧ (рис. 5б).
Рис. 5.
Генерация биогенных НЧ метаболически активными наноклетками (а) и наноклетками неактивных препаратов (б).
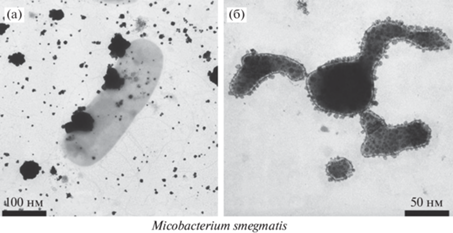
Особенности генерации НЧ серебра в присутствии покоящихся клеток микобактерий и вирусных частиц. Известно, что клетки микобактерий M. smegmatis при культивировании в длительной стационарной фазе переходят в неактивное состояние и по своим характеристикам могут быть отнесены к покоящимся, “некультивируемым” формам, сохраняющим способность к выживанию [35]. Покоящиеся клетки микобактерий оказались способны восстанавливать катионы и генерировать НЧ серебра размером не более 10 нм и ассоциированные с поверхностями клеточных стенок (рис. 6б). Такая локализация биогенных НЧ указывает на то, что основными восстановителями катионов являются химические группировки поверхностных биополимеров клеток. Практически полное отсутствие НЧ в межклеточном пространстве хорошо согласуется с полным подавлением секреции низкомолекулярных восстановителей, что характерно для клеток после перехода из метаболически активного в покоящееся состояние.
Рис. 6.
Метаболически активные клетки Mycobacterium smegmatis формируют крупные НЧ серебра (а), мелкие НЧ ассоциированны с поверхностью покоящихся клеток (б).
Точно такая же локализация биогенных НЧ металлов характерна для обширной группы биообъектов – вирусов и бактериофагов. В проведенных экспериментах с использованием суспензий вирусных частиц колифага G7C [36] на ПЭМ-изображениях видно, что практически все биогенные НЧ серебра находятся на поверхности капсидов (рис. 7). Эти результаты совпадают с полученными ранее и могут быть объяснены тем, что формирование НЧ происходило за счет восстановительной активности отдельных аминокислотных группировок белков капсидов как доноров электронов [37, 38].
Подтверждением этому являются отмеченные различия параметров НЧ металлов, формирующихся de novo на поверхностях капсидов штаммов вирусов, различающихся из-за генетически полученных аминокислотных замен [39]. Благодаря поверхностной локализации капсид-ассоциированных нанокристаллических структур за ними в литературе закрепилось выражение “инкрустированные вирусные частицы”.
На основании опубликованных и полученных в настоящей работе данных видно, что линейные размеры НЧ, генерируемых в присутствии биологических объектов за фиксированное время, тем больше, чем выше уровень метаболической активности клеток (из-за синтеза клетками биогенных восстановителей катионов). Эти различия в характере распределения размеров биогенных НЧ проиллюстрированы на рис. 8.
Анализ сообществ микроорганизмов для экологических исследований
Природные пробы, отбираемые микробиологами в экспедициях, обычно предназначены для исследования автохтонных микробных сообществ, для выявления наиболее интересных культур, в частности форм, обладающих полезными с практической точки зрения свойствами [40].
Применение протокола DBNG для быстрого исключения из рассмотрения “неинформативных/бессодержательных” природных образцов позволило облегчить выявление наиболее интересных проб, содержавших культуры с искомыми свойствами. Важно отметить, что экомониторинг микробных сообществ, основанный на оценке их способности генерировать НЧ металлов, позволяет контролировать стабильность свойств/составов этих сообществ в естественной среде обитания.
Выявление метаболически активных микробных сообществ зоны многолетнемерзлых грунтов Мамонтовой горы (Якутия). Поиск метаболически активных природных микробных сообществ по способности клеток in situ восстанавливать катионы серебра и формировать НЧ серебра впервые был применен в отношении проб, отобранных в зоне многолетнемерзлого льда на высоком левом берегу реки Алдан. Исследовали четыре водные пробы: собранную с поверхности ледяного обнажения, в изливе из термоцирка у подножья обнажения, в среднем и нижнем течении водно-грязевого ручья [36]. Было показано, что генерация однотипных НЧ серебра диаметром 4–5 нм происходила только в трех водных пробах, в которых вытаявшие микроорганизмы некоторое время находились в термоцирке. Отсутствие генерации НЧ серебра в свежевытаявшей изо льда воде четко указывало на отсутствие в ней микроорганизмов с выраженной восстановительной активностью.
Из пробы ручейной воды были выделены в чистом виде и таксономически идентифицированы шесть культур-изолятов аэробных гетеротрофных мезофильных бактерий [22]. Клетки культуры-изолята Rhizobium selenitireducens MS302 представлялись перспективными для практического использования, поскольку способны за 20 мин генерировать монодисперсные НЧ серебра, 60% от общего числа которых имеют диаметр 4 нм – наиболее востребованный размер для практического применения НЧ.
Отметим, что аналогичные исследования, нацеленные на выявление активных культивируемых микроорганизмов, проводимые традиционными микробиологическими методами, требуют гораздо больше времени и объемного лабораторного оборудования [40]. Результаты проведенной серии экспериментов указывают на возможность использования подхода DBNG для быстрого выявления различий метаболического статуса на основании оценки уровней восстановительной активности клеток микроорганизмов в природных водных пробах, что может быть использовано при поиске новых практически значимых культур-продуцентов.
Формирование биогенных НЧ серебра микробными сообществами различных водных горизонтов озера Унтерзее. Антарктическое озеро Унтерзее является объектом многолетних микробиологических и биогеохимических исследований в качестве модели подледного озера, существующего не менее 12 тысяч лет [41]. Озеро имеет уникальные физико-химические и гидрохимические характеристики, отличающие обитателей его западной аэробной суперокисленной сверхолиготрофной части от восточной части – аэробной до 80 м и анаэробной в придонных слоях. Исследовали пробы из всех трех групп горизонтов восточной части озера (4–70, 70–80 и 80–100 м), характеризующихся существенными различиями гидрохимических свойств, которые и определяют различия составов автохтонных микробных сообществ. Во всех природных пробах озерной воды в присутствии клеток автохтонных микроорганизмов озера Унтерзее после внесения источника катионов наблюдали формирование НЧ серебра, тогда как во всех контрольных образцах, освобожденных от клеток, генерации НЧ не происходило. В пробах из поверхностных слоев воды было отмечено формирование двух выраженных пулов НЧ (3–4 и 18 нм), что указывало на наличие в данном микробном сообществе двух групп культур, способных эффективно, но с различной скоростью превращать кластеры восстановленных атомов серебра в НЧ (рис. 9). Микроорганизмы с горизонта 40 м генерировали НЧ серебра с нормальным (гауссовским) распределением размеров и выраженным пиком 12–13 нм, что свидетельствовало о присутствии эффективных микроорганизмов-восстановителей. Выраженное очень широкое разнообразие размеров биогенных НЧ, сформировавшихся в пробах с глубины 72 м, свидетельствовало о наличии в сообществе существенно различающихся по своим физиологическим (восстановительным) свойствам микроорганизмов, обитающих в микроаэробных условиях хемоклина. В пробах с двух наиболее глубоких горизонтов воды озера Унтерзее (80 и 98 м) генерировались мелкие НЧ с распределением размеров, близким к нормальному. Эти данные указывали на отсутствие в пробах из анаэробной зоны активных восстановителей катионов либо на секрецию клетками неких стабилизаторов НЧ, препятствующих самосборке. Было также отмечено, что в пробах воды с различных горизонтов озера Унтерзее генерировались биогенные НЧ серебра, различающиеся не только по распределению размеров, но и количественно (рис. 10). Постепенное повышение концентрации сформированных в реакционных смесях биогенных НЧ по мере перехода к более глубоким горизонтам отражает возрастание уровней физиологической активности сообществ микроорганизмов озера Унтерзее в целом [22].
Рис. 9.
Формирование биогенных НЧ серебра клетками микробных сообществ различных водных горизонтов антарктического озера Унтерзее.
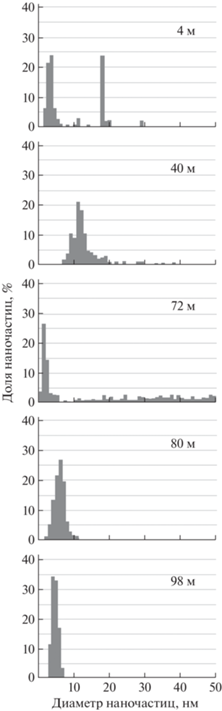
Рис. 10.
Повышение концентрации биогенных НЧ серебра, формирующихся в присутствии клеток микробных сообществ более глубоких горизонтов озера Унтерзее.

Поиск метаболически активных клеток микроорганизмов для конструирования активных илов. Многие технологические процессы включают в себя на завершающих этапах очистку водных стоков с применение активного микробного ила для биосорбции токсичных ионов металлов. В стоках предприятий гальванической, текстильной, уран- и сереброперерабатывающей промышленности могут в значимых количествах присутствовать катионы Ni, Zn, Cu, U. Методический подход DBNG был применен при отборе микробных культур для целенаправленного создания искусственного активного ила, устойчивого к специфическому набору токсичных металлов и способного длительное время эффективно извлекать металлы из растворов и накапливать их в биомассе [20]. Поскольку катионы Ag+ обладают высочайшей бактерицидностью, именно соли серебра использовали при оценке уровней относительной устойчивости препаратов ила и чистых культур к солям других металлов. Из проб исходного активного ила были выделены основные культуры, устойчивые к металлам и способные быстро формировать НЧ серебра. Наиболее активные микроорганизмы выделили в чистом виде, идентифицировали и использовали для создания искусственных многослойных гранул ила, в которых клетки менее стойких к металлам микроорганизмов были экранированы слоем наиболее стойких. Тестирование клеток исходного ила (при 20 мг/л Ag+ в среде) показало существенное повышение уровня их выживаемости при помещении в трехслойные гранулы – с 7 до 24%. Многослойный искусственный активный ил длительное время сохранял способность развиваться в присутствии 70 мг/л Ag+ и мог накапливать серебро с сорбционной емкостью до 380 мг/г при 95%-ном извлечении за 3–5 мин. Таким образом, подход DBNG, примененный при целенаправленном поиске культур с высокой восстановительной активностью, позволил сконструировать сообщество искусственного активного ила с оптимальным составом и структурой гранул, что обеспечило устойчивость к высоким концентрациям токсичных катионов.
Высокая устойчивость к катионам серебра была обнаружена также при исследовании сообщества автохтонных микроорганизмов иловых отложений Онежского озера из районов выраженной субаквальной разгрузки постоянно живущих в среде с повышенным накоплением катионов Fe, Mn, Cu, Zn, Mo, As, Ni, Cd, Pb естественным образом присутствующих в водах придонного горизонта.
Микрофлюидное устройство для реализации метода DBNG в полевых условиях. К настоящему времени хорошо разработан микрофлюидный исследовательский подход, позволяющий все шире использовать устройства laboratory-on-a-chip (LОC) для манипуляций с одной или несколькими жидкостями, содержащими суспензии клеток и НЧ металлов. Реализованы микрофлюидные методы, позволяющие оценивать концентрацию и размеры отдельных частиц в многокомпонентной смеси с пропускной скоростью анализа до 105 с–1 [42–44]. В целом микрофлюидный подход и методы компьютеризированного управления, являющиеся основой современной приборной миниатюризации, позволяют по-новому организовывать многие химические, аналитические и нанобиотехнологические процессы. Поскольку протокол метода DBNG прост и не требует больших объемов реактивов, была разработана концепция применения данного подхода в микрофлюидном варианте LОC [21]. В комплекс LОC включены взаимодополняющие микроустройства, обеспечивающие многостадийный физико-химический процесс восстановления катионов и осуществляющие качественную и/или количественную детекцию генерируемых de novo биогенных НЧ металлов в микролитровых объемах. Соответственно этим двум этапам исследования в “биосинтетической” части системы LОC используются типовые современные микроустройства для работы с суспензиями клеток в жидких ростовых средах различного состава, позволяющие концентрировать клетки или освобождать от них исходные суспензии для получения контрольных аликвот. В аналитической части для регистрации процесса укрупнения нанокристаллических структур предусмотрены оптофлюидные устройства (спектрометры, интерферометры). Поскольку в момент появления флюоресценции у биогенных нанокластеров, формирующихся de novo, приходится регистрировать световые потоки малой интенсивности, предусмотрено использование фотоумножителя и очень компактных лавинных фотодиодов silicon photomultiplier (SiPM), которые способны регистрировать даже единичные фотоны. Комплекс LОC пригоден для использования высокочувствительных методов исследования микрообъектов с применением усиленного комбинационного рассеяния (surface-enhanced Raman scattering – SERS), а также поверхностных акустических волн (surface acoustic waves – SAWs). Разработанный авторами алгоритм логического анализа параметров формирующихся биогенных НЧ позволяет автоматизировать процесс оценки метаболического статуса исследуемых биообъектов. В целом очевидны актуальность и важность создания на основе предложенного нами метода DBNG очень компактного микрофлюидного прибора для экспресс-оценки свойств биологических объектов в полевых или клинических условиях [45].
Супрамолекулярные взаимодействия восстановленных атомов при формировании de novo наночастиц металлов
Реакционные смеси, приготовляемые по протоколу DBNG, имеют точно известный состав, за исключением тех компонентов, которые привносят живые клетки исследуемых биообъектов. Соответственно, различия при формировании биогенных нанокристаллических структур de novo строго зависят от восстановительных химических группировок поверхностных биополимеров клеток и/или от различий биогенных секретируемых восстановителей [19, 32, 46]. Подход DBNG использовали для обнаружения нескольких вариантов таких различий.
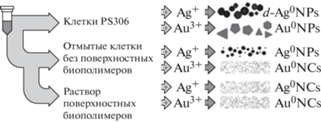
Формирование димерных НЧ серебра клетками актинобактерий Serinibacter sp. PS306. В мировой литературе нет данных о биосинтезе димерных НЧ, из-за чего это свойство выделенного нами изолята можно считать уникальной особенностью (рис. 11). Для исследования способности клеток культуры Serinibacter sp. PS306 формировать димерные НЧ серебра было проведено восстановление катионов с иной валентностью. Из трехвалентных катионов золота Au3+ актинобактерии формировали типичные угловатые плеоморфные НЧ, выраженного присутствия димерных форм не наблюдалось. Чтобы определить, играют ли ключевую роль во временнóй стабилизации димерного состояния НЧ серебра сами клетки Serinibacter sp. PS306 или специфичные для них внеклеточные соединения, было проведено восстановление катионов Ag+ и Au3+ в трех вариантах реакционных смесей: в свежей суспензии клеток культуры Serinibacter sp. РS306 (стандартный вариант протокола метода DBNG); в суспензии клеток этой культуры, лишенных поверхностных биополимеров отмывкой бидистиллятом; в полученном смыве поверхностных биополимеров, освобожденном от клеток Serinibacter sp. РS306 (рис. 12). Как и в предыдущих опытах, свежие клетки актинобактерий формировали НЧ серебра, значительная часть из которых была представлена димерами. В суспензии клеток, отмытых от ассоциированных поверхностных биополимеров, формировались выполненные НЧ серебра не димерного, а обычного вида и меньших размеров. В смыве поверхностных биополимеров формирования НЧ серебра не наблюдали. Во всех вариантах получения биогенных НЧ золота димерных форм также не выявлено. Эти результаты позволили сделать вывод, что ключевую роль в формировании уникальных димерных НЧ серебра играет специфическое химическое взаимодействие катионов Ag+ c поверхностными биополимерами, характерными для клеток растущей культуры актинобактерий Serinibacter sp. РS306.
Рис. 11.
Димерные НЧ серебра, массово генерируемые клетками актинобактерий культуры-изолята Serinibacter sp. PS306.

Рис. 12.
Принципиальная схема эксперимента для изучения роли поверхностных биополимеров в формировании биогенных димерных НЧ серебра клетками Serinibacter sp. PS306.
Выявление различий в восстановлении катионов серебра и палладия изогенными культурами облигатных метилотрофных бактерий Methylopilus quaylei. Для сравнения способности микробных клеток генерировать НЧ металлов с различной валентностью в [26] впервые предложили использовать пары изогенных культур облигатных метилотрофных бактерий. Ростовые характеристики исходного штамма Methylopilus quaylei МТТ дикого типа и его стрептомицинустойчивого (до 4 мг/мл) производного M. quaylei SMR не различались в стандартных условиях культивирования на средах с метанолом в качестве единственного источника углерода и энергии [28]. В отличие от исходной культуры клетки мутанта M. quaylei SMR характеризовались пониженной секрецией экзополисахаридов и пониженной гидрофобностью поверхности (табл. 1). Была оценена способность изогенных культур восстанавливать катионы серебра Ag+ и палладия Pd2+, различающиеся валентностью. В стандартных условиях протокола DBNG клетки обеих культур за 20 мин формировали крупные НЧ восстановленного серебра размером 45 и 70 нм. При этом формирование НЧ палладия происходило только в присутствии клеток стрептомицинустойчивого производного M. quaylei SMR, что коррелировало с гораздо более высокой устойчивостью его клеток к соли палладия. Поскольку в реакционной смеси с клетками дикого типа наблюдалось формирование многочисленных оптически плотных частиц, не содержащих НЧ палладия, сделано заключение, что восстановление катионов Pd2+ тормозилось на стадии нанокластеров, сорбированных во внеклеточном слое экзополисахаридов.
Таблица 1.
Характеристики клеток изогенной пары культур облигатных метилотрофных бактерий M. quaylei и параметры генерируемых ими НЧ благородных металлов
| Характеристики клеток культур M. quaylei | Дикий тип МТТ | Устойчивый мутант SMR | ||
|---|---|---|---|---|
| Продукция экзополисахаридов, г/л | 1.05 | 0.2 | ||
| Гидрофобность поверхности, % | 39 | 5.5 | ||
| Характеристики процессов | Генерация НЧ, Ø нм | Выживаемость, % | Генерация НЧ, Ø нм | Выживаемость, % |
| Ag+ | 45 | 32 | 70 | 0.4 |
| Pd2+ | нет | 5 | 70 | 59 |
Формирование биогенных НЧ серебра при моделировании технологии 3D-биопринтинга в агарозных гидрогелях. Очевидно, что для нормального роста клеток при 3D-моделировании живой ткани крайне важно поддерживать доставку всех субстратов и ростовых факторов, поскольку отклонение от оптимального уровня их концентрации в среде приводит к снижению метаболического статуса, ухудшению физиологического состояния и остановке роста клеток. В экспериментах доставку субстратов и ростовых факторов (источников кислорода, углерода, азота, минорных ростовых компонентов) оценивали по способности клеток модельного эукариотного микроорганизма Yarrowia lipolytica [47] генерировать НЧ при росте в гидрогеле. Культивирование дрожжей проводили в кюветах, заполненных двухслойным гидрогелем с одинаковой концентрацией агарозы 0.4 мас. % в полноценной LВ-среде. Клетки Y. lipolytica вносили в верхний слой, нижний стерильный слой гидрогеля служил источником катионов серебра (5 мкг/мл) (рис. 13). Важно подчеркнуть, что для реализации подхода DBNG использовали гелирующий агент с низким уровнем электроэндоосмоса (тип EEO), поскольку только этот коммерческий тип агарозы не способен самостоятельно восстанавливать катионы. Рост культуры Y. lipolytica в верхнем слое гидрогеля регистрировали с применением оптоволоконной спектрометрической системы по постоянно снижающейся проницаемости образцов в течение 6–7 дней [48].
Рис. 13.
Генерация биогенных НЧ серебра при глубинном культивировании в агарозном гидрогеле дрожжей Yarrowia lipolytica.
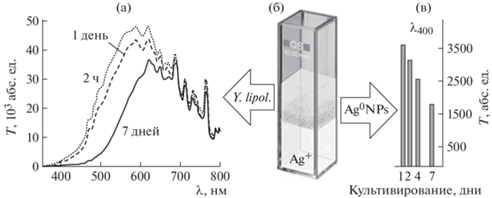
Динамику формирования биогенных НЧ серебра регистрировали при специфической для них длине волны λ = 400 нм. Поскольку и рост дрожжей Y. lipolytica, и формирование НЧ серебра наблюдались на протяжении всего этого времени, сделано заключение, что уровень восстановительной активности исследуемой эукариотной культуры сохранялся на достаточно высоком уровне для длительной генерации НЧ in situ. В целом применение методического подхода DBNG при глубинном культивировании эукариотных дрожжей показало возможность наблюдения за физиологическим состоянием живых клеток в агарозно-гидрогелевой среде по генерации in situ биогенных НЧ серебра.
Психрофильные бактерии генерируют анизотропные НЧ серебра. Использование в экспериментах по генерации НЧ психрофильных бактерий C. unterzee, культивируемых при оптимальной для них температуре 5°С, позволило впервые наблюдать генерацию in situ биогенных анизотропных НЧ серебра [45]. Невысокая скорость роста (μ ~ 0.035) и снижение скорости восстановления катионов при низкой температуре создавали особые условия для исследования реакции клеток на присутствие в ростовой среде ингибиторов основных метаболических процессов. В этих экспериментах при температуре 5°С в присутствии низких концентраций хлорамфеникола и 5-фторурацила (снижавших выживаемость клеток лишь на 20–30%) впервые была отмечена массовая генерация биогенных анизотропных НЧ серебра игольчатой формы. На микрофотографиях видно, что большинство клеток C. unterzee, проинкубированных сутки в условиях подавления синтеза белка хлорамфениколом, после внесения соли серебра оказывались плотно “инкрустированны” игольчатыми кристаллами (рис. 14а). После инкубирования клеток с 5-фторурацилом при четко выраженной гетерогенности популяции клеток и значительного количества V-образных пар, не завершивших клеточное деление, наблюдалось формирование еще более вытянутых игольчатых нанокристаллов серебра длиной 170–500 нм и диаметром 20–50 нм (рис. 14в). На основании современных представлений следует заключить, что генерация de novo НЧ серебра ярко выраженной игольчатой формы объясняется сохранением биосинтеза неких соединений (в оптимальной для психрофильных бактерий температуре среды), способных избирательно сорбироваться исключительно на боковые поверхности растущих нанокристаллов, но не блокировавших торцевые поверхности нанокристаллов серебра. Поскольку игольчатые нанокристаллы обладают особыми физическими свойствами, востребованными в электронике, представляется актуальным продолжение разработки биотехнологии массового получения анизотропных игольчатых НЧ серебра.
Применение методического подхода DBNG при исследовании медицинских объектов
Медицинские исследования часто сводятся к определению той или иной конкретной биосинтетической активности, тогда как к оценке общего уровня метаболизма клеток тканей прибегают в случаях исследований различных типов раковых заболеваний [49]. Тем не менее оценка метаболического статуса определенных клеток или тканей с применением подхода DBNG может быть применена в отношении различных медицинских объектов.
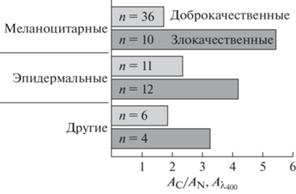
Опухолевые клетки восстанавливают катионы активнее, чем здоровые клетки той же ткани. Злокачественные новообразования являются одними из распространенных опухолей всех типов тканей. Клиническое течение злокачественных опухолей характеризуется большим полиморфизмом, из-за чего их дифференциальная диагностика путем клинического осмотра и цитологического исследования может представлять значительные сложности. Еще более актуален вопрос срочной интраоперационной диагностики доброкачественных и злокачественных опухолей [50]. Подход DBNG, основанный на анализе совокупности характеристик биогенных НЧ, формирующихся de novo, был применен для исследования новообразований придаточного аппарата глаза, выявляемых у пациентов клинически. Для каждого пациента сравнивали объем НЧ серебра, сформировавшихся в присутствии опухолевых клеток (С – cancer), с уровнем синтеза НЧ контрольных образцов здоровой ткани (N – normal) из того же глаза. Результаты спектрофотометрических определений активности генерации биогенных НЧ серебра при длинах волн, близких к специфическим для них (λ = 400 нм), представляли как коэффициент АC/АN (рис. 15). Впервые было показало, что для всех исследованных пар образцов во всех препаратах НЧ, генерированных материей из злокачественных и доброкачественных опухолей, синтез НЧ de novo выше, чем в контрольных образцах аналогичных здоровых тканей (даже за 5 мин восстановления катионов серебра) [29, 51]. Таким образом, подход DBNG решает задачи определения степени злокачественности различных опухолей на основе оценки уровня их метаболической (восстановительной) активности для быстрой оптимизации тактики хирургического вмешательства.
Рис. 15.
Сравнение уровней генерации НЧ серебра в биопсиях различных типов опухолевых клеток и клеток нормальных тканей придаточного аппарата глаза человека.
Генерация биогенных НЧ золота для сравнительной оценки активности нейтрофилов. Нейтрофилы – многофункциональные клетки крови, которые активируются для координированного иммунного ответа организма на внедрение инфекционных агентов, а также на тканевое повреждение, имеющее место при различных нейродегенеративных, психических и иных хронических заболеваниях неинфекционной природы. Активация нейтрофилов приводит к фагоцитозу и уничтожению патогенов через производство активных форм кислорода, дегрануляцию клеток и высвобождение сериновых протеаз (например, лейкоцитарной эластазы нейтрофилов) [52, 53]. К настоящему моменту ясно, что адекватная оценка дегрануляционной активности нейтрофилов человека важна для ранней диагностики многих нейродегенеративных заболеваний, а также для мониторинга состояния пациентов и оценки эффективности терапии.
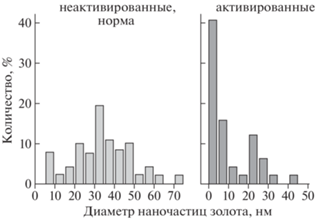
Применение подхода DBNG для сравнения результатов генерации in situ биогенных НЧ в присутствии препаратов нейтрофилов из крови пациентов с эндогенными психозами и препаратов нейтрофилов здоровых доноров было предпринято, поскольку известно, что при дегрануляции нейтрофилов изменяется молекулярное окружение этих клеток, а значит, у больных может изменяться количество возможных доноров электронов, секретируемых в среду. Сравнительный анализ результатов исследования показал существенные различия в распределении размеров биогенных НЧ золота, сформировавшихся in situ в препаратах неактивированных нейтрофилов здоровых доноров и активированных нейтрофилов доноров с эндогенными психозами или болезнью Альцгеймера. В препаратах из крови здоровых доноров генерировались НЧ золота диаметром до 60–70 нм со средним размером частиц 35 нм (рис. 16). У всех обследуемых больных ранее были выявлены высокая активность лейкоцитарной эластазы и низкие значения активности ее ингибитора, что свидетельствовало о высоком уровне дегрануляционной активности клеток нейтрофилов. В соответствующих пробах активированных нейтрофилов отмечалось присутствие значительной фракции нанокластеров, а размер формирующихся de novo НЧ золота не превышал 20–25 нм, что указывало на общее снижение восстановительной активности клеток. Торможению процесса самосборки НЧ золота в препаратах из крови людей с нейродегенеративными заболеваниями могли способствовать также секретированные пептиды – характерные продукты сериновых протеаз активированных нейтрофилов.
ОБСУЖДЕНИЕ
Достаточно хорошо изученная способность микроорганизмов формировать НЧ металлов при взаимодействии с растворами солей путем восстановления катионов (а фактически – их детоксикации) является одной из основных защитных реакций для выживания микробных клеток в окружающей среде [32]. Эту фундаментальную естественную восстановительную способность живых клеток использовали для сравнения их метаболического статуса и для изучения разных аспектов функционирования. В [54] наши исследования начинались как разработка метода оценки контаминации полноценных ростовых сред и сывороток. На нескольких микробных моделях было показано, что разнообразные низкомолекулярные органические соединения полноценных сред восстанавливают катионы лишь до величины нанокластеров (до 1.5 нм), тогда как живые клетки способны длительно активно синтезировать восстановители и тем самым быстро генерировать НЧ металлов диаметром от 5 до 10 нм и крупнее (рис. 8).
В ходе оптимизации протокола метода было определено время проведения реакции восстановления катионов и то, что источник катионов в реакционной смеси должен присутствовать в минимально достаточной концентрации [54].
Исследования многих микробных объектов подтвердили наличие четкой корреляции между выходом биогенных НЧ и скоростью роста культур: клетки в неблагоприятных внешних условиях снижают восстановительную активность в отношении катионов [20]. После анализа распределения размеров НЧ, генерируемых клетками in situ за короткое фиксированное время, появилось понимание того, что данный подход позволяет сравнивать свойства природных микробных сообществ, а также отслеживать изменения в составах сообществ при изменении параметров окружающей клетки среды [21].
Простота методики регистрации интегральных восстановительных свойств исследуемых проб позволила говорить о возможности использования подхода DBNG для поиска новых, практически значимых культур в огромном числе исходных вариантов, например природных проб. В частности, из большого количества проанализированных природных водных проб, в которых клетки восстанавливали вносимые катионы наиболее активно, выделить несколько интересных, наиболее перспективных для применения, культур микроорганизмов [20–22, 45]. Тот же подход может быть использован при создании селективных схем для целенаправленного выявления активных высокоустойчивых микробных сообществ или культур с требуемыми заданными свойствами и активностями.
Поскольку восстановителями катионов могут выступать не только сами клетки, но и секретируемые ими низкомолекулярные соединения или поверхностные биополимеры, экспериментально было показано, что динамика формирования НЧ металлов может служить удобным способом изучения свойств продуктов клеточного биосинтеза [45]. Соответственно, активная генерация НЧ может служить индикатором при селекции высокопроизводительных культур микроорганизмов.
Для возможности более точной трактовки получаемых результатов впервые применили некоторые приемы, нестандартные для исследований, проводимых с использованием НЧ. Так, при сопоставлении свойств пары изогенных культур метилотрофов удалось выявить различия в сорбции нанокластеров палладия молекулами экзополисахаридов, синтезируемых этими бактериями [26]. Генерация димерных форм НЧ серебра в присутствии клеток Serinibacter sp. PS306 выявила принципиальное отличие специфических экзополисахаридов этих актинобактерий при их взаимодействии с катионами другой валентности – золота [22]. Мониторинг длительного роста культуры дрожжей в толще агарозного гидрогеля, проведенный как наблюдение за постепенным укрупнением биогенных НЧ серебра, показал необходимость использования ЕЕО-типа агарозы для подобных экспериментов при 3D-биопринтинге [47]. Специально для повышения чувствительности методического подхода DBNG предлагаются новые варианты спектрометрического определения ранних стадий генерации нанокластеров и НЧ металлов. Впервые интегрирующая сфера Ульбрихта была применена в качестве детектора при vis-спектрометрии и при измерении флюоресценции НЧ, генерируемых in situ непосредственно в суспензиях исследуемых клеток [45, 54]. Также впервые использовали оценку динамики генерации НЧ серебра de novo из катионов (а не из предварительно полученных стабилизированных нанокластеров металлов) при сравнительных исследованиях опухолевых и нормальных клеток придаточного аппарата глаза человека [29].
В целом наблюдение за процессом формирования de novo НЧ серебра и некоторых других благородных металлов позволило получить новую информацию при изучении микробных биообъектов в различных физиологических состояниях, сравнении природных микробных сообществ, изучении супрамолекулярных взаимодействий в процессе генерации биогенных НЧ металлов, а также при сравнительном анализе нескольких медицинских модельных объектов (рис. 17).
ЗАКЛЮЧЕНИЕ
Рассмотрены особенности генерации de novo биогенных НЧ металлов в различных вариантах взаимодействия исследуемых клеток и различных катионов. Показано, что распределение линейных размеров биогенных НЧ металлов, формирующихся в присутствии тех или иных биологических объектов за фиксированное время, существенно различаются из-за различий уровеней синтеза клетками восстановителей катионов, что коррелирует с уровнем метаболической активности клеток. На основании этого разработан методический подход DBNG, предоставляющий экспериментальные возможности:
– оценки и сравнения физиологического состояния чистых культур микроорганизмов в ходе их культивирования;
– проведения оценки взаимодействия биоцидных агентов с микробными клетками;
– оценивать физиологическое состояние природных микробных сообществ в изменяющихся экологических условиях;
– выявлять метаболические различия при сравнении генетически близкородственных культур микроорганизмов;
– проводить поиск культур с повышенным уровнем целевых метаболических активностей для практического использования;
– дифференцировать различные типы опухолевых и нормальных тканей человека.
Авторы выражают благодарность коллегам, принимавшим участие в подготовке образцов для исследования и в обсуждении полученных результатов, А.П. Алексеевой, О.В. Безнос, Л.В. Васильевой, В.В. Волкову, А.В. Вязьмину, В.Ф. Гальченко, А.С. Громовой, С.Н. Дедыш, П.А. Иванову, Д.Г. Имаметдиновой, С.П. Карлову, Е.Е. Куликову, В.В. Куракову, В.Н. Лясниковой, А.Л. Мулюкину, С.Д. Оголенко, Е.Н. Осокиной, Д.Ю. Побережному, С.И. Погосяну, А.Б. Пшеничниковой, С.В. Саакян, Е.Ю. Терещенко, Д.В. Тюпе.
Электронно-микроскопические исследования выполнены при финансовой поддержке Министерства науки и высшего образования РФ в рамках государственного задания Федеральному исследовательскому центру биотехнологии РАН (проект № 1220408-00164-6).
Список литературы
Loh N.D., Sen S., Bosman M. et al. // Nat. Chem. 2016. https://doi.org/10.1038/NCHEM.2618
Tan S., Chee S., Lin G. et al. // Acc. Chem. Res. 2017. V. 50. № 6. P. 1303. https://doi.org/10.1021/acs.accounts.7b00063
Luo B., Smith J.W., Ou Z. et al. // Acc. Chem. Res. 2017. V. 50. № 5. P. 1125.https://doi.org/10.1021/acs.accounts.7b00048
Roy A., Pandit, Gacem A. et al. // Hindawi Bioinorg. Chem. Appl. 2022. Art. 8184217. https://doi.org/10.1155/2022/8184217
Wang J., Lin X., Shu T. et al. // Int. J. Mol. Sci. 2019. V. 20. P. 1891. https://doi.org/10.3390/md17050300
Xia Y., Xiong Y., Lim B. et al. // Angew Chem. Int. Ed. Engl. 2009. V. 48. № 1. P. 60. https://doi.org/10.1002/anie.200802248
Zhou Y., Wang H., Lin W. et al. // J. Colloid Interface Sci. 2013. V. 407. P. 8. https://doi.org/10.1016/j.jcis.2013.06.053
Jones M.R., Song X., Chen Q. // Nat. Commun. 2017. V. 2. № 8. P. 761. https://doi.org/10.1038/s41467-017-00857-1
Deeba F., Parveen S., Rashid R. et al. // J. Oleo Sci. 2023. V. 72. № 4. P. 429. https://doi.org/10.5650/jos.ess22380
Liu M., Tang F., Yang Z. et al. // J. Analyt. Meth. Chem. 2019. Art. 1095148. https://doi.org/10.1155/2019/1095148
Kowalczyk P., Szymczak M., Maciejewska M. et al. // Int. J. Mol. Sci. 2021. V. 22. P. 854. https://doi.org/10.3390/ijms22020854
Longo E., Avansi W., Bettini J. et al. // Sci. Rep. 2015. V. 6. P. 21498. https://doi.org/10.1038/srep21498
Roy D., Palb A., Pal T. // RSC Adv. 2022. V. 12. P. 12116. https://doi.org/10.1039/d2ra00403h
Xie Y., Dong H., Zeng G. et al. // J. Hazard. Mater. 2017. V. 321. № 3. P. 90. https://doi.org/10.1016/j.jhazmat.2016.09.028
Navarro G., Alpaslan E., Wang M. et al. // Mater. Sci. Eng. C. 2019. V. 99. P. 685. https://doi.org/10.1016/j.msec.2019.01.134
Miu B.A., Dinischiotu A. // Molecules. 2022. V. 27. P. 6472. https://doi.org/10.3390/molecules27196472
Qamer S., Romli M.H., Che-Hamzah F. et al. // Molecules. 2021. V. 26. P. 5057. https://doi.org/10.3390/molecules26165057
Carmona M., Poblete-Castro I., Rai M. et al. // Microbiol. Biotechnol. 2023. Mar. 25. https://doi.org/10.1111/1751-7915.14254
Sorokin V.V., Skladnev D.A., Volkov V.V. et al. // Dokl. Biol. Sci. 2013. V. 452. P. 325. https://doi.org/10.1134/S0012496613050153
Tyupa D.V., Kalenov S.V., Baurina M.M. et al. // Enzyme Microbial Technol. 2016. https://doi.org/10.1016/j.enzmictec.2016.10.008
Skladnev D.A., Vasilyeva L.V., Berestovskaya Yu.Yu. et al. // Front. Astron. Space Sci. 2020. V. 7. P. 59. https://doi.org/10.3389/fspas.2020.00059
Skladnev D.A., Sorokin V.V., Gromova A.S. et al. // J. Microbiol. Biotechnol. 2022. V. 7. № 4. P. 24. https://doi.org/10.23880/oajmb-16000240
Angelikopoulos P., Sarkisov L., Cournia Z. et al. // Nanoscale. 2017. V. 9. № 3. P. 1040. https://doi.org/10.1039/c6nr05853a
Ballottin D., Fulaz S., Souza M.L. et al. // Nanoscale Res. Lett. 2016. V. 11. P. 313. https://doi.org/10.1186/s11671-016-1538-y
Deng H., Yu H. // Materials. 2019. V. 12. P. 2592. https://doi.org/10.3390/ma12162592
Sorokin V., Pshenichnikova A., Kalenov S. et al. // Trace Element Res. 2020. V. 193. P. 564. https://doi.org/10.1007/s12011-019-01740-4
Zinjarde S., Apte M., Mohite P. et al. // Biotechnol. Adv. 2014. https://doi.org/10.1016/j.biotechadv.2014.04.008
Doronina N., Ivanova A., Trotsenko Y. et al. // Syst. Appl. Microbiol. 2005. V. 28. № 4. P. 303. https://doi.org/10.1016/j.syapm.2005.02.002
Саакян С.В., Складнев Д.А., Алексеева А.П. и др. // Head and Neck. Russian J. 2022. № 10 (2). Прил. 2. С. 94. https://doi.org/10.25792/HN.2022.10.2.S2.94-97
Svergun D.I., Konarev P.V., Volkov V.V. et al. // J. Chem. Phys. 2000. V. 113. P. 1651. https://doi.org/10.1063/1.481954
Kaur A., Pan M., Meislin M. et al. // Genome Res. 2006. V. 16. P. 841. https://doi.org/10.1101/gr.5189606
Gadd G.M. // Microbiology. 2010. V. 156. P. 609. https://doi.org/10.1099/mic.0.037143-0
Belova S.E., Fedotova A.V., Dedysh S.N. // Microbiology. 2012. V. 81. P. 614. https://doi.org/10.1134/S0026261712050050
Liu J., Li B., Wang Y. et al. // Env. Int. 2019. V. 131. P. 104998. https://doi.org/10.1016/j.envint.2019.104998
Kuznetsov B.A., Davydova M.E., Shleeva M.O. et al. // Bioelectrochemistry. 2004. V. 64. № 2. P. 125. https://doi.org/10.1016/j.bioelechem.2004.05.001
Skladnev D.A., Mulyukin A.L., Filippova S.N. et al. // Microbiology. 2016. V. 85. № 5. P. 580. https://doi.org/10.7868/S0026365616050165
Love A.J., Makarov V., Yaminsky I. et al. // Virology. 2014. V. 449. P. 133. https://doi.org/10.1016/j.virol.2013.11.002
Wang L., Liu Z., Xu C. et al. // J. Virol. Methods. 2017. V. 243. P. 113. https://doi.org/10.1016/j.jviromet.2017.01.010
Kobayashi M., Tomita S., Sawada K. et al. // Opt. Express. 2012. V. 20. № 22. P. 24856. https://doi.org/10.1364/OE.20.024856
Мулюкин А.Л., Сорокин В.В., Воробьёва Е.А. и др. // Микробиология. 2002. Т. 71. № 6. С. 836. https://doi.org/10.1023/A:1021444309796
Andersen D.T., Sumner D.Y., Hawes I. et al. // Geobiology. 2011. V. 9. P. 280. https://doi.org/10.1111/j.1472-4669.2011.00279.x
Anisimkin V.I., Kuznetsova I.E., Kolesov V.V. et al. // Ultrasonics. 2015. V. 62. № 9. P. 156. https://doi.org/10.1016/j.ultras.2015.05.012
Chiesa E., Dorati R., Pisani S. et al. // Pharmaceutics. 2018. V. 10. P. 267. https://doi.org/10.3390/pharmaceutics10040267
Qamar A.Z., Shamsi M.H. // Micromachines. 2020. V. 11. P. 126. https://doi.org/10.3390/mi11020126
Складнев Д.А., Карлов С.П., Анисимкин В.И. и др. // РЭНСИТ: Радиоэлектроника. Наносистемы. Информационные технологии. 2022. № 14 (4). С. 393. https://doi.org/10.17725/rensit.2022.14.393
Han X., Liu K., Sun C. // Materials. 2019. V. 12. P. 1411. https://doi.org/10.1080/14686996.2018.1553108
Agnihotri M., Joshi B., Rumar A.R. et al. // Mater. Lett. 2009. V. 63. № 15. P. 1231. https://doi.org/10.1016/j.matlet.2009.02.042
Vyazmin A., Pokusaev B., Karlov S. et al. // Chem. Eng. Trans. 2021. V. 84. P. 73. https://doi.org/10.3303/CET2184013
Heiden M.G.V., DeBerardinis R.J. // Cell. 2017. V. 168. № 4. P. 657. https://doi.org/10.1016/j.cell.2016.12.039
Мякошина Е.Б., Саакян С.В. // Клиническая офтальмология. 2022. № 22 (4). С. 216. https://doi.org/10.32364/2311-7729-2022-22-4-216-223
Саакян С.В., Алексеева А.П., Складнев Д.А. и др. // Нанобиотехнологический способ экспресс-диагностики злокачественных опухолей век и конъюнктивы. Пат. 2776647 (Россия). 2022.
Klyushnik T.P., Androsova L.V., Simashkova N.V. et al. // Neurosci. Behav. Physiol. 2013. V. 43. № 1. P. 84. https://doi.org/10.1007/s11055-012-9695-7
Maas S.L., Soehnlein O., Viola J.R. // Front. Immunol. 2018. V. 9. P. 2739. https://doi.org/10.3389/fimmu.2018.02739
Складнев Д.А., Сорокин В.В., Куликов Е.Е. и др. // Нанотехника. 2013. № 2. С. 12.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии