Российские нанотехнологии, 2023, T. 18, № 3, стр. 327-336
Оценка потенциала использования микроводорослей рода Desmodesmus для биоремедиации загрязнений воды наночастицами TiO2
С. П. Чеботарева 1, *, О. В. Захарова 1, 2, 3, П. А. Баранчиков 1, Е. А. Колесников 2, А. А. Гусев 1, 2, 3
1 Тамбовский государственный университет им. Г.Р. Державина
Тамбов, Россия
2 Национальный исследовательский технологический университет “МИСИС”
Москва, Россия
3 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
* E-mail: sweta-chebotarjova@yandex.ru
Поступила в редакцию 10.01.2023
После доработки 10.01.2023
Принята к публикации 17.03.2023
Аннотация
Возрастающий спрос на продукты, произведенные с использованием нанотехнологий, способствует масштабному увеличению синтеза наноразмерных материалов и поступлению их в водную среду. Наночастицы (НЧ) TiO2 в качестве микрополлютантов водной среды воздействуют на многие живые организмы, оказывая, как правило, негативные эффекты. Микроводоросли имеют доказанную эффективность в области биоремедиации, что делает их потенциальным агентом для биоудаления НЧ из сточных вод. Проведена оценка способности микроводорослей рода Desmodesmus к биоаккумуляции НЧ TiO2, а также определена степень устойчивости клеток микроводоросли к воздействию экологически значимых концентраций данных НЧ. Использовались сферические НЧ TiO2 размером 30–40 нм. Методом проточной цитометрии обнаружено, что НЧ TiO2 в концентрациях 10, 100 и 1000 мкг/л не оказывали значимого влияния на жизнеспособность клеток микроводоросли и уровень окислительного стресса. НЧ в концентрации 1000 мкг/л повышали содержание фотосинтетических пигментов на 18–33% на 13-е сутки эксперимента. Desmodesmus sp. оказалась относительно устойчивой культурой к воздействию НЧ, методом ICP-MS выявлено повышенное бионакопление титана клетками микроводоросли в экспериментальных группах. Все это указывает на значительный потенциал Desmodesmus sp. для удаления наноструктурных поллютантов из водной среды.
ВВЕДЕНИЕ
Наночастицы (НЧ) благодаря своим уникальным физическим и химическим характеристикам все чаще используются в промышленных и коммерческих целях. Широкое распространение получили НЧ TiO2, которые нашли разнообразное применение в производстве текстиля, косметики, электроники, пластмасс, батарей, красок и пищевых добавок [1–3]. НЧ TiO2 проявляют фотореактивность и используются в качестве катализаторов для очистки воды и сточных вод [4]. Применение НЧ продолжает расширяться и по прогнозам к 2025 г. мировое производство НЧ TiO2 достигнет 2.5 млн тонн [5].
Использование НЧ в различных областях приводит к их неконтролируемому выбросу в окружающую среду, вызывая риск негативного воздействия на природные экосистемы [1]. Содержание НЧ TiO2 в водной среде может достигать экологически значимых концентраций [6]. В свою очередь, НЧ TiO2 могут способствовать образованию реактивных форм кислорода, способных вызывать окислительное повреждение бактерий и гидробионтов [7]. Экотоксичность НЧ для водорослей была описана в некоторых исследованиях, например в [8] указано, что адсорбция НЧ TiO2 на поверхности клеток P. tricornutum вызывала повреждение клеточной стенки. Также НЧ TiO2 ингибировали рост популяции морских микроводорослей D. tertiolecta из-за интернализации НЧ в клетках и дестабилизации структуры ДНК [9, 10]. Было показано 50%-ное снижение роста D. subspicatus в присутствии частиц TiO2 размером 25 и 100 нм в концентрации 4 и 50 мг/дм3 [11]. Таким образом, НЧ TiO2 вызывают снижение роста культур водорослей, причем степень подавления зависит от размера и формы частиц, а также от видовой специфики объекта. В то же время некоторые работы свидетельствуют о положительной роли НЧ. Например, в [12] установили, что НЧ TiO2 оказывали стимулирующее действие на рост клеток водоросли Picochlorum sp. Отметим, что различия полученных результатов прежде всего могут быть связаны с используемыми концентрациями. Так, в [13–15] показано токсическое действие НЧ TiO2 при дозе более 1 мг/л, в то время как реальное содержание TiO2 в водной среде не превышает 1 мг/л [16, 17], при этом в [18, 19] показано отсутствие ингибирующих эффектов для низких доз TiO2.
Известно, что НЧ, накапливаясь в живых организмах, могут переноситься через пищевую цепь от низших трофических организмов к высшим, при этом концентрируясь, что представляет большую опасность как для природных экосистем, так и для человека [20].
Подобное воздействие синтетических НЧ на окружающую среду наряду с появляющимися признаками экотоксичности привело к необходимости создания научно обоснованных подходов, направленных на снижение негативных эффектов, вызванных НЧ, на экосистемы. Поэтому все большее внимание уделяется разработке методов биоудаления НЧ из окружающей среды [21]. Поскольку использование механических систем очистки требует высоких энергетических затрат, все чаще изучают технологии применения микроорганизмов при очистке окружающей среды от микрополлютантов [22]. Одним из перспективных решений проблемы очистки сточных вод от НЧ является культивирование микроводорослей, так как данные организмы уже успешно применяются в области биоремедиации [23]. Согласно [9, 10] микроводоросли способны аккумулировать НЧ TiO2. Однако, как уже говорилось, данные НЧ, особенно в высоких концентрациях, токсичны для многих видов микроводорослей.
Для создания основы биотехнологии очистки сточных вод от загрязнения НЧ TiO2 с помощью микроводорослей необходимо подобрать вид, устойчивый к воздействию реалистичных концентраций НЧ (до 1 мг/л) и проявляющий способность к биоаккумуляции НЧ или их компонентов. Поэтому цель данного исследования – оценка толерантности к воздействию НЧ TiO2 и оценка биоаккумуляционного потенциала микроводорослей Desmodesmus sp. [24, 25].
МАТЕРИАЛЫ И МЕТОДЫ
Наночастицы
Характеризация наночастиц. В работе использовали НЧ TiO2 (Sigma-Aldrich, США). Морфологию и размер частиц перед началом эксперимента определяли методом сканирующей электронной микроскопии (СЭМ) на микроскопе Tescan Vega 3 (Чехия). Элементный анализ осуществляли методом энергодисперсионной рентгеновской спектроскопии с помощью энергодисперсионного анализатора “10mm2 SDD Detector – X-Act” (Oxford Instruments, Великобритания).
Получение и анализ суспензий наночастиц. Для внесения НЧ в культивационную среду готовили их водные дисперсии. Навески порошков частиц (0.5 мг) взвешивали при помощи аналитических весов ViBRA HT (Shinko Denshi, Япония), всыпали в цилиндрические пробирки с завинчивающимися крышками объемом 10 мл со стерильной дистиллированной водой (рН 7.1 ± 0.2) и перемешивали. После перемешивания суспензии обрабатывали в ультразвуковой ванне VBS-41H (Вилитек, Россия) в течение 10 мин (мощность ультразвука – 180 Вт, объем – 4 л). Таким образом получали водный коллоидный раствор с концентрацией НЧ 500 мкг/10 мл. После чего из исходного раствора путем разбавления получали суспензии с концентрацией 50 и 5 мкг/10 мл.
Для оценки стабильности полученных дисперсных систем проводили анализ ζ-потенциала частиц в суспензиях с использованием анализатора ZetasizerNanoZS (Malvern, Великобритания).
Размер частиц и агрегатов частиц в полученных коллоидных растворах определяли методом динамического рассеяния света также на приборе ZetasizerNanoZS.
Влияние наночастиц на микроводоросли
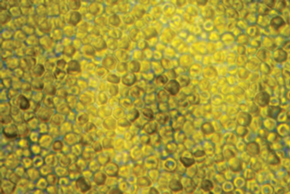
Тест-объекты. В качестве объекта исследования была выбрана культура одноклеточных зеленых водорослей Desmodesmus sp., штамм 3 Dp 86 E-1. Исследуемый штамм микроводоросли выделен из фрагментов беспозвоночного животного гидроида D. pumila [24]. Микрофотография культуры водоросли Desmodesmus sp. представлена на рис. 1.
Рис. 1.
Микрофотография клеток микроводоросли Desmodesmus sp., выполненная на световом микроскопе (увеличение ×20/0.40 BD).
Культивирование Desmodesmus sp. проводили на среде BG-11 [26, 27] в стеклянных конических колбах емкостью 250 мл при постоянном освещении светодиодными лампами белого света (480 мкE/(м2 с) ФАР) и поддержании температуры 27°C, pH – 7.0–7.2.
Методики оценки воздействия наночастиц на микроводоросли
Дизайн эксперимента. В исследовании использовали питательную среду BG-11. Изначальная оптическая плотность засеваемой тест-культуры водоросли при длине волны 560 нм составляла 0.59. Внесение НЧ осуществляли непосредственно перед началом эксперимента.
В каждую из лунок шестилуночного планшета вносили по 6 мл питательной среды, содержащей микроорганизмы. Туда же вносили 120 мкл суспензий НЧ и аккуратно перемешивали круговыми движениями, в контрольные лунки вносили 120 мкл дистиллированной воды без добавления НЧ. Таким образом, в ходе культивирования микроорганизмы экспонировались наночастицами в концентрациях 10, 100 и 1000 мкг/л питательной среды, так как данные значения лежат в пределах экологически значимых концентраций [16, 17].
Анализ жизнеспособности. Основным показателем состояния культуры служило изменение процента жизнеспособности опытного тест-объекта по отношению к контрольному. Контролем служил рост водорослей в чистой среде без добавления токсикантов. Данный показатель определяли с помощью клеточного анализатора Muse Cell Analyzer, (Merck Millipore, Германия) с использованием реагента Muse Count & Viability. Так как изначальные клеточные суспензии были высококонцентрированные, перед добавлением культуры водорослей в опытные и контрольные пробы потребовалось дополнительное разведение 1:20 питательной средой BG-11. После этого культуры клеток разбавляли реагентом Muse Count & Viability в соотношении 1:20 и давали клеткам окраситься в течение 5 мин перед выполнением расчетов. Дополнительно определяли общую численность клеток в присутствии НЧ и в контрольных образцах без добавления токсикантов.
Анализ окислительного стресса. Параметры окислительного стресса получали с помощью клеточного анализатора Muse Cell Analyzer, (Merck Millipore, Германия) с использованием набора Muse Oxidative Stress kit. Для приготовления промежуточного раствора реагент Muse oxidative stress разводили в соотношении 1:100 с 1Х Assay buffer. Рабочий раствор был приготовлен при разбавлении промежуточного раствора с 1Х Assay buffer в соотношении 1:80. Перед добавлением культуры водорослей в опытные и контрольные пробы клетки разводили 1Х Assay buffer в соотношении 1:20. После чего отбирали 10 мкл клеток и добавляли к ним 190 мкл рабочего раствора. Перед выполнением анализа полученные образцы инкубировали в течение 30 мин при 37°С.
Определение содержания фотосинтетических пигментов. Для количественного определения пигментного состава микроводорослей использовали традиционный метод – приготовление экстракта для спектрофотометрического анализа [29]. Экстракцию образцов проводили при помощи диметилсульфоксида (ДМСО). Для этого 1 мл суспензии клеток центрифугировали в течение 5 мин при 6000 оборотов на центрифуге MiniSpin (Eppendorf, Германия). Супернатант удаляли. Клетки инкубировали в ДМСО при 70°C в течение 10 мин при интенсивном перемешивании. Затем клетки удаляли путем центрифугирования.
Определение концентрации хлорофиллов a и b, а также суммарной концентрации каротиноидов в экстракте проводили спектрофотометрически в 96-луночных планшетах на спектрофотометре Multiskan Sky (Thermo Scientific, США). Расчет суммарной концентрации каротиноидов и концентрации хлорофиллов проводили по уравнениям [29]:
(3)
${{С}_{{{\text{Кар}}}}} = (1000{{D}_{{480}}}--1.29{{С}_{{{\text{хл}}\,а}}}--53.7{{С}_{{{\text{хл}}}}}_{{\,b}}){\text{/}}220,$Описанные выше исследования проводили с использованием оборудования Центра коллективного пользования научным оборудованием ТГУ им. Г.Р. Державина.
Измерение максимального квантового выхода фотосистемы 2. Для характеристики состояния фотосистемы 2 регистрировали ее максимальный квантовый выход (Fv/Fm) с помощью флуорометра PAR-FluorPen FP 110 (“Photon Systems Instruments”, Чехия). Перед измерением образцы водорослей выдерживали в темноте в течение 15 мин. Данный показатель обычно используется для мониторинга стрессовых воздействий на растение, он отражает высокую чувствительность фотосистемы 2 к раздражителям окружающей среды прямо или косвенно. Любое нарушение, приводящее к ингибированию фотосистемы или повреждению ее реакционных центров, приводит к снижению $Fv$/Fm [30].
Анализ эффективности бионакопления/адсорбции. Количественное содержание НЧ или их компонентов в клетках микроводорослей и остаточное содержание частиц в питательной среде определяли методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой (ICP-AES) на спектрометре Varian 720-ES ICP-AES (Agilent Technologies, США). В ходе подготовки образцов для анализа 2 мл отфильтровывали через мембранные фильтры (Millipore, США) с размером пор 0.45 мкм. В качестве проб для анализа брали микроводоросли, инкубируемые с НЧ при максимальной концентрации. С учетом того что крупные агрегаты НЧ могли задержаться на фильтре независимо от накопления/адсорбции водорослями, дополнительно проводили фильтрацию питательной среды, содержащей ту же концентрацию НЧ без культуры водорослей. Полученные данные учитывали при расчете эффективности биоаккумуляции.
Для проведения анализа образцы биоматериала разлагали с помощью смеси насыщенной HCl и HNO3 3:1 $v{\text{/}}v$ и затем анализировали.
Эффективность биоаккумуляции/адсорбции НЧ клетками микроводорослей рассчитывали по формуле [31, 32]:
(4)
$\begin{gathered} {\text{Биоаккумуляция/адсорбция}}\left( {\text{\% }} \right) = \\ = {\text{(}}{{C}_{{\text{i}}}}{\text{/}}{{C}_{{\text{f}}}}{\text{)}} \times {\text{100\% ,}} \\ \end{gathered} $Статистическая обработка данных. Все эксперименты проводили в трех повторностях. Статистическую достоверность основных показателей состояния культуры (содержание хлорофиллов и каротиноидов, общая численность клеток, показатели жизнеспособности и оксидативного стресса) оценивали при помощи стандартного t-критерия (значения p < 0.05 были признаны значимыми). Для оценки статистической достоверности параметра $Fv$/Fm использовали непараметрический U-тест Манна–Уитни (значения p < 0.05 были признаны значимыми), так как параметры флуоресценции в общем случае не подчиняются нормальному распределению [34]. Значения показателя $Fv$/Fm определяли через 24 ч, 4, 6, 7, 11, 13 сут после внесения суспензий НЧ. На рис. 2–8 приведены средние значения и их стандартные отклонения. Статистическую обработку результатов проводили в программе Excel-2010 с использованием пакета анализа данных.
Рис. 4.
Анализ жизнеспособности клеток микроводоросли Desmodesmus sp., инкубируемых в лунках с добавлением НЧ TiO2 и в контрольных образцах без добавления НЧ. Здесь и далее * – достоверные различия с контролем.
Рис. 6.
Анализ наличия окислительного стресса у клеток микроводоросли Desmodesmus sp. под действием НЧ TiO2.
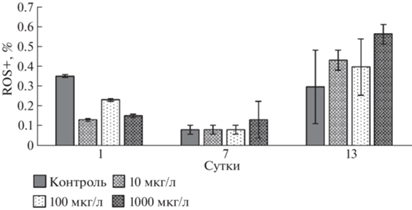
Рис. 7.
Динамика содержания пигментов в культуре Desmodesmus sp. при культивировании с добавлением НЧ TiO2: a – хлорофилла a, б – хлорофилла b, в – каротиноидов, г – хлорофиллов a + b.
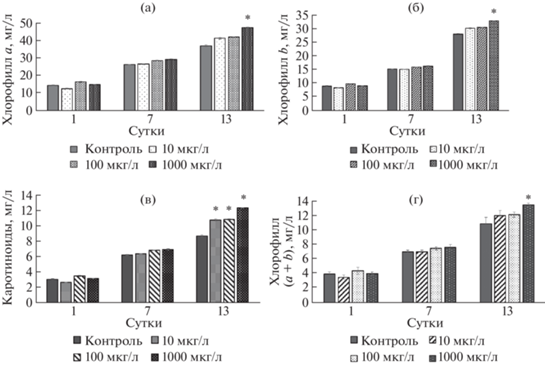
Рис. 8.
Динамика изменения параметра $Fv$/Fm в культуре Desmodesmus sp. при культивировании в среде BG-11 с добавлением НЧ TiO2.
РЕЗУЛЬТАТЫ
Результаты исследования наночастиц
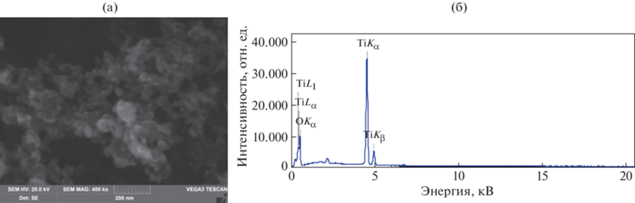
Методом СЭМ установлено, что средний размер частиц TiO2 составляет 30–40 нм, при этом они имеют сферическую форму и узкий размерный диапазон (рис. 2a).
С помощью энергодисперсионной рентгеновской спектроскопии установлено, что анализируемый порошок является диоксидом титана без каких-либо примесей (рис. 2б).
Таким образом, проведенное электронно-микроскопическое исследование показало сферическую форму и нанометровый размер частиц TiO2 (30–40 нм), а также отсутствие примесей в образце.
Результаты исследования коллоидных систем наночастиц
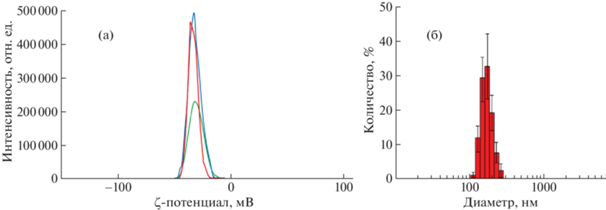
Измерение ζ-потенциала суспензии НЧ показало значение 32 мВ (рис. 3a), что говорит о высокой стабильности дисперсной системы.
При анализе водной дисперсии TiO2 наблюдалось увеличение размера частиц до 150–250 нм (рис. 3б) при 30–40 нм в порошке.
В целом результаты анализа дисперсного состава коллоидных суспензий НЧ показывали, что, несмотря на применение ультразвуковой обработки, частицы в водной среде агрегировали.
Результаты исследования влияния наночастиц на микроводоросли
Жизнеспособность. Полученные результаты по определению жизнеспособности клеток не выявили значимого влияния НЧ TiO2 на анализируемый показатель (рис. 4).
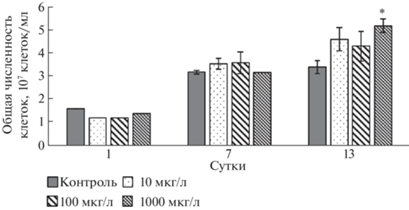
На рис. 5 показана динамика изменения общей численности клеток в присутствии НЧ и в контрольных образцах без добавления токсиканта. Как видно, НЧ TiO2 в концентрации 1000 мкг/л значительно повлияли на общую численность клеток микроводоросли Desmodesmus sp., причем количество клеток увеличилось на 53% на 13-е сутки. Похожий эффект наблюдался в [12]. Снижения количества клеток выявлено не было.
Таким образом, микроводоросль Desmodesmus sp. оказалась относительно устойчивой культурой к воздействию НЧ TiO2, если рассматривать показатели жизнеспособности и динамику изменения общей численности клеток.
Окислительный стресс. Анализ окислительного стресса показал, что НЧ TiO2 не оказывали значимого влияния на генерацию активных форм кислорода (АФК) (рис. 6).
Пигментный состав. При количественном анализе пигментного состава статистически значимые отличия от контроля были выявлены у проб только на 13-е сутки. Так, содержание хлорофилла а, b и каротиноидов увеличено на 27, 18 и 33% соответственно в культурах, обработанных НЧ TiO2 в максимальной концентрации, такой же эффект получен с более низкими концентрациями, но значительно увеличены были только каротиноиды в среднем на 22% (рис. 7а–7в). В случае с общей (а + b) концентрацией хлорофилла значительные отличия были выявлены только при максимальной концентрации НЧ на 13-е сутки, где концентрация пигментов увеличилась на 18% (рис. 7г). Снижения содержания пигментов установлено не было.
Характеристика состояния фотосистемы 2. Результаты оценки максимального квантового выхода фотосистемы 2 обобщены на рис. 8. Так, проведенные флуоресцентные исследования показали, что НЧ TiO2 (100 и 1000 мкг/л) на 13-е сутки вызвали увеличение параметра Fv/Fm на 17 и 22% соответственно. Похожий эффект наблюдался на 4-е и 6-е сутки при тех же концентрациях. В то же время на 7-е сутки под действием НЧ в концентрации 100 мкг/л был замечен спад данного параметра на 18%, на 11-е сутки при максимальной концентрации ингибирование установлено на уровне 11%.
Таким образом, структура распределения $Fv$/Fm в изучаемой культуре может изменяться в зависимости от концентрации НЧ и времени их воздействия на тест-объект.
Анализ бионакопления/адсорбции. Результаты по определению содержания металлических НЧ в клетках микроводоросли показали, что количество НЧ TiO2, которое поглотилось или адсорбировалось Desmodesmus sp., составило 1 мкг/л при концентрации клеток 1.16 × 107 (клеток/мл). В итоге эффективность биоаккумуляции и адсорбции НЧ TiO2 клетками Desmodesmus sp. составила 0.1%.
ОБСУЖДЕНИЕ
В настоящее время мощное развитие получили нанотехнологии, отличительными чертами которых являются создание, эксплуатация и утилизация продуктов, содержащих НЧ. Создавая беспрецедентный класс промышленных загрязнений окружающей среды, НЧ непосредственно воздействуют на живые организмы, поэтому вызванные ими риски как для человека, так и для природных экосистем должны быть оценены. Основной целью данной работы было изучение влияния НЧ на микроводоросль Desmodesmus sp. для оценки толерантности культуры к воздействию выбранных НЧ. Также было важным выяснить, можно ли использовать культуру Desmodesmus sp. для биоремедиации сточных вод, загрязненных НЧ TiO2.
При изучении влияния НЧ TiO2 на различные биологические объекты были описаны неоднозначные результаты [10–12]. Установлено, что техногенные НЧ могут иметь как положительное, так и отрицательное влияние на изучаемые параметры различных культур. В целом настоящее исследование продемонстрировало высокую устойчивость тест-объекта к присутствию в среде НЧ TiO2. Так, НЧ не оказывали значимого влияния как на жизнеспособность образца, так и на увеличение процента клеток, подвергшихся окислительному стрессу. Кроме того, отмечено увеличение общей численности клеток на 53% под действием НЧ TiO2 в концентрации 1000 мкг/л. В [12] предложены несколько возможных механизмов, описывающих увеличение общего количества клеток под действием НЧ. Один из них обусловлен возможностью НЧ TiO2 стимулировать выработку АФК клетками. Считается, что АФК оказывают негативное воздействие на клетки микроводоросли, но, с другой стороны, эти же радикалы кислорода обладают потенциалом для разрушения естественного органического вещества и высвобождения питательных веществ, которые способны стимулировать рост водорослей. Возможно, подобный эффект наблюдался и в проведенном исследовании, так как отмечена тенденция к увеличению общего количества клеток, подвергшихся окислительному стрессу на 13-е сутки под действием НЧ в максимальной концентрации.
Также установлено, что НЧ TiO2 в концентрации 1000 мкг/л на 13-е сутки способствовали увеличению содержания хлорофилла а, b и каротиноидов на 10.4, 5 и 3.7 мг/л соответственно. Общее содержание хлорофиллов увеличилось на 2.6 мг/л. При более низких концентрациях TiO2 наблюдалось увеличение содержания только каротиноидов – на 2 мг/л. Повышение содержания хлорофилла можно объяснить увеличением числа клеток водоросли в максимальной концентрации на 13-е сутки, так как известно, что концентрация пигмента прямо пропорциональна числу живых клеток [35]. С другой стороны, сообщалось, что концентрация пигментов может увеличиваться в ответ на условия низкой освещенности, вызванной НЧ TiO2 [12, 36].
Известно [37], что НЧ металлов способны влиять на ферменты антиоксидантной системы и стимулировать накопление в тканях растений низкомолекулярных антиоксидантов – пролина, глутатиона и каротиноидов. Возможно, увеличение концентрации каротиноидов в клетках микроводоросли, наблюдавшееся в настоящем исследовании, стало защитным механизмом против воздействия АФК. Это могло стать одной из причин низкого процентного содержания клеток, подвергшихся окислительному стрессу.
Результаты исследования максимального квантового выхода фотосистемы 2 показали нелинейный характер токсического действия используемых НЧ, что согласуется с данными [38–40]. Предполагается, что подобный нелинейный характер токсичности может быть связан с такими факторами, как ступенчатый характер адаптации живых организмов к стрессам, сигнальная роль низкоинтенсивного влияния НЧ, нелинейный стохастический резонанс, индуцированный слабыми воздействиями [41]. Также нелинейные эффекты в данном случае могут быть обусловлены индивидуальными различиями НЧ [40].
Ингибирование показателя $Fv$/Fm, наблюдаемое в данном исследовании, можно объяснить несколькими механизмами. Доказано, что токсичность НЧ TiO2 обусловлена их фотокаталитической активностью, которая проявляется в увеличении ингибирующего эффекта после обработки УФ-излучением. Относительно низкие уровни УФ-лучей, согласующиеся с природным солнечным излучением, могут способствовать повышению токсичности НЧ для фитопланктона [42–44]. Также показано, что НЧ TiO2 способны прикрепляться к поверхности клеток микроводорослей [8], приводя к прямой или косвенной токсичности через эффект затенения [12].
Таким образом, микроводоросль Desmodesmus sp. оказалась относительно устойчивой культурой к воздействию НЧ TiO2. Установлено, что Desmodesmus sp. обладает способностью поглощать и/или адсорбировать НЧ из водной среды. Известно, что для проникновения НЧ в клетки водорослей им необходимо преодолеть два барьера – клеточные стенки и плазматические мембраны. При этом клеточные стенки водорослей полупроницаемы и обычно пористы по своей структуре. Диаметр этих пор находится в пределах 5–20 нм. Как правило, НЧ размером меньше максимального диаметра пор могут легко проходить через клеточную стенку [45]. Так как в настоящем исследовании средний размер частиц TiO2 составил 30–40 нм, можно предположить, что их интернализация в клетки микроводоросли затруднена, поэтому в данном случае велика вероятность именно адсорбции НЧ, а не внутреннего поглощения.
Эффективность биоудаления НЧ составила 0.1%, что делает Desmodesmus sp. потенциальным инструментом для биоремедиации сточных вод, загрязненных НЧ TiO2.
Авторы выражают благодарность коллективу кафедры биоинженерии биологического факультета МГУ им. М.В. Ломоносова и лично проф. А.Е. Соловченко за предоставленную культуру микроводорослей.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 21-74-20004).
Список литературы
Mueller N.C., Nowack B. // Environ. Sci. Technol. 2008. V. 42. P. 4447. https://doi.org/10.1021/es7029637
Chen X., Mao S.S. // Chem. Rev. 2007. V. 107. P. 2891. https://doi.org/10.1021/cr0500535
Chen D., Huang F., Cheng Y.B., Caruso R.A. // Adv. Mater. 2009. V. 21. P. 2206. https://doi.org/10.1002/adma.200802603
Ozkaleli M., Erdem A. // Int. J. Environ. Res. Public Health. 2018. V. 15. P. 416. https://doi.org/10.3390/ijerph15030416
Robichaud C., Uyar A.E., Darby M.R et al. // Environ. Sci. Technol. 2009. V. 43. P. 4227. https://doi.org/10.1021/es8032549
Kaegi R., Ulrich A., Sinnet B. et al. // Environ. Pollut. 2008. V. 156. P. 233. https://doi.org/10.1016/j.envpol.2008.08.004
Hu J., Wang J., Liu S. et al. // J. Environ. Sci. 2018. V. 66. P. 208. https://doi.org/10.1016/j.jes.2017.05.026
Wang Y., Zhu X., Lao Y. et al. // Sci. Total Environ. 2016. V. 565. P. 818. https://doi.org/10.1016/j.scitotenv.2016.03.164
Schiavo S., Oliviero M., Miglietta M. et al. // Sci. Total Environ. 2016. V. 550. P. 619. https://doi.org/10.1016/j.scitotenv.2016.01.135
Miao A.J., Luo Z., Chen C.S. et al. // PLoS One. 2010. V. 5. P. 15196. https://doi.org/10.1371/journal.pone.0015196
Hund-Rinke K., Baun A., Cupi D. et al. // Nanotoxicology. 2016. V. 10. P. 1442. https://doi.org/10.1080/17435390.2016.1229517
Kulacki K.J., Cardinale B.J. // PLoS One. 2012. V. 7. P. 47130. https://doi.org/10.1371/journal.pone.0047130
Middepogu A., Hou J., Gao X., Lin D. // Ecotoxicol. Environ. Saf. 2018. V. 161. P. 497. https://doi.org/10.1016/j.ecoenv.2018.06.027
Li Z., Juneau P., Lian Y. et al. // Plants (Basel). 2020. V. 9. P. 1748. https://doi.org/10.3390/plants9121748
Bameri L., Sourinejad I., Ghasemi Z., Fazelian N. // Environ. Sci. Pollut. Res. Int. 2022. V. 29. P. 30427. https://doi.org/10.1007/s11356-021-17870-z
Gottschalk F., Sun T., Nowack B. // Environ. Pollut. 2013. V. 181. P. 287. https://doi.org/10.1016/j.envpol.2013.06.003
Kiser M.A., Westerhoff P., Benn T. et al. // Environ. Sci. Technol. 2009. V. 43. P. 6757. https://doi.org/10.1021/es901102n
Morelli E., Gabellieri E., Bonomini A. et al. // Ecotoxicol. Environ. Saf. 2018. V. 148. P. 184. https://doi.org/10.1016/j.ecoenv.2017.10.024
Kulacki K.J, Cardinale B.J., Keller A.A. et al. // Environ. Toxicol. Chem. 2012. V. 31. P. 2414. https://doi.org/10.1002/etc.1962
Peng C., Zhang W., Gao H. et al. // Nanomaterials. 2017. V. 7. P. 21. https://doi.org/10.3390/nano7010021
Gusev A.A., Zakharova O.V., Vasyukova I.A. et al. // Moscow Univ. Biol. Sci. Bull. 2021. V. 76. P. 165. https://doi.org/10.3103/S0096392521040039
Plappally A., Lienhard J.H. // Renew. Sust. Energ. Rev. 2012. V. 16. P. 4818. https://doi.org/10.1016/j.rser.2012.05.022
Rempel A., Gutkoski J.P., Nazari M.T. et al. // Sci. Total Environ. 2021. V. 772. P. 144918. https://doi.org/10.1016/j.scitotenv.2020.144918
Solovchenko A., Gorelova O., Selyakh I. et al. // Mar. Biotechnol. 2014. V. 16. P. 495. https://doi.org/10.1007/s10126-014-9572-1
Solovchenko A., Gorelova O., Selyakh I. et al. // Algal Res. 2015. V. 11. P. 399. https://doi.org/10.1016/j.algal.2015.04.011
Lobakova E.S., Selyakh I.O., Semenova L.R. et al. // Moscow Univ. Biol. Sci. Bull. 2016. V. 74. P. 284. https://doi.org/10.3103/S009639251602005X
Stanier R.Y., Kunisawa R., Mandel M., Cohen-Bazire G. // Bacteriol. Rev. 1971. V. 35. P. 171. https://doi.org/10.1128/br.35.2.171-205.1971
De Marchi L., Coppola F., Soares A.M. et al. // Environ. Res. 2019. V. 178. P. 108683. https://doi.org/10.1016/j.envres.2019.108683
Solovchenko A.E., Merzlyak M.N., Khozin-Goldberg I. et al. // J. Phycol. 2010. V. 46. P. 763. https://doi.org/10.1111/j.1529-8817.2010.00849.x
Murchie E.H., Lawson T. // J. Exp. Bot. 2013. V. 64. P. 3983. https://doi.org/10.1093/jxb/ert208
Sarı A., Tuzen M. // J. Hazard. Mater. 2008. V. 6. P. 302. https://doi.org/10.1016/j.jhazmat.2007.06.097
Ababna H., Afkar E., Fathi A. // Am. J. Environ. Sci. 2010. V. 6. P. 230. https://doi.org/10.3844/AJESSP.2010.230.237
Che X., Ding R., Li Y. et al. // Nanotoxicology. 2018. V. 12. P. 923. https://doi.org/10.1080/17435390.2018.1498928
Lazár D. // Funct. Plant. Biol. 2006. V. 33. P. 9. https://doi.org/10.1071/FP05095
Janani B., Al Farraj D.A., Raju L.L. et al. // J. Environ. Health Sci. Eng. 2020. V. 18. P. 1465. https://doi.org/10.1007/s40201-020-00561-1
Jøsrgensen E.G. // Physiol. Plant. 1969. V. 22. P. 1307. https://doi.org/10.1111/j.1399-3054.1969.tb09121.x
Venzhik Y.V., Moshkov I.E., Dykman L.A. // Biol. Bull. 2021. V. 48. P. 140. https://doi.org/10.1134/S106235902102014X
Zakharova O.V., Godymchuk A.Y., Gusev A.A. et al. // Biomed. Res. Int. 2015. V. 2015. P. 2206. https://doi.org/10.1155/2015/412530
Bayade G., Rong Wu M., Massicotte R. et al. // Eng. Biomater. 2021. V. 159. P. 2. https://doi.org/10.34821/eng.biomat.159.2021.2-17
Bell I.R., Ives J.A., Jonas W.B. // Dose Response. 2013. V. 12. P. 202. https://doi.org/10.2203/dose-response.13-025.Bell
Stovbun S.V., Kiselev A.V., Zanin A.M. et al. // Bull. Exp. Biol. Med. 2012. V. 153. P. 455. https://doi.org/10.1007/s10517-012-1739-z
Zhang A.P., Sun Y.P. // World J. Gastroenterol. 2004. V. 10. P. 3191. https://doi.org/10.3748/wjg.v10.i21.3191
Hund-Rinke K., Simon M. // Environ. Sci. Pollut. Res. Int. 2006. V. 13. P. 225. https://doi.org/10.1065/espr2006.06.311
Gurr J.R., Wang A.S., Chen C.H., Jan K.Y. // Toxicology. 2005. V. 213. P. 66. https://doi.org/10.1016/j.tox.2005.05.007
Wang F., Guan W., Xu L. et al. // Appl. Sci. 2019. V. 9. P. 1534. https://doi.org/10.3390/app9081534
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии