Российские нанотехнологии, 2023, T. 18, № 3, стр. 402-410
Физиолого-биохимические показатели растений картофеля in vitro, культивируемых на средах с нанокомпозитами гидроксида марганца и оксида меди в арабиногалактановой матрице
А. И. Перфильева 1, *, Т. В. Липчанская 2, А. Р. Харасова 2, О. А. Ножкина 1, Т. Е. Путилина 1, А. В. Сидоров 1, 3, Т. В. Конькова 4, Б. Г. Сухов 4
1 Сибирский институт физиологии и биохимии растений СО РАН
Иркутск, Россия
2 Иркутский государственный университет
Иркутск, Россия
3 Иркутский государственный медицинский университет
Иркутск, Россия
4 Институт химической кинетики и горения им. В.В. Воеводского СО РАН
Новосибирск, Россия
* E-mail: alla.light@mail.ru
Поступила в редакцию 25.11.2022
После доработки 12.12.2022
Принята к публикации 18.08.2023
Аннотация
Изучена биологическая активность химически синтезированных нанокомпозитов (НК) на основе наночастиц (НЧ) оксида меди(I) (НК Cu2О/АГ) и гидроксида марганца (НК Mn(ОН)2/АГс) на основе природной полимерной матрицы арабиногалактан (АГ) с целью разработки нового ростостимулятора для растений картофеля. Растения картофеля выращивали на питательной среде, в которую вместо солей CuSO4 · 4H2O и MnSO4 · 4H2O добавляли соответствующие НК по отдельности или их смесь. Обнаружено, что НК Mn(ОН)2/АГс в концентрации 0.0132% как самостоятельно, так и в комплексе с НК Cu2О/АГ в концентрации 0.0084% стимулировал прирост на 20% по сравнению с контрольными растениями картофеля in vitro. Этот НК усиливал рост растений картофеля за счет удлинения междоузлий; увеличивал биомассу корней и надземной части. Биомасса корней при выращивании растений на среде с двумя НК была на 70% выше, чем в контроле. Стимуляция увеличения биомассы может быть связана с повышением интенсивности фотосинтеза благодаря повышению количества пигментов под влиянием этого НК. Содержание каротиноидов под влиянием марганецсодержащего НК повышалось на 40%. Обработка исследуемым НК снижала количество активных форм кислорода в тканях корней от 35 до 68% благодаря повышенной активности антиоксидантных ферментов. Активность каталазы повышалась от 16 до 120% по сравнению с контролем. Эти данные и ранее полученные результаты свидетельствуют о перспективности изучения НК марганца в качестве ростостимулятора культурных растений.
ВВЕДЕНИЕ
В связи с глобальным изменением климата наблюдается расширение ареала обитания фитопатогенных микроорганизмов в мире на северные и восточные территории [1]. Это приводит к увеличению использования пестицидов, оказывающих негативное воздействие на окружающую среду и здоровье человека [2]. Обозначенные проблемы свидетельствуют о необходимости поиска эффективных и экологически безопасных веществ для регуляции численности фитопатогенных бактерий и грибов.
В настоящее время активно исследуется биологический синтез субмикро- и наночастиц (НЧ), способных найти применение в самых разных областях. Перспективны препараты, используемые в агрохимии, содержащие элементы, относящиеся к макро-, микро- и ультрамикроэлементам. Функциональные полимерные наносоединения находят широкое применение в ветеринарии и растениеводстве, являются основой медико-биологических препаратов с разнообразными видами активностей (антимикробной, противогрибковой, противовирусной, противоопухолевой и т.д.), обладающих антиоксидантным и иммуномодулирующим действием [3–13]. Свойства таких материалов во многом определяются полимерной матрицей (низкая токсичность, гидрофильность, биосовместимость, биологическая активность, термическая и химическая стойкость), а также параметрами наноразмерной фазы (размеры, форма, дисперсность и пространственная локализация), что определяет возрастающий интерес к контролируемому синтезу подобных гибридных материалов [14, 15].
Необходимость поиска новых биологических препаратов сельскохозяйственного назначения не оставляет сомнений. Разнообразие применяемых синтетических средств, как правило, обладает только фунгицидной активностью, не имея бактерицидного эффекта, кроме того, они вызывают развитие микробной устойчивости к этим средствам и токсичны для человека и обитателей окружающей среды. Кроме того, металлы, необходимые для растительного организма, в виде НЧ поглощаются растением более эффективно по сравнению с обычными солями.
Ранее была изучена биологическая активность нанокомпозитов (НК) селена, серебра, марганца, упакованных в природные полимерные матрицы (каррагинан, арабиногалактан (АГ), крахмал, гуминовые вещества). Выявлено, что эти агенты снижают жизнеспособность фитопатогенной бактерии Clavibacter sepedonicus и фитопатогенных грибов р. Phytophthora [16]. Часть исследуемых химически синтезированных НК стимулирует рост и развитие картофеля in vitro, прорастание семян культурных растений (соя, горох, картофель) [17]. При этом показано, что после обработки растений НК в их тканях селен не накапливался [18–20]. Кроме того, химически синтезированные НК на основе природных полимерных матриц не угнетали жизнеспособность почвенных микроорганизмов, что свидетельствует об относительной безопасности для реального применения [16].
Настоящая работа направлена на изучение новых НК на основе соединений НЧ меди и марганца с арабиногалактаном для применения в области сельскохозяйственных технологий, в частности ростостимуляторов растений и агентов для оздоровления растений от фитопатогенных грибов и бактерий.
МЕТОДЫ
Нанокомпозиты были синтезированы в Институте химической кинетики и горения им. В.В. Воеводского СО РАН (г. Новосибирск). АГ получен из полисахарида лиственницы сибирской Larix sibirica Ledeb (ООО «Химия древесины», Иркутск, Россия) [21], прошел дополнительную очистку от примесей и флавоноидов пропусканием через полиамидную колонку. АГс получен модификацией исходного АГ по патенту [22].
НК синтезировали согласно следующим процедурам.
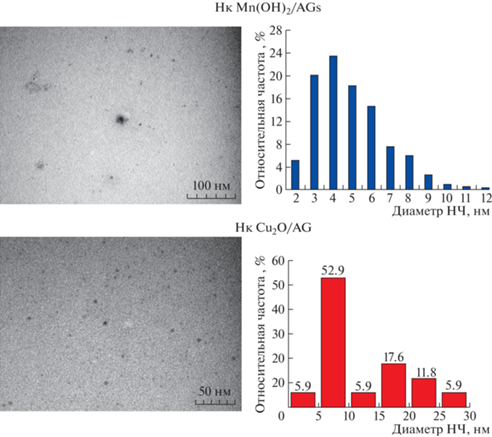
Марганецсодержащие нанокомпозиты. НК Mn(ОН)2/АГс: сульфатированный арабиногалактан (АГс) (2 г, 22 кДа) растворяли в дистиллированной H2O (6 мл) и MnSO4·5H2O (0.3 г) в H2O (2 мл) добавляли к раствору. Затем добавляли NH4OH (0.2 мл) при перемешивании магнитной мешалкой. Через 4 ч реакционную смесь осаждали в спирт и высушивали. Промывка спиртом дала 1.8 г НК Mn(ОН)2/АГс. Содержание НЧ Mn в образце НК, определенное рентгеновским энергодисперсионным микроанализом, составило 4.8%. При микроскопическом исследовании АГ не визуализировался. Нанокомпозит представлял собой электронно-контрастные НЧ марганца размером в диапазоне от 2 до 12 нм. Большинство НЧ имело величину 3–6 нм (рис. 1).
Медьсодержащие нанокомпозиты. НК медь–арабиногалактан-сырец (Cu2O/АГ) синтезировали по следующей методике. К раствору 1 г арабиногалактана в 6 мл воды при интенсивном перемешивании приливали 2 мл водного раствора CuCl2, содержащего 0.09 г CuCl2·2H2O, выдерживали 30 мин при 320 К, затем добавляли 5 мл водного раствора, содержащего 0.08 г NaBH4 и 0.003 г NaOH, выдерживали реакционную смесь 3 ч при интенсивном перемешивании и фильтровали через бумажный фильтр. Целевой продукт выделяли из фильтрата и очищали от низкомолекулярных примесей двухкратным переосаждением из этилового спирта, высушивали в вакууме. Содержание НЧ Cu в образце НК, определенное рентгеновским энергодисперсионным микроанализом, составило 7.5%. Нанокомпозит представлял собой электронно-контрастные НЧ меди диаметром до 30 нм. Более половины НЧ имели величину 5–10 нм (рис. 1).
Схема эксперимента. НК вносили в виде компонентов микросолей среды Мурасиге–Скуга, где соль MnSO4·4H2O заменяли на НК Mn(ОН)2/АГс, массовая доля растворенного вещества составляла 0.0132%. Соль CuSO4·4H2O заменяли на НК Cu2O/АГ, массовая доля растворенного вещества составляла 0.0084%. Такие концентрации НК были подобраны эксперментально и соответствуют концентрации 0.000625% НЧ в конечном растворе. Эта концентрация обладает негативным эффектом по отношению к фитопатогенной бактерии C. sepedonicus [23]. Микроклональное размножение пробирочных растений in vitro сорта Лукьяновский осуществляли с помощью черенкования. Контрольные растения выращивали на среде Мурасиге–Скуга стандартного состава. Растения культивировали в факторостатных условиях в течение 52 сут при 26ºС и освещенности 5–6 кЛк. Каждые 7 сут проводили измерения длины растений и подсчет количества листьев.
По окончании эксперимента снимали биометрические показатели: массу корней, массу надземной части растений, длину междоузлий, а также проводили биохимические исследования: определение содержания активных форм кислорода (АФК) в тканях корней, измерение уровня активности антиоксидантных ферментов (АОФ) – пероксидазы и каталазы в тканях листьев и корней, содержание малонового диальдегида (МДА), содержание пигментов.
Содержание АФК, а именно перекиси водорода, в растительных образцах определяли спектрофотометрически с использованием красителя ксиленоловый оранжевый [24]. Этот метод определения пероксида водорода основан на окислении ионов железа Fe+2 перекисью водорода до ионов железа Fe+3, которые образуют окрашенные соединения с ксиленоловым оранжевым. Активность общей гвояколзависимой пероксидазы определяли по методу Бояркина [25]. Анализ активности каталазы в растениях проводили с помощью спектрофотометрии путем проведения цветной реакции между перекисью водорода и молибдатом аммония с измерением оптической плотности продуктов реакции при λ = 470 нм [26]. Концентрацию МДА определяли по методу Heath, Packer (1968) с применением 20%-ной трихлоруксусной кислоты и 0.5%-ного раствора тиобарбитуровой кислоты [27]. Пигменты экстрагировали 80%-ным ацетоном, их количество определяли на спектрофотометре Specord S 100 («Analytik Jena», Германия). Содержание хлорофилла и каррагинана рассчитывали по формулам Vernon и Wettstein в расчете на единицу сырого веса листа [28].
Статистическую обработку данных провели с применением программы MS Excel. Полученные данные были статистически сопоставлены с использованием непараметрического U-критерия Манна–Уитни.
РЕЗУЛЬТАТЫ
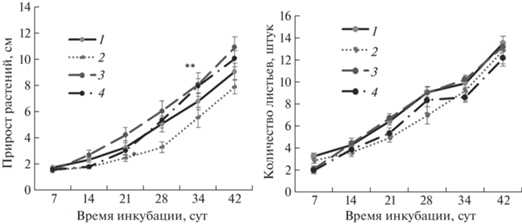
Результаты показали, что НК не оказывали выраженного негативного влияния на рост растений (рис. 2а). При этом длина растений, выросших на среде с Mn(ОH)2/АГс, была больше по сравнению с контролем в течение всего периода эксперимента. Начиная с 28 сут наблюдения отмечена стимуляция прироста растений под влиянием Mn(ОH)2/АГс + Cu2О/АГ. Не выявлено выраженных различий по количеству листьев у исследуемых растений (рис. 2б).
Рис. 2.
Влияние Mn(ОH)2/АГс и Cu2О/АГ на прирост и количество листьев картофеля in vitro: растения, выращенные на питательной среде Мурасиге–Скуга (контроль) (1), на питательной среде с внесением НК Cu/АГ (2), НК Mn(OH)2/АГс (3), НК Mn(ОH)2/АГс и НК Cu2О/АГ (4); ** p ≤ 0.05, значение находится в зоне значимости по U-критерию Манна–Уитни.
Отмечено достоверное стимулирование биомассы корней под влиянием всех НК, а также их смеси (табл. 1). Биомасса надземной части и длина междоузлий у растений, выросших на среде с НК Mn(OH)2/АГс, были выше, чем в контроле, в отличие от НК Cu2О/АГ, который снижал данные показатели. При использовании смеси данных НК (Mn(ОH)2/АГс + Cu2О/АГ) масса надземной части уменьшилась незначительно, а длина междоузлий увеличилась в сравнении с контролем (табл. 1).
Таблица 1.
Влияние НК на морфометрические признаки картофеля in vitro
| Масса корней, г | Масса надземной части, г | Длина междоузлий, см | |
|---|---|---|---|
| К | 0.44 ± 0.15 | 0.66 ± 0.04 | 0.89 ± 0.03 |
| НК Cu/АГ | 0.52 ± 0.14** | 0.58 ± 0.04 | 0.84 ± 0.03 |
| НК Mn/АГс | 0.63 ± 0.22** | 0.65 ± 0.03 | 0.92 ± 0.03 |
| НК Cu/АГ + НК Mn/АГс | 0.75 ± 0.19** | 0.64 ± 0.04 | 0.95 ± 0.03 |
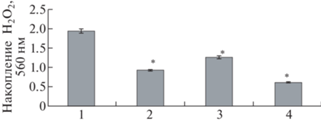
Для оценки влияния НК на статус антиоксидантной системы растений исследовали накопление АФК в тканях корней картофеля. На рис. 3 отображены полученные результаты. Содержание АФК во всех вариантах было ниже по сравнению с контролем, в варианте НК Mn(ОH)2/АГс + НК Cu2О/АГ этот эфект демонстрируется ярче всех.
Рис. 3.
Содержание АФК в тканях корней картофеля in vitro: растения, выращенные на питательной среде Мурасиге–Скуга (контроль) (1), на питательной среде с внесением НК Cu/АГ (2), НК Mn(OH)2/АГс (3), НК Mn(ОH)2/АГс и НК Cu2О/АГ (4); * p ≤ 0.01, значение находится в зоне значимости по U-критерию Манна–Уитни.
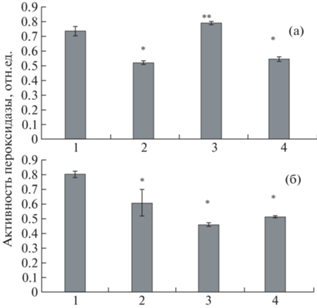
Далее проанализировали изменение активности АОФ в тканях картофеля под влиянием НК. В качестве АОФ были выбраны пероксидаза и каталаза. На рис. 4 представлены данные об активности пероксидазы в тканях корней (а) и листьев (б). Обнаружено достоверное снижение исследуемого показателя в варианте “НК Cu2О/АГ”. Под влиянием НК Mn(ОH)2/АГс отмечено повышение активности пероксидазы в тканях корней картофеля. Однако культивирование картофеля на среде, содержащей “смесь НК”, снова приводило к снижению активности пероксидазы в тканях корня (рис. 4а). Исследование активности фермента в тканях листьев показало снижение изучаемого параметра во всех экспериментальных вариантах по сравнению с контролем (рис. 4б).
Рис. 4.
Активность пероксидазы в тканях корней (а) и листьев (б) картофеля in vitro: растения, выращенные на питательной среде Мурасиге–Скуга (контроль) (1), на питательной среде с внесением НК Cu/АГ (2), НК Mn(OH)2/АГс (3), НК Mn(ОH)2/АГс и НК Cu2О/АГ (4); * p ≤ 0.01, ** p ≤ 0.05, значение находится в зоне значимости по U-критерию Манна–Уитни.
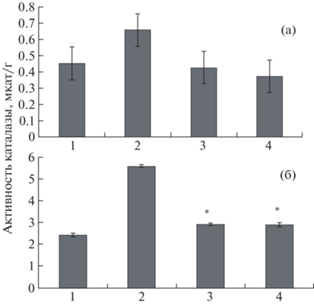
Вторым значимым ферментом антиоксидантной системы является каталаза. Для оценки действия стресса было оценено содержание каталазы в тканях корней и листьев картофеля in vitro. По результатам, представленным на рис. 5, видно, что в тканях листьев активность каталазы во всех вариантах НК выше, чем в контроле (а), в тканях корней изменений не наблюдалось (б).
Рис. 5.
Активность каталазы в тканях корней (а) и листьев (б) картофеля in vitro: растения, выращенные на питательной среде Мурасиге–Скуга (контроль) (1), на питательной среде с внесением НК Cu/АГ (2), НК Mn(OH)2/АГс (3), НК Mn(ОH)2/АГс и НК Cu2О/АГ (4); * p ≤ 0.01, ** p ≤ 0.05, значение находится в зоне значимости по U-критерию Манна–Уитни.
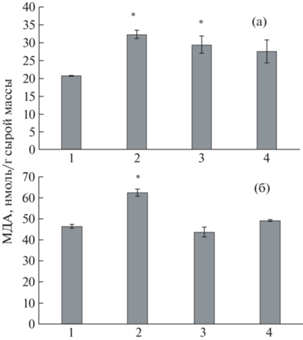
Результатом влияния стрессового фактора являются процессы перекисного окисления липидов (ПОЛ), происходящие вследствие повреждения липидов мембран растительных клеток избыточным количеством АФК. Конечным продуктом ПОЛ является МДА. В тканях корня выявлено достоверное увеличение содержания МДА под влиянием как НК Cu2О/АГ, так и НК Mn(ОH)2/АГс (рис. 6). Однако совеместное их введение в питательную среду не вызывало повышения исследуемого показателя. В тканях листьев содержание МДА повышалось только под влиянием НК Cu2О/АГ.
Рис. 6.
Содержание малонового диальдегида в тканях корней (а) и листьев (б) картофеля in vitro: растения, выращенные на питательной среде Мурасиге–Скуга (контроль) (1), на питательной среде с внесением НК Cu/АГ (2), НК Mn(OH)2/АГс (3), НК Mn(ОH)2/АГс и НК Cu2О/АГ (4); * p ≤ 0.01, значение находится в зоне значимости по U-критерию Манна–Уитни.
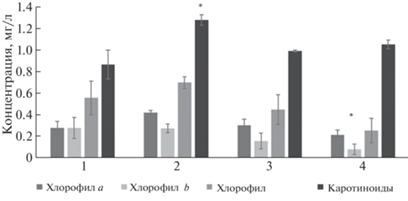
Считается, что увеличение роста высших растений под воздействием НЧ может происходить благодаря повышению продуктивности фотосинтеза. Поэтому в качестве биохимических показателей состояния растений было исследовано содержание пигментов в тканях листьев картофеля, выращенного на средах с НК (рис. 7). Результаты показали, что Mn(ОH)2/АГс увеличивал содержание каротиноидов, а НК Mn(ОH)2/АГс + НК Cu2О/АГ снижали содержание хлорофилла b (рис. 7). Остальные НК не оказывали стимулирующего эффекта на содержание фотосинтетических пигментов в тканях растений картофеля in vitro.
Рис. 7.
Содержание фотосинтетических пигментов в тканях листьев картофеля in vitro: растения, выращенные на питательной среде Мурасиге–Скуга (контроль) (1), на питательной среде с внесением НК Cu/АГ (2), НК Mn(OH)2/АГс (3), НК Mn(ОH)2/АГс и НК Cu2О/АГ (4); * p ≤ 0.01, значение находится в зоне значимости по U-критерию Манна–Уитни.
ОБСУЖДЕНИЕ
Для лучшего понимания эффектов НК на растения полученные данные были систематизированы в табл. 2.
Таблица 2.
Обобщение результатов исследования
| НК Cu2О/АГ | НК Mn(ОH)2/АГс | НК Mn(ОH)2/АГс + + НК Cu2О/АГ | |
|---|---|---|---|
| Прирост растений | снижение | стимуляция | стимуляция |
| Масса корней | стимуляция | стимуляция | стимуляция |
| Накопление Н2О2 в тканях корня | снижение | снижение | снижение |
| Активность пероксидазы (корни/листья) | снижение | повышение/снижение | снижение |
| Активность каталазы (корни/листья) | нет эффекта/повышение | нет эффекта/повышение | нет эффекта/повышение |
| Содержание МДА (корни/листья) | повышение | повышение/нет эффекта | нет эффекта |
| Содержание пигментов | нет эффекта | повышение содержания каротиноидов | снижение содержания хлорофилла b |
В настоящей работе показано, что Mn(ОH)2/АГс самостоятельно и в комплексе с НК Cu2О/АГ стимулировал прирост растений картофеля (рис. 2а), при этом стимуляция происходила благодаря удлинению междоузлий растений (табл. 1) Стимуляцию биометрических параметров растений под влиянием НЧ изучали на различных объектах. Например, НЧ оксида цинка (ZnO) и железа (Fe) стимулировали высоту растений, длину колосьев, а также сухую массу побегов, корней и зерен пшеницы Triticum aestivum [29], у этой же культуры марганецсодержащие НК стимулировали повышение урожайности на 18% [10]. НЧ CuO стимулировали рост огурцов Cucumis sativus [30], биомассу растений томатов Solanum lycopersicum и их урожайность [7]. Кроме того, отмечено достоверное стимулирование биомассы корней под влиянием всех НК (табл. 1). Эти данные подтверждаются сведениями об увеличении корнеобразования под влиянием НЧ. Это хорошо известный эффект НЧ [31, 32].
В качестве биохимических показателей влияния медь- и марганецсодержащих НК на растения картофеля исследовали компоненты окислительно-восстановительной системы растительной клетки: содержание АФК, активность АОФ: пероксидазы и каталазы и содержание МДА в тканях корней и листьев. Каталаза и пероксидаза разлагают перекись водорода и поэтому являются первым уровнем защиты от разрушающего действия АФК [33]. Они максимально снижают концентрацию супероксид-аниона и пероксида водорода в клетке и не позволяют им вступать в реакции с образованием гидроксильного аниона [34]. Каталаза является хромопротеидом и имеет в качестве небелковой группы окисленный гем. Одна молекула каталазы способна расщеплять несколько миллионов молекул H2O2 в секунду. Однако каталаза имеет низкое сродство к перекиси водорода, из-за этого начинает функционировать только при высоком ее содержании в клетке [35]. Пероксидазы являются одним из самых важных ферментов антиоксидантной системы растительной клетки. Группа этих ферментов включает в себя множество классов в зависимости от функций, выполняемых в клетке [36]. В проведенных исследованиях выявлено, что активность пероксидазы практически во всех изученных пробах растений, выращенных на средах с НК, снижалась по сравнению с контролем (рис. 4). Эти данные коррелируют с результатами по содержанию АФК в тканях корней (рис. 3). Под влиянием НК содержание АФК снижалось, что может быть связано с антиоксидантным эффектом НЧ. Было проведено исследование [37], продемонстрировавшее, что внесение НЧ селена в растения, предварительно подверженные абиотическому стрессу, значительно снижало продуцирование АФК. Показано in vivo, что НЧ оксида церия способны каталитически инактивировать АФК [38].
При анализе данных об активности каталазы в тканях картофеля было выявлено, что в листьях активность фермента повышалась под влиянием всех НК. Повышение активности антиоксидантных ферментов в тканях растений ранее наблюдали под влиянием НЧ селена [39].
Разница по эффекту НК на активность антиоксидантных ферментов может быть связана с их функциями. Оба этих фермента катализируют окислительные процессы, играют значительную роль в дыхании растений. Каталаза и пероксидаза утилизируют перекись водорода и тем самым являются передовой линией защиты от токсического действия АФК. При этом основная функция пероксидазы – окисление органических соединений в растениях (полифенолы и ароматические соединения) с помощью перекиси водорода или других органических перекисей [40], а основная функция каталазы – разложение перекиси водорода на воду и молекулярный кислород [35].
Увеличение роста высших растений под воздействием НЧ может происходить благодаря повышению продуктивности фотосинтеза [4, 41]. Растения с повышенной фотосинтетической активностью и эффективностью фотосинтеза формируют высокую и качественную урожайность с меньшим использованием химических средств защиты растений, более эффективно потребляют воду и элементы минерального питания, меньше зависят от изменений в окружающей среде [42]. Результаты проведенного исследования показали, что Mn(ОH)2/АГс увеличивал содержание каротиноидов, а НК Mn(ОH)2/АГс + Cu2О/АГ снижали содержание хлорофилла b (рис. 7). Подобный эффект снижения хлорофилла b описан в [43], где обработка семян Яровой пшеницы T. aestivum L. НЧ никеля в концентрациях 0.0125–1 М приводила к снижению количества хлорофилла b в листьях. В другом эксперименте влияние НЧ CuО на растения отличалось от контрольных повышенным содержанием каротиноидов на 14.5%. На содержание хлорофилла a отрицательное влияние оказывали НЧ CuО (снижение относительно контроля на 22.0–33.0%), хлорофилла b – НЧ NiО (снижение на 16.0–68.0%) [44]. На проростках пшеницы T. aestivum L. показано увеличение содержания каротиноидов после обработки семенного материала марганецсодеражащими НК [10].
ЗАКЛЮЧЕНИЕ
Результаты проведенных экспериментов демонстрируют, что из ряда исследуемых веществ наибольшей биологической активностью для оздоровления культурных растений и повышения их продуктивности обладает НК Mn(ОH)2/АГс. Он стимулировал рост растений картофеля за счет удлинения междоузлий, увеличивал биомассу корней и надземной части. Стимуляция увеличения биомассы может быть связана с повышением интенсивности фотосинтеза благодаря повышению количества пигментов под влиянием этого НК. Обработка НК снижала количество АФК в тканях корней благодаря повышенной активности пероксидазы. В [16] показано, что марганецсодержащие НК не оказывают выраженного негативного эффекта на жизнеспособность почвенных бактерий.
В [18–20] были проведены исследования биологической активности НК селена в природных полимерных матрицах. Показано отсутствие или низкое накопление НЧ селена в тканях картофеля in vitro после его обработки НК селена. Результаты полевых экспериментов демонстрируют стимуляцию продуктивности картофеля и уменьшение инфицированных клубней в составе урожая, полученных после предпосадочной обработки семенного материала НК [45].
На основании опубликованных данных и ранее полученных нами результатов по исследованию эффекта НК селена на растения в естественных условиях вегетации можно заключить, что внесение НК металлов, в частности марганецсодержащих наносоединений, к культурным растениям в качестве ростостимулятора представляет интерес для применения в агрохимии.
Исследование выполнено при поддержке Министерства науки и высшего образования Российской Федерации в рамках базового проекта «Изучение молекулярных механизмов физиологических процессов и аллелопатии в растительно-микробных отношениях» (программы № 0277-2021-0004 (121031300011-7)).
Список литературы
Кошкин Е.И., Андреева И.В., Гусейнов Г.Г. др. // Агрохимия. 2021. № 1. С. 79. https://doi.org/10.31857/S0002188121010063
Захаренко В.А. // Агрохимия. 2022. № 1. С. 50. https://doi.org/10.31857/S0002188122010112
Youssef F.S., El-Banna H.A., Elzorba H.Y. et al. // Int. J. Vet. Sci. Med. 2019. V. 7. № 1. P. 78 https://doi.org/10.1080/23144599.2019.1691379
Ye Y., Medina-Velo I.A., Cota-Ruiz K. et al. // Ecotoxicol. Environ. Saf. 2019. V. 184. 109671. https://doi.org/10.1016/j.ecoenv.2019.109671
El-Sayed A., Kamel M. // Environ. Sci. Pollut. Res. Int. 2020. V. 27. № 16. P. 19073. https://doi.org/10.1007/s11356-018-3913-y
Zhao L., Lu L., Wang A. et al. // J. Agric. Food. Chem. 2020. V. 68. № 7. P. 1935. https://doi.org/10.1021/acs.jafc.9b06615
Shen Y., Borgatta J., Ma C. et al. // J. Agric. Food Chem. 2020 V. 68 (41). P. 11327. https://doi.org/10.1021/acs.jafc.0c04546
El-Abeid S.E., Ahmed Y., Daròs J.A. et al. // Nanomaterials (Basel). 2020. V. 10 (5). 1001. https://doi.org/10.3390/nano10051001
Ekanayake S.A., Godakumbura P.I. // ACS Omega. 2021. V. 6 (40). P. 26262. https://doi.org/10.1021/acsomega.1c03271
Zarinkoob A., Esmaeilzadeh Bahabadi S., Rahdar A. et al. // Environ. Monit. Assess. 2021. V. 193 (12). P. 800. https://doi.org/10.1007/s10661-021-09506-z
Neme K., Nafady A., Uddin S. et al. // Heliyon. 2021. V. 7. № 12. e08539. https://doi.org/10.1016/j.heliyon.2021.e08539
Mabrouk M., Das D.B., Salem Z.A. et al. // Molecules. 2021. V. 26. № 4. P. 1077. https://doi.org/10.3390/molecules26041077
Fu D., Ding Y., Guo R. et al. // Int. J. Biol. Macromol. 2022. V. 195. P. 538. https://doi.org/10.1016/j.ijbiomac.2021.12.022
Albanese A., Tang P., Chan C. // Annu Rev. Biomed. Eng. 2012. V. 14. P. 1. https://doi.org/10.1146/annurev-bioeng-071811-150124
Jeevanandam J., Barhoum A., Chan Y.S. et al. // Beilstein J. Nanotechnol. 2018. V. 9. P. 1050. https://doi.org/10.3762/bjnano.9.98
Perfileva A.I., Tsivileva O.M., Nozhkina O.A. et al. // Nanomaterials. 2021. V. 11. P. 2274. https://doi.org/10.3390/nano11092274
Нурминский В.Н., Перфильева А.И., Капустина И.С. и др. // Докл. РАН. 2020. Т. 495. № 1. С. 607. https://doi.org/10.1134/S1607672920060113
Перфильева А.И., Ножкина О.А., Третьякова М.С. и др. // Российские нанотехнологии. 2020. Т. 15. № 1. С. 108. https://doi.org/10.1134/S199272232001015X
Ножкина О.А., Перфильева А.И., Граскова И.А. и др. // Российские нанотехнологии. 2019. Т. 14. № 5–6. С. 74.https://doi.org/10.21517/1992-7223-2019-5-6-74-81
Граскова И.А., Перфильева А.И., Ножкина О.А. и др. // Химия растительного сырья. 2019. № 3. С. 345. https://doi.org/10.14258/jcprm.2019034794
Ганенко Т.В., Танцырев А., Сапожников А.Н. и др. // Gen Chem. (in Russian). 2015. Т. 85. С. 477. https://doi.org/10.1134/S1070363215020206
Костыро Я.Т., Ганенко Т.В., Медведева С.А. и др. Способ получения сульфатированных производных арабиногалактана, обладающих антикоагуляционной и гиполипидемической активностью. Патент № 2319707 C1 (Россия). 2007.
Khutsishvili S.S., Perfileva A.I., Nozhkina O.A. et al. // Int. J. Mol. Sci. 2021. V. 22 (21). 12006. https://doi.org/10.3390/ijms222112006
Bindschedler L.V., Minibayeva F., Gardner S.L. et al. // New Phytologist. 2001. V. 151. P. 185.
Бояркин А.Н. // Биохимия. 1951. Т. 16. № 4. С. 352.
Королюк М.А., Иванова Л.И., Майорова Н.О. и др. // Лабораторное дело. 1988. № 1. С. 16.
Heath R.L., Packer L. // Arch. Biochem. Biophys. 1968. V. 125. P. 189. https://doi.org/10.1016/0003-9861(68)90654-1
Гавриленко В.Ф., Ладыгина М.Е., Хандобина Л.М. // Большой практикум по физиологии растений. М.: Высш. шк., 1975. С. 392.
Rizwan M., Ali S., Ali B. et al. // Chemosphere. 2019. V. 214. P. 269. https://doi.org/10.1016/j.chemosphere.2018.09.120
Zong X., Wu D., Zhang J. et al. // Environ. Sci. Pollut. Res. Int. 2022. V. 29. № 46. P. 69517. https://doi.org/10.1007/s11356-022-20662-8
Юркова И.Н., Омельченко А.В., Пидгайная Е.С. // Ученые записки КФУ. Биология. Химия. 2018. № 4. С. 283.
Венжик Ю.В., Мошков И.Е., Дыкман Л.А. // Физиология растений. 2021. Т. 68. № 3. С. 245. https://doi.org/10.31857/S0015330321020202
Gomes M.P., Kitamura R.S.A., Marques R.Z. et al. // Antioxidants. 2022. V. 11. № 1. P. 151. https://doi.org/10.3390/antiox11010151
Chioti V., Zervoudakis G. // Antioxidants. 2017. V. 6. № 2. P. 39. https://doi.org/10.3390/antiox6020039
Palma J.M., Mateos R.M., López-Jaramillo J. et al. // Redox Biology. 2020. V. 34. 101525. https://doi.org/10.1016/j.redox.2020.101525
Pandey V.P., Awasthi M., Singh S. et al. // Biochem. Anal. Biochem. 2017. V. 6. P. 308. https://doi.org/10.4172/2161-1009.1000308
Qi W.Y., Li Q., Chen H. et al. // J. Hazard. Mater. 2021. V. 5. P. 417. https://doi.org/10.1016/j.jhazmat.2021.125900
Newkirk G.M., Wu H., Santana I., Giraldo J.P. // J. Vis. Exp. 2018. V. 26. P. 138. https://doi.org/10.3791/58373
Zahedia S.M., Abdelrahman M., Hosseini M.S. et al. // Environ. Pollut. 2019. V. 253. P. 246. https://doi.org/10.1016/j.envpol.2019.04.078
Рогожин В.В. // Пероксидаза растений: строение, механизм действия, активный центр, использование пероксидазы. LAP LAMBERT Acad. Publ. 2010. С. 210.
Feng T., Chen S., Gao D. et al. // Photosynthetica. 2015. V. 53. P. 609. https://doi.org/10.1007/s11099-015-0118-1
Baslam M., Mitsui T., Hodges M. et al. // Front. Plant. Sci. 2020. V. 11. P. 882. https://doi.org/10.3389/fpls.2020.00882
Зотикова А.П., Астафурова Т.П., Буренина А.А. и др. // Сельскохозяйственная биология. 2018. Т. 53. № 3. С. 578. https://doi.org/10.15389/agrobiology.2018.3.578rus
Короткова А.М., Лебедев С.В., Каюмов Ф.Г. и др. // Сельскохозяйственная биология. 2017. Т. 52. № 1. С. 172. https://doi.org/10.15389/agrobiology.2017.1.172rus
Perfileva A.I., Graskova I.A., Sukhov B.G. et al. // Agronomy. 2022. V. 12. 1281. https://doi.org/10.3390/agronomy12061281
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии