Российские нанотехнологии, 2023, T. 18, № 4, стр. 436-455
Таргетная ядерная медицина. Достижения, проблемы и перспективы
М. В. Ковальчук 1, С. М. Деев 2, 3, 4, К. А. Сергунова 1, *
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Москва, Россия
3 Томский политехнический университет, Научно-исследовательский центр “Онкотераностика”, Исследовательская школа химических и биомедицинских технологий
Томск, Россия
4 ФГАОУ ВО “Казанский (Приволжский) федеральный университет”, Научно-исследовательская лаборатория “Биомаркер”, Институт фундаментальной медицины и биологии
Казань, Россия
* E-mail: Sergunova_KA@nrcki.ru
Поступила в редакцию 17.07.2023
После доработки 17.07.2023
Принята к публикации 18.07.2023
Аннотация
Представлен путь развития ядерной медицины на международном и отечественном уровнях. Представлены значимые достижения в развитии и становлении ядерно-физических технологий, разработке таргетных радиофармацевтических лекарственных препаратов (РФЛП). Показаны основные направления таргетной ядерной медицины. Рассмотрены физико-химические аспекты синтеза РФЛП, показаны преимущества и специфичность векторных молекул-носителей.
ОГЛАВЛЕНИЕ
Введение
1. Основные принципы адресной доставки радионуклидов
2. Таргетные радиофармацевтическихе лекарственные препараты
2.1. Диагностические и терапевтические радионуклиды
2.2. Механизмы нацеливания
3. Векторные молекулы-носители
3.1. Антитела и их производные
3.2. Аналоги антител
3.3 Пептиды
3.4. Микросферы и наночастицы
Заключение
ВВЕДЕНИЕ
История развития ядерно-физических методов, применяемых в медицинской практике, насчитывает более века.
8 ноября 1895 г. Вильгельм Конрад Рентген открыл рентгеновские лучи, что стало отправной точкой в формировании направлений лучевой диагностики и терапии.
В России первые экспериментальные работы по изучению рентгеновских лучей были выполнены уже в начале 1896 г. Российские ученые не только повторили опыты В.К. Рентгена, но и стали основоположниками клинического применения рентгеновского излучения (Н.Г. Егоров, А.С. Попов и Р.А. Попова, С.Я. Терешина, А.К. Яновский, С.П. Федоров, М.И. Неменов, И.И. Боргман) [1].
Другим величайшим событием, положившим начало развития ядерной медицины, стало открытие в начале 1896 г. А. Беккерелем спонтанной (самопроизвольной) радиоактивности. Вскоре к исследованиям спонтанного излучения вещества (ядер) приступили Пьер и Мария Кюри (Склодовская-Кюри), так в 1898 г. был открыт радий [2].
В 1901 г. французские физики А. Данло и Э. Блок впервые применили радий для терапии туберкулеза кожи. Данло также изучал возможность применения радия для терапии кожных проявлений системной красной волчанки, а в 1903 г. А. Белл предложил использовать радий для лечения опухолей [3].
В 1908 г. впервые начали применять радий для терапии рака матки, а в 1909 г. – внутриполостном лечении рака простаты [4], что послужило основой для появления брахитерапии – вида радиотерапии, при котором источник излучения вводится внутрь пораженного органа.
Возрастающий интерес к применению источников ионизирующего излучения в медицинской практике определил необходимость более глубокого изучения механизмов радиационного воздействия на различные органы и ткани. В 1903 г. выдающийся русский ученый Е.С. Лондон впервые показал, что радий при длительном облучении может оказывать летальное действие на мышей [5, 6]. В период 1904–1909 гг. он продолжает исследования медико-биологических эффектов излучения радия, связанных с влиянием эманации радия (радона) на живые организмы. Так появляется первая в мире монография по радиобиологии – “Радий в биологии и медицине” [7]. Впоследствии Е.С. Лондон не только устанавливает закономерности дифференцированной радиочувствительности и радиорезистентности разных органов и тканей, но также, предвидя значимую роль и перспективность ядерной медицины, убеждает императора Николая II выделить средства на развитие ядерной науки в России, которая, по мнению ученого, должна была определить в будущем силу и могущество наций [8].
В 1913 г. Д. де Хевеши предлагает метод изотопных индикаторов, а в 1925 г. Г. Блюмгарт проводит первую радиодиагностическую процедуру, предусматривающую внутривенное введение радиоактивной смеси продуктов распада 226Ra пациенту. Так появились новые направления – радионуклидная диагностика и терапия.
Дальнейшее развитие ядерной медицины требовало расширения спектра доступных радионуклидов. Стала очевидной необходимость создания специальных установок для возможности наработки искусственных радиоизотопов, принципиальная возможность получения которых была установлена еще Э. Резерфордом в 1919 г.
Так, в 1929 г. Э. Лоуренс изобретает 27-дюймовый циклотрон – резонансный циклический ускоритель протонов и дейтронов с энергией 4.8 МэВ, в 1937 г. на его основе создает 37-дюймовый циклотрон с энергией ускорения ионов до 8 МэВ, а в 1939 г. – 60-дюймовый (16 МэВ) циклотрон, ставший главным инструментом для получения радионуклидов [9].
Его брат Д. Лоуренс, доктор медицинских наук, в тот же период демонстрирует ценность циклотронов для производства изотопов в медицинских целях. Начиная с 1936 г. под его руководством проводится лечение пациентов с лейкемией и полицитемией с помощью произведенного на циклотроне радиоактивного 32P. Это были первые терапевтические применения искусственно произведенных радиоизотопов на людях. Таким образом, Джон Лоуренс стал “отцом ядерной медицины”.
В России также велась активная разработка ускорительных технологий и параллельно в 1937 г. в Радиевом институте (г. Ленинград) был запущен первый в Европе циклотрон диаметром 1 м и энергией 3.2 МэВ.
Мощным толчком в дальнейшем развитии ядерно-физических технологий, применяемых в современной медицине, послужил первый Атомный проект [10].
Создание под научным руководством И.В. Курчатова первых циклотронов и реакторов на базе Лаборатории № 2 АН СССР, в дальнейшем переименованной в НИЦ “Курчатовский институт”, привело к появлению огромной сети ускорительных и реакторных центров по всей стране, а разработанные методы обогащения и разделения изотопов урана стали основой для современных технологий получения радионуклидов для ядерной медицины.
В 1944 г. осуществляется физический пуск циклотрона М-1, позволивший вывести первый в СССР протонный пучок и получить первые образцы плутония, заложив основу радиохимии. Вскоре в 1946 г. происходит запуск крупнейшего циклотрона в ЛФТИ.
Появление первых циклотронов (1937, 1944 и 1946 г.) становится мощным толчком для развития отечественных ускорительных технологий: в 1947 г. в Курчатовском институте создается ускоритель У-150, за ним в 1999 г. – специализированный синхротрон КИСИ-Курчатов, а также целый ряд ускорителей: протонные ускорители У-7 и У‑70 в Курчатовском институте–ИТЭФ (Лаборатории № 3), У-120 в ФТИ им. А.Ф. Иоффе, синхроциклотрон и NICA в ОИЯИ (Гидротехнической лаборатории), протонный синхротрон У-70 в Курчатовском институте–ИФВЭ, СЦ-1000 и Ц‑80 в Курчатовском институте–ПИЯФ (филиале ФТИ), ВЭП-1 в ИЯФ (Лаборатории новых методов ускорения ИАЭ), У-150М в ИЯФ Республики Казахстан и т.д.
25 декабря 1946 г. под научным руководством И.В. Курчатова осуществляется запуск первого в СССР и Европе реактора Ф-1, в 1948 г. – реактора “Аннушка”, которые заложили основу создания огромной ветви, так называемого “Курчатовского древа”, новых ядерных реакторов, различающихся по конструктивным особенностям и принципам работы [11]. Сегодня созданные установки представляют собой основу не только современной энергетики, военного и гражданского ледокольных флотов, решают задачи обороноспособности государства, но и способствуют активному развитию технологий для ядерной медицины и лучевой терапии и обеспечивают присутствие России в пятерке лидеров мирового рынка изотопной продукции.
Именно в послевоенный период в связи с новыми задачами по использованию атомной энергии в мирных целях основными направлениями стали изучение патогенеза, клиники, профилактики и лечения лучевой болезни, разработка методов применения радиоактивных изотопов и других видов ионизирующих излучений для диагностики и лечения. Для изучения влияния радиации на человека и разработки средств защиты в 1946 г. по инициативе И.В. Курчатова в системе Академии наук СССР была создана радиационная лаборатория, позже переименованная в Институт биофизики, которому было поручено изучение биологического действия радиации. Это направление было продолжено в радиобиологическом отделе НИЦ “Курчатовский институт”–ПИЯФ, тогда еще филиал ФТИ АН СССР, где в 1964 г. была открыта лаборатория радиационной генетики, а позже общей радиобиологии, молекулярной биологии, органического синтеза. Особое внимание уделялось обеспечению биологических экспериментов на биоканале реактора ВВР-М, запущенного в том же институте в 1959 г. [12]. Именно такой междисциплинарный подход и слаженная работа ученых и инженерных кадров позволили руководителю отдела молекулярной биологии С.Е. Бреслеру создать новое направление и специальность “биофизика”. Сегодня на базе этого отдела создан и достаточно успешно функционирует центр доклинических и клинических исследований Курчатовского института, который стал первой в Российской Федерации специализированной площадкой для доклинических исследований радиофармацевтических лекарственных препаратов (РФЛП).
Активное развитие в середине XX века молекулярной биологии приводит к формированию совершенно новой концепции “magic bullet”, предложенной немецким ученым и практикующим врачом Паулем Эрлихом, согласно которой мишени-рецепторы, расположенные на внешней стороне клетки патогенного организма и отсутствующие в теле пациента, способны связываться с конкретными химическими веществами. Впоследствии данная теория, используемая изначально для создания антибактериальных препаратов, стала основой для появления нового поколения таргетных противоопухолевых препаратов, способных к строго специфическому уничтожению опухолевых клеток [13].
В результате объединения достижений в области радиобиологии и молекулярной онкологии в конце XX века формируется отдельное направление таргетной радионуклидной терапии с использованием РФЛП направленного действия, состоящих из фармацевтической субстанции (ФС), обеспечивающей доставку к рецептору-мишени открытого источника ионизирующего излучения – радионуклида, воздействующего на злокачественное образование (опухолевые клетки). До 1980-х гг. Россия шла в ногу с ведущими мировыми странами в области внедрения ядерно-физических методов в медицину, однако в 1990-х–начале 2000-х гг. произошло резкое отставание. В Курчатовском институте тогда осознали критичность ситуации: в 2007 г. Е.П. Велихов и М.В. Ковальчук обратились к руководству страны с проектом по возрождению ядерной медицины, благодаря чему направления, связанные с применением ядерно-физических методов в медицине, обрели второе дыхание и сегодня активно развиваются в стенах Курчатовского института в рамках не имеющего прямых аналогов в мире исследовательско-технологического комплекса конвергентных нано-, био-, информационных, когнитивных и социогуманитарных природоподобных наук и технологий (НБИКС-пт) [10].
Современные тенденции развития ядерно-физических методов в первую очередь направлены на:
− повышение точности и достоверности диагностических исследований;
− минимизацию воздействия ионизирующего излучения на окружающие здоровые ткани;
− усовершенствование технологий лечения радиорезистивных (радиоустойчивых) злокачественных новообразований, отдаленных метастазов и диссеминированных опухолей;
− повышение эффективности лечения путем ранней диагностики заболеваний, повышения точности терапевтического воздействия, а также применения комбинированных методов лечения;
− обеспечение мониторинга терапевтического воздействия за счет применения тераностических РФЛП.
Сегодня технологии конвенциальной терапии позволили повысить качество дозовых распределений и снизить объем облучаемых здоровых тканей (технологии IMRT, IGRT), повысить точность системы дозно-анатомического планирования, применяя fusion-технологии КТ, МРТ, ПЭТ.
Для минимизации лучевого воздействия на здоровые ткани активное развитие получили методы адронной лучевой терапии: протонной (ПЛТ) и ионной (ИЛТ) с использованием ускоренных пучков протонов – ПЛТ и тяжелых ионов углерода – ИЛТ. Физическое преимущество данных методов заключается в способности максимально точно локализовать лучевое воздействие в области заданного объема (обеспечить конформное облучение) за счет реализации эффекта пика Брэгга [14]. Кроме того, поскольку ионы углерода с высокой линейной передачей энергии (ЛПЭ) вызывают сложные повреждения ДНК (плотноионизирующее излучение), ИЛТ является эффективным методом воздействия на радиорезистивные (радиоустойчивые) опухоли.
В целях повышения эффективности лечения отдаленных метастазов и диссеминированных опухолей при незначительных побочных эффектах и минимальном повреждении нормальных тканей активно используется метод радионуклидной терапии, основанный на применении таргетных РФЛП. Механизмы доставки таких препаратов основаны на специфическом распознавании характерных для новообразований молекулярных аномалий [15, 16].
В последние десятилетия стало очевидным, что микроокружение солидных образований играет важную роль в возникновении, развитии, метастазировании раковых опухолей, а также их устойчивости к воздействию лекарственных препаратов. Таким образом, стромальные клетки и другие компоненты внеклеточного матрикса, а также изменения обменных процессов (гипоксия, кислотность, усиление метаболизма) могут содержать ценную прогностическую и патофизиологическую информацию и рассматриваются в качестве информативного маркера и/или терапевтической мишени для таргетной радионуклидной диагностики и терапии [17–19]. С учетом активного внедрения подходов персонализированной медицины в повседневную клиническую практику все больший интерес получает направление тераностики, предусматривающее использование для задач диагностики и лечения одной и той же молекулы-вектора, помеченной разными радиоизотопами [20]. Такой подход имеет неоспоримые преимущества в планировании и оптимизации тактики ведения каждого конкретного пациента, повышении эффективности терапии и минимизации дозовой нагрузки [21].
Среди комбинированных методов лечения онкологических заболеваний особое внимание уделяется совмещению ядерно-физических методов и иммунотерапии [22]. По сравнению с дистанционной лучевой терапией радионуклидная терапия показывает лучшие результаты в сочетании с иммунотерапией пациентов с вторичными (метастатическими) поражениями. Однако до сих пор остается много вопросов, связанных с механизмами противоопухолевого иммунного ответа на фоне ионизирующего излучения и оптимальными подходами к клиническому применению этих комбинаций [23].
Для скорейшего решения этих задач, безусловно, требуется государственная поддержка, которая позволит перейти на качественно новый уровень оказания высокотехнологичной помощи населению нашей страны.
Ярким примером служит Федеральная научно-техническая программа синхротронно-нейтронных исследований и исследовательской инфраструктуры на 2019–2027 гг., утвержденная постановлением Правительства РФ от 16 марта 2020 г. № 287. В ее рамках предусмотрено создание на базе НИЦ “Курчатовский институт” научно-образовательного медицинского центра ядерной медицины (НОМЦ ЯМ), включающего в себя модернизированные комплексы ионной (углеродной) и протонной лучевой терапии, а также радиоизотопный комплекс наработки широкого спектра медицинских радионуклидов для создания РФЛП. Деятельность НОМЦ ЯМ позволит обеспечить разработку, ускоренное внедрение и быстрое распространение передовых технических средств и технологий медицинской радиологии на базе отечественного оборудования, в том числе для наработки перспективных радионуклидов и создания на их основе соответствующих РФЛП [24].
1. ОСНОВНЫЕ ПРИНЦИПЫ АДРЕСНОЙ ДОСТАВКИ РАДИОНУКЛИДОВ
Современные методы радионуклидной диагностики и терапии, основанные на введении в организм пациента соответствующих диагностических, терапевтических и тераностических РФЛП, получили широкое применение не только в онкологии [25] и кардиологии [26], но и эндокринологии [27], психиатрии, неврологии [28], остеологии [29], педиатрии [30] и ряде других областей медицины.
Отличительной особенностью РФЛП от других лекарственных препаратов является наличие в его составе источника ионизирующего излучения – радионуклида, определяющего характер и степень воздействия на заданную область интереса. В процессе радиоактивного распада испускаемые частицы или γ-кванты либо регистрируются внешним детектором, что впоследствии дает возможность реконструировать изображение и визуализировать исследуемую зону интереса (патологические изменения), либо воздействовать на патологические очаги в органах и тканях в терапевтических целях.
Возможность применения радионуклида для целей диагностики или терапии определяется:
− его ядерно-физическими характеристиками (периодом полураспада, типом излучения, ЛПЭ (LET), относительной биологической эффективностью (ОБЭ, RBE) и пр.) [31];
− химическими свойствами (например, возможностью получения устойчивых биомолекул, содержащих радионуклид);
− технико-экономической обоснованностью (возможностью масштабирования технологий, экономической целесообразностью его производства и пр.).
Основной принцип таргетной ядерной медицины основан на обеспечении адресной доставки радионуклида в область интереса и минимизации воздействия на здоровые органы и ткани.
Однако немногие радиоизотопы при инкорпорации в организм человека способны накапливаться в определенных тканях и клетках. Классическим примером является 131I, активно поглощаемый фолликулярными клетками щитовидной железы. С 1940-х гг. он активно применяется при лечении рака щитовидной железы и тиреотоксикоза благодаря его возможности взаимодействия с трансмембранным белком (гликопротеином) – натрий-йодным симпортером, позволяющим переносить ионы йода через базальную мембрану [32, 33].
Другой естественный процесс, приводящий к накоплению 223Ra или 89Sr в области повышенного метаболизма костной ткани, основан на их физико-химическом сходстве с кальцием. Дихлорид радия-223 и хлорид стронция-89 способны включаться в кристаллическую структуру костного минерала гидроксиапатита вместо кальция, что позволяет использовать их для терапии остеобластических (склеротических) метастазов [34], наиболее часто встречаемых при раке молочной железы, раке предстательной железы и мелкоклеточном раке легкого.
Подавляющее большинство радионуклидов не могут быть избирательно захвачены определенными типами тканей и клеток, поэтому в целях обеспечения направленной доставки радионуклида к мишени используют специальные ФС – молекулы-носители, отвечающие за биораспределение РФЛП [15].
Основным условием успешного применения меченых соединений в онкологии являются их высокая чувствительность и специфичность к злокачественным новообразованиям. Подобная адресная доставка РФЛП может осуществляться за счет механизмов активного и пассивного нацеливания.
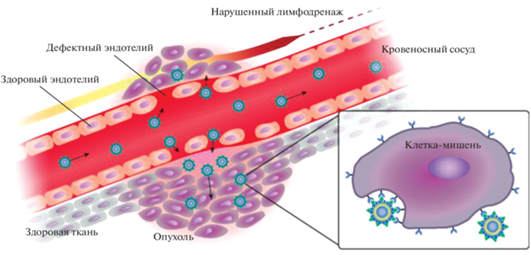
Стратегия пассивной доставки радионуклидов и соответствующих РФЛП осуществляется путем накопления молекул-носителей в определенном месте за счет присущих им патофизиологических, физико-химических или фармакологических факторов. В основе данной стратегии лежит открытый в 1986 г. эффект аномального повышения проницаемости сосудистой сети с последующим удержанием в опухолевой ткани – EРR-эффект (Enhanced Permeability and Retention effect) [35]. Из-за чрезмерного разрастания сосудов, вызванного аномальной потребностью солидной опухоли в кислороде и питании, образуются большие поры (фенестриции) между эндотелиальными клетками (от 380–780 нм до 1.2 мкм в зависимости от типа опухоли) (рис. 1), что приводит к повышенной проницаемости опухолевых капилляров по сравнению с капиллярами в нормальных тканях и в сочетании с нарушением лимфатического дренажа накоплению макромолекулярных соединений (как правило, выше 40 кДа) в васкуляризированной области опухоли. Для пассивного нацеливания используются наночастицы разнообразной природы: неорганические, включающие в себя благородные металлы, магнитные металлы, квантовые точки и неметаллы; органические, состоящие из полимеров и липидов (липосомы, альбуминовые наночастицы, дендримеры, полимерные мицеллы, полимерные наночастицы); углеродные наночастицы [36–40].
Механизм активной доставки предназначен для транспортировки в опухолевую клетку токсинов [40–43], лекарств [44], диагностических реагентов и цитотоксических радионуклидов [45–47]. Он предполагает использование таргетных молекул-носителей, способных специфически взаимодействовать с молекулярными мишенями, которые, как правило, расположены на поверхности опухолевых клеток (рис. 1).
Обладая высокой аффинностью к связыванию с определенным типом клеток или тканей в организме, таргетные молекулы-носители позволяют снизить риск облучения здоровых тканей и снизить требуемую дозу вводимого РФЛП, тем самым повысив точность и эффективность лечения.
В качестве таргетных молекул-носителей применяются такие нацеливающие лиганды, как антитела, их фрагменты и производные, каркасные белки, пептиды и малые молекулы [48, 49]. Они также могут использоваться для таргетной доставки меченых радионуклидами наночастиц (сочетание стратегий активного и пассивного нацеливания). Для таргетной доставки подобных РФЛП могут быть выбраны мишени, расположенные не только на самих опухолевых клетках, но и на нормальных клетках микроокружения опухоли, например эндотелиальных клетках кровеносных сосудов, c последующим высвобождением инкапсулированных агентов [50].
В последние годы появился многообещающий подход, основанный на доставке радионуклида к определенной органелле клетки-мишени. Данный механизм субклеточного нацеливания является наиболее перспективным при использовании α-эмиттеров и эмиттеров электронов Оже, однако требует усовершенствования методов определения локализации и визуализации РФЛП, а также более детального изучения биохимических и физико-химических процессов и оценки рисков накопления в здоровых тканях [51, 52].
2. ТАРГЕТНЫЕ РАДИОФАРМАЦЕВТИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
2.1. Диагностические и терапевтические радионуклиды
В зависимости от энергии и преобладающего типа излучения применяемые в медицинской практике радионуклиды принято разделять на диагностические и терапевтические.
Для диагностических целей используют в основном радионуклиды с короткими периодами полураспада (минуты, часы, десятки часов), излучающими (табл. 1):
Таблица 1.
Основные параметры и свойства различных типов излучений, применяемых в радионуклидной терапии
| Показатель | β-распад | α-распад | Эмиссия электронов Оже |
|---|---|---|---|
| Эмиссия | Электрон | Ядро гелия-4 | Электроны Оже и Костера–Кронига |
| Энергия | 0.05–2.5 МэВ | 2–10 МэВ | 10 эВ–10 кэВ |
| Пробег | 0.2–15 мм | 50–100 мкм | Нанометры |
| Траектория | Извилистая | Прямая | Искривленная |
| Ионизация | Менее плотная | Плотная | Очень плотная, но только в непосредственной близости от источника |
| Линейная передача энергии | 0.2 кэВ/мкм | 80–300 кэВ/мкм | 4–26 кэВ/мкм |
| Механизм действия | Эффект “перекрестного огня”, зависимость от активности, периода полураспада, фазы цикла, количества кислорода | Длина пройденного пути в ядрах клеток, не зависит от фазы цикла, количества кислорода в клетках | Разрывы цепей ДНК (эффект “Свидетеля”) |
| Необходимое условие | Источник должен находиться близко к мишени/поверхности клетки | Связывание с клеткой-мишенью | Включение в ядро клетки |
– γ-кванты (фотоны) с достаточно небольшими энергиями (50–400 кэВ), испускаемые в результате изомерного перехода (99mTc) или K-захвата (111In, 123I и др.);
– позитроны, которые при взаимодействии с электронами аннигилируют, испуская два γ-кванта с энергией 511 кэВ (18F, 82Rb, 124I и др).
Большинство из них (кроме 99mTc) являются нейтронно-дефицитными ядрами и могут быть получены на ускорителях заряженных частиц.
Единичные γ-кванты регистрируются с помощью γ-камеры. Для получения двумерных изображений распределения γ-излучающих радионуклидов в теле пациента применяется планарная γ-сцинтиграфия, для создания трехмерных изображений – однофотонная эмиссионная компьютерная томография (ОФЭКТ) (табл. 2).
Таблица 2.
Радионуклиды для ОФЭКТ и планарной γ-сцинтиграфии
| Радионуклид | Период полураспада (Т1/2), ч | Преобладающая энергия γ-квантов, кэВ (выход) | Способ получения (реакция) |
|---|---|---|---|
| 43Sc | 3.89 | NatCa(p,x)43Sc | |
| 40Ca(α,p)43Sc | |||
| 40Ca(α,p)43Sc | |||
| 45Sc(3He,α)43Sc | |||
| 46Ti(p,α)43Sc | |||
| 67Ga | 78.3 | 93.3 (39%), | 68Zn(p,2n)67Ga |
| 185 (24%), | |||
| 300 (17%) | |||
| 99mТc | 6 | 140.5 (89%) | 235U(n,f)98Mo |
| 98Mo(n,γ)99Mo → 99mTc | |||
| 100Mo(p,d+pn)99Mo → 99mTc | |||
| 100Mo(p,2n)99mTc | |||
| 232Th(p,f)99Mo → 99mTc | |||
| 100Mo(d,3n)99mTc | |||
| 123I | 13.2 | 159 (83%) | 123Te(p,n)124Xe(p,x)123Xe → 123I |
| 124Te(p,2n)123I | |||
| 124Xe(p,2n)123Cs → 123Xe → 123I | |||
| 124Xe(p,pn)123X → 123I | |||
| 111In | 67.2 | 171 (90%), | 112Cd(p,5n)111In |
| 245 (94%) | |||
| 133Xe | 5.24 дн | 132Xe(n,γ)133Xe | |
| 201Тl | 73 | 167 (10%) | 203Tl(p,3n)201Pb |
Для четкого выделения области, в которой расположен источник излучения, используются специальные коллиматоры различных геометрических форм и размеров. Наиболее часто применяют плоскопараллельные коллиматоры. В них каналы выполнены в форме отверстий, расположенных на одной линии.
Ключевым параметром для γ-излучающих радионуклидов является энергия фотонов. Исходя из нее проектируются толщины перегородок (септы) между линиями и их количество. Низкоэнергетические γ-кванты (~70 кэВ) сильно поглощаются в ткани, что приводит к значительным искажениям на изображениях. Низкоэнергетические коллиматоры имеют тонкую септу и большое количество отверстий (до нескольких тысяч) [53].
Чем больше толщина коллиматора, тем ниже эффективность регистрации γ-квантов, но лучше пространственное разрешение. Однако при высоких энергиях требуемая толщина коллиматора становится не оправдано большой. Поэтому, как правило, γ-излучающие радионуклиды с энергией >400 кэВ для целей диагностики не применяются.
До сих пор самым востребованным радионуклидом, применяемым в ядерной медицине, остается 99mTc [54]. С его участием во всем мире проводится около 40 млн процедур в год, что составляет ~80% от всех радионуклидных исследований и 85% от диагностических сканирований [55]. Этот радионуклид образуется из 99Mo (период полураспада – 66 ч), на основе которого изготавливается генератор 99mTc, что делает технеций доступным и достаточно дешевым в производстве. Период его полураспада (6 ч) позволяет получать изображения в день инъекции, однако есть возможность визуализации через 24 ч после введения нуклида. Современные ОФЭКТ-сканеры оптимизированы для получения изображений с использованием 99mTc.
Для регистрации аннигиляционного излучения от позитрон-излучающих радионуклидов применяется метод позитронной эмиссионной томографии (ПЭТ), в основе которого лежит схема совпадений. Одновременная регистрация испускаемых при аннигиляции позитрона γ-квантов помогает определить линию, вдоль которой произошла аннигиляция. Обработка информации, полученной при множественных регистрациях, позволяет реконструировать распределение активности.
Пространственное разрешение в ПЭТ определяется пробегом позитронов в ткани до точки аннигиляции и некоторыми другими параметрами [56]. Допустимым показателем разрешения является величина ~ 5 мм. Расстояние до точки аннигиляции (столкновения) – варьируемая величина для разных радионуклидов, этим и объясняется различное разрешение радиограммы для разных РФЛП.
Метод ПЭТ традиционно ассоциируется с использованием короткоживущих “биогенных” радионуклидов (табл. 3), применение которых позволяет проводить мечение органических биологически активных молекул без изменения их биологических и химических свойств. Таким образом, ПЭТ является уникальным инструментом для изучения in vivo биохимических процессов и их нарушений, связанных с различными заболеваниями.
Таблица 3.
Короткоживущие радионуклиды для ПЭТ
| Радионуклид | Период полураспада | Выход позитрона при распаде, % | Способ получения (реакция) |
|---|---|---|---|
| 15O | 122 с | 99.9 | |
| 13N | 9.97 мин | 99.8 | 16O(p,α)13N |
| 11C | 20.39 мин | 99.8 | 14N(p,α)11C |
Растущий интерес и доступность нестандартных позитрон-излучающих радионуклидов (например, 52Mn, 86Y, 89Zr) повысили актуальность выбора радионуклидов при разработке и оптимизации новых протоколов ПЭТ-исследований как аппаратными, так и программными методами. В [57] предложены алгоритмы коррекции на этапе реконструкции изображения с использованием метода Монте-Карло, позволяющие повысить четкость ПЭТ-изображений.
В общем случае к радионуклидам, используемым для создания диагностических РФЛП, предъявляется ряд рекомендуемых требований [58]:
– отсутствие или минимизация радиационного выхода β–-частиц, которые не несут диагностической информации, но увеличивают дозовую нагрузку на нормальные органы и ткани;
– минимальный средний пробег позитронов в биологических тканях, т.е. минимизация расстояния от точки эмиссии β+-частицы до точки ее аннигиляции и, как следствие, более высокое качество ПЭТ-визуализации;
– максимально возможный радиационный выход β+-частиц у радионуклидов, используемых для ПЭТ, или наличие единственной линии γ-излучения с энергией 100–200 кэВ для радионуклидов, используемых в ОФЭКТ;
– отсутствие или минимальный выход побочного γ-излучения, возникающего при распаде некоторых позитронно-излучающих радионуклидов и приводящего к возрастанию числа ложных совпадений при ПЭТ;
– период полураспада должен быть равен нескольким часам: слишком большой период полураспада увеличит лучевую нагрузку на пациента за счет чрезмерно продолжительного внутреннего облучения после проведения исследований, а слишком маленький приведет к необходимости введения поправки на распад при проведении исследований;
– удельная эффективная доза диагностического облучения в единицах мЗв/МБк (т.е. на 1 МБк активности введенного в организм пациента РФЛП) должна быть минимально возможной;
– технология наработки радионуклида должна быть доступной для ее применения в серийном производстве и экономически приемлемой.
Согласно мировой статистике [59], в развитых странах ~2% населения ежегодно проходят исследования с применением методов ядерной медицины, из которых только 10% приходится на радионуклидную терапию. Несмотря на это, интерес к радионуклидной терапии возрастает с каждым годом. Развитие ядерных технологий сделало доступным достаточно широкий спектр потенциальных терапевтических радионуклидов, обладающих различными физическими и радиобиологическими свойствами.
Степень клеточного повреждения от воздействия ионизирующего излучения зависит от ряда факторов, включая поглощенную дозу облучения, мощность дозы, параметры области (геометрические характеристики, гетерогенность и пр.), тип облучения, длину пробега и ЛПЭ. Для терапии применяются радионуклиды, испускающие α-, β-частицы или электроны Оже [60]. Мощность дозы и распределение дозы в тканях являются аспектами радиационного облучения, которые можно варьировать экспериментально или во время лечения. В то же время тип облучения, длина пробега и ЛПЭ характеризуют непосредственно сам радионуклид (табл. 1). Излучение с высокой ЛПЭ определяет большую концентрацию энергии на более коротком расстоянии при прохождении через ткани по сравнению с излучением с низкой ЛПЭ. Высокая ЛПЭ приводит к интенсивному повреждению макромолекул и гибели клеток посредством многочисленных механизмов, таких как радиолиз воды и пероксидное окисление липидов, ионизация макромолекул, образование одно- и двуцепочечных разрывов и т.д.
Сегодня для синтеза таргетных терапевтических РФЛП применяются (табл. 4–6):
Таблица 4.
Позитрон-излучающие нуклиды для мечения нацеливающих белков
| Радионуклид | Период полураспада, ч | Распад (выход, %) | Основное γ-излучение, кэВ (выход, %) | Способ получения (реакция) |
|---|---|---|---|---|
| 11C | 0.34 | β+ | 14N(p,α)11C | |
| Короткоживущие излучатели позитронов (получение изображений в день интекции) | ||||
| 18F | 1.83 | β+ (97) | 511 (194) | 18O(p,n)18F |
| 20Ne(d, α)18F | ||||
| 44Sc | 3.93 | β+ (94) | 511 (188), 1157 (100) | 44Ti → 44Sc (генератор) |
| 44Ca (p, n) 44Sc | ||||
| 68Ga | 1.14 | β+ (89) | 511 (178), 1077(3.0) | 69Ga(p,2n)68Ge → 68Ga |
| EC (17) | 68Zn(p, n) 68Ga | |||
| 75Br | 1.61 | β+ (76) | 511 (152),141 (6.6), 286 (88) | |
| EC (24) | ||||
| 94mТc | 0.87 | β+ (70) | 511 (140), 871 (94), 1868 (5.7) | |
| EC (30) | ||||
| 110mIn | 1.15 | β+ (62) | 511 (124), 658 (98) | |
| EC (38) | ||||
| 45Тi | 3.08 | β+ (85) | 511 (170), 719 (0.15) | |
| EC (15) | ||||
| 61Cu | 3.4 | β+ (61) | 511 (122), 283 (12.5) | |
| EC (39) | 656 (10.7), 1185 (3.7) | |||
| 44Sc | 3.93 | β+ (94) | 511 (188), 1157 (100) | 44Ti → 44Sc (генератор) |
| EC (6) | 44Ca (p, n) 44Sc | |||
| 66Ga | 9.49 | β+ (57) | 511 (114), 834 (6.0) | |
| EC (43) | 1039 (37.9), 2752 (23.2) | |||
| 64Cu | 12.7 | β+ (18) β– (37) | 511 (36), 1346 (0.5) | 61Ni(α,n)64Cu |
| 64Ni(p,n)64Cu | ||||
| EC (24) | ||||
| 86Y | 14.7 | β+ (33) | 511 (66), 443 (16.9), 628 (32.6) | 89Y(p,4n)86Zr |
| EC (67) | 646 (9.2), 703 (15.4), 778 | |||
| (22.4), 1077 (82.5), 1153 (30.5) | ||||
| 1854 (17.2), 1920 (20.8) | ||||
| 76Br | 16.2 | β+ (54) | 511 (108), 559 (74), 657 (15.9) | |
| EC (46) | 1216 (8.8), 1854 (14.7), 2391 | |||
| (4.7), 2792 (5.6), 2950.5 (7.4) | ||||
| 55Co | 17.53 | β+ (76) | 511 (152), 477 (20.2), 931 (75) | |
| EC (24) | 1317 (7.1), 1408 (16.9) | |||
| 72As | 26.0 | β+ (88) | 511 (176), 630 (7.9), 834 (80) | |
| EC (12) | ||||
| 71As | 64 | β + (30) | 511 (60), 175 (83.1) | |
| EC (70) | ||||
| 89Zr | 78.4 | β + (23) | 511 (46), 909 (100) | Nat Sr(α,x)89Zr |
| EC (77) | 89Y(d,2n)89Zr | |||
| Nat Zr(p,x)89Zr | ||||
| 89Y(p,n)89Zr | ||||
| 124I | 100.2 | β + (23) | 511 (46), 603 (61) | Nat Sb(3he,x)124I |
| Nat Sb(α,x)124I | ||||
| EC (77) | 723 (9.96), 1691 (10.4) | |||
| 52Mn | 134.2 | β + (30) | 511 (60), 744 (90) | |
| EC (70) | 936 (95), 1434 (100) | |||
| 48V | 383 | β + (50) | 511 (100), 944 (7.8) | |
| EC (50) | 983 (100), 1312 (98) | |||
| 74As | 426.5 | β + (29) | 511 (58), 596 (59), 635 (15.4) | |
| β – (34) | ||||
Таблица 5.
Физические свойства некоторых β-излучающих нуклидов, потенциально пригодных для таргетной радионуклидной терапии
| Нуклид | Период полураспада, сут | Средний пробег, мм | Эмиссия | Интенсивность | Энергия фотона, кэВ (выход) | Энергия (МэВ) средняя | CDSA Range (Диапазон α-частиц в приближении непрерывного замедления для средней эмиссии энергии (β) или наиболее вероятной эмиссии энергии (α) в мягких тканях) | Способ получения (реакция) |
|---|---|---|---|---|---|---|---|---|
| Низкоэнергетические β-излучатели | ||||||||
| 67Cu | 2.6 | 0.71 | β– | 100% | 91 (7%) | 0.141 | 0.25 нм | реактор: 67Zn(n,p)67Cu; Ускоритель: 68Zn(p,2p)67Cu 70Ni(p, α)67Cu (70 МэВ – ФНТП) |
| 93 (16%) | ||||||||
| 185 (49%) | ||||||||
| 131I | 8.0 | 0.91 | β– | 100% | 364 (82%) | 0.182 | 0.38 нм | 130Te(n,γ)131I |
| 161Тb | 6.9 | 0.77 | 75 (10%) | |||||
| 177Lu | 6.7 | 0.67 | β– | 113 (6%) | 176Lu(n,γ)177Lu | |||
| 208 (11%) | ||||||||
| Среднеэнергетические β-излучатели | ||||||||
| 77As | 1.6 | 1.2 | β– | 100% | – | 0.226 | 0.53 нм | 77Ge/77As генератор |
| 153Sm | 1.9 | 1.2 | β– | 103 (30%) | 152Sm(n,γ)153Sm | |||
| 186Re | 3.7 | 1.8 | β– | 100% | 137 (9.4%) | 0.347 | 1.0 нм | 185Re(n,γ)186Re 186W(d,2n)186Re |
| Высокоэнергетические β-излучатели | ||||||||
| 188Re | 0.71 | 3.5 | β– (7.47%) ε (92.53%) |
155 (15%) | 0.763 | 3.0 нм | 186W(2n,γ)188W → → 188Re | |
| 166Ho | 1.1 | 3.2 | β– | 80.5 (6.7%) | 165Ho(n,γ)166Ho | |||
| 90У | 2.7 | 3.9 | ||||||
| 76As | 1.1 | 5.0 | 559 (45%) | |||||
| 657 (6.2%) | ||||||||
Таблица 6.
α-излучающие нуклиды, потенциально пригодные для таргетной радионуклидной терапии
| Радионуклид в цепочке распада | Период полураспада | Распад (эмиссия) | Интенсивность | Энергия (МэВ) средняя | CDSA Range (Диапазон α-частиц в приближении непрерывного замедления для средней эмиссии энергии (β) или наиболее вероятной эмиссии энергии (α) в мягких тканях) |
Способ получения (реакция) |
|---|---|---|---|---|---|---|
| 211At | 7.2 ч | α (42%) | 100% | 5.9–7.5 | 49–71 мкм | 209Bi(α,2n)211At |
| EC (58%) | ||||||
| 211Po | 0.52 с | α (100%) | ||||
| 207Bi | 39 лет | |||||
| 207Pb | Стабильный | |||||
| 225Ac | 9.9 сут | α (100%) β |
400% | 5.8–8.4 | 47–86 мкм | 225Ac → 213Bi генератор |
| 300% | 0.198–0.660 | 0.43–2.5 нм | ||||
| 221Fr | 4.9 мин | α (100%) | ||||
| 217At | 32 мс | α (99.98%) /β– (0.01%) | ||||
| 213Bi | 45.6 мин | β–(98%) α (2%) |
300% | 0.198–0.660 | 0.43–2.5 нм | 229Th генератор |
| 100% | 5.9–8.4 | 49–86 мкм | ||||
| 213Po | 4.2 мкс | α (100%) | ||||
| 209Pb | 3.3 ч | β–(100%) | ||||
| 209Bi | Стабильный | |||||
| 227Тh | 18.7 сут | α (100%) | ||||
| 223Ra | 11.4 сут | α (100%) 14C (4 × 10–9%) |
||||
| 219Rn | 4.0 с | α (100%) | ||||
| 215Po | 1.8 мс | α (100%) | ||||
| 211Bi | 2.2 мин | α (99.7%) / β– (0.3%) | ||||
| 207Тl | 4.8 мин | β– (100%) | ||||
| 207Pb | Стабильный | |||||
| 212Pb | 10.6 ч | α β– (100%) |
100% | 6.05 | 51 мкм | 224Ra → 212Pb → 212Bi |
| 200% | 0.10–0.77 | |||||
| 212Bi | 60.6 мин | β– (64%) α– (36%) |
100% | 6.05 | 51 мкм | 224Ra → 212Pb → 212Bi |
| 100% | 0.56–0.77 | 2.0–3.1 нм | ||||
| 208Тl | 3.0 мин | β– (100%) | ||||
| 212Po | 0.3 мкс | α (100%) | ||||
| 208Pb | Стабильный |
– α-излучатели с высокой ЛПЭ (~80 кэВ/мкм) и коротким пробегом частиц (50–90 мкм), например 211At, 212Bi;
– β-излучатели с относительно коротким пробегом частиц (520 мкм), например 33P, 121Sn, 177Lu, 191Os, 199Au;
– β-излучатели со средним пробегом частиц (≥200 мкм при средней величине ~1 мм), например 47Sс, 67Cu, 77As, 109Pd, 111Ag, 131I, 143Pr, 161Tb, 188Re;
– β-излучатели с относительно большим пробегом частиц (в среднем >1 мм), например 32P, 90Y, 186Re;
– радионуклиды, распадающиеся при электронном захвате или внутренней электронной конверсии, например 77Ge, 103Pd, 109Sb, 131Cs, 193Pt, 197Hg.
Характеристики радионуклида должны обеспечить, с одной стороны, избирательное и необратимое повреждение ткани-мишени, с другой – минимальное поражение органов выведения и прилежащих к опухоли здоровых тканей.
Таким образом, на выбор того или иного вида излучения влияют, в том числе, такие параметры, как размер и гетерогенность опухоли, типы тканей, подверженность риску облучения. Диапазон частиц должен быть оптимизирован для облучения всего объема мишени при минимальном облучении здоровых тканей. Этот идеальный диапазон сильно варьируется, поскольку характеристики мишеней сильно различаются между заболеваниями, отдельными пациентами и отдельными мишенями.
2.2. Механизмы нацеливания
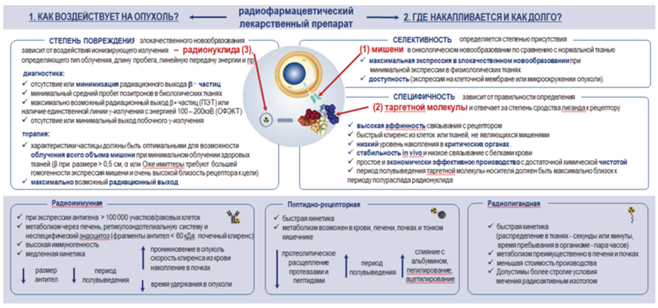
Успешность и безопасность применения РФЛП в клинической онкологии во многом зависят от возможности обеспечения максимально точной доставки источника ионизирующего излучения к онкологическому новообразованию при минимальном воздействии на здоровую ткань. Именно поэтому меченые молекулы для адресной доставки должны обладать высокой специфичностью (избирательность взаимодействия с определенным типом рецепторов), аффинностью связывания и селективностью (избирательность действия на те или иные органы и ткани).
Если специфичность отвечает за степень сродства лиганда к рецептору и зависит от правильности определения таргетной молекулы-носителя, то селективность связана в первую очередь со степенью присутствия мишени (таргета, рецептора) в онкологическом новообразовании по сравнению с нормальной тканью.
Поэтому важной задачей при создании РФЛП становится правильность выбора таргетной мишени. Идеальной мишенью является рецептор, сверхэкспрессированный в злокачественном новообразовании, но не экспрессирующийся или имеющий очень низкую экспрессию в физиологических тканях. Кроме того, рецептор должен быть легко доступен и, следовательно, преимущественно экспрессироваться на клеточной мембране или иметь внеклеточную часть.
Такие мишени включают в себя гликопротеины клеточной поверхности и трансмембранные гликопротеины (такие как антигены кластера дифференцировки (CD), рецепторы фолиевой кислоты), глико- или фосфолипиды (например, дисиалоганглиозид GD2, фосфатидилсерин), углеводы (например, лектины), рецепторы клеточной поверхности (например, рецепторы, связанные с G-белком), интегрины (например, αvβ3), рецепторы факторов роста (например, EGFR и VEGFR), транспортеры (например, LAT1, переносчик норадреналина) или ферменты (например, матриксная металлопротеиназа).
В последние десятилетия очевидным стало, что микроокружение (составляет ~90% от всей опухолевой ткани) солидных образований играет важную роль в возникновении, развитии, метастазировании раковых опухолей, а также их устойчивости к воздействию лекарственных препаратов. Таким образом, стромальные клетки и другие компоненты внеклеточного матрикса (опухоль-ассоциированные фибробласты, макрофаги, адипоциты, опухоль-инфильтрирующие лимфоциты, эндотелиальные клетки новой сосудистой сети и пр.), а также изменения обменных процессов (гипоксия, кислотность, усиление метаболизма) могут содержать ценную прогностическую и патофизиологическую информацию и рассматриваются в качестве информативного маркера и/или терапевтической мишени для таргетной радионуклидной диагностики и терапии [16].
В зависимости от механизма нацеливания выделяют следующие направления таргетной ядерной медицины (рис. 2).
1. Пептидно-рецепторная радионуклидная диагностика и терапия, основанная на фиксации по типу “замок–ключ” таргетных молекул на рецепторах регуляторных пептидов, большинство из которых принадлежат семейству G-белков: рецепторы соматостатина, гастрин-высвобождающий пептидный рецептор, нейрокининовые рецепторы, рецептор холецистокинина и ряд других.
В качестве нацеливающих лиганд используются синтетические пептиды с количеством аминокислот не более 50, обладающие высокой стабильностью и аффинностью связывания.
Данный метод успешно применяется при лечении нейроэндокринных опухолей (НЭО) во многих центрах ядерной медицины [61]. Для визуализации рецепторов соматостатина и оценки степени экспрессии применяются 111In-DTPA-Octreotide и 68Ga-DOTA-TOC, а для последующей терапии – 90Y- и 177Lu-DOTA-TOC(DOTA-TATE) и их аналоги [62].
2. Радиоиммунная диагностика и терапия. Механизм присоединения антител к антигенам заключается в выработке иммунной системой специализированных защитных белков (антител) в ответ на большое количество антигенов, экспрессируемых на поверхности опухолевых клеток и различных компонентов стромы [63]. Два радиоиммуноконъюгата, способные нацеливаться на антиген CD20, были одобрены рядом национальных регулирующих органов: 131I-тозитумомаб и 90Y-ибритумомаб тиуксетан. Клинические результаты этих препаратов показали значительную эффективность и долгосрочное действие при лечении неходжкинской лимфомы [64].
3. Радиолигандная диагностика и терапия на основе применения малых молекул. Благодаря относительно низкой молекулярной массе и повышенной липофильности эти лиганды обладают более высокими фармакокинетическими параметрами по сравнению с антителами или пептидами. Кроме того, они характеризуются более экономичным производством и возможностью мечения радиоактивными изотопами при более строгих условиях (выше температура и более широкий диапазон pH). Наиболее известными являются низкомолекулярные конъюгаты-ингибиторы ПСМА (PSMA-11, PSMA-617, PSMA I&T и др.), применяемые в диагностике и терапии рака предстательной железы. В качестве диагностических радиометок, как правило, используются 68Ga и 64Cu, а для терапевтических целей – 177Lu, 225Ac и 213Bi [65–70].
3. ВЕКТОРНЫЕ МОЛЕКУЛЫ-НОСИТЕЛИ
В качестве таргетных молекул-носителей применяются такие нацеливающие лиганды, как антитела, их фрагменты и производные, каркасные белки, пептиды и малые молекулы. Они также могут использоваться для таргетной доставки меченых радионуклидами наночастиц (сочетание стратегий активного и пассивного нацеливания).
3.1. Антитела и их производные
Использование моноклональных антител (МАТ) как самостоятельных единиц, так и в составе РФЛП широко известно в лечении различных злокачественных новообразований.
Однако, несмотря на несомненную клиническую эффективность, применение данных таргетных ФС совместно с радионуклидами имеет ряд ограничений.
Основным недостатком полноразмерных антител является их большая молекулярная масса (150 кДа). В связи с непрерывным процессом распада радионуклида, в том числе до момента связывания антитела с соответствующим антигеном, происходит облучение здоровых тканей, поэтому крайне важно максимально сократить период свободной циркуляции радиоконъюгатов. Из-за больших размеров МАТ характеризуются длительным временем циркуляции в крови и сниженной диффузией в опухолевые массы, что может привести к накоплению радионуклидов в критических органах, особенно в печени.
Таким образом, основной проблемой при использовании радиоактивно меченых МАТ является их медленная фармакокинетика, приводящая к высоким дозам облучения интактной ткани, включая радиочувствительный костный мозг [64]. Именно поэтому, несмотря на активное использование МАТ при лечении радиочувствительных гематологических опухолей, применение РФЛП для терапии солидных новообразований вызывает множество вопросов.
Современные технологии белковой инженерии позволяют решить указанную выше проблему и ускорить клиренс, экстравазацию, а также проникновение в опухолевую ткань путем преобразования интактных МАТ в более мелкие производные антител. Последние состоят из моновалентных фрагментов, таких как однодоменные антитела (sdAb), диатела, минитела, белковые каркасы и более сложные биспецифические антитела (bsAbs), что позволяет значительно сократить их размеры (15–110 кДа).
Фрагменты антител малого размера (менее ~70 кДа) способны резко ускорить клиренс и обеспечить получение высококонтрастных изображений в течение 4–8 ч, но в то же время привести к негативным последствиям, связанным с изменением путей экскреции РФЛП. Минуя гепатобилиарную систему, подобные фрагменты антител реабсорбируют в почках, которые менее радиорезистентны по сравнению с печенью.
Многообещающим подходом, который может уменьшить радиационное негативное воздействие на почки и снизить гематоксичность при длительном нахождении таргетных молекул в крови, является радиоиммунотерапия с претаргетингом [71]. В начале процедуры пациенту вводится нацеливающий вектор, предназначенный для связывания с целевым антигеном. После его накопления в опухоли и в значительной степени выведения избытка из крови вводится дополнительный агент, представляющий собой небольшую молекулу или короткий пептид, меченный радионуклидом. При столкновении с нацеливающим вектором между двумя молекулами происходит лигирование, приводящее к образованию радиоиммуноконъюгата in vivo. Из-за небольшого размера вторичного агента он обладает благоприятными фармакокинетическими свойствами, следовательно, оставшиеся радиоактивно меченные малые молекулы быстро выводятся из организма. Иногда вводится дополнительная стадия с “очищающим” средством для удаления несвязанного нацеливающего вектора из кровотока перед инъекцией меченой радиоактивным веществом малой молекулы. После инъекции “очищающего” агента молекула быстро связывает целевой вектор, и вновь образованный комплекс выводится через печень.
3.2. Аналоги антител
Аналоги антител на основе альтернативных каркасных белков (АКБ) получают все большее распространение в биомедицине и биотехнологии, что связано с легкостью их конструирования и возможностью получения различных модификаций путем химического синтеза или низкозатратного бактериального производства [72]. Они представляют собой модифицированные природные полипептиды или их фрагменты, лишенные определенных недостатков в виде больших размеров, необходимости замыкания дисульфидных связей, тенденции к образованию агрегатов, снижения аффинности и др. Кроме того, АКБ способны восстанавливать свои свойства и высокую аффинность к молекулярным мишеням после термической или химической денатурации. Это позволяет получать меченные соединения при высоких температурах (до 95°C) из кислотных или щелочных растворов (в диапазоне pH 3.6–11.0). К ним относятся синтезируемые химическим путем аптамеры (~5–30 кДа) и ноттисы (~ 4 кДа), а также получаемые методом фагового дисплея и бактериальной экспрессии дарпины (~14–18 кДа), аффимеры (~12–14 кДа), авимеры (~4 кДа), монотела (~10 кДа), антикалины (~20 кДа), финомеры (~7 кДа), аффибоди (~6.5 кДа). Малые размеры белков (от 2 до 20 кДа) позволяют легче проникать в ткани для связывания, однако это также приводит к быстрой почечной фильтрации, и в некоторых случаях может потребоваться применение дополнительных технологий белковой инженерии для увеличения периода полувыведения из плазмы.
Первым каркасным белком, предназначенным для таргетной радионуклидной терапии, стал доменный каркас белка А из бактерий Staphylococcus aureus – аффибоди (affibody) [73]. Его небольшой размер (58 аминокислот) обеспечивает хорошее проникновение молекулы в опухоль и быстрое выведение из крови несвязанного препарата.
В рамках доклинических исследований было продемонстрировано успешное нацеливание аффибоди на опухоли, а также в несколько раз более высокое соотношение распределения метки опухоль/кровь, чем МАТ, через 72 ч после введения [74, 75]. Сегодня ряд РФЛП на основе HER2-связывающих молекул аффибоди (например, ABY-002 и ABY-025), меченных 68Ga и 111In, проходят вторую и третью фазы клинических испытаний, демонстрируя хорошее биораспределение и высокую контрастную разрешающую способность в пределах от 2 до 24 ч после инъекций [76].
Другой перспективной разновидностью АКБ является каркасный белок, состоящий из четырех или пяти повторов по 33 аминокислоты, β-складки и двух параллельных α-спиралей – дарпин (DARPin) [77]. Данный белок, состоящий из 130–160 аминокислот, обладает высоким сродством к рецепторам эпидермального фактора роста EGFR и HER2 [78], а также мембранному белку межклеточной адгезии EpCAM [79] и представляет несомненный интерес для молекулярной визуализации различных новообразований, в первую очередь рака яичников [80] и трижды отрицательного рака молочной железы [81].
3.3. Пептиды
Таргетные пептиды рассматриваются как альтернативное средство для доставки диагностических агентов и (или) лекарственных препаратов. Пептиды обладают небольшими размерами (от 1 до 15 кДа), благодаря чему хорошо диффундируют в ткани, не являются иммуногенными, быстро выводятся из крови и исключительно хорошо переносятся пациентами.
Еще одним преимуществом использования пептидов являются легкость и экономически выгодный синтез, а также возможность многогранного конъюгирования с агентами для визуализации и лекарственными препаратами, наночастицами для адресной доставки. Пептиды обеспечивают дополнительные перспективные способы лечения для современной персонализированной медицины.
Многие опухоли человека сверхэкспрессируют рецепторы регуляторных пептидов, большинство из которых принадлежит семейству рецепторов, сопряженных с G-белком: рецепторы соматостатина, гастрин-высвобождающий пептидный рецептор, нейрокининовые рецепторы, рецептор холецистокинина и ряд других.
Рецепторы соматостатина (РС, SSTR). Для диагностики и лечения НЭО положительно зарекомендовали себя РФЛП к рецепторам соматостатина на основе лиганд-агонистов DOTA-TATE, DOTA-TOC, DOTA-NOС, меченные радиоизотопами 68Ga, 18F (для диагностики) и 177Lu (для терапии). Когортное исследование пациентов с метастатическими высокодифференцированными НЭО показало, что терапия данными препаратами позволяет увеличить общую продолжительность выживаемости (более 40 мес с момента проведения первой процедуры) и время до прогрессирования заболевания (медиана составила 23.9 мес).
В 2018 г. РФЛП Lutathera (177Lu-DOTA-TATE) был одобрен Управлением по контролю за продуктами и лекарствами (FDA) для лечения НЭО.
Несмотря на достижимую интернализацию радионуклида в опухолевых клетках при использовании лигандов-агонистов РС, современные исследования обращены в сторону поиска перспективных антагонистов, способных взаимодействовать с большим количеством сайтов связывания. В публикациях приводятся данные о высоком потенциале лиганда OPS201 (DOTA-JR11), продемонстрировавшего на клеточных линиях и в рамках доклинических исследований более высокое поглощение опухолью, более длительное время пребывания в опухоли и улучшенное соотношение дозы опухоль/почка, чем 177Lu-DOTA-TATE. Было также показано, что 111In-OPS201 является хорошим кандидатом для диагностики рака молочной железы.
Рецептор бомбезина (гастринвысвобождающий пептид) (РБ, GRPR). Гиперэкспрессия РБ обнаружена во многих различных опухолях, включая мелкоклеточный рак легкого, рак молочной железы, поджелудочной железы или простаты. Нацеливание на РБ является хорошей стратегией визуализации и лечения пациентов с ER-положительным раком молочной железы. Разрабатываются новые РФЛП на основе пептидов-антагонистов РБ, например Neo-BOMB1, меченный 68Ga, 111In и 177Lu. ПЭТ/КТ-сканирование двух пациентов с раком предстательной железы показало, что использование 68Ga-NeoBOMB1 обеспечивает высококонтрастную визуализацию патологических поражений, в настоящее время продолжаются исследования перспектив применения данного РФЛП для тераностических целей.
Рецепторы нейрокинина (или тахикинина) (РН, NK). Сверхэкспрессия РН наблюдается в первичных злокачественных глиомах. Субстанция Р (нейропептид из 11 аминокислот семейства тахикининов, SP) является эндогенным лигандом для рецептора РН типа 1 и представляется интересным агентом для нацеливания на опухоли головного мозга. Первоначальные результаты некоторых пилотных исследований с 90Y-SP и 177Lu-SP продемонстрировали высокий потенциал данного препарата для визуализации и терапии.
С учетом возрастающего интереса к α-излучающим радионуклидам была проведена серия экспериментов по оценке эффективности и безопасности SP, меченных 213Bi, 225Ac и 211At. Использование от 1.4 до 9.7 ГБк [213Bi]Bi-DOTA-SP продемонстрировало среднюю выживаемость без прогрессирования 5.8 и 16.4 мес в целом [82, 83]. В настоящее время проводятся дополнительные доклинические и клинические исследования (фаза 1) [225Ac]Ac-DOTA-SP и [211At]At-DOTA-SP.
Хемокиновый рецептор 4 (CXCR4). Вместе с хемокином CXCL12, который продуцируется в основном в костном мозге, лимфатических узлах, легких, сердце, тимусе и печени, CXCR4 образует сигнальную ось CXCL12-CXCR4, участвующую в гомеостазе кроветворной системы взрослых и адекватном ответе иммунной системы. В настоящее время две радиоактивно меченые пептидные молекулы для визуализации, которые являются лигандами к CXCR4, были протестированы на пациентах – 68Ga-Pentixafor и 68Ga-NOTA-NFB. 68Ga-Pentixafor показал очень хороший фармакокинетический профиль и быстрый клиренс. CXCR4 также является хорошей терапевтической и тераностической целью. Терапевтический пептидный агент к CXCR4 представляет собой Pentixather. Pentixather, меченный 90Y и 177Lu, подтвердил свою эффективность при лечении пациентов с множественной миеломой.
Интегрины αᴠβ3 и αᴠβ5 используются в качестве индикаторов при раке молочной железы, поскольку они сигнализируют о росте клеток, в том числе о злокачественных новообразованиях, метастазах и индуцированном раком ангиогенезе. В качестве нацеливающего лиганда используются радиоактивно меченые структуры с ядром из аргинилглициласпарагиновой кислоты (Arg-Gly-Asp, RGD), обладающей высоким сродством и селективностью в отношении интегринов αᴠβ3 и αᴠβ5. В качестве примеров могут служить исследуемые перспективные РФЛП: 99mTc-EDDA/HYNIC-E-[c(RGDfK)]2, 68Ga-BBN-RGD, 68Ga-TRAP-(RGD)3 и пр.
3.4. Микросферы и наночастицы
Последние достижения в области нанотехнологий позволяют значительно расширить возможности ядерно-физических методов, применяемых в медицине. Наночастицы, размер которых варьируется от 1 до нескольких сотен нм, используются в качестве радиосенсибилизаторов в радиотерапии (рентгеновской и адронной лучевой терапии), в составе препаратов для нейтрон-захватной терапии, а также таргетной доставки радиоизотопов при проведении радионуклидной диагностики и терапии [84]. В последнем случае радионуклиды могут быть либо инкапсулированы в наночастицы, либо присоединены к их поверхности с помощью хелаторов. В качестве носителей используются как неорганические (наноматерилы на основе золота, серебра, кремния и пр.), так и органические наночастицы (углеродные нанотрубки и полимеры, липосомы и пр.) [85]. В обзоре [86] описаны примеры использования РФЛП на основе наночастиц, меченных 99mTс, 64Cu, 177Lu и 223Ra, в рамках доклинических и клинических исследований.
Очевидными преимуществами применения нанотехнологий являются способность поглощения на единицу своей массы большего по сравнению с пептидами и антителами количества адсорбируемых веществ (ионов тяжелых металлов, ядохимикатов, радионуклидов), возможность совмещения механизмов активного и пассивного нацеливания, способность одновременного включения нескольких токсических агентов в целях проведения комбинированной терапии (радио-, иммуно-, химиотерапии) [87], а также применимость ряда неорганических наночастиц (за счет дополнительных оптических, магнитных и других свойств) для мультимодальной тераностики.
Одним из наиболее заметных ограничений является быстрое распознавание наночастиц системой мононуклеарных фагоцитов и системой комплимента, что приводит к ускоренной элиминации наночастиц из кровотока, а также высокому поглощению печенью и селезенкой. Другой проблемой, препятствующей активному внедрению в клиническую практику, является ограничение проникновения наночастиц в опухоли, обусловленное их размером.
Для решения первой задачи в [88] предложен новый подход, основанный на введении в организм антител против собственных эритроцитов. В результате иммунная система на несколько часов концентрируется на выведении отработавших эритроцитов, не обращая внимание на наночастицы, что дает возможность продлить время циркуляции последних в кровотоке до 32 раз. Другой вариант блокировки мононуклеарной фагоцитарной системы – предварительное введение нефункциональных наноагентов [89–91], которые подвергаются атаке со стороны иммунной системы, не вызывая при этом снижения гематокрита. Подобный подход позволяет продлить период полувыведения функциональных частиц до 18 раз.
Вторая задача, связанная с увеличением проникающей способности РФЛП на основе наночастиц, может быть решена за счет совместного введения специального рекомбинантного белка, связывающего демосглеин 2, который отвечает за структурное сцепление соседних эпителиальных клеток. Подобное решение позволяет обеспечить временное и специфичное открытие плотных контактов и способствовать эффективному накоплению наночастиц вокруг и внутри злокачественного новообразования [92, 94].
Отдельного внимания достойны модульные нанотранспортеры, позволяющие на основе естественных клеточных процессов транспорта обеспечить “интеллектуальную” пошаговую доставку радионуклида в ядро раковых клеток [94]. Такое средство доставки является наиболее привлекательным для радиоизотопов с эмиссией электронов Оже, способных при таргетной доставке к компартментам ядра вызывать значительные повреждения в непосредственной близости от места распада (табл. 1), не оказывая губительного воздействия на соседние нормальные клетки.
ЗАКЛЮЧЕНИЕ
Одним из прорывов в медицине в целом и в онкологии, в первую очередь, стало применение ядерно-физических методов, в том числе тех, которые основаны на введении пациенту различных РФЛП – радионуклидная диагностика и терапия.
Современная ядерная медицина играет существенную роль в реализации принципов персонализированной (или прецизионной) медицины за счет применения таргетных молекул-носителей, обеспечивающих избирательную доставку, накопление и удержание связанного с ними диагностического или терапевтического радионуклида непосредственно в клетки злокачественных опухолей, обеспечивая их эффективную диагностическую визуализацию или локальную радиотерапию без существенного лучевого поражения как рядом лежащих, так и отдаленных органов и тканей.
Поэтому крайне важными задачами при разработке современных РФЛП становятся правильность выбора таргетной мишени и создание масштабируемой технологии синтеза молекулы-носителя с высокой аффинностью связывания к ней.
Понимание молекулярно-генетических и метаболических механизмов жизнедеятельности опухолевых клеток, молекулярных процессов их взаимодействия с клетками стромы, открывает большие возможности для создания эффективных РФЛП на основе не только пептидов и МАТ, но и каркасных адресных белков и наночастиц путем “интеллектуальной” пошаговой доставки радионуклида к заданной мишени, а также проведения комбинированной терапии.
Список литературы
Трофимова Т.Н., Карлова Н.А., Бойцова М.Г., Зорин Я.П. // REJR. 2018. № 8 (1). С. 9. https://doi.org/10.21569/2222-7415-2018-8-1-9-15
Diamantis A., Magiorkinis E., Papadimitriou A., Androutsos G. // Hell. J. Nucl. Med. 2008. V. 11 (1). P. 33.
Bell A.G., Sowers Z.T. // Nature. 1903. № 68 (1762). P. 320. https://doi.org/10.1038/068320a0
Pasteau O. Degrais // J. Urologie Med. Chirur. 1913. V. 4 (341). P. 66.
Гребенюк А.Н., Кушнир Л.А., Тимошевский А.А. // Радиационная биология. Радиоэкология. 2021. № 1 (61). С. 44.
Мазинг Ю.А., Чурилов Л.П. // Клиническая патофизиология. 2018. № 4 (24). С. 4.
London E.S. Das Radium in Der Biologie Und Medizin. Leipzig, 1911.
Линденбратен В.Д., Королюк И.П. Медицинская радиология. М.: Медицина, 1993. 556.
Chu W.T. // Lawrence Berkeley National Laboratory. 2005. https://escholarship.org/uc/item/4vc4c8fg
Ковальчук М.В., Нарайкин О.С., Яцишина Е.Б. // Вестн. РАН. 2019. Т. 89. № 5. С. 455.
История атомной энергетики Советского Союза и России: сборник статей Рос. науч. центра “Курчатовский институт” / Под ред. Сидоренко В.А. М.: ИздАТ, 2001. Вып. 1. 254 с.
Реактор ВВР-М и нейтронные исследования. Гатчина: Изд-во ФГБУ “ПИЯФ” НИЦ “Курчатовский институт”, 2016. 240 с.
Strebhardt K., Ullrich A.P. // Nat. Rev. Cancer. 2008. № 8. P. 473. https://doi.org/10.1038/nrc2394
Хорошков В.С., Жидков Д.А., Клёнов Г.И. и др. // Медицинская физика. 2021. № 1 (89). С. 81.
Толмачев В.М., Чернов В.И., Деев С.М. // Успехи химии. 2022. № 91 (3). С. 1.
Bragina O.D., Deyev S.M., Chernov V.I., Tolmachev V.M. // Acta Naturae. 2022. V. 14. P. 4. https://doi.org/10.32607/actanaturae.11611
Van der Heide C.D., Dalm S.U. // Eur. J. Nucl. Med. Mol. Imaging. 2022. V. 49(13). P. 4616. https://doi.org/10.1007/s00259-022-05870-1
Shilova O.N., Shilov E.S., Lieber A., Deyev S.M. // Journal of controlled release. 2018. V. 286. P. 125.
Трашков А.П., Гаглоева Т.Д., Будько А.И. и др. // Педиатр. 2022. Т. 13. № 6. С. 35. https://doi.org/10.17816/PED13635-44.
Румянцев П.О. // Проблемы эндокринологии. 2023. Т. 68. № 6. С. 5.
Чернов В.И., Брагина О.Д., Синилкин И.Г. и др. // Вестн. рентгенологии и радиологии. 2016. Т. 97. № 5. С. 306. https://doi.org/10.20862/0042-4676-2016-97-5-306-313
Болдырев П.П., Деев С.М., Головаченко В.А. и др. // Медицинская физика. 2013. № 3. С. 66.
Kerr C.P., Grudzinski J.J., Nguyen T.P. et al. // Pharmaceutics. 2023. V. 15. P. 128. https://doi.org/10.3390/ pharmaceutics15010128
Kovalchuk M.V., Naraikin O.S., Sergunova K.A. et al. // Crystallography Reports. 2022. V. 67. P. 745. https://doi.org/10.1134/S106377452205011X
Каприн А.Д. // Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2022. № 12 (4). С. 359. https://doi.org/10.30895/1991-2919-2022-12-4-359-361
Завадовский К.В., Веснина Ж.В., Анашбаев Ж.Ж. и др. // Российский кардиологический журнал. 2022. № 27 (12). С. 5134. https://doi.org/10.15829/1560-4071-2022-5134
Румянцев П.О. // Проблемы эндокринологии. 2021. № 67 (1). С. 8. https://doi.org/10.14341/probl12731
Гранов А.М., Тютин Л.А., Станжевский А.А. // Вестн. РАМН. 2012. № 9. С. 13.
Кодина Г.Е., Малышева А.О., Клементьева О.Е. // Изв. РАН. Серия Химическая. 2016. Т. 65. № 2. С. 350.
Крылов А.С., Наркевич Б.Я., Рыжков А.Д. // Онкологический журнал: лучевая диагностика, лучевая терапия. 2022. № 5 (1). С. 18. https://doi.org/10.37174/2587-7593-2022-5-1-18-36
Stokke C., Kvassheim M., Blakkisrud J. // Molecules. 2022. V. 27. P. 5429. https://doi.org/10.3390/ molecules27175429
Шуринов А.Ю., Крылов В.В., Бородавина Е.В. // Онкологический журнал: лучевая диагностика, лучевая терапия. 2021. № 4 (4). С. 9. https://doi.org/10.37174/2587-7593-2021-4-4-9-19
Джикия Е.Л., Авилов О.Н., Киселева Я.Ю. и др. // Вестн. РНЦРР. 2018. Т. 18. № 1. С. 3.
Каприн А.Д., Костин А.А., Воробьев Н.В., Попов С.В. // Медицинский совет. 2018. № 10. С. 78. https://doi.org/10.21518/2079-701X-2018-10-78-82
Wu J. // J. Pers. Med. 2021. V. 11. P. 771. https://doi.org/10.3390/ jpm11080771
Zavestovskaya I.N., Grigorieva M., Petrunya D. et al. // J. Phys.: Conf. Ser. 2021. V. 2058. № 1. P. 012035.
Man F., Gawne P.J., Rafael T.M. de Rosales// Adv. Drug. Deliv. Rev. 2019. V. 143. P. 134. https://doi.org/10.1016/j.addr.2019.05.012
Pijeira M.S.O., Viltres H., Kozempel J. et al. // EJNMMI Radiopharm. Chem. 2022. V. 7. P. 8. https://doi.org/10.1186/s41181-022-00161-4
Peltek O.O., Muslimov A.R., Zyuzin M.V. et al. // J. Nanobiotechnol. 2019. V. 17. P. 90. https://doi.org/10.1186/s12951-019-0524-9
Petriev V.M., Tischenko V.K., Mikhailovskaya A.A. et al. // Scientific reports. 2019. V. 9. P. 1.
Stepanov A.V., Belogurov A.A., Ponomarenko N.A. et al. // PLoS One. 2011. V. 6 (6). P. 20991.
Shramova E., Proshkina G., Shipunova V. et al. // Cancers (Basel). 2020. V. 12 (10). P. 3014. https://doi.org/10.3390/cancers12103014
Shilova O., Shramova E., Proshkina G., Deyev S. // International Journal of Molecular Sciences. 2021. V. 22. P. 4975.
Shilova O.N., Deyev S.M. // Acta Naturae. 2019. V. 11(4 (43)). P. 42.
Keam S.J. // Drugs. 2020. № 80 (5). P. 501. https://doi.org/10.1007/s40265-020-01281-4
Lepareur N., Ramée B., Mougin-Degraef M., Bourgeois M. // Pharmaceutics. 2023. V. 15 (6). https://doi.org/10.3390/pharmaceutics15061733
Guryev E.L., Shilyagina N.Y., Kostyuk A.B. et al. // Toxicological Sciences. 2019. V. 170(1). P. 123.
Olaleye O., Govorukhina N., van de Merbel N.C., Bischoff R. // Biomolecules. 2021. V. 11. P. 1791. https://doi.org/10.3390/biom11121791
Tian H., Zhang T., Qin S. et al. // J. Hematol. Oncol. 2022. V. 15. P. 132. https://doi.org/10.1186/s13045-022-01320-5
Bavelaar B.M., Lee B.Q., Gill M.R. et al. // Front. Pharmacol. 2018. V. 9. P. 996. https://doi.org/10.3389/fphar.2018.00996
Saminathan A., Zajac M., Anees P. et al. // Nat. Rev. Mater. 2022. V. 7. P. 355. https://doi.org/10.1038/s41578-021-00396-8
Duatti A. // Nucl. Med. Biol. 2021. № 92. P. 202. https://doi.org/10.1016/j.nucmedbio.2020.05.005
Beijst C., Elschot M., Viergever Max A., Hugo W.A.M de Jong // J. Nucl. Med. 2015. V. 56 (3). P. 476. https://doi.org/10.2967/jnumed.114.149658
World Nuclear Association. Radioisotopes in Medicine. https://world-nuclear.org/information-library/non-power-nuclear-applications/radioisotopes-research/radioisotopes-in-medicine.aspx
Moses WW. // Nucl. Instrum. Methods Phys. Res. A. 2011. V. 21. P. 648. https://doi.org/10.1016/j.nima.2010.11.092
Carter L.M., Kesner A.L., Pratt E.C. et al. // Mol. Imaging Biol. 2020 № 22 (1). P. 73. https://doi.org/10.1007/s11307-019-01337-2
Sgouros G., Bodei L., McDevitt M.R., Nedrow J.R. // Nat. Rev. Drug. Discov. 2020. V. 19 (9). P. 589. https://doi.org/10.1038/s41573-020-0073-9
Наркевич Б.Я., Долгушин М.Б., Крылов В.В. и др. // Онкологический журнал: лучевая диагностика, лучевая терапия. 2020. № 3 (1). С. 38. https://doi.org/10.37174/2587-7593-2020-3-1-38-56
Stokke C., Kvassheim M., Blakkisrud J. // Molecules. 2022. № 27. P. 5429. https://doi.org/10.3390/ molecules27175429
Reshetov I., Deev S., Chuvilin D. et al. // European Journal of Cancer, Supplement. 2008. V. 6. № 11. P. 9.
Merola E., Grana C.M. // Cancers. 2023. V. 15. P. 2975. https://doi.org/10.3390/cancers15112975
Morschhauser F., Radford J., Van Hoof A. et al. // J. Clin. Oncol. 2013. V. 31 (16). P. 1977. https://doi.org/10.1200/JCO.2012.45.6400
Чувилин Д.Ю, Загрядский В. А., Дубинкин Д.О., Бочагин Ф.С., Панченко В.Я., Деев С.М., Головаченко В.А., Решетов И.В. Способ получения радиоиммунного препарата для диагностики и терапии онкологических заболеваний. Патент РФ № 2537175, 31.10.2014.
Larson S.M., Carrasquillo J.A., Cheung N.K., Press O.W. // Nat. Rev. Cancer. 2015. V. 15 (6). P. 347. https://doi.org/10.1038/nrc3925
Debnath S., Zhou N., McLaughlin M. et al. // Int. J. Mol. Sci. 2022. V. 23. P. 1158. https://doi.org/10.3390/ ijms23031158
Artyukhov A.A., Golovachenko V.A., Deev S.M., Egorova B.V., Kokov K.V. // Nanobiotechnology Reports. 2022. V. 17. No. 3. P. 429.
Панкратов А.А., Немцова Е.Р., Плютинская А.Д. и др. // Бюллетень экспериментальной биологии и медицины. 2021. Т. 171. № 5. С. 601.
Болдырев П.П., Деев С.М., Головаченко В.А. и др. // Медицинская физика. 2013. № 3. С. 66.
Болдырев П.П., Бочагин Ф.С., Деев С.М. и др. // Онкохирургия. 2013. № 1. С. 83.
Chuvilin D., Boldirev P., Bochagin F. et al. // European Journal of Nuclear Medicine and Molecular Imaging. 2012. V. 39. P. 345.
Altai M., Membreno R., Cook B. et al. // J. Nucl. Med. 2017. V. 58 (10). P. 1553. https://doi.org/10.2967/jnumed.117.189944
Gebauer M., Skerra A. // Ann. Rev. Pharmacol. Toxicol. 2020. V. 60 (1). P. 391. https://doi.org/10.1146/annurev-pharmtox-010818-021118
Nord K., Gunneriusson E., Ringdahl J. et al. // Nat. Biotechnol. 1997. V. 15 (8). P. 772. https://doi.org/10.1038/nbt0897-772
Altai M., Perols A., Karlstrom A.E. et al. // Nucl. Med. Biol. 2012. V. 39 (4). P. 518. https://doi.org/10.1016/j.nucmedbio.2011.10.013
Orlova A., Tolmachev V., Pehrson R. et al. // Cancer Res. 2007. V. 67 (5). P. 2178. https://doi.org/10.1158/0008-5472.CAN-06-2887
Altunay B., Morgenroth A., Beheshti M. et al. // Eur. J. Nucl. Med. Mol. Imaging. 2021. V. 48 (5). P. 1371. https://doi.org/10.1007/s00259-020-05094-1
Шилова О.Н., Деев С.М. // Acta Naturae. 2019. V. 11. № 4. P. 42. https://doi.org/10.32607/20758251-2019-11-4-42-53
Deyev S., Vorobyeva A., Schulga A. et al. // Mol Pharm. 2019. V. 16 (3). P. 995. https://doi.org/10.1021/acs.molpharmaceut.8b00922
Deyev S.M., Vorobyeva A., Schulga A. et al. // Int. J. Biol. Macromol. 2020. V. 145. P. 216. https://doi.org/10.1016/j.ijbiomac.2019.12.147
Vorobyeva A., Konovalova E., Xu T. // Int. J. Mol. Sci. 2020. V. 21. P. 3310.
Vorobyeva A., Bezverkhniaia E., Konovalova E. et al. // Molecules. 2020. V. 25. P. 4719.
Болдырев П.П., Деев С.М., Головаченко В.А. и др. // Радиохимия. 2014. Т. 56. № 2. С. 165.
Болдырев П.П., Деев С.М., Головаченко В.А. и др. // Тезисы доклада на Первой Российской конференции по медицинской химии (MedChem Russia-2013). Москва. 2013.
Roy I., Krishnan S., Kabashin A. et al. // ACS Nano. 2022. V. 16 (4). P. 5036. https://doi.org/ff10.1021/acsnano.1c10550f
Panoraia I. Siafaka, Neslihan Üstündağ Okur, Ioannis D. Karantas et al. // Asian J. Pharm. Sci. 2021. V. 16. № 1. P. 24. https://doi.org/10.1016/j.ajps.2020.03.003
Pijeira M.S.O., Viltres H., Kozempel J. et al. // EJNMMI Radiopharm. 2022. V. 7. P. 8. https://doi.org/10.1186/s41181-022-00161-4
Shipunova V.O., Komedchikova E.N., Kotelnikova P.A. et al. // ACS Nano. 2020. V. 14 (10). P. 12781. https://doi.org/10.1021/acsnano.0c03421
Nikitin M.P., Zelepukin I.V., Shipunova V.O. et al. // Nat. Biomed. Eng. 2020. V. 4 (7). P. 717. https://doi.org/10.1038/s41551-020-0581-2
Zelepukin I.V., Yaremenko A.V., Yuryev M.V. et al. // J. Control. Release. 2020. V. 326. P. 181. https://doi.org/10.1016/j.jconrel.2020.07.014
Mirkasymov Aziz B., Zelepukin Ivan V., Nikitin Petr I. et al. // J. Control. Release. 2021. V. 330. https://doi.org/10.1016/j.jconrel.2020.12.004
Zelepukin I.V., Yaremenko A.V., Ivanov I.N. et al. // ACS Nano. 2021. V. 15 (7). P. 11341. https://doi.org/10.1021/acsnano.1c00687
Shilova O., Shramova E., Proshkina G., Deyev S. // Int. J. Mol. Sci. 2021. V. 22 (9). P. 4975. https://doi.org/10.3390/ijms22094975
Shilova O., Shilov E., Lieber A., Deyev S. // J. Control. Release. 2018. V. 286. P. 125. https://doi.org/10.1016/j.jconrel.2018.07.030
Rosenkranz A.A., Slastnikova T.A., Georgiev G.P. et al. // Nucl. Med. Biol. 2020. V. 80–81. P. 45. https://doi.org/10.1016/j.nucmedbio.2019.11.005
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии