Российские нанотехнологии, 2023, T. 18, № 4, стр. 456-474
Тенденции и пути развития протонной лучевой терапии в России
М. В. Ковальчук 1, Ю. А. Дьякова 1, В. И. Максимов 1, 2, Г. И. Кленов 1, Д. И. Гранин 1, Д. Г. Орлов 1, К. А. Сергунова 1, В. С. Хорошков 1, А. И. Халиков 1, 2, А. Н. Черных 1, *
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Петербургский институт ядерной физики Национального исследовательского центра “Курчатовский институт”
Гатчина, Россия
* E-mail: Chernykh_AN@nrcki.ru
Поступила в редакцию 15.03.2023
После доработки 15.06.2023
Принята к публикации 15.06.2023
Аннотация
Протонная лучевая терапия (ПЛТ) на пути своего развития прошла несколько этапов: экспериментальные исследования и накопление клинических данных, затем, начиная с 1990 г., строительство клинических многокабинных центров ПЛТ, которое после 2011 г. дополнилось разработками однокабинных комплексов. Накопленные к настоящему времени клинические результаты в ряде случаев показали безальтернативность ПЛТ для лечения ряда онкологических заболеваний, что позволяет говорить о целесообразности разработки как многокабинных, так и специализированных однокабинных комплексов ПЛТ. Обзор посвящен роли НИЦ “Курчатовский институт” в развитии ПЛТ в России, а именно, разработке двух комплексов ПЛТ в рамках создания Научно-образовательного медицинского центра ядерной медицины НИЦ “Курчатовский институт”.
ОГЛАВЛЕНИЕ
Введение
1. Развитие протонной лучевой терапии в России
1.1. Экспериментальный период протонной лучевой терапии
1.1.1. ЦПЛТ НИЦ “Курчатовский институт” – ИТЭФ
1.1.2. Медицинский протонный комплекс НИЦ “Курчатовский институт” – ПИЯФ
1.1.3. Медико-технический комплекс протонной терапии в Объединенном институте ядерных исследований
1.2. Клинические комплексы ПЛТ в России
1.2.1. Комплекс протонной лучевой терапии “Прометеус”
1.2.2. Центр протонной лучевой терапии МИБС в Санкт-Петербурге
1.2.3. Центр протонной лучевой терапии ФВЦМР ФМБА в г. Димитровград
2. Пучки ускоренных протонов: их достоинства и проблемы использования в дистанционной лучевой терапии
2.1. Физические основы адронной лучевой терапии
2.2. Ускорительная техника для адронной лучевой терапии
2.3. Формирование дозового распределения в адронной лучевой терапии
2.3.1. Пассивный метод формирования дозового распределения
2.3.2. Активный метод формирования дозового распределения
3. Развитие протонной лучевой терапии в НИЦ “Курчатовский институт”
3.1. Комплекс протонной лучевой терапии
3.2. Онкоофтальмологический комплекс протонной лучевой терапии на базе циклотрона Ц-80
3.3. Система дозно-анатомического планирования
Заключение
ВВЕДЕНИЕ
Адронная лучевая терапия (АЛТ) после 70-летнего развития завоевала свое место в мировом здравоохранении как высокоэффективный метод лечения онкологических заболеваний. Протонами и ионами углерода уже облучено более 320 000 [1] пациентов, и их число продолжает стремительный рост. Однако этот высокотехнологичный метод лечения остается эксклюзивным, так как даже в развитых странах, таких как США, Япония и страны Европейского союза, число лучевых установок, необходимое для оказания этого вида медицинской помощи населению региона, еще не достигло целевого значения. Это положение иллюстрируется данными табл. 1, в которой показано, что США и Япония лидируют в области АЛТ и что до полного охвата населения этих стран лечением с помощью АЛТ еще предстоит потрудиться.
Таблица 1.
Обеспечение населения некоторых стран оборудованием для протонной лучевой терапии
| Страна | Население, млн. чел | Количество работающих клинических центров ПЛТ | Число лучевых установок в работающих центрах | Нужно центров из расчета один центр на 8 млн чел. | Число пациентов для АЛТ 300 пациентов на 1 млн человек | Нужное число лучевых установок |
|---|---|---|---|---|---|---|
| Англия | 67 | 6 | 10 | 8 | 20 100 | 67 |
| Германия | 83 | 7 | 19 | 10 | 24 900 | 83 |
| Испания | 47 | 2 | 1 | 6 | 14 100 | 47 |
| Италия | 59 | 4 | 8 | 7 | 17 700 | 59 |
| Нидерланды | 17 | 3 | 6 | 2 | 5100 | 17 |
| США | 337 | 40 | 104 | 42 | 101 100 | 337 |
| Франция | 65 | 3 | 6 | 8 | 19 500 | 65 |
| Япония | 126 | 24 | 57 | 16 | 37 800 | 126 |
| Китай | 1459 | 6 | 9 | 182 | 437 700 | 1459 |
| Индия | 1415 | 1 | 3 | 177 | 424 500 | 1415 |
| Россия | 147 | 3 | 7 | 18 | 44 100 | 147 |
Обычно потребности оборудования для АЛТ оцениваются исходя из предположений, что на 5–10 млн населения целесообразно иметь один центр адронной терапии. Однако создаваемые центры могут сильно отличаться друг от друга числом медицинских кабинетов, поэтому более наглядно делать оценки, опираясь на число медицинских кабинетов, в которых размещаются лучевые установки.
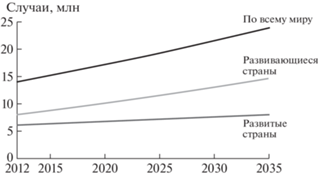
При составлении табл. 1 были приняты допущения, что число онкологических больных, которым показана АЛТ, равно 300 на 1 млн жителей, а максимальный годовой поток пациентов на одну лучевую установку равен также 300 пациентам. При таких допущениях получается, что число лучевых установок равно числу миллионов жителей этой страны, и такой оценкой легко пользоваться. Заметим, что оценка по числу лучевых установок дает необходимое число центров с четырьмя медицинскими кабинетами примерно в 2 раза больше, чем при общепринятой оценке. Также укажем, что в развивающихся странах число пациентов, облученных адронами, малозаметно по причинам довольно высокой стоимости оборудования АЛТ, отсутствия квалифицированных кадров и стремительного роста числа ежегодно выявляемых онкологических пациентов. Статистические данные за 2020/2021 г. [2] утверждают, что в 2021 г. было выявлено 19.3 млн новых случаев заболеваний раком. Если предположить [3], что ~10% пациентов безальтернативно нуждаются в АЛТ, то ежегодно нужно облучать адронами ~1.9 млн пациентов. Годовой поток пациентов, который может быть обеспечен одной лучевой установкой, не превышает в настоящее время 300 пациентов. Следовательно, для полного удовлетворения нужд населения земного шара необходимо иметь ~6300 лучевых установок. По прогнозам [4] к 2030 г. в мире будет насчитываться ~1000 лучевых установок АЛТ, и дефицит этого вида медицинской помощи будет сохраняться еще многие годы. На самом деле положение более серьезно, так как число людей, заболевающих ежегодно раком, по прогнозам ВОЗ все время растет и к 2030 г. достигнет значения 21.6 млн. человек (рис. 1).
Рис. 1.
Прогноз всемирной организации здравоохранения увеличения онкологических заболеваний в мире [5].
Отметим, что сегодня в мире действуют 105 центров протонной лучевой терапии (ПЛТ) и 14 центров ионной лучевой терапии. Кроме того, строятся еще 33 центра и планируются к строительству 30 центров ПЛТ. В России работают три центра ПЛТ, два из них на оборудовании иностранного производства.
Участие России в создании оборудования для АЛТ и выход с этим оборудованием на рынок хотя и запоздали, но могут быть востребованы с учетом политической и экономической обстановки.
1. РАЗВИТИЕ ПРОТОННОЙ ЛУЧЕВОЙ ТЕРАПИИ В РОССИИ
1.1.1. ЦПЛТ НИЦ “Курчатовский институт” – ИТЭФ
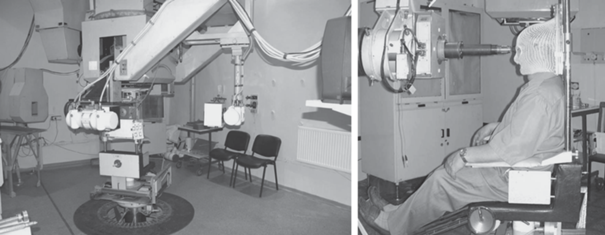
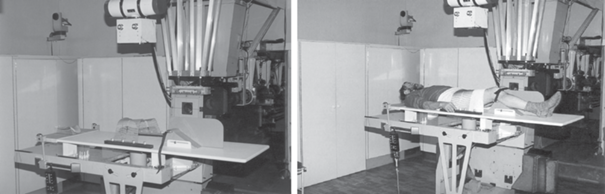
Физико-технический опыт. Центр ПЛТ НИЦ “Курчатовский институт” – ИТЭФ (Центр) создавался в период 1964–1969 гг., в 1969 г. был облучен первый больной. До 1990 г. Центр оставался самым крупным среди десяти экспериментальных центров ПЛТ, работающих в мире на тот момент, и включал в себя три процедурных кабинета с четырьмя лучевыми установками. Все оборудование, используемое в Центре, спроектировано под руководством отдела медицинской физики НИЦ “Курчатовский институт” – ИТЭФ и изготовлено на российских предприятиях. В состав каждой лучевой установки центра ПЛТ входят следующие устройства: роботизированные позиционеры (стол, кресло), системы формирования дозового распределения, системы лазерного и рентгеновского позиционирования, системы безопасности и т.п. Все лучевые установки сертифицированы и являются изделиями медицинского назначения (рис. 2–4).
Рис. 4.
Лучевая установка для проведения ПЛТ злокачественных новообразований урогинекологической сферы.
Клинический опыт. Как отмечалось, в Центре первого больного облучили в 1969 г. До 1990 г. было пролечено 1945 больных, что составляло 23% мирового клинического опыта, накопленного в десяти аналогичных центрах в США, Европе и Японии. При этом до 1990 г. в Центре был самый широкий в мире спектр облучаемых опухолей. В то время как во всем мире до 1990 г. облучались в основном опухоли глаза и внутричерепные мишени (75% опыта), в Центре пять ведущих клиник Москвы облучали своих профильных больных с опухолями глаза, внутричерепными опухолями, раком предстательной железы, раком шейки матки, раком молочной железы, костными и мягкоткаными саркомами и другими.
В то время как в каждом из десяти центров в этот период работали один, максимум два врача, облучение в Центре вел, накапливая клинический опыт, большой “многопрофильный” коллектив лучевых терапевтов из упомянутых пяти крупнейших клиник Москвы: Б.В. Астрахан, А.Ф. Бровкина, Г.Д. Зарубей, В.А. Крымский, Г.Д. Макарова, Е.И. Марова, Е.И. Минакова, Г.Д. Монзуль, В.Н. Киселева, Л.Е. Кирпатовская, В.Г. Хазанов, В.Е. Хмелевский, Ю.И. Бородин.
Именно этот российский физико-технический и клинический опыт наряду с опытом американских исследователей (к 1990 г. в России было пролечено 29%, в США – 58% больных от общемирового количества) обусловил возможность создания первого в 1990 г. в мире клинического центра ПЛТ в многопрофильном госпитале в г. Лома-Линда, США. Сегодня в мире работают более 100 подобных центров и их количество стремительно растет.
К 2013 г. в Центре прошли лечение 4368 больных, что составляет сегодня 4% мирового клинического опыта и 64% российского клинического опыта [6].
1.1.2. Медицинский протонный комплекс НИЦ “Курчатовский институт” – ПИЯФ
Физико-технический опыт. Медицинский протонный комплекс на базе Ленинградского института ядерной физики (НИЦ “Курчатовский институт” – ПИЯФ) в тесном сотрудничестве с ЦНИРРИ (сейчас РНЦРХТ им. акад. А.М. Гранова) был создан в период с 1967 по 1972 г. В январе 1973 г. введен в эксплуатацию 1000 МэВ синхроциклотрон Ленинградского института ядерной физики. Одновременно в Российском научном центре радиологии и хирургических технологий имени академика А.М. Гранова (ЦНИРРИ) было создано отделение протонной терапии (рис. 5).
Под общим руководством А.М. Гранова, Б.А. Кононова и А.А. Абросимова были проведены полномасштабные экспериментально-дозиметрические и радиобиологические клинические исследования в период с 1971 по 1974 г. С целью исследования биологической эффективности протонов 1000 МэВ проведена серия экспериментов с дрожжевыми клетками, асцитными опухолевыми клетками, мухами дрозофилами, клетками Hela, мышами и собаками. Облучение объектов проводилось не только на воздухе, но и внутри фантома.
Результаты экспериментов были доложены на заседании комиссии по аппаратам и техническому оснащению, применяемым в радиологии, и принято решение о возможности проведения клинических испытаний.
Клинический опыт. Как отмечалось, в ЦНИРРИ было создано отделение протонной терапии. В период с 1975 по 2013 г. проводились клинические испытания по протонной терапии, в том числе области аденомы гипофиза для купирования болевого синдрома. После облучения гипофиза головного мозга 65% больных перестали принимать обезболивающие препараты. У остальных пациентов необходимость в обезболивающей процедуре сохранялась, но эффект позволил им перейти на анальгетики периферического действия или снизить дозировку наркотических анальгетиков. Обезболивание после было длительным и продолжалось в течение всего периода стабилизации заболевания. Это значительно улучшило качество жизни больных.
Метод лечения высокоэнергетическим (1000 МэВ) пучком протонов “напролет” отличается от остальных, в которых в основном используют протоны с энергией 70–250 МэВ, выделяющих максимум своей энергии в мишени – пик Брэгга.
Зона облучения и подводимая доза выбирались с учетом структуры новообразования, ее объема и заключения нейрофизиолога. Облучение однократное, а максимальная поглощенная доза варьируется с учетом конкретной нозологии от 40 до 120 Гр.
Всего с 1975 по 2013 г. протонная терапия на синхроциклотроне НИЦ “Курчатовский институт” – ПИЯФ осуществлена 1391 пациенту (в 151 случае она осуществлялась повторно), из них с аденомой гипофиза 477 пациентов, 502 – с артериально-венозными аневризмами, у 268 пациентов облучение проводилось с целью купирования болевого синдрома.
Медицинский протонный комплекс НИЦ “Курчатовский институт” – ПИЯФ сегодня. В связи с вступлением в силу Постановления Правительства РФ от 27 декабря 2012 г. № 1416 “Об утверждении Правил государственной регистрации медицинских изделий” с 2013 г. оказание медицинской помощи приостановлено.
В 2017 г. начата модернизация комплекса с целью улучшения эксплуатационных характеристик (скорости перемещения, точности позиционирования) электромеханических узлов и элементов (стола пациента) комплекса и приведения аппаратного комплекса к современным стандартам лучевой терапии. Программа модернизации включила в себя три основных раздела: общая ревизия механического и электротехнического хозяйства, программное обеспечение и система визуализации.
С августа 2021 г. приступили непосредственно к регистрации медицинского изделия, включающей в себя:
– разработку перечня нормативной документации для Комплекса протонной стереотаксической терапии, файла менеджмента риска, отчета по файлу менеджменту риска, ТУ на “Комплекс протонной стереотаксической терапии”, руководства по эксплуатации, паспорта изделия;
– проведение технических испытаний и разработку программ испытаний.
– проведение токсикологических исследований, а также проведение испытаний на электро-магнитную совместимость.
В конце декабря 2022 г. получено разрешение на проведение клинических испытаний [8].
1.1.3. Медико-технический комплекс протонной терапии в Объединенном институте ядерных исследований
Физико-технический опыт. В Лаборатории ядерных проблем (ЛЯП) Объединенного института ядерных исследований (ОИЯИ) программа по развитию адронной терапии на пучках синхроциклотрона была начата еще в 1967 г. по инициативе академика Венедикта Петровича Джелепова. На первом этапе исследований на протонном пучке было облучено 84 пациента, после чего ускоритель был остановлен для модернизации. В это же время было начато строительство многокабинного медико-технического комплекса (МТК) для проведения адронной терапии онкологических больных.
Ускоритель ЛЯП, фазотрон, ускоряет протоны до фиксированной энергии 660 МэВ с выходным током ~1 мкА. Выведенный из ускорителя пучок протонов с помощью регулируемого из пультовой замедлителя подтормаживается до нужной энергии и транспортируется в одно из процедурных помещений. Комплекс включает в себя шесть процедурных кабин (рис. 6).
Кабина 1 является наиболее универсальной и позволяет проводить протонное облучение мишеней, расположенных в области головы–шеи и в других частях тела пациента. Кабина 2 предназначена для протонной терапии онкогинекологических пациентов. В кабине 3 можно облучать малые внутричерепные мишени протонным пучком 660 МэВ методом “напролет” (аналог кабины, работающей в ПИЯФ). В кабину 4 выведен пучок отрицательных π-мезонов с перестраиваемой энергией 30–80 МэВ. В кабине 5 можно проводить как протонную терапию, так и терапию высокоэнергетическим пучком нейтронов больших радиорезистентных опухолей. В кабине 6 установлен стандартный γ-аппарат РОКУС-М с источником 60Со, используемый как резервный источник излучения, а также для проведения комбинированного лечения, когда часть необходимой дозы набирается от γ-излучения, а далее проводится протонный буст.
Из-за ограниченного финансирования и времени работы на ускорителе было решено сконцентрировать основные усилия на развитии первой процедурной кабины как наиболее универсальной с точки зрения облучения широкого круга локализаций (рис. 7). Облучение пациентов здесь можно проводить в положении как сидя, так и лежа горизонтальным широким фиксированным протонным пучком с энергией от 150 до 230 МэВ. Эта кабина была модернизирована нами в соответствии с требованиями прецизионной протонной терапии.
Клинический опыт. После реконструкции ускорителя ЛЯП в сильноточный фазотрон сеансы по лечению онкологических больных были возобновлены. С 1987 по 1996 г. были пролечены 40 пациентов, в основном по поводу рака шейки матки. Затем в исследованиях наступил длительный перерыв, обусловленный рядом причин, основной из которых является общее ухудшение экономической ситуации в России. Новый виток развития настоящая работа получила в декабре 1999 г., когда усилиями В.П. Джелепова в Дубне было открыто специализированное радиологическое отделение на 20 коек. С 2000 г. в МТК проводятся регулярные сеансы по лечению больных с мишенями, расположенными в области головы, шеи и др. Так, с 2000 по ноябрь 2015 г. на протонном пучке курс лучевой терапии прошли около 1118 пациентов. Была реализована и применена техника трехмерного конформного облучения глубоко залегающих опухолей протонным пучком, когда максимум дозового распределения наилучшим образом совпадает с формой мишени. Тем самым достигается максимальное снижение лучевой нагрузки на нормальные ткани и органы, окружающие опухоль.
Медико-технический комплекс в ОИЯИ принимал пациентов до июня 2019 г. – пока у местной больницы не закончилась разрешительная документация на лучевую терапию [10].
1.2.1. Комплекс протонной лучевой терапии “Прометеус”
Комплекс протонной терапии “Прометеус” ФТЦ ФИАН (г. Протвино) представляет собой компактный синхротрон, способный ускорять протоны в диапазоне значения энергии от 30 до 300 МэВ. Он разработан под руководством члена корреспондента РАН В.Е. Балакина.
Комплексом протонной терапии “Прометеус” оснащен МРНЦ имени А.Ф. Цыба – филиал ФГБУ “НМИЦ радиологии” в г. Обнинск (рис. 8). В состав комплекса входят синхротрон и системы формирования терапевтического пучка, укладки и фиксации пациента, рентгеновской томографии для точного позиционирования пациента и 3D-планирования терапии.
В ноябре 2015 г. на комплексе протонной терапии “Прометеус” начато лечение пациентов с новообразованиями в области головы и шеи.
ФТЦ ФИАН совместно с МРНЦ накопили опыт использования комплекса в клинических условиях, а результаты показали эффективность и надежность установки при лечении рака головы и шеи. При наличии развитой инфраструктуры пропускная способность установки может составить более 700 человек в год. В марте 2017 г. комплекс протонной терапии “Прометеус” был лицензирован для облучения всего тела человека [11].
По данным международной организации PTCOG с 2018 по 2021 г. проведено лечение 632 пациентов [1].
1.2.2. Центр протонной лучевой терапии МИБС в Санкт-Петербурге
Аппаратный комплекс. Центр протонной терапии в Санкт-Петербурге работает с 2017 г. на базе онкологической клиники Медицинского института им. Березина Сергея. В центре установлена система ProBeam (Varian, США), основой которой является сверхпроводящий высокочастотный ускоритель (циклотрон), способный разгонять протоны до 2/3 скорости света включительно (рис. 9).
Из циклотрона ускоренный пучок протонов поступает по протонопроводу в специальное устройство – деградатор, где тормозится до требуемой энергии и затем транспортируется по тому же протонопроводу, оснащенному множеством различных электромагнитных элементов: поворотные магниты, линзы и т.д., которые фокусируют пучок положительно заряженных частиц и направляют в один из двух медицинских кабинетов с системой многопольного облучения гантри пациентов в положении лежа.
Клинический опыт. В центре ПЛТ в Санкт-Петербурге может проводиться облучение любых опухолей, чувствительных к действию лучевой терапии. Наилучшие результаты достигаются при лечении:
– рака простаты, легких, пищевода, печени;
– опухолей головы и шеи;
– опухолей головного мозга, в том числе расположенных в стволе, мозжечке и других нижних отделах;
– лимфом, в том числе устойчивых к действию химиотерапевтических препаратов.
По данным международной организации PTCOG с 2018 по 2021 г. проведено лечение 600 пациентов [1].
1.2.3. Центр протонной лучевой терапии ФВЦМР ФМБА в г. Димитровград
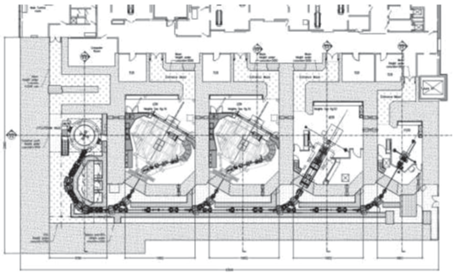
Аппаратный комплекс. В центре протонной терапии федерального высокотехнологичного центра медицинской радиологии г. Димитровграда установлен циклотрон С235-V3 (IBA, Бельгия), который генерирует пучок протонов с постоянной энергией 235 МэВ. Выведенный пучок протонов фокусируется парой электромагнитных квадрупольных линз в небольшой пучок на блоке дегрейдера. На пластинах дегрейдера происходит торможение пучка до значения выбранной энергии в диапазоне 70–235 МэВ. Регулировка энергии происходит менее чем за 1 с. Далее пучок проходит через систему магнитов, при взаимодействии с магнитным полем которых проводятся конфигурация поперечной формы и направление в канал транспортировки пучка. Первые две лечебные процедурные комнаты оснащены современным оборудованием, позволяющим использовать для лечения пациентов методику сканирования тонким пучком. Система доставки пучка оснащена изоцентричной гантри с возможностью вращения на 360°. Третья процедурная оборудована системой гантри с фиксированным положением нозла* под углами 90° и 30°. Система доставки пучка поддерживает методику облучения равномерного сканирования с применением индивидуальных апертур и компенсаторов, обеспечивающих конформное распределение дозы в мишени. Каждая из этих комнат оборудована роботом, управляющим положением стола с шестью степенями свободы, что позволяет обеспечить точность укладки пациента до 0.5 мм. Четвертая процедурная – с горизонтальным пучком, позволяющим проводить лечение небольших (до 4 см) поверхностно расположенных опухолей, в том числе офтальмологических. Позиционирование пациента осуществляется с помощью специально разработанного кресла, обеспечивающего фиксацию пациента в положении сидя. Общий вид центра протонной лучевой терапии показан на рис. 10.
Рис. 10.
Центр протонной терапии в федеральном высокотехнологичном центре медицинской радиологии г. Димитровграда [15].
Верификация точности положения пациента во всех лечебных комнатах проводится с использованием ортогональных рентгеновских изображений. Для облучения опухолей, локализованных в подвижных участках тела (грудная и брюшная полости), предусмотрено использование системы синхронизации с дыханием пациента SDX (DYN’R Medical systems) в полностью автоматизированном режиме. Система синхронизации с дыханием позволяет уменьшать дозы в критических структурах и проводить наиболее качественное облучение подвижных органов. Для облучения с применением методики равномерного сканирования предусмотрено изготовление индивидуальных (для каждого подводимого поля) болюсов (компенсаторов), обеспечивающих хорошее выделение дистальной границы мишени. Форма компенсаторов рассчитывается индивидуально для каждого поля облучения с помощью специализированного модуля планирующей системы. Компенсаторы изготавливаются из акрила или воска в специально оборудованной мастерской, расположенной в здании Протонного центра, в соответствии с данными, переданными от системы планирования на фрезерный станок по локальной сети [14].
2. ПУЧКИ УСКОРЕННЫХ ПРОТОНОВ: ИХ ДОСТОИНСТВА И ПРОБЛЕМЫ ИСПОЛЬЗОВАНИЯ В ДИСТАНЦИОННОЙ ЛУЧЕВОЙ ТЕРАПИИ
2.1. Физические основы адронной лучевой терапии
Впервые преимущества облучения злокачественных новообразований протонным пучком описал Р. Вильсон [15]. Эти преимущества следуют в основном из особенностей потерь энергии протонами в конце своего пробега в веществе, которая приводит к эффекту, когда протоны внезапно останавливаются (пик Брэгга).
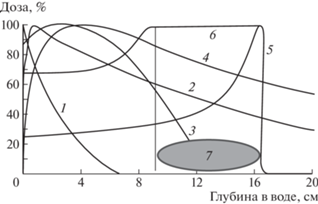
На рис. 11 приведены кривые прохождения через вещество (воду) различных видов излучений. Для наглядности на рисунке под номером 7 показана мишень (опухоль). Понятно, что при облучении мишени протонами за ее отдаленной (дистальной) границей выделения энергии нет, и здоровые ткани не облучаются в отличие от случаев облучения другими видами излучения, например при облучения фотонами, генерируемыми 60Со, или фотонами, рождающимися при торможении электронов в веществе. Также можно увидеть, что при транспортировке излучений от границы тела (значение 0 на графике) до передней границы мишени здоровые ткани получают при облучении фотонами по сравнению с протонным облучением дополнительную дозу. Таким образом, можно утверждать, что протонное (и облучение ионами углерода) излучение является более щадящим по сравнению с конвенциональными видами при облучении опухоли, расположенной на определенной глубине человеческого тела. Именно поэтому для уменьшения риска отдаленных последствий, связанных с так называемым индуцированным раком, АЛТ рекомендована детям, страдающим онкологическими заболеваниям.
Рис. 11.
Глубинные дозовые распределения различных типов излучения: 1 – рентгеновское излучение, Е – 140 кэВ; 2 – γ-излучение 60Со, Е = 1.17, Е = = 1.33 кэВ; 3 – пучок электронов, Е = 25 МэВ; 4 – тормозное фотонное излучение, Е = 25 МэВ; 5 – монохроматический протонный пучок, Е = 160 МэВ (кривая Брэгга); 6 – модифицированная кривая Брэгга, энергетический спектр пучка модифицирован для равномерного облучения мишени протяженностью по глубине от 9 до 16 см; 7 – облучаемая мишень.
2.2. Ускорительная техника для адронной лучевой терапии
Требования, предъявляемые к медицинским протонным ускорителям, существенно отличаются от требований к установкам для физических исследований (табл. 2). Для создания требуемых дозовых распределений необходим жесткий контроль интенсивности пучка, стабильности его энергии, поперечного размера и положения оси, равномерности распределения частиц в поперечном сечении пучка.
Таблица 2.
Основные параметры медицинских протонных циклотронов и синхротронов
| Параметры | Циклотрон | Синхротрон |
|---|---|---|
| Разброс по энергии, % | 0.2 | 0.1 |
| Стабильность энергии, % | 0.1 | 0.1 |
| Максимальная интенсивность пучка, нА ** | 300 | 15 |
| Коэффициент использования пучка, % | <50 | >50 |
| Эффективность вывода, % | 60–80 | 90 |
| Эмиттанс пучка, π мм мрад | 5–10 | 1–2 |
| Потребляемая энергия, кВт | 400 | 200 |
| Диаметр, м | 4 | 5.5–8 |
| Вес, т | 200 | 15–20 |
Протонная терапия требует, чтобы энергия частиц варьировалась от 70 до 250 МэВ и изменялась с шагом 0.4 МэВ, а точность и стабильность энергии пучка должны быть не хуже 0.1%. Интенсивность пучка протонов, подводимого к пациенту, должна быть не менее 3 × 109 с–1, чтобы время облучения даже крупной мишени не превышало нескольких минут. При этом необходимо учитывать, что при любом методе формирования дозового распределения потери частиц в системе формирования могут достигать 90%. Для создания оптимальных условий формирования дозового распределения необходимо также обеспечить динамический диапазон регулирования интенсивности пучка не менее 1000.
В настоящее время в качестве генераторов протонных и ионных пучков применяются два основных типа ускорителей, разработанных специально для работы в условиях клинических центров адронной терапии: циклотроны (их модификация – фазотроны) и синхрофазотроны (другое название синхротроны). Возможно также (пока существуют лишь проекты) использование линейных ускорителей. Основные параметры медицинских протонных циклотронов и синхротронов приведены в табл. 2 [16].
Рассмотрим подробнее принципы работы медицинских протонных ускорителей и начнем с циклических, которые работают на одном и том же принципе: заряженные частицы, двигаясь по спиральным или кольцевым орбитам в поперечном магнитном поле, постепенно ускоряются до максимальной энергии, многократно проходя ускоряющий зазор.
Циклотрон и его модификация – фазотрон. В циклотроне магнитное поле постоянно, как постоянна и частота ускоряющего протоны высокочастотного напряжения. Ускоряемые протоны двигаются по раскручивающейся спирали в зазоре довольно большого магнита (вес до 200 т, энергопотребление магнита и высокочастотной ускоряющей системы ~550 кВт) пока не приблизятся к его краям и не выйдут наружу. Ускорение протонов осуществляется при многократном прохождении частицами зазора между дуантами, на которые подается высокочастотное ускоряющее напряжение (рис. 12).
Рис. 12.
Схема циклотрона: а – разрез магнита и дуантов, б – движение протонов внутри дуантов (показан ускоряющий зазор).
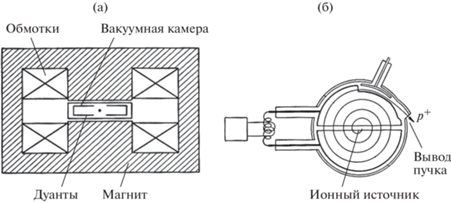
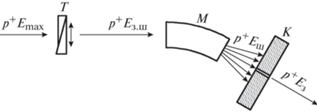
В циклотроне ограничением максимальной энергии протонов является релятивистское нарастание их массы из-за приближения скорости протона к скорости света. Это приводит к нарушению синхронизма между частотой обращения протонов (моментом прохождения протоном ускоряющего зазора между дуантами) и частотой приложенного к этому зазору ускоряющего переменного напряжения. Изменение частоты обращения протонов при сильных магнитных полях происходит также из-за того, что магнитное поле на краю магнита ослабляется (“вываливается”). Чтобы исключить эти ограничения, приходится вводить синхронное с изменением частоты обращения протонов изменение частоты ускоряющего напряжения, что и осуществляется в модификации этого типа ускорителя – фазотроне или синхроциклотроне. И циклотрон, и фазотрон ускоряют протоны до конечной энергии, определяемой конструкцией этих ускорителей. Протоны, таким образом, всегда выводятся из ускорителя при этой максимальной энергии, в то время как для целей ПЛТ требуется регулировать энергию протонов в диапазоне 70–250 МэВ в зависимости от глубины залегания облучаемой мишени. Поэтому за простоту конструкции циклотрона приходится расплачиваться не только большим весом и большим расходом электроэнергии (табл. 2), необходимым для работы его магнита и высокочастотной системы, но и установкой дополнительного устройства – деградатора энергии. Это устройство за счет введения на пути пучка графитового тормозителя изменяемой толщины частично поглощает энергию пучка и приводит ее к нужному для данного клинического случая значению. Но частицы в тормозителе теряют энергию стохастичиски (по-разному) и значительное (на толстом графитовом тормозителе) снижение энергии исходного монохроматического пучка сопровождается заметным расширением его энергетического спектра. Кривая Брэгга “размывается” (рис. 13), в итоге сформировать присущие протонам высокоградиентные дозовые распределения становится невозможным. Чтобы выделить пучок требуемой энергии из широкого энергетического спектра пучка в деградаторе (рис. 14), после деградатора приходится устанавливать дополнительный магнит – анализатор и коллиматор.
Рис. 13.
Распределение дозы по глубине от двух пучков протонов с разными энергетическими спектрами: 1 – распределение монохроматического пучка протонов энергией 185 МэВ, 2 – распределение пучка протонов заторможенного от энергии 680 до 185 МэВ.
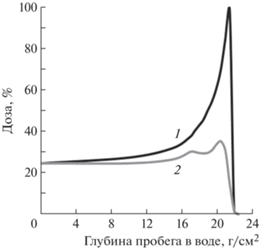
При такой селекции частиц одной энергии происходят большие потери протонов других энергий. На практике из протонного тока величиной 100 нА, выходящего после ускорения из циклотрона, до мишени при некоторых режимах доходит не более, а то и менее 5 нА протонного тока. Погибшие в деградаторе и стенках коллиматора протоны создают большой радиоактивный фон (гамма, нейтроны).
Это приводит к необходимости иметь после деградатора усиленную биологическую защиту толщиной до 5 м. Кроме того, все элементы деградатора сильно активируются, что осложняет любые ремонтные и профилактические работы с этими системами. Таким образом, недостатками циклотрона являются большая потребляемая мощность (до 550 кВт), неэффективное использование генерируемых протонов (более 95% потерь в некоторых режимах) и, что особенно неприятно, значительный радиационный фон.
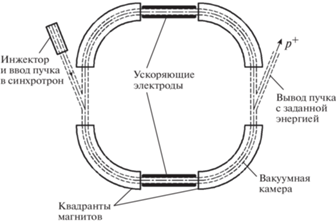
Синхротрон. В синхротроне протоны двигаются по одной и той же траектории (орбите) внутри сравнительно узкого магнитного канала, создаваемого несколькими секциями поворотного магнита (рис. 15).
Для движения протонов по одной и той же траектории одновременно с изменением частоты ускоряющего напряжения и постепенным набором частицами скорости (энергии) величина магнитного поля также поднимается. При использовании синхротрона деградатор энергии не требуется, поскольку энергия выведенных протонов может быть задана заранее и будет определяться только моментом снятия (вывода) пучка с орбиты.
Протонный синхротрон является несколько более сложной по сравнению с циклотроном машиной, но усложнения компенсируются рядом преимуществ:
– потери частиц в процессе ускорения в синхротроне малы;
– необходимая энергия протонов задается заранее и определяется моментом их вывода из ускорителя;
– отпадает необходимость в основном источнике радиационного фона – деградаторе, где при использовании циклотрона теряется, как отмечалось, до 95% ускоренных частиц, все это в совокупности и определяет очень низкий по сравнению с циклотроном радиационный фон;
– энергопотребление синхротрона не превышает 200 кВт (в 2–2.5 раза ниже, чем у циклотрона), поскольку “замагничивается” очень узкая магнитная дорожка.
Все преимущества синхротрона как базового ускорителя для протонной и ионной терапии предельно очевидны. Для первого в мире центра ПЛТ в г. Лома-Линда специалистами лаборатории имени Ферми был разработан именно синхротрон [18].
Габариты циклических ускорителей определяются достижимой на магнитах магнитной индукцией и, соответственно, радиусом поворота пучка при его максимальной энергии. На обычных “теплых” магнитах (сверхпроводящие при температуре гелия магниты описаны ниже) значение магнитной индукции составляет 1.5–1.8 Тл11, что обеспечивает радиус поворота пучка протонов с энергией 250 МэВ около 1.5 м. Таким образом, диаметр орбиты пучка с энергией 250 МэВ в циклотроне и синхротроне составляет ~3 м. Но и в том, и в другом случае габариты самого ускорителя примерно в 1.5–2 раза больше. У циклотрона увеличение габаритов происходит за счет размеров обмотки и магнитопровода (слева и справа от полюсов магнита на рис. 12), у синхротрона – за счет технологических прямолинейных промежутков между секциями магнита, необходимых для ввода пучка от инжектора, вывода пучка и для размещения высокочастотной ускоряющей системы (рис. 15).
Снизить габариты ускорителей удается путем использования для поворота пучка вместо “теплых” железных магнитов сверхпроводящих магнитных систем22.
Сверхпроводящая магнитная система представляет собой соленоид требуемой геометрии, обмотка которого собрана из охлаждаемых гелием (или другим хладагентом) проводников33 довольно большого сечения, пропускающих большие токи. На сверхпроводящих “безжелезных” магнитных системах легко достижима магнитная индукция 5–8 Тл, что, соответственно, уменьшает радиус поворота пучка и габариты ускорителей в 2.5–3 раза. Уменьшение габаритов ускорителя становится особенно важным при конструировании малогабаритных комплексов ПЛТ “один ускоритель–одна лучевая установка”. Второе достоинство ускорителей на сверхпроводящих магнитах – заметная экономия электроэнергии. Источник питания потребляет электроэнергию лишь в момент подъема тока (магнитной индукции) в системе. Поскольку активное сопротивление соленоидов при низкой температуре практически равно нулю, поддержание нужного тока не требует после его подъема расхода электроэнергии. В то же время использование систем охлаждения проводников до сверхнизких температур, несомненно, усложняет ускоритель.
2.3. Формирование дозового распределения в адронной лучевой терапии
В настоящее время существуют два метода формирования дозового распределения при использовании ускоренных протонных пучков в лучевой терапии:
– пассивный метод, искусственное рассеяние пучка;
– активный метод, сканирование узкого пучка протонов по объему мишени.
2.3.1. Пассивный метод формирования дозового распределения
Пример типичного дозового распределения и системы формирования конформного мишени дозового распределения пассивным методом, применяемым для облучения внутриглазных злокачественных новообразований с одного направления, представлен на рис. 16 [19].
Рис. 16.
Схема формирования дозового распределения при облучении опухоли глаза пассивным методом [19]: 1 – рассеиватель пучка, 2 – коллиматор, 3 – энергетический модулятор пучка, 4 – болюс, 5 – глаз, 6 – опухоль.
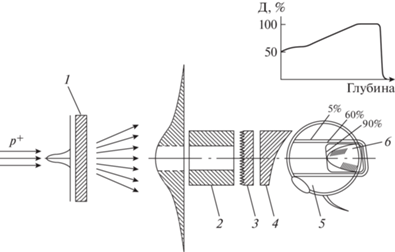
Как видно из рис. 16, вся опухоль размещена внутри 90%-ной изодозы, а высокий градиент дозы на боковых и задней границах опухоли позволяет обеспечить хорошую сохранность окружающих здоровых тканей.
Система формирования конформного мишени дозового распределения пассивным методом включает в себя четыре элемента: рассеиватель пучка, коллиматор, энергетический модулятор пучка и болюс44. Рассеиватель размещается в 1–3 м от коллиматора и используется для расширения сравнительно узкого пучка протонов, приходящего после транспортировки от ускорителя. Толщина рассеивателя подбирается таким образом, чтобы плотность частиц в сечении пучка на входе в коллиматор была относительно равномерной (±5–7%) в пределах апертуры коллиматора.
На рис. 16 условно показано распределение частиц в двух сечениях пучка: перед рассеивателем и перед коллиматором.
Коллиматор изготавливается индивидуально, и его апертура соответствует сечению мишени при взгляде по пучку.
Форма периодических элементов энергетического модулятора пучка (гребенчатого фильтра) выбрана и изготовлена таким образом, чтобы трансформированный энергетический спектр пучка (часть частиц, проходящих через “зубцы” фильтра, замедляются сильнее, нежели частицы, проходящие через “впадины” фильтра) обеспечил требуемую модификацию кривой Брэгга (рис. 16). Болюс индивидуально подобранной формы компенсирует кривизну дистальной поверхности опухоли (мишени) таким образом, чтобы остановить все частицы на задней границе мишени.
Пассивный метод формирования дозового распределения имеет ряд недостатков, в результате чего потенциальные возможности протонного излучения по формированию дозовых распределений, конформных мишени, использованы не полностью или вообще не используются. Так, при пассивном методе формирования дозового распределения с остановкой пучка вся опухоль размещена внутри 90% изодозы, и она хорошо совпадает с задней границей мишени. При этом здоровые ткани, расположенные по краям мишени, также вовлечены в высокую изодозу и облучаются абсолютно неоправданно (рис. 16). Причина заключается в том, что расширенный пик Брэгга, точно покрывающий протяженный центр мишени, излишне длинен для конформного облучения менее протяженных боковых частей мишени. Кроме того, пассивный метод формирования дозового распределения ведет к значительным потерям частиц – все частицы, оказавшиеся вне апертуры коллиматора (заштрихованные участки гауссовского распределения плотности частиц), выбывают из рабочего пучка и должны быть перехвачены специальной защитой (на рис. 16 не показана).
Задачу конформного облучения с помощью пассивных средств формирования дозового распределения (коллиматор, энергетический модификатор пучка, болюс) полностью решить не удается. Но несмотря на все недостатки пассивного формирования дозового распределения, эта методика является широко используемой. Этот метод является относительно стабильным по отношению к подвижности органов и сама система формирования является простой.
Для решения задачи более конформного облучения разработан так называемый активный метод формирования дозового распределения (современное название PBS, pensile beam scanning) путем трехмерного сканирования узкого пучка протонов по объему мишени, физический принцип метода представлен на рис. 17 [19].
Рис. 17.
Одна из возможных схем трехмерного сканирования узкого (характерный диаметр 1–2 см) пучка протонов по объему мишени: 1 – дефлектор (“выключатель пучка”), 2 – магнит, сканирующий пучок по оси Y, 3 – магнит, сканирующий пучок по оси Х, 4 – могильник отклоненного пучка, 5 – мишень, условно разбитая на микрообъемы.
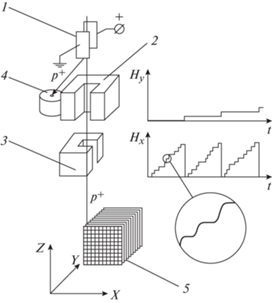
2.3.2. Активный метод формирования дозового распределения
Активный метод формирования дозового распределения заключается в совмещении узкого пика Брэгга (несколько миллиметров) моноэнергетического пучка протонов с каждым из микрообъемов мишени (рис. 17, 5), а после набора заданной дозы смещении пучка (и пика) в следующий микрообъем.
При формировании дозового распределения узким пучком его смещение осуществляется быстрыми сканирующими магнитами (рис. 17, 2, 3), иногда вместе с ортогональным перемещением стола (например, в Paul Scherrer Institut [20]).
Смещение пучка по глубине микрообъемов мишени происходит за счет изменения его энергии. Одним из вариантов реализации смещения пучка по глубине может быть введение дополнительных поглощающих пластин на ось пучка, непосредственно перед пациентом, как это реализовано на лучевой установке в Paul Scherrer Institut (PSI) [20, 23], где в качестве ускорителя используется циклотрон с фиксированной энергией протонного пучка. При использовании в качестве ускорителя синхротрона задача смещения пучка по глубине может быть решена путем выбора соответствующей энергии каждого импульса пучка [21]. Во всех системах 3D-сканирования (т.е. где магнитное сканирование используется в обоих поперечных направлениях и по глубине) время изменения энергии является доминирующим фактором, который определяет общее время сканирования всего объема.
Метод сканирования в настоящее время применяется в PSI, HIT в Гейдельберге (с ионами углерода), RPTC в Мюнхене, MD Anderson Cancer Center в Хьюстоне и Francis Burr Proton Therapy Center в Бостоне. Этот метод проходит клинические испытания еще в нескольких центрах. Ограничение применения этого метода обусловлено его чувствительностью к подвижности органов и мишени. Из-за отсутствия взаимосвязи между отпуском предписанной дозы и подвижностью органов высока вероятность недооблучения отдельных микрообъемов мишени [22], что чревато продолжением роста опухоли или рецидивом. В связи с этим метод PBS применяется главным образом для облучения неподвижных мишеней, а проблема отслеживания положения мишени и отдельных ее микрообъемов активно исследуется во многих клинических центрах.
3. РАЗВИТИЕ ПРОТОННОЙ ЛУЧЕВОЙ ТЕРАПИИ В НИЦ “КУРЧАТОВСКИЙ ИНСТИТУТ”
Понимая необходимость развития ПЛТ в стране, Правительство РФ Постановлением от 16 марта 2020 г. № 287 поручило НИЦ “Курчатовский институт” создать в рамках будущего Научно-образовательного медицинского центра ядерной медицины (НОМЦ ЯМ) комплекс ПЛТ, онкоофтальмологический комплекс ПЛТ, а также комплекс ионной лучевой терапии и типовое оборудование для тиражирования подобных комплексов [24, 25].
Создание НОМЦ ЯМ на базе НИЦ “Курчатовский институт” должно обеспечить развитие современных центров АЛТ в других субъектах Российской Федерации при научной и организационно-методической поддержке НИЦ “Курчатовский институт”.
3.1. Комплекс протонной лучевой терапии
Создание комплекса протонной лучевой терапии (“Луч-Протон”), размещаемого на территории НИЦ “Курчатовский институт”, предназначено для многолетних разработок оборудования и технологий ПЛТ новых поколений и подготовки кадров (медицинских физиков и клиницистов).
Основные параметры комплекса протонной лучевой терапии (Комплекс ПЛТ) НИЦ “Курчатовский институт” приведены в табл. 3.
Таблица 3.
Основные характеристики комплекса “Луч-Протон”
| Параметр установки | Значение | |
|---|---|---|
| 1 | Ускорительный комплекс | |
| 1.1 | Ускоритель | Протонный синхротрон |
| 1.2 | Энергия ускоренных протонов | 70–250 МэВ |
| 1.3 | Интенсивность | 5 × 1010 протонов в секунду |
| 2 | Лучевая установка Гантри | |
| 2.1 | Энергия протонов | 70–250 МэВ |
| 2.2 | Поворот протонного пучка | ±185° |
| 2.3 | Система формирования дозового распределения | активно/пассивная |
| 2.4 | Максимальный размер дозового распределения | 25 × 25см2 |
| 2.5 | Система позиционирования | 2D- и 3D-система рентгеновского позиционирования |
| 2.6 | Позиционер | 6D-стол позиционер |
| 2.7 | Локализации | – голова, шея; – новообразования абдоминальной области |
| 3 | Лучевая установка с фиксированным направлением протонного пучка | |
| 3.1 | Энергия протонов | 70–250 МэВ |
| 3.2 | Система формирования дозового распределения | пассивная |
| 3.3 | Максимальный размер дозового распределения | 25 × 25 см2 |
| 3.4 | Система позиционирования | 2D-система рентгеновского позиционирования |
| 3.5 | Позиционер | кресло позиционер |
| 3.6 | Локализации | – голова, шея; – внутриглазные новообразования; – новообразования орбиты глаза |
Концепцией создания комплекса “Луч-Протон” предусмотрены разработка и оснащение его тремя основными элементами оборудования – ускоритель с каналами транспортировки протонных пучков в два медицинских кабинета с лучевой установкой гантри для многопольного облучения пациента в положении лежа и лучевая установка с фиксированным в горизонтальной плоскости направлением протонного пучка для облучения пациента как в положении сидя, так и лежа с помощью универсального роботизированного позиционера.
В качестве ускорителя для Комплекса ПЛТ НИЦ “Курчатовский институт” будет разработан протонный синхротрон, позволяющий осуществлять выбор энергии выводимых из него пучков протонов в диапазоне от 70 до 250 МэВ и изменять ее от одного цикла ускорения к другому. Таким образом, вывод протонов не при максимальной, как в циклотроне, а при требуемой для конкретного пациента энергии и высокая эффективность вывода делают протонный синхротрон более удобной машиной в эксплуатации и более безопасной в радиационном смысле.
Отметим, что гибкая конфигурация Комплекса “Луч-Протон” (рис. 18) предлагает комплексное и настраиваемое решение для ПЛТ, позволяет оснащать как однокабинные, так и многокабинные центры в соответствии с клиническими и исследовательскими задачами. Возможные варианты процедурных кабинетов включают в себя гантри полного (на 360°) поворота протонного пучка, кабинет с фиксированным направлением протонного пучка для проведения терапии пациентов с новообразованиями глаза, головы и шеи в положении сидя и лежа, исследовательские кабинеты для неклинического применения пучка протонов.
Рис. 18.
Двухкабинная конфигурация расположения технологического оборудования Комплекса “Луч-Протон”.

Оборудование и технологии ПЛТ в последние три десятилетия во всем мире совершенствуются, предлагаются и отрабатываются новые, зачастую принципиальные решения, которые затем внедряются в рутинную практику лечения. В соответствии с этой общемировой тенденцией назначение Комплекса ПЛТ НИЦ “Курчатовский институт” не ограничивается созданием опытного образца типового клинического центра ПЛТ, планируется долговременное многолетнее использование Комплекса ПЛТ НИЦ “Курчатовский институт” для развития проблемы – разработки и испытаний новых аппаратных средств и технологий ПЛТ, а также подготовки кадров.
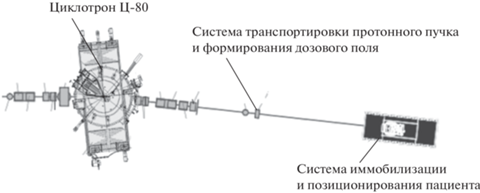
3.2. Онкоофтальмологический комплекс протонной лучевой терапии на базе циклотрона Ц-80
Создание онкоофтальмологического комплекса на базе действующего циклотрона Ц-80, размещаемого на территории НИЦ “Курчатовский институт” – ПИЯФ (“ОКО”), предназначено для обеспечения высокотехнологичными средствами лечения пациентов со сложными онкоофтальмологическими заболеваниями Северо-Западного региона России и частично из других регионов страны. Основные параметры онкоофтальмологического комплекса на базе действующего циклотрона Ц-80 приведены в табл. 4.
Таблица 4.
Основные характеристики комплекса “ОКО”
| Параметр установки | Значение |
|---|---|
| Энергия протонов | 70 МэВ |
| Интенсивность | 1.0–1.5 мкА |
| Диаметр | 60 мм |
| Расходимость | не более 3 мрад |
| Неравномерность плотности тока по сечению | не более ±3% |
| Высота оси пучка относительно пола процедурного кабинета | 1500 мм |
| Система формирования дозового распределения | пассивная |
| Система позиционирования | 2D-система рентгеновского позиционирования |
| Позиционер | кресло позиционер |
| Локализации | – внутриглазные новообразования; – новообразования орбиты глаза |
Создаваемый онкоофтальмологический комплекс будет иметь в своем составе новое оборудование и системы:
− инновационное кресло-позиционер с системой управления;
− устройство транспортировки терапевтического протонного пучка от ускорителя к лучевой установке (ЛУ);
− устройства формирования дозового поля;
− система мониторинга пучка и поглощенной дозы;
− система позиционирования пациента;
− программно-аппаратный комплекс (ПАК), интегрированный в автоматизированную систему управления технологическим процессом и лучевой установкой (АСУ ТП и АСУ ЛУ);
− помещение для подготовки пациентов к процедуре.
Предполагаемый план расположения основных узлов технологического оборудования схематически представлен на рис. 19.
В результате реализации проекта Северо-Западный регион России будет обеспечен высокотехнологичными медицинскими средствами лечения сложных онкоофтальмологических заболеваний: внутриглазных новообразований, новообразований орбиты и придаточного аппарата глаза.
3.3. Система дозно-анатомического планирования
Способы формирования дозового поля, рассмотренные в разд. 2.3.1, 2.3.2, позволяют проводить конформное облучение при лечении методом ПЛТ пациентов с новообразованиями различной локализации. Для этого требуется провести формирование равномерного дозового поля, которое конформно совмещается с мишенью для заданной изодозы, что связанно с модификацией исходного пучка протонов и правильным позиционированием пациента. В большинстве случаев последнее можно провести разными способами: кроме конформного совмещения для конформного облучения существенным фактором является минимизация дозы, получаемой здоровыми тканями. По результату процедуры планирования утверждается оптимальный план конформного облучения, который включает в себя данные, достаточные для формирования дозового поля в теле пациента, в том числе позиционирование пациента. Развитие информационных технологий позволило автоматизировать многие аспекты процедуры планирования.
При разработке типового комплекса ПЛТ (проект “Луч-Протон”) для НОМЦ ЯМ, создаваемого в рамках федеральной научно-технической программы, задачу планирования облучения выполняет программно-аппаратный комплекс (ПАК) НОМЦ ЯМ.
В состав ПАКНОМЦ ЯМ входят функциональные блоки:
− Медицинская информационная система (МИС) – обеспечивает первичную регистрацию пациента, ведение карты пациента в процессе лучевого лечения, учитывает и предоставляет данные, необходимые для функционирования лечебного процесса;
− Радиологическая информационная система (РИС) – обеспечивает оперативное поступление полной и достоверной топометрической информации и дозно-анатомического плана персоналу для обработки и принятия оптимальных решений;
− Система хранения и обработки дозиметрических данных (СХОДД) – обеспечивает оперативное поступление полной и достоверной дозиметрической информации персоналу для обработки и принятия оптимальных решений;
− Система дозно-анатомического планирования (СДАП) – обеспечивает расчет плана облучения (лечения) методом протонной терапии пациентов с новообразованиями различной локализации, в том числе с внутриглазными новообразованиями. План облучения должен обеспечить данные, достаточные для проведения конформного облучения: формирования (пассивным или активным методом) индивидуального дозового распределения (включая данные для изготовления индивидуальных средств формирования дозового распределения) и оптимального конформного совмещения сформированного дозового распределения с мишенью-опухолью, дающего минимальную дозовую нагрузку на критические структуры, высокий уровень гарантии качества облучения.
РИС и СХОДД обеспечивают СДАП входными данными – топометрическими данными пациента и дозиметрическими данными лучевой установки. В РИС также сохраняются выходные данные СДАП – план облучения пациента.
В общем случае локализаций планирование облучения проводится по томографическим топометрическим данным (модальности КТ, МРТ, ПЭТ), для отдельных локализаций (например, онкоофтальмология) томографические данные получаются параметрическим моделированием и используются cg-томограммы (cg – computer-generated, рассчитанные на компьютере). На томограммах определяются (оконтуриваются) области интереса (ROI – region of interest), т.е. мишени и критических структур, для которых будут анализироваться дозовые нагрузки. После задания взаимного положения пациента и пучка проводятся расчет дозовых распределений и анализ по заданным критериям эффективности плана облучения. Варьированием параметров облучения оптимизируют план облучения по критериям эффективности.
Использование собственной российской системы дозно-анатомического планирования должно позволить как реализовать существующие наработки, полученные за время работы экспериментальных центров ПЛТ в России, и разработать новые протоколы лечения по клиническим рекомендациям, так и оставить задел для дальнейшего повышения качества проведения ПЛТ.
ЗАКЛЮЧЕНИЕ
В работе показано, что в России существуют необходимые условия для того, чтобы обеспечить здравоохранение современным высокотехнологичным оборудованием для АЛТ. В НИЦ “Курчатовский институт” в содружестве с ведущими онкологическими учреждениями страны накоплен опыт облучения протонами более 7000 пациентов. В 2012 г. завершен и прошел государственную экспертизу проект Центра протонной лучевой терапии на базе ГКБ им. С.П. Боткина, полностью выполненный усилиями российских предприятий под научным руководством НИЦ “Курчатовский институт”. Проведенные в НИЦ “Курчатовский институт” эскизные проработки онкоофтальмологического комплекса ПЛТ позволили в кратчайшие сроки разработать проект и получить положительное заключение государственной экспертизы, что открывает возможности уже в 2023 г. осуществить физический пуск оборудования, обеспечивающего с высочайшей эффективностью лечение такого сложного заболевания, как меланома глаза. В 2023 г. будет разработан и передан в экспертизу проект комплекса ПЛТ, создаваемого на территории НИЦ “Курчатовский институт”. Отработка оборудования комплекса и сопутствующих необходимых технологий позволит создать условия для обеспечения под научным и организационным руководством НИЦ “Курчатовский институт” тиражирования оборудования и внедрения в ближайшие годы созданного оборудования в медицинские учреждения страны. Таким образом, в области ПЛТ будет ликвидировано технологическое отставание в этом важном для здравоохранения и эффективном виде медицинской помощи.
Список литературы
WWW.PTCOG (Particles Therapy Co-Operative Group), Online 2022.
Ferlay J., Ervik M., Lam F. et al. // Global Cancer Observatory: Cancer Today. Lyon: International Agency for Research on Cancer. 2020. https://gco.iarc.fr/today/online-analysis-table
Ugo Amaldi // Hadrontherapy and its Accelerators. II Technische Universitat Munchen and TERA Foundation. EPFL. 29.11.12.
https://www.medraysintell.com/
https://cgbmyski.ru/rating/rejting-regionov-po-onkologiceskim-zabolevaniam-2021.html
Хорошков В.С., Жидков Д.А., Кленов Г.И. и др. // Медицинская физика. 2021. № 1 (89). С. 81.
http://gpc.pnpi.nrcki.ru/index.php/ustanovki/sinkhrotsiklotron.html
Брожик Д.С., Жидкова О.М., Иванов Е.М. и др. // Ядерная физика и инжиниринг. 2021. Т. 12. № 1. С. 64.
https://thepresentation.ru/uncategorized/162928-tsentr-radiatsionnoy-meditsiny-v-dubnegv-mitsin-em-syresin
Мицын Г.В. // Медицинская физика. 2016. № 2. С. 39.
Пряничников А.А., Сокунов В.В., Шемяков А.Е. // Письма в журнал “Физика элементарных частиц и атомного ядра”. 2018. Т. 15. № 17 (219). С. 993.
https://www.varian.com/products/proton-therapy/treatment-delivery/probeam
Климанов В.А., Галяутдинова Ж.Ж., Забелин М.В. // Онкологический журнал: лучевая диагностика, лучевая терапия. 2018. Т. 1. № 4. С. 14. https://doi.org/10.37174/2587-7593-2018-1-4-14-33
Шулепова Л.И., Маслюкова Е.А., Бондаренко А.В. и др. // Медицинская физика. 2019. № 3. С. 43.
Wilson R.R. //Radiolodgy. 1948. V. 41. P. 481.
Костромин С.А., Сыресин Е.М. // Письма в журнал “Физика элементарных частиц и атомного ядра”. 2013. Т. 10. № 7 (184). С. 1346.
Abazov V.I., Astrakhan B.V., Blokhin N.N. et al. // Use of proton beam in USSR for medical and biological proposes. OИЯИ Y-5854, 1971.
Slater J.M., Archambeau J.O., Miller D.W. et al. // Int. J. Radiat. Oncol. Biol. Phys. 1992. V. 22. P. 383.
Хорошков В.С. // Введение в технику протонной лучевой терапии: учебное пособие. М: УНЦ ДО, 2001.
Pedroni E., Bacher E., Blattmann H. et al. // Med. Phys. 1995. V. 22. P. 37.
Schippers J.M., Dölling R., Duppich J. et al. // Nucl. Instrum. Methods. B. 2007. V. 261. P. 773.
Phillips M.H., Pedroni E., Blattmann H. et al. // Phys. Med. Biol. 1992. V. 37. P. 223.
Haberer T., Becher W., Schardt D., Kraft G. // Nucl. Instrum. Methods. A. 1993. V. 330. P. 296.
http://publication.pravo.gov.ru/Document/View/0001202003260022?index=0&rangeSize=1
Иванов Е.М., Клёнов Г.И., Максимов В.И. и др. // Медицинская радиология и радиационная безопасность. 2022. Т. 67. № 3. С. 41.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии