Российские нанотехнологии, 2023, T. 18, № 4, стр. 568-576
Фармацевтическая разработка инновационных отечественных радиофармпрепаратов на основе биспецифических наноантител к GITR и CTLA-4 для тераностики онкологических заболеваний
Д. Н. Майстренко 1, А. А. Станжевский 1, *, К. А. Сергунова 2, С. В. Шатик 1, Д. О. Антуганов 1, Р. И. Аль-Шехадат 3, Д. С. Сысоев 1, М. С. Надпорожский 1, А. Л. Коневега 4, А. П. Трашков 4, О. Е. Молчанов 1, Л. А. Чипига 1, 5, А. В. Водоватов 5
1 Российский научный центр радиологии и хирургических технологий им. А.М. Гранова Минздрава России
Санкт-Петербург, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 ООО “Иннова плюс”
Санкт-Петербург, Россия
4 Петербургский институт ядерной физики им. Б.П. Константинова – НИЦ “Курчатовский институт”
Санкт-Петербург, Россия
5 Санкт-Петербургский научно-исследовательский институт радиационной гигиены им. П.В. Рамзаева
Санкт-Петербург, Россия
* E-mail: stanzhevsky@gmail.com
Поступила в редакцию 15.03.2023
После доработки 15.03.2023
Принята к публикации 13.06.2023
Аннотация
Описана фармацевтическая разработка инновационных радиофармацевтических лекарственных препаратов (РФЛП) на основе биспецифических высокоаффинных гипервариабельных фрагментов однодоменных моноклональных антител (наноантител) к поверхностным рецепторам Т-регуляторных клеток (GITR и CTLA-4: 68Ga-DFO-anti-CTLA4-GITR и 177Lu-DOTA-anti-CTLA4-GITR. Указанные РФЛП предназначены для диагностики методом иммуно-ПЭТ (68Ga-DFO-anti-CTLA4-GITR) и системной лучевой терапии (177Lu-DOTA-anti-CTLA4-GITR) генерализованных форм социально значимых онкологических заболеваний. В рамках фармацевтической разработки созданы технологии введения хелатирующих групп в молекулу биспецифического наноантитела, а также методики получения основного действующего вещества и готовой лекарственной формы РФЛП с выбором оптимального состава вспомогательных веществ для обеспечения стабильности радионуклидного комплекса и молекулы предшественника.
ВВЕДЕНИЕ
Выявление и дифференциальная диагностика опухолей, а также точная оценка их распространенности и эффективности лечения являются одной из наиболее актуальных проблем современной онкологии и лучевой визуализации. Хорошо известно, что эффективность лечения различных заболеваний онкологического профиля в значительной степени зависит от своевременной и точной их диагностики. Так, В США пятилетняя выживаемость при онкологических заболеваниях составляет 64%. При этом у 70% фактически излеченных больных злокачественные опухоли были выявлены на самых ранних стадиях заболевания [1]. В России подавляющее большинство больных онкологического профиля поступают в лечебные учреждения с запущенными формами патологического процесса (III–IV стадии) [2].
Решение проблемы ранней диагностики онкологических заболеваний в последние годы в значительной степени связывают с развитием технологий ядерной медицины, прежде всего позитронной эмиссионной томографии (ПЭТ), позволяющей количественно оценивать состояние перфузии, метаболизма и рецепторного статуса различных органов и тканей, а также определять и своевременно выявлять функционально-морфологические нарушения, лежащие в основе развития опухолевого процесса. Установлено, что широкое применение достижений ядерной медицины позволяет определять и предупреждать многие болезни, в том числе онкологические заболевания, за три–четыре года до развития их тяжелых и запущенных форм [3]. Специальные исследования, проведенные в США, Японии, развитых странах Европы и Австралии, показали, что широкое внедрение ПЭТ в клиническую практику помимо революционизирующего влияния на диагностический процесс имеет важную экономическую составляющую. В частности, отмечено, что в указанных странах вложение одного доллара США в развитие национальной ядерной медицины позволяет сэкономить от 1.5 до 2.5 долл. других расходов на систему здравоохранения в целом [4]. Это объясняется прежде всего тем, что благодаря повышению эффективности диагностики, выявлению онкологических заболеваний на более ранних стадиях их развития и своевременному назначению адекватного лечения удается существенно сократить расходы на лекарства, уменьшить продолжительность стационарного и амбулаторного лечения, улучшить прогноз, уменьшить инвалидизацию, снизить показатели нетрудоспособности и смертности населения [4, 5]. Перечисленные достоинства ПЭТ, подтвержденные обширным коллективным клиническим опытом, накопленным в ведущих ПЭТ-центрах мира, обусловили бурное развитие ПЭТ в последние годы. Достаточно сказать, что если в 2001 г. во всем мире функционировало 140 позитронных эмиссионных томографов, на которых было выполнено 255 тыс. исследований, то уже в 2004 г. количество ПЭТ-установок достигло почти 1500, а число исследований – 2.5 млн. Только в США за последние несколько лет количество центров ПЭТ возросло в 6 раз и составило 2000 [1, 3]. К 2030 г. прогнозируется их увеличение до шести тысяч. Доля радиофармацевтических лекарственных препаратов (РФЛП) для ПЭТ также растет и к настоящему времени только для РФЛП, меченных 18F, составляет 27.2% от общего числа РФЛП (второе место после 99mTc) [6]. Такие темпы развития ПЭТ в США обусловлены, в частности, тем, что более 500 медицинских страховых компаний страны включили этот вид услуг в свои программы медицинского страхования. Аналогичными темпами развивается ПЭТ в большинстве стран Европы и Азии. Очевидно, что ПЭТ во многом определяет научный и практический уровень развития клинической медицины [7].
Как известно, основными методами лечения пациентов со злокачественными опухолями в клинической практике по-прежнему остаются хирургическое воздействие и химиолучевое лечение. В последние несколько десятилетий был достигнут существенный прогресс в области изучения опухолей: исследованы механизмы трансформации клеток, сигнальные каскады, антигены, причины резистентности к терапевтическому воздействию, нестабильность генома и т.п. [8]. Накопленные фундаментальные знания позволили по-новому взглянуть на проблему диагностики и лечения онкологических заболеваний, что привело к созданию принципиально нового подхода – таргетной радионуклидной терапии [9]. В ее основе лежит принцип использования высокоаффинных молекул (моноклональные антитела, фрагменты антител, наноантитела пептиды и др.) в качестве переносчиков радиоактивных изотопов целенаправленно к опухолевой клетке [9, 10]. Сегодня стало очевидно, что радиоиммунотерапия злокачественных опухолей имеет целый ряд преимуществ перед другими видами системного лечения, к которым относят селективную доставку цитотоксической дозы радиации к опухолевой клетке, длительное дозируемое воздействие излучения на опухоль и прежде всего минимизацию негативного воздействия на интактные окружающие ткани [11]. Таргетная радионуклидная терапия является уникальной, многообещающей технологией персонифицированного лечения социально-значимых заболеваний, так как вещество-носитель и радионуклид могут быть индивидуально подобраны для каждого конкретного пациента [12].
Менее 50 лет назад “первое поколение” терапевтических антител состояло из мышиных моноклональных антител (mAb), при этом более 30 mAb в настоящее время одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для клинического использования. Несмотря на клинический потенциал, их иммуногенность и большой размер (~150 кДа) стали серьезным препятствием для их эффективности [13].
Это побудило к появлению улучшенного “второго поколения” антител, подразумевающего использование лишь фрагментов антител, таких как антигенсвязывающий фрагмент (Fab ~ 50 кДа) и одноцепочечный вариабельный фрагмент (scFv ~ 30 кДа). Однако этот подход оставался ограниченным из-за короткого периода полувыведения из сыворотки и иммуногенности, вызванной агрегацией [14].
Случайное открытие антител, содержащих только тяжелые цепи (HcAbs) у верблюдовых, открыло новое направление исследований и появление антител “третьего поколения”. По сравнению с обычными моноклональными антителами данные антитела состоят всего из двух тяжелых цепей с одним вариабельным доменом (VHH ~ ~ 15 кДа) в качестве антигенсвязывающей области. Было установлено, что эти антитела сохраняют полный антигенсвязывающий потенциал при выделении, что сделало их наименьшим природным антигенсвязывающим фрагментом [15]. В 1993 г. естественные тяжелые цепи антител были обнаружены случайно при анализе сыворотки дромадера на практическом курсе биохимии в Брюссельском университете. Вскоре было установлено, что все современные представители семейства верблюжьих, в частности дромадеры, верблюды, ламы и альпаки, помимо обычных антител в природе вырабатывают антитела, состоящие только из тяжелых цепей. Эти полностью функциональные антитела демонстрируют высокую специфичность, большое разнообразие и связывающую способность, аналогичные тем, которые получают с помощью обычных mAb, даже несмотря на то, что у них отсутствуют легкая цепь и домен CH1 тяжелой цепи. В тяжелой цепи антител верблюдовых есть один вариабельный домен, обозначенный VHH, который связан непосредственно с шарнирным и Fc-доменами тяжелой цепи IgG. Таким образом, тяжелая цепь антитела имеет размер, составляющий примерно половину (75 кДа) обычного mAb (150 кДа).
Вариабельная область антитела верблюда содержится в одном домене тяжелой цепи в отличие от обычных антител млекопитающих, которые содержат как тяжелую, так и легкую цепи. Наименьшая функциональная единица антитела ~15 кДа.
В отличие от других фрагментов антител эти маленькие антитела не требуют обширной сборки или молекулярной оптимизации для создания сложных конструкций. Благодаря тому что они обладают такой высокомодульной природой, появился широкий спектр гибридных молекул с этими антителами. Хотя отсутствие домена VL может негативно влиять на связывание антигена, наноантитела эволюционировали в направлении компенсации этого и развили функции, которые также повышают стабильность, разнообразие и связывающую способность. Как правило, специфичность антигена определяется на открытых концах каждого вариабельного домена с помощью трех пептидных петель или областей, определяющих комплементарность (CDR). Петля CDR3 обеспечивает наиболее значительный вклад в специфичность и разнообразие антител, в среднем наноантитела имеют гораздо большую длину фрагмента CDR3 по сравнению с доменами VH человека, что усиливает их взаимодействие с антигенами-мишенями [15].
Более того, их участки CDR3 могут образовывать пальцеобразные выступы, которые обеспечивают высокоаффинное связывание с традиционно недоступными полыми эпитопами [16]. Их участки CDR1 и CDR2 также способствуют связыванию антигена, что обеспечивает большее разнообразие паратопов, чем у обычных моноклональных антител [17].
Присущие VHH-антителам свойства делают их полезными для лечения рака. Их маленькие размеры позволяют глубоко проникать в опухоли, а некоторые такие антитела способны преодолевать гематоэнцефалический барьер [17, 18].
Наноантитела также сохраняют высокую аффинность и специфичность по отношению к своим антигенам-мишеням с низким накоплением вне мишени из-за их гидрофильных участков [8]. Эти антитела оказались неожиданно устойчивы из-за их высокой способности к повторной укладке, которая восстанавливается после химической денатурации с минимальным повреждением функциональности, хотя в [18] предполагалось, что термическая денатурация может быть необратимой.
Кроме того, они могут переносить высокие температуры (60–80°C, несколько недель при 37°C), повышенное давление (500–750 МПа), нефизиологические значения pH (3.0–9.0) и даже самые сильные химические денатуранты (2–3 M гуанидиния хлорид, 6–8 M мочевина) [19].
Наноантитела просты и недороги в производстве. В отсутствие посттрансляционных модификаций наноантитела могут быть синтезированы с помощью микробных систем с дополнительным преимуществом создания гомогенных продуктов [18, 19].
В современных исследованиях, посвященных нарушениям иммунофизиологических функций при опухолевом росте, большое внимание уделяется изучению механизмов регуляции иммунного ответа и сохранения постоянства внутренней среды организма. Важную роль в поддержании гомеостаза в иммунной системе играют регуляторные Т-клетки (Treg). Регуляторные Т-клетки представляют собой субпопуляцию, составляющую примерно 5–10% от общего числа периферических лимфоцитов здорового человека. Впервые они были описаны Sakaguchi et al. в 1995 г. В настоящее время этим клеткам отводят ключевую роль в предотвращении развития аутоиммунных реакций и развития иммуносупрессии в процессе канцерогенеза. У онкологических больных число Т-регуляторных лимфоцитов резко повышается, что приводит к ускорению прогрессирования заболевания и снижению эффективности проводимого лечения. К настоящему времени описаны три вида Treg: CD4 + CD25 + + FOXP3Treg, Tr1 и TH3. Функции Tr1 и TH3 до конца не ясны, их поверхностные маркеры не определены. Индукторы дифференцировки: IL-10 – для Tr1 и TGF-β – для TH3. Синтезируемые цитокины: Tr1 – IL-10 и TGF-β, TH3 – TGF-β. Среди CD4 + CD25 + FOXP3Treg выделяются две субпопуляции. Одна из них имеет фенотип CD4 + + CD25hi CTLAhi FOXP3 и образуется в тимусе из недифференцированных лимфоцитов, другая, с фенотипом CD4 + CD25variable CTLAhi FOXP3, возникает из периферических Т-хелперов под действием избыточной концентрации глюкокортикоидов, эстрогенов, интерлейкина-2, трансформирующего фактора роста. Однако по функциям они идентичны. Общие признаки Treg:
– экспрессия рецепторов к интерлейкину-2 – CD25;
– рецепторы Т-хелперов – CD4;
– антиген, ассоциированный с цитотоксическими лимфоцитами четвертого типа (CTLA-4);
– глюкокортикоид индуцированный, связанный с рецептором фактора некроза опухоли протеин (GITR);
– транскрипционный фактор FoxP3.
Treg обладают способностью подавлять пролиферацию, продукцию цитокинов CD8+-лимфоцитами и иммуноглобулинов CD19+-лимфоцитами, а также блокируют функции NK, NKT, DC. Механизм действия этих клеток связан с контактным ингибированием функциональной активности, секрецией супрессорных цитокинов (IL-10, IL-35, TGF-β), а также прямым лизисом иммунокомпетентных клеток. В ряде работ показано, что высокая концентрация Treg в тканях и периферической крови определяет плохой прогноз у больных с опухолями легких, головы и шеи, яичников, желудка, кожи, почки [21].
Для визуализации Treg, инфильтрирующих опухолевую ткань, недостаточно оценить экспрессию только одного рецептора на поверхности клетки. Для этого требуется использование биспецифических моноклональных антител, позволяющих связываться с несколькими антигенами на поверхности клетки.
Более 50 лет назад Аlfred Nisonoff показал, что из моновалентных Fab-фрагментов антител разной специфичности можно создать биспецифические Fab-фрагменты [16]. Это событие стало началом эры биспецифических антител, объединяющих в одной молекуле функциональные домены, способные связываться с двумя разными антигенами или двумя различными эпитопами одного антигена. Изначально основной областью применения биспецифических антител стало “перенаправление” Т-клеток в опухолевые очаги. Эти антитела нашли применение в иммуногистохимических, радиоиммунологических и других направлениях диагностики, что позволило увеличить чувствительность и специфичность этих методов [22]. В настоящее время биспецифические антитела получают в основном с помощью трех групп методов: конъюгации с использованием химических сшивающих агентов; квадромной технологии (quadromas); генетических (рекомбинантных) подходов [20].
Несмотря на большую перспективность применения биспецифических моноклональных антител для визуализации и радиоиммунотерапии, практических разработок в этом направлении нет.
МЕТОДЫ
Технологическая схема производства РФЛП 68Ga-DFO-anti-CTLA4-GITR. Получение РФЛП для ПЭТ на основе радионуклида галлий-68 и хелатирующих производных олигопептидной природы основано на образовании радионуклидного хелатного комплекса катиона галлия (галлий-68) с хелатирующей группой DFO DFO (дефероксамин), введенной в молекулу таргетирующего (специфично связывающегося с определенными биомаркерами – рецепторами, экспрессирующимися в клетках тех или иных злокачественных новообразований) агента.
На рис. 1 приведена схема реакции образования хелатного комплекса галлия-68 с хелатирующим производным генноинженерного скаффолда на основе наноантител – VHH-фрагментов тяжелоцепочечных моноклональных антител верблюда, специфично связывающихся с биомаркерами CTLA4 и GITR для получения РФЛП 68Ga-DFO-anti-CTLA4-GITR.
Рис. 1.
Схема реакции образования хелатного комплекса галлия-68 с хелатирующим производным DFO-anti-CTLA4-GITR.
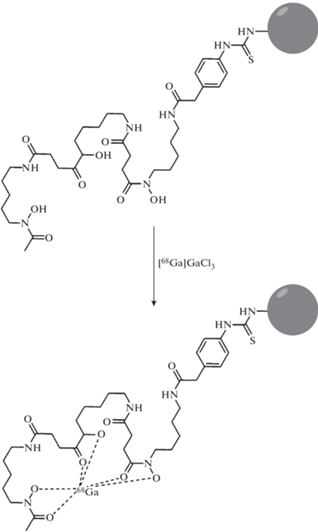
Содержащиеся в реакционной массе примеси металлов (Fe, Zn и др.) могут вступать в конкурирующие реакции с образованием нерадиоактивных комплексов с хелатирующей группой олигопептидного предшественника.
Технологическая схема производства представлена на рис. 2. В качестве радиоактивного сырья при синтезе “68Ga-DFO-anti-CTLA4-GITR” использовали 68GaCl3 в 0.1 М растворе соляной кислоты. Радионуклид получают при элюировании 68Ge/68Ga-генератора 0.1 М HCl. Германий-68, служащий материнским изотопом для галлия-68, сорбирован на колонке, содержащей сорбент: двуокись титана, модифицированного двуокисью циркония. В качестве нерадиоактивного сырья при синтезе “68Ga-DFO-anti-CTLA4-GITR” использовали генноинженерную конструкцию из наноантител к CTLA-4 и GITR, модифицированную хелатирующими группами DFO (молярная масса (ММ) – 29842.7 г·мол.–1).
Рис. 2.
Технологическая схема производства РФЛП 68Ga-DFO-anti-CTLA4-GITR. ВР – вспомогательные работы, ТП – технология производства, УМО – упаковка, маркировка, отпуск.
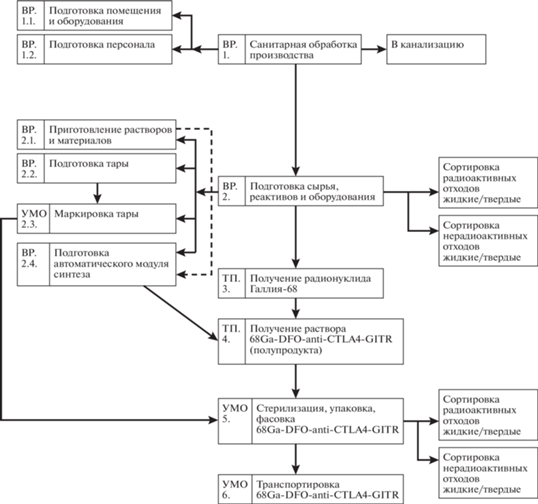
Синтез препарата “68Ga-DFO-anti-CTLA4-GITR” проводили на автоматизированной установке (модуле синтеза) собственного изготовления. Данная установка позволяет проводить химические и радиохимические превращения в микрореакторе, а также выполнять такие процедуры, как нагрев, охлаждение, упаривание в потоке инертного газа. Автоматизированный модуль дает возможность контролировать и регистрировать такие параметры, как давление, температура и радиоактивность в реакционном сосуде. На выходе из установки получают РФЛП, готовый к применению после проведения контроля его качества.
Технологическая схема производства РФЛП 177Lu-DOTA-anti-CTLA4-GITR. Получение РФЛП для системной лучевой терапии на основе радионуклида лютеций-177 и хелатирующих производных олигопептидной природы основано на образовании радионуклидного хелатного комплекса трехзарядного катиона лютеция (лютеций-177) с хелатирующей группой DOTA (тетраазациклододекантетрауксусная кислота), введенной в молекулу таргетирующего (специфично связывающегося с определенным биомаркером – рецептором, экспрессирующимся в клетках тех или иных злокачественных новообразований) агента.
На рис. 3 приведена схема реакции образования хелатного комплекса лютеция-177 с хелатирующим производным DOTA-anti-CTLA4-GITR для получения РФЛП 177Lu-DOTA-anti-CTLA4-GITR.
Рис. 3.
Схема реакции образования хелатного комплекса лютеция-177 с хелатирующим производным DOTA-anti-CTLA4-GITR.
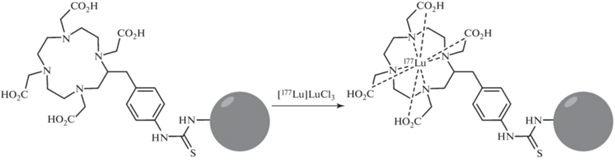
Содержащиеся в реакционной массе примеси металлов (Fe, Zn и др.) могут вступать в конкурирующие реакции с образованием нерадиоактивных комплексов с хелатирующей группой олигопептидного предшественника.
Технологическая схема производства РФЛП 177Lu-DOTA-anti-CTLA4-GITR представлена на рис. 4.
Рис. 4.
Технологическая схема производства РФЛП 177Lu-DOTA-anti-CTLA4-GITR. ВР – вспомогательные работы, ТП – технология производства, УМО – упаковка, маркировка, отпуск.
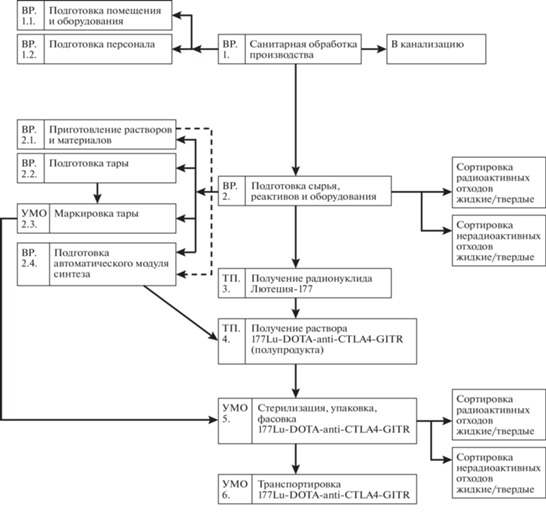
В качестве радиоактивного сырья при синтезе “177Lu-DOTA-anti-CTLA4-GITR” использовали 177LuCl3 в 0.1 М растворе соляной кислоты. Радионуклид получают при облучении тепловыми нейтронами в ядерном реакторе стабильных изотопов лютеций-176 или иттербий-176. В качестве нерадиоактивного сырья при синтезе “177Lu-DOTA-anti-CTLA4-GITR” использовали генноинженерную конструкцию из наноантител к CTLA-4 и GITR, модифицированную хелатирующими группами DOTA (ММ – 29842.7 г·мол.–1). Синтез препарата “177Lu-DOTA-anti-CTLA4-GITR” проводили на автоматизированной установке (модуле синтеза) собственного изготовления. На выходе из установки получали РФЛП, готовый к применению после выполнения соответствующих процедур контроля качества.
РЕЗУЛЬТАТЫ
Целевыми продуктами настоящей технологии являются два РФЛП на основе производного таргетирующего агента – генноинженерного скаффолда, представляющего собой наноантитело – VHH-фрагмент тяжелоцепочечных моноклональных антител верблюда, специфично связывающегося с биомаркерами CTLA4 и GITR. Диагностический РФЛП для иммуно-ПЭТ представляет собой радионуклидный хелатный комплекс трехзарядного катиона галлий (галлий-68) с хелатирующим предшественником за счет связывания катиона с хелатирующей группой DFO (дефероксамин), введенной в молекулу предшественника (наноанттела). В табл. 1 представлена информация о составе РФЛП на основе биспецифического наноантитела, меченного 68Ga.
Таблица 1.
Состав препарата 68Ga-DFO-anti-CTLA4-GITR
| Активное вещество | Показатель |
|---|---|
| 68Ga | Не менее 1.5 МБк |
| Вспомогательные вещества | |
| Натрия хлорид ФС 2.2.0014.15 | 9 мг |
| Гентизинат натрия CAS: 4955-90-2 | 5 мг |
| Вода для инъекций ФС.2.2.0019.18 | до 1.0 мл |
Cрок годности РФЛП “68Ga-DOTA-anti-CTLA4-GITR” составляет 4 ч с даты и времени изготовления (с учетом снижения объемной активности вследствие радиоактивного распада).
Разработанный РФЛП для системной (радиолигандной) лучевой терапии на основе радионуклида лютеций-177 и хелатирующего производного таргетирующего агента VHH-фрагментов тяжелоцепочечных моноклональных антител верблюда представляет собой радионуклидный хелатный комплекс трехзарядного катиона лютеция (лютеций-177) с хелатирующим предшественником за счет связывания катиона с хелатирующей группой DOTA (тетраазациклододекантетрауксусная кислота), введенной в молекулу предшественника. В табл. 2 представлена информация о составе РФЛП на основе биспецифического наноантитела, меченного 177Lu.
Таблица 2.
Состав препарата 177Lu-DOTA-anti-CTLA4-GITR
| Активное вещество | Показатель |
|---|---|
| 177Lu | Не менее 1.5 МБк |
| Вспомогательные вещества | |
| Натрия хлорид ФС 2.2.0014.15 | 9 мг |
| Гентизинат натрия CAS: 4955-90-2 | 5 мг |
| Вода для инъекций ФС.2.2.0019.18 | до 1.0 мл |
Cрок годности РФЛП составляет 120 ч с даты и времени изготовления (с учетом снижения объемной активности вследствие радиоактивного распада).
ОБСУЖДЕНИЕ
Основные подходы к радионуклидной диагностике и терапии опухолевых заболеваний связан с использованием агентов полипептидной природы, меченных радионуклидами металлов и галогенов. Указанные РФЛП могут успешно использоваться у пациентов с химиорезистентными распространенными формами онкологических заболеваний, в том числе в тех случаях, когда опухолевые очаги не чувствительны к воздействию неконъюгированных лекарственных антител [19–21].
К ключевым преимуществам наноантител по сравнению с моноклональными антителами и их фрагментами относятся: небольшие размеры, способствующие их проникновению в опухолевые клетки и большей селективности накопления в опухоли; гибкость гипервариабельных участков, что дает возможность достижения ранее недоступных эпитопов; термостабильность и устойчивость к экстремальным pH, облегчающие синтез РФЛП; низкая иммуногенность; высокие специфичность и аффинность, соизмеримые c моноклональными антителами.
Наноантитела можно легко конъюгировать с радионуклидами и флуорохромами, используя стратегии сортировки или классической химической конъюгации. Такие конъюгаты наноантитело–радионуклид и наноантитело–NIRF являются полезными инструментами для визуализации опухолевых антигенов или связанных с опухолью стромальных клеток, таких как рецептор маннозы макрофагов (MMR, CD206). Более того, такие конъюгаты обладают терапевтическим потенциалом, например за счет локальной доставки ионизирующего излучения к опухоли или за счет термической цитотоксичности через светочувствительный NIRF.
Обычные стратегии конъюгации белков используют случайную конъюгацию с реактивными боковыми цепями, чаще всего амидную конъюгацию с аминогруппой боковых цепей лизина или с N-концом белка (который в случае V-доменов находится рядом с антигеном – привязка паратопа). Поскольку случайную конъюгацию трудно контролировать, она может поставить под угрозу функциональность наноантитела, например, стерически нарушая связывание мишени, стерически нарушая распределение в тканях и обеспечивая потенциально иммуногенные эпитопы. Поэтому были разработаны два подхода для конъюгирования химических веществ с наноантителами в определенном месте. Один из них включает в себя введение остатка цистеина на С-конце или в определенные остатки каркаса, обеспечивая основу для сайт-специфических конъюгаций малеимида [17, 19]. В другом методе вводится пентапептид (LPXTG), который позволяет катализируемую сортировкой транспептидацию [22].
В настоящем исследовании осуществили фармацевтическую разработку инновационных РФЛП на основе наноантител к поверхностным рецепторам регуляторных Т-клеток GITR и CTLA-4 для диагностики методом ПЭТ-КТ и радионуклидной терапии социально значимых онкологических заболеваний. В рамках фармацевтической разработки созданы технологии введения хелатирующих групп в молекулу биспецифического наноантитела к GITR и CTLA‑4, а также методики получения основного действующего вещества РФЛП 68Ga-DFO-anti-CTLA4-GITR и 177Lu-DOTA-anti-CTLA4-GITR и готовой лекарственной формы указанных РФЛП с выбором оптимального состава вспомогательных веществ для обеспечения стабильности радионуклидного комплекса и молекулы предшественника.
Список литературы
Гранов А.М., Тютин Л.А. Позитронная эмиссионная томография: руководство для врачей. СПб.: Фолиант, 2008. 368 с.
Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). М.: Московский научно-исследовательский онкологический институт им. П.А. Герцена – филиал Федерального государственного бюджетного учреждения “Национальный медицинский исследовательский центр радиологии” Министерства здравоохранения РФ, 2018. 250 с.
Гранов А.М., Тютин Л.А., Станжевский А.А. // Вестн. РАМН. 2012. № 9. С. 13. https://doi.org/10.15690/vramn.v67i9.401
Buck A.K., Herrmann K., Stargardt T. et al. // J. Nucl. Med. Technol. 2010. V. 38. № 1. P. 6. https://doi.org/10.2967/jnmt.108.059584
Adams S.J., Rakheja R., Bryce R. et al. // Canadian Association of Radiologists J. 2018. V. 69. № 1. P. 63. https://doi.org/10.1016/j.carj.2017.08.001
Гранов А.М., Тютин Л.А., Станжевский А.А. и др. // Лучевая диагностика и терапия. 2012. № 4. С. 11.
Granov A., Tyutin L., Schwarz Th. Positron emission tomography. Heildelberg: Springer, 2013. 384 p.
Prasad V., Fojo T., Brada M. // Lancet Oncology. Rev. 2016. V. 17. № 2. P. E81. https://doi.org/10.1016/S1470-2045(15)00620-8
Gill M.R., Falzone N., Du Y. et al. // Lancet Oncology. 2017. V. 18. № 7. P. E414. https://doi.org/10.1016/S1470-2045(17)30379-0
Martins C.D., Kramer-Marek G., Oyen W.J.G. // Expert Opinion on Drug Delivery. 2018. V. 15. № 2. P. 185. https://doi.org/10.1080/17425247.2018.1378180
Vallabhajosula S. Molecular Imaging. Radiopharmaceuticals for PET and SPECT. NY.: Springer, 2009. 370 p.
Kendi A.T., Moncayo V.M., Nye J.A. et al. // PET clinics. 2017. V. 12. № 1. P. 93. https://doi.org/10.1016/j.cpet.2016.08.006
Корсаков М.В. Руководство по ПЭТ радиохимии. СПб.: ТЕЗА, 2002. 180 с.
Hosono M. // Nuclear Medicine and Molecular Imaging. 2019. P. 167. https://doi.org/10.1007/s13139-019-00586-x
Шаталова А.В., Якубова А.С., Палимпсестов В.В., Есмагамбетов И.Б. // Разработка и регистрация лекарственных средств. 2019. Т. 8. № 1. С. 14. https://doi.org/10.33380/2305-2066-2019-8-1-14-22
Hamers-Casterman C., Atarhouch T., Muyldermans S. et al. // Nature. 1993. V. 363. № 6428. P. 446. https://doi.org/10.1038/363446a0
Cogne M., Silvain C., Khamlichi A.A., Preud’homme J.L. // Blood. 1992. V. 79. № 9. P. 2181.
Arbabi Ghahroudi M., Desmyter A., Wyns L. et al. // FEBS Lett. 1997. V. 414. № 3. P. 521.
Nagano K., Tsutsumi Y. // Viruses. 2021. V. 13. № 178. P. 1. https://doi.org/10.1016/s0014-5793(97)01062-4
Андреев А.А., Лопина Н.П., Бордина Г.Е., Некрасова Е.Г. // Современная наука: от теории к практике. Пенза: Наука и просвещение, 2020. С. 99.
Hassanzadeh-Ghassabeh G., Devoogdt N., De Pauw P. et al. // Nanomedicine. 2013. V. 8. № 6. P. 1013. https://doi.org/10.2217/nnm.13.86
Yan J., Wang P., Zhu M. et al. // J. Nanobiotechnology. 2015. V. 13. № 33. P. 1. https://doi.org/10.1186/s12951-015-0091-7
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


