Российские нанотехнологии, 2023, T. 18, № 4, стр. 564-567
Инновационный подход к достижению ремиссии рака после первичной терапии
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: zagryadskiy_VA@mail.ru
Поступила в редакцию 11.01.2023
После доработки 11.01.2023
Принята к публикации 23.01.2023
Аннотация
Проведен анализ возможности достижения ремиссии рака на завершающих этапах терапии с применением радиофармпрепаратов (РФП) с излучателями разного типа радиоактивности. С целью снижения сопутствующего избыточного радиологического воздействия от РФП и использования естественного биохимического процесса для доставки конъюгата к раковой клетке впервые предложен терапевтический подход, сочетающий в себе использование транспортной молекулы в форме модифицированной глюкозы и терапевтического агента в виде эмиттера оже-электронов. Обосновано преимущество применения эмиттеров оже-электронов по сравнению с α- и β-излучателями для разрушения микрометастазов и отдельных раковых клеток. Сделан выбор в пользу радиоизотопа 103mRh как наиболее удобного и эффективного эмиттера оже-электронов.
ВВЕДЕНИЕ
Во всем мире растет интерес к возможностям применения методов ядерной медицины для диагностики и терапии онкологических заболеваний. Радионуклидная диагностика основана на регистрации внешними детекторами излучения и, соответственно, распределения в организме пациента радиофармпрепаратов (РФП). К методам радионуклидной диагностики можно отнести однофотонную эмиссионную компьютерную томографию (ОФЭКТ), позитронно-эмиссионную томографию (ПЭТ) и планарную сцинтиграфию (ПС). Эти методы позволяют определить функциональные изменения в органах и тканях, характерные для злокачественных клеток, а также размеры и расположение опухолевых образований. Кроме указанных методов для определения размера, формы и расположения новообразования используют компьютерную рентгеновскую томографию (КТ) и магнитно-резонансную томографию (МРТ). Несмотря на существующее разнообразие диагностических методов, на практике разрешение ни одного из них не позволяет однозначно диагностировать наличие опухоли (сгустка раковых клеток) размером менее 1–2 мм. Поэтому реализация назначенных пациенту терапевтических процедур и удовлетворительный результат последующей инструментальной диагностики не гарантируют отсутствие у пациента отдельных раковых клеток и(или) микрометастазов и достижения ремиссии. Борьба с микрометастазами и отдельными раковыми клетками остается важнейшей задачей терапии.
МЕТОДЫ
Радионуклидная терапия основана на разрушающем воздействии излучения радионуклидов на злокачественные новообразования. Спектр терапевтических радионуклидов достаточно широк. Они характеризуются видом излучения, периодом полураспада, химическими свойствами. Важную роль при выборе того либо иного радионуклида играют простота и удобство его получения. Из эмиттеров β-излучения для целей радионуклидной терапии (в том числе для паллиативной терапии костных метастазов) активно используются РФП на основе 153Sm, 89Sr, 186Re, 188Re, 117mSn, 177Lu, 90Y, 131I, 161Tb и др. [1]. Большое внимание уделяется радиоизотопам рения 186Re (T1/2 = 3.72 сут, Eβmax = 1069 кэВ, Eγ = 137 кэВ, 9.42%) и 188Re (T1/2 = 17.0 ч, Eβmax = 2120 кэВ, Eγ = = 155 кэВ, 15.1%) [2, 3]. Это связано с близостью химических свойств рения и технеция и открывает возможности для разработки многочисленных РФП с изотопами рения, являющихся (по химическим свойствам) аналогами первоначально созданных РФП на основе 99mTc. Оба изотопа рения могут рассматриваться как тераностические, так как наличие мягких γ-линий позволяет визуализировать распределение радионуклида в организме методом ОФЭКТ. Преимуществом 188Re является то, что он может быть получен генераторным методом, преимущество 186Re – в более удобном периоде полураспада.
В последнее время за рубежом и в России набирает популярность применение как для диагностики, так и терапии радиоизотопов тербия. Тербий имеет четыре радиоизотопа, представляющих интерес для ядерной медицины – 149Tb (Т1/2 = 4.12 ч, ε + β+, α), 152Tb (Т1/2 = 17.5 ч, ε + β+), 155Tb (Т1/2 = 5.32 дн, ε) и 161Tb (Т1/2 = 6.89 дн, β–). Разнообразие видов излучения, испускаемых этими изотопами, позволяет рассматривать их как тераностические, например 149Tb одновременно испускает α-частицы и позитроны, т.е. может быть использован для α-радиотерапии с одновременной ПЭТ-визуализацией; 155Tb представляет интерес как диагностический радионуклид для ОФЭКТ [4]. Интерес к 152Tb в основном обусловлен его позитронным излучением (E = 1140 кэВ, Iβ+ = 20.3%), что позволяет использовать его в ПЭТ в качестве диагностической пары к 177Lu и терапевтическим изотопам тербия [5]. Ядерно-физические характеристики радионуклида 177Lu, такие как удобный период полураспада (T1/2 = = 6.71 сут), мягкое β-излучение, а также возможность нарабатывать большие активности реакторным способом, обеспечили ему наивысшую популярность в медицинском сообществе. Производство 177Lu в мире уже реализуется в промышленных масштабах. Например, согласно недавнему (26.10.2022) сообщению на сайте Atominfo.ru, на седьмом энергоблоке канадской АЭС “Bruce” началось коммерческое производство 177Lu.
Известно, что заряженные частицы имеют наибольшую плотность ионизации при торможении в конце пробега. Поскольку пробег β-частиц большинства β-эмиттеров составляет в ткани несколько миллиметров, отдельные раковые клетки и микрометастазы в радиусе длины пробега от РФП могут остаться неуязвимыми для β-частиц, а пострадают при этом в большей степени здоровые ткани.
Более эффективными для терапии по сравнению с β-эмиттерами считаются α-эмиттеры. Однако круг используемых α-эмиттеров достаточно узок. Причем практически все они обременены теми или иными неблагоприятными факторами: либо слишком сложен и дорог способ получения (225Ас, 223Ra) [6], либо из-за очень короткого периода полураспада неудобно их практическое применение. Большинство наиболее часто упоминаемых в литературе α-эмиттеров (или их предшественников) имеют слишком короткие периоды полураспада: 212Pb (T1/2 = 10.64 ч), 212Bi (T1/2 = 46 мин), 213Bi (T1/2 = 61 мин), 211At (T1/2 = = 7.21 ч), 149Tb (T1/2 = 4.15 ч), что ограничивает операционное время, необходимое для синтеза РФП, и приводит к необходимости работать с избыточными активностями. Хотя пробег α-частиц в ткани (~0.1 мм) значительно меньше пробега β‑частиц (несколько миллиметров), он, тем не менее, почти на 2 порядка превышает средний размер клетки (~4–5 мкм). Это значит, что основная зона поражения α-частицами будет находиться примерно в 100 мкм от точки локализации РФП. В этом случае, как и в случае с β-частицами, будут страдать здоровые клетки и могут оказаться неуязвимыми как отдельные раковые клетки, так и микрометастазы размером до 100 мкм. Таким образом, применение для терапии опухолей РФП на основе α- и β-эмиттеров целесообразно для опухолей достаточно больших размеров, определяемых известными инструментальными методами. Использование на заключительном этапе терапии для достижения ремиссии α- и β-эмиттеров, по-видимому, не эффективно. Отметим, что единовременная терапевтическая активность, вводимая пациенту, традиционно составляет для β‑эмиттеров ~ 100 мКи (1 мКи/кг), для α-эмиттеров ~ 10 мКи. Повторные сеансы терапии с указанными активностями могут привести к необратимым последствиям для пациентов уже от радиологического воздействия.
РЕЗУЛЬТАТЫ
В течение достаточно длительного времени в России и за рубежом разрабатываются разного рода векторные молекулы для целевой (таргетной) доставки терапевтических радионуклидов к раковым клеткам. Большинство разработок основано на применении специфичных к рецепторам на поверхности раковых клеток антител или пептидов. Во многих работах продемонстрировано в той либо иной степени достижение терапевтического эффекта от применения указанных средств на лабораторных животных [7, 8]. Однако до сих пор широкого практического применения методы таргетной доставки радионуклидов, особенно в России, не получили. По-видимому, в большинстве случаев это связано как с неподтвержденной, так и с недостаточной эффективностью указанных выше конъюгатов и (или) с большой стоимостью разработки соответствующих векторных молекул. Вместе с тем известен метод доставки радионуклида в клетку, основанный на естественном биохимическом процессе поглощения клеткой глюкозы [9]. Злокачественным клеткам свойственны более активные процессы гликолиза, обеспечивающиеся повышенным уровнем белков, транспортирующих глюкозу через клеточную мембрану. На этом принципе основано ПЭТ-исследование с 18F-ФДГ в диагностике опухолей. Именно такой механизм доставки радионуклида в клетку, в отличие от механизмов, основанных на искусственно синтезированных векторных молекулах со специфичными к рецепторам на поверхности раковой клетки антителами или пептидами, можно отнести к “природоподобному”.
Известно, что основной причиной рецидивов рака и основной трудностью в борьбе с ним являются микрометастазы и отдельные раковые клетки, не выявляемые современными инструментальными диагностическими методами, а также не поддающиеся идентификации с помощью известных онкомаркеров. После хирургического вмешательства и удаления опухоли пациентам, как правило, предлагается пройти курсы химиотерапии или радионуклидной терапии с α- или β-эмиттерами. Указанная терапия несет большие риски негативного воздействия на организм пациентов. В результате многие не доживают до ремиссии. Перспектива уничтожения отдельных раковых клеток и микрометастазов – важнейшая задача терапии, решение которой предлагается реализовать в рамках предлагаемого подхода. Его суть состоит в следующем. Вместо традиционного применения радионуклидной терапии с α или β-эмиттерами предлагается использовать радионуклиды “ближнего действия”. В качестве терапевтического агента “ближнего действия” предлагается использовать эмиттеры оже-электронов. Оже-электроны имеют малый пробег и высокую удельную линейную потерю энергии, они способны повреждать клетки в пределах нескольких десятков нанометров от местоположения эмиттера, но не оказывают цитотоксического действия на больших расстояниях и не повреждают здоровые клетки и ткани. В качестве транспортной молекулы (носителя эмиттера оже-электронов) предлагается использовать конъюгат на основе модифицированной глюкозы с естественным (природным) вектором доставки. К наиболее эффективным и удобным для практического применения эмиттерам оже-электронов можно отнести 103mRh (T1/2 = 56.1 мин), который имеет наименьшее отношение числа γ-квантов к электронам и может быть получен генераторным способом. Обоснование выбора радионуклида 103mRh среди иных эмиттеров оже-электронов подробно изложено в [10]. Предшественником 103mRh (T1/2 = 56.1 мин) в генераторе может быть 103Ru (T1/2 = 39.274 сут) или 103Pd (T1/2 = 16.98 сут). В отличие от 103Ru палладий-103 имеет эмиссионные характеристики, близкие к 103mRh. Поэтому “in vivo”-генератор 103Pd/103mRh может быть использован в качестве терапевтического агента в системе таргетной доставки РФП к раковым клеткам [11]. Предложенный подход, сочетающий в себе транспортную молекулу в форме модифицированной глюкозы и терапевтического агента в виде эмиттера оже-электронов, будет применен впервые. Функционально кроме технологии “in vivo” изотопный генератор 103Pd/103mRh может быть использован в классическом варианте для получения и последующего независимого применения в качестве терапевтического агента эмиттера оже-электронов 103mRh. Для обеспечения таргетной доставки исследуем возможности конъюгатов на основе модифицированной глюкозы, меченых 103Pd и (или) 103mRh.
ОБСУЖДЕНИЕ
Указанный подход для достижения ремиссии может применяться как после хирургического вмешательства, так и после химиотерапии в качестве финишной терапевтической процедуры, направленной на исключение рецидива появления рака. Практическое отсутствие цитотоксического действия на здоровые ткани (возможное сопутствующее уничтожение части здоровых клеток в результате поглощения клетками глюкозы, меченной эмиттерами оже-электронов, будет компенсировано естественными процессами обновления клеток) позволит применять указанную процедуру онкологическим больным многократно, в том числе в профилактических целях. Поскольку рак многообразен в своих проявлениях, предлагаемый подход, безусловно, не может гарантировать достижения ремиссии при всех проявлениях, но, тем не менее, может помочь продлить жизнь очень многим онкологическим больным.
ЗАКЛЮЧЕНИЕ
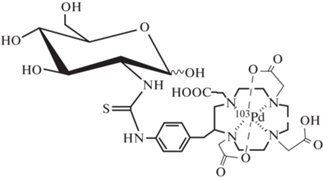
В настоящее время в НИЦ “Курчатовский институт” ведутся работы по реализации предложенного подхода. Разрабатывается генератор эмиттера оже-электронов 103mRh, разрабатываются методики синтеза конъюгатов на основе модифицированной глюкозы. Одним из первых планируется синтезировать и в дальнейшем исследовать конъюгат, структурная формула которого представлена на рис. 1. Указанный конъюгат является аналогом конъюгата 68Ga-DOTA-DG из [12], меченного 68Ga и предназначенного для диагностики методом ПЭТ.
Список литературы
Filosofov D., Kurakina E., Radchenko V. // Nucl. Med. Biol. 2021. V. 94–95. P. 1. https://doi.org/10.1016/j.nucmedbio.2020.12.001
Алиев Р.А., Кормазева Е.С., Фуркина Е.Б. и др. // Российские нанотехнологии. 2020. Т. 15. № 4. С. 451. https://doi.org/10.1134/S1992722320040020
Загрядский В.А., Латушкин С.Т., Маковеева К.А. и др. // Атомная энергия. 2020. Т. 128. № 3. С. 151. https://doi.org/10.1007/s10512-020-00668-6
Moiseeva A.N., Aliev R.A., Furkina E.B. et al. // Nucl. Med. Biol. 2022. V. 106–107. P. 52. https://doi.org/10.1016/j.nucmedbio.2021.12.004
Moiseeva A.N., Aliev R.A., Unezhev V.N. et al. // Nucl. Instrum. Methods Phys. Res. 2021. V. 497. P. 59. https://doi.org/10.1016/j.nimb.2021.04.007
Robertson A.K.H., McNeil B.L. // Inorg. Chem. 2020. № 59 (17). P. 12156.
Müller C., Zhernosekov K., Köster U. et al. // J. Nucl. Med. 2012. V. 53. № 12. P. 1951. https://doi.org/10.2967/jnumed.112.107540
Karyagina T.S., Ulasov A.V., Slastnikova T.A. et al. // Frontiers in Pharmacology. 2020. V. 11. P. 1. https://doi.org/10.3389/fphar.2020.00176
Петриев В.М., Тищенко В.К., Красикова Р.Н. // Химико-фармацевтический журнал. 2016. Т. 50. № 4. С. 3.
Bernhardt P., Forssell-Aronsson E., Jacobsson L., Skarnemark G. // Acta Oncologica. 2001. V. 40. № 5. P. 602.
Rooyena J., Szucsb Z., Zeevaartb J. // Appl. Radiat. Isotop. 2008. V. 66. P. 1346. https://doi.org/10.1016/j.apradiso.2008.02.088
Yang Z., Xiong C., Zhang R. et al. // Am. J. Nucl. Med. Mol. Imaging. 2012. V. 2 (4). P. 499.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии