Российские нанотехнологии, 2023, T. 18, № 4, стр. 533-539
Эффективный способ получения медицинского радионуклида 177Lu и терапевтические соединения на его основе
К. А. Маковеева 1, *, А. А. Артюхов 1, Б. В. Егорова 1, К. В. Коков 1, Т. М. Кузнецова 1, А. В. Курочкин 1, Д. Ю. Чувилин 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: makoveeva_ka@nrcki.ru
Поступила в редакцию 15.03.2023
После доработки 15.03.2023
Принята к публикации 09.06.2023
Аннотация
Описан разработанный метод получения медицинского радионуклида 177Lu, который получается при помощи “непрямого” метода, а именно, облучением иттербиевой мишени с высокой степенью обогащения по целевому изотопу 176Yb. Данный метод позволяет получать радионуклид без носителя и с высокой радионуклидной чистотой для получения терапевтических комплексов для целей ядерной медицины.
ВВЕДЕНИЕ
В последние годы активно развивается направление ядерной медицины, основанное на введении в организм человека радиофармпрепаратов, содержащих радиоизотопы для осуществления различных диагностических и терапевтических процедур. Таргетная терапия с применением меченных радионуклидами специфических органических молекул рассматривается как один из наиболее эффективных и перспективных вариантов лечения многих онкологических заболеваний. В связи с этим весьма актуальной задачей является разработка новых способов получения терапевтических радионуклидов и радиофармацевтических лекарственных препаратов (РФЛП) на их основе.
Одним из перспективных изотопов для применения в радионуклидной терапии направленной доставки является 177Lu [1]. Лютеций-177 обладает оптимальными характеристиками для применения в ядерной медицине – сравнительно небольшим периодом полураспада (6.7 сут), приемлемой энергией β-частиц (максимальная энергия 0.5 МэВ), наличием γ-излучения, которое дает возможность следить за биораспределением препарата с помощью γ-камеры. Продукт распада 177Lu – стабильный изотоп 177Hf. В табл. 1 приведены основные характеристики β- и γ-излучений 177Lu.
Таблица 1.
Граничные энергии спектра β-частиц и основные γ-линии 177Lu
| β-излучение, кэВ | γ-излучение, кэВ |
|---|---|
| 498 (79.3%) | 321.3 (0.22%) |
| 380 (9.1%) | 249.7 (0.21%) |
| 176 (12.2%) | 208.37 (11.00%) |
| 112.95 (6.40%) | |
| 71.65 (0.15%) |
Успешное применение 177Lu для препаратов адресной доставки ограничено возможностью получения высокой удельной активности радионуклида и его чистоты. Период полураспада 177Lu является удобным при направленной доставке препаратов с медленной фармакокинетикой, как правило, в случае полноразмерных антител. Кроме того, 177Lu обладает химическими характеристиками, подходящими для комплексообразования с бифункциональными хелатирующими агентами, такими как DTPA или DOTA.
Для получения препарата 177Lu высокой удельной активности могут использоваться два способа:
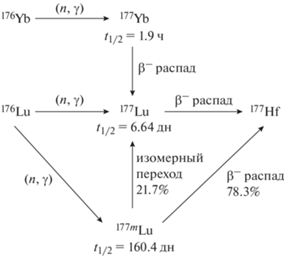
– облучение нейтронами ядерного реактора стартового материала, содержащего 176Lu (“прямой” способ);
– облучение нейтронами ядерного реактора стартового материала, содержащего 176Yb (“непрямой” способ).
Схема ядерных превращений, описывающая эти процессы, приведена на рис. 1.
В настоящей работе наработка 177Lu для приготовления РФЛП проводится по реакции радиационного захвата 176Yb(n,γ)177Yb → 177Lu. Использование непрямого способа позволило за счет радиохимического выделения 177Lu из облученной иттербиевой мишени минимизировать примесь в целевом радионуклиде изотопного носителя 176Yb. Кроме того, непрямой способ 177Lu сводит к минимуму примесь радионуклида 177mLu (T1/2 160 дн), который неизбежно образуется одновременно с 177Lu по “прямой” реакции 176Lu(n,γ)177Lu.
В связи со сказанным выше цель проведенного исследования заключалась в разработке метода получения 177Lu без носителя высокой радионуклидной чистоты для применения непосредственно в таргетной терапии онкологических заболеваний.
МЕТОДЫ
Для облучения использовали порошковые мишени из оксида иттербия-176 (176Yb2O3), обогащение по изотопу 176Yb составляло 99.85 мас. %. Для облучения использовали кварцевые ампулы длиной 50 мм, ее наружный диаметр – 8.1 мм, толщина стенки – 1.5 мм. Оксид иттербия помещали в ампулу, после чего ее взвешивали, а затем герметично заваривали в инертной атмосфере для исключения контакта материала мишени с внешней средой, что позволяло предотвратить загрязнение материала мишени. В табл. 2 приведены данные по изотопному составу оксида иттербия, полученного методом электромагнитной сепарации, который использовали в качестве мишени. В табл. 3 приведены данные по химическим примесям, содержащимся в исходном оксиде иттербия.
Таблица 2.
Изотопный состав иттербия (%)
| 168Yb | 170Yb | 171Yb | 172Yb | 173Yb | 174Yb | 176Yb |
|---|---|---|---|---|---|---|
| <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | 0.10 ± 0.02 | 99.85 ± 0.10 |
Таблица 3.
Химические примеси в исходном оксиде иттербия (ppm)
| Lu | Eu | Fe | Ni | Cu | Zn | Ba | Mg | Cr | Co |
|---|---|---|---|---|---|---|---|---|---|
| <4 | <0.5 | <10 | <30 | <5 | <1 | <1 | <20 | <10 | <15 |
| Cd | Ga | Pb | Al | Mn | B | Bi | Sr | Ca | Si |
| <1 | <40 | <9 | <50 | <10 | <10 | <10 | <2 | 100 | 150 |
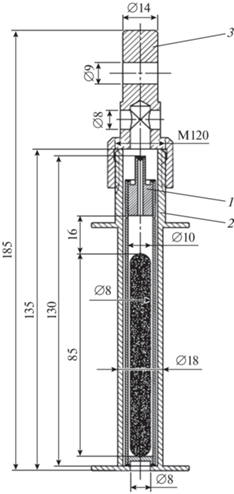
Для облучения использовали алюминиевые ампульные устройства (АУ). Герметично заваренную кварцевую ампулу, содержащую оксид иттербия, помещали в АУ с завинчивающейся крышкой. Для создания АУ использовали чистый алюминий марок А5К1 и АД0. На рис. 2, 3 приведены чертеж алюминиевого АУ и фотография ампулы с иттербиевой мишенью соответственно. Полученную таким образом мишень облучали в реакторе ИР-8 НИЦ “Курчатовский институт”, мощность реактора в ходе облучения составляла 4.7 МВт. Облучение проводилось в вертикальном канале (поток нейтронов ~ 5.5 × 1013 см–2с–1).
Рис. 2.
Эскиз АУ для проведения облучения образцов 176Yb, все размеры даны в мм; 1 – ампула с радиоизотопами, 2 – корпус, 3 – переходник.
После окончания облучения выжидали трое суток для распада короткоживущего 24Na (T1/2 = = 14.997 ч), активность которого наводится в материале алюминия в ходе облучения. После извлечения АУ из канала внутреннюю ампулу извлекали и перегружали в свинцовый контейнер для перевозки в помещение для переработки. Внутреннюю ампулу переносили в вытяжной шкаф и надламывали по линии надреза, после чего кварцевую ампулу извлекали, а алюминиевую помещали в контейнер для дальнейшей выдержки. Порошок оксида иттербия переводили в раствор, после чего отбирали исходную пробу, которую затем измеряли на γ-спектрометре. Для измерения активности использовали cпектрометр-радиометр γ-излучения МКГБ-01 “РАДЭК” в составе: коаксиальный детектор БДЕГ-К из особо чистого германия GCD-40 190, спектрометрическое устройство СПУ-01 на базе BOSON, программное обеспечение ASW ver. ASW2. Использовали библиотеку констант, сформированную на основе базы рекомендованных данных NUDAT-2 (МАГАТЭ). В пределах чувствительности прибора в исходном растворе были обнаружены радионуклиды 177Lu, 169Yb, 175Yb. Параметры облучения, активность, полученная после облучения, и итоговая активность после переработки мишеней приведены в табл. 4.
Таблица 4.
Параметры облучения и полученная активность
| Масса мишени, мг Yb2O3 | Время облучения, сут | Время выдержки, сут | Активность сразу после облучения, Бк | Активность в финальном образце, Бк |
|---|---|---|---|---|
| 40 | 6 | 3 | 6.3 × 109 | 5.75 × 109 |
| 40 | 5 | 3 | 5.5 × 109 | 2.70 × 109 |
| 40 | 5 | 3 | 7 × 109 | 4.51 × 109 |
Измерения активности 177Lu выполняли в соответствии с методикой “Методика определения активности гамма-излучающих радионуклидов в нейтронно-активационных индикаторах, в конструкционных и топливных материалах после их облучения в ядерных энергоустановках”, аттестованной ФГУП ВНИИФТРИ свидетельство № 407 RA.RU.311243-2017/400.151-541 от 20 октября 2017 г. (Зарегистрирована в Федеральном информационном фонде по обеспечению единства измерений).
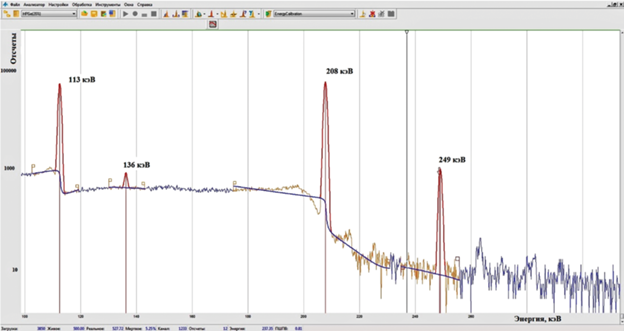
Для определения активности 177Lu использовали γ-линии с энергиями 113, 136, 208 и 249 кэВ, квантовые выходы которых равны 6.174, 0.047, 10.36 и 0.20% соответственно (в качестве библиотеки констант использовали ENDF/B-VIII.0). Активность каждой γ-линии определяли с помощью программного пакета для обработки γ-спектров SpectralineGP (свидетельство о государственной регистрации программы для ЭВМ № 2014615622) согласно формуле
где S – число отсчетов в пике полного поглощения γ-линии, ε – эффективность регистрации γ-квантов для выбранной γ-линии, t – длительность измерения, γ – квантовый выход γ-линии.Итоговое значение активности Аобщ определялось с помощью программного обеспечения (ПО) SpectralineGP как усредненное по всем γ-линиям. Неопределенность измеренной активности 177Lu рассчитывалась с помощью ПО SpectralineGP.
Удельную активность 177Lu в пробе определяли в соответствии с формулой
где Аобщ – итоговая активность 177Lu в мишени, Бк; М – масса нанесенной на мишень капли, г; k – коэффициент разбавления.Для измерения активности 177Lu в жидкой пробе из части пробы изготавливали “невесомые” мишени. Исходный раствор разбавляли дистиллированной водой ввиду высокой удельной активности 177Lu. “Невесомые” мишени изготавливали нанесением на них аликвоты разбавленного раствора 177Lu. С помощью автоматической пипетки отбирали ~10 мкл раствора, который переносили на полиамидную подложку толщиной 50 мкм с контролем массы выкапываемого объема на аналитических весах Cubis MSA225S-1CE-DI (свидетельство о поверке № С-АФС/21-02-2022/134706883 до 20.02.2023 г.) с последующим высушиванием и герметизацией полиамидной пленкой. Диаметр капель после высушивания составлял ~2.5 мм. Использование изготовленных таким образом “невесомых” мишеней позволяет пренебречь поправками на самопоглощение излучения в контейнере с жидкой пробой и на его геометрию.
Всего в эксперименте измеряли пять жидких проб. Из пробы 1 для подтверждения результатов были изготовлены две мишени, из остальных проб изготавливали по одной мишени. Коэффициенты разбавления растворов и массы растворов, перенесенных на невесомые мишени, указаны в табл. 5.
РЕЗУЛЬТАТЫ
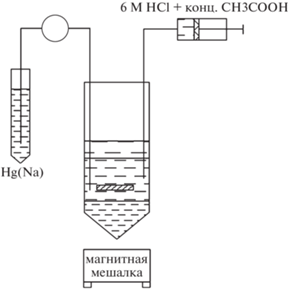
Для процесса разделения использовали натриевую амальгаму – в присутствии амальгамы как сильного восстановителя Yb восстанавливался до степени окисления +2, после чего образовывал амальгаму со ртутью. Для разделения использовали установку, состоящую из четырех или пяти ступеней контактного восстановления (в зависимости от массы мишени) и финальной стадии хроматографического концентрирования, перевода в подходящую для реакции комплексообразования среду, и доочистку от примесей натрия и иных металлов.
Как было сказано выше, после облучения алюминиевую ампулу выдерживали в течение трех суток для распада короткоживущего 24Na, образующегося в алюминии при облучении, затем кварцевую ампулу извлекали из АУ и обмывали 4 М азотной кислотой, дистиллированной водой и спиртом для удаления возможных загрязнений с поверхности ампулы. После этого кварцевую ампулу разрезали на две части с помощью бормашины, облученный оксид иттербия перемещали в стаканчик, а половинки ампулы аккуратно промывали при помощи дозатора для удаления остатков оксида иттербия с внутренней поверхности ампулы. Для промывки использовали 6 М соляную кислоту.
В стаканчик с облученным оксидом иттербия добавляли 2–3 мл 6 М соляной кислоты и нагревали на плитке до растворения оксида, поддерживая температуру, достаточную для растворения, и следя за тем, чтобы не происходило активного кипения и разбрызгивания раствора. После растворения оксида иттербия полученный раствор упаривали досуха, а сухой остаток растворяли в 0.3 мл концентрированной (16.6 М) уксусной кислоты и доводили объем раствора до 10 мл деионизованной водой. Концентрация полученного таким образом раствора по ацетат-иону составляла 0.5 М, рН раствора ~2.5. На рис. 4 приведена схема одной ступени контактного восстановления.
Полученный исходный раствор, содержащий иттербий и лютеций, помещали в полипропиленовую пробирку (d = 27 мм, h = 100 мм), после чего пробирку закрепляли на магнитной мешалке. Для проведения контактного восстановления использовали амальгаму натрия с содержанием по Na 0.3–0.33 мас. %, содержание Na в амальгаме контролировали титрометрическим методом, для подачи амальгамы использовали перистальтический насос. На каждой стадии контактного восстановления использовали по 5 мл амальгамы. Для предотвращения потерь раствора при разбрызгивании на поверхность раствора подавали гептан. Процесс проводили при непрерывном перемешивании с помощью магнитной мешалки, продолжительность одной стадии контактного восстановления составляла 30–40 мин при скорости подачи амальгамы 0.09–0.15 мл/мин. Для поддержания рН раствора в диапазоне 5.0–5.5 в раствор при необходимости подавали смесь 6 М соляной и 16.6 М уксусной кислот в соотношении 2 : 1.
После окончания процесса перемешивание выключали, раствор вместе с гептаном аккуратно отбирали при помощи шприца и перемещали в новую полипропиленовую пробирку, рН раствора опускали до 4, добавляя смесь соляной и уксусной кислот. Последующие цементации проводили аналогичным образом. По завершении последней стадии контактного восстановления полученный раствор отбирали и переносили в новую полипропиленовую пробирку, гептан отделяли при помощи дозатора, раствор слегка подогревали для окончательного удаления остатков гептана. После этого раствор разбавляли деионизованной водой вдвое для уменьшения концентрации Na.
В случае переработки мишеней массой более 100 мг методика может быть модифицирована – объем исходного раствора увеличивается до 16 мл, в качестве первой ступени проводятся два параллельных контактных восстановления, каждое с 8 мл раствора, после этого растворы объединяются и проводятся еще три–четыре стадии.
Для перевода раствора в форму, подходящую для комплексообразования с адресными молекулами, для концентрирования и удаления примесей металлов использовали хроматографическую методику. Очистку и концентрирование проводили на колонке, заполненной слабой катионообменной смолой Chelex-100 (200–400 mesh), площадь сечения колонки составляла 0.125 см2, высота слоя смолы – 7 см.
Исходный раствор пропускали через колонку со скоростью 0.05–0.08 мл/мин. После сорбции лютеция колонку промывали деионизованной водой, затем 0.5 М уксусной кислотой для удаления излишков натрия, затем снова деионизованной водой. Потери 177Lu при нанесении и промывке составляли ~1.5%. Скорость подачи промывочных растворов – 0.13 мл/мин, на весь процесс нанесения и промывки уходило ~8 ч. После окончания промывки деионизованной водой колонку заполняли 0.1 М соляной кислотой, контролируя значение рН на выходе из колонки при помощи тест-полосок, когда рН опускалось до ~1.5, подачу кислоты останавливали и колонку выдерживали в течение 1 ч, после чего 177Lu десорбировали 0.1 М соляной кислотой со скоростью 0.05–0.08 мл/мин. Элюент собирали в полипропиленовые пробирки типа “эппендорф” порциями по 250 мкл, после окончания смыва проводили измерение активности полученных растворов, из них выбирали аликвоты, в которых содержалась наибольшая активность, и объединяли в один образец. Основная доля 177Lu десорбировалась в небольшом объеме – 0.5–1 мл 0.1 М соляной кислоты. Потери при смыве составляли 2–3%. Из полученных образцов отбирали пробы, которые после соответствующего разбавления и приготовления мишеней измеряли на γ-спектрометрической установке для определения активности и нуклидного состава.
Измерения активности радионуклида 177Lu проводили на γ-спектрометрическом комплексе, состоящем из полупроводникового детектора ORTEC GMX10 с кристаллом из особо чистого германия n-типа проводимости и входным окном из бериллиевой фольги и многоканального анализатора ORTEC DSpec Jr 2.0. Диаметр кристалла германия – 49 мм, толщина – 34.6 мм, толщина бериллиевой фольги – 0.5 мм. Разрешение детектора по линии 5.9 кэВ составляет 506 эВ, разрешение детектора по линии 1.33 МэВ – 1.84 кэВ. Гамма-спектрометрический комплекс имеет действующее свидетельство о поверке (Свидетельство № С-АФС/08-08-2022/176656541 до 07.08.2023 г.).
Для выбранной геометрии измерения образцов была определена зависимость эффективности регистрации γ-квантов от их энергии с помощью набора образцовых спектрометрических γ‑источников типа ОСГИ, включающего в себя изотопы 241Am, 44Ti, 133Ba, 152Eu.
Изготовленные мишени размещали на заданной высоте над детектором. Для каждой мишени проводили серию из пяти измерений. Обработку спектров и определение активности и ее неопределенности проводили с помощью пакета для обработки γ-спектров SpectralineGP. Пример обработанного спектра представлен на рис. 5. Результаты измерения удельной активности 177Lu в исходных растворах представлены в табл. 6.
Таблица 6.
Удельная активность 177Lu в исходных растворах
| Проба | Удельная активность, Бк/г |
|---|---|
| 1 | (5.75 ± 0.40) × 109 |
| 2 | (2.61 ± 0.26) × 109 |
| 3 | (2.67 ± 0.27) × 109 |
| 5 | (6.31 ± 0.63) × 109 |
| 6 | (1.35 ± 0.13) × 109 |
Полученный описанным методом лютеций-177 использовали для синтеза прототипа РФЛП на основе HER2/neu специфичного полипептидного соединения ZHER2 (специфическое связывание с HER2 c KD 22 pM), методы синтеза и определения радиохимической чистоты которого описаны в [4]. Биоконъюгат DOTA–ЧСА–ZHER2 представлял собой комплекс из адресного вектора ZHER2, человеческого сывороточного альбумина в качестве адресной платформы, а также бифункционального хелатирующего агента DOTA. Реакция комплексообразования протекает в среде 0.1 М фосфатного буфера при pH 5.5–6.5 при температуре 60°С на протяжении 40–60 мин. Радиохимическая чистота достигала значения 57 ± 10%. В настоящей работе значение радиохимической чистоты было улучшено до значения >90% за счет дополнительной очистки раствора радионуклида от металлических примесей.
ОБСУЖДЕНИЕ
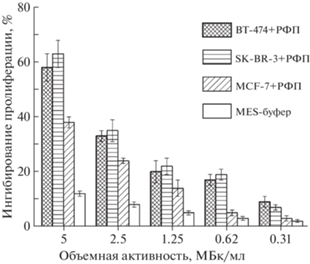
Полученный в [4] препарат использовали для исследования цитотоксичности на клеточных культурах. Результаты исследований [177Lu]DOTA–ЧСА–ZHER2 представлены на рис. 6, 7 (адаптировано из [4]). При 24-часовой инкубации опухолевых клеток линий BT-474 и SK-BR-3 в присутствии РФЛП [177Lu]DOTA–ЧСА–ZHER2 при максимальной объемной активности 5 МБк/мл цитотоксическая активность РФЛП не превысила 35–38% (рис. 6). Сопоставимую активность относительно клеток в культуре проявлял и несвязанный с биоконъюгатом 177Lu в виде соли. При увеличении времени инкубации до 72 ч цитотоксическая активность [177Lu]DOTA–ЧСА–ZHER2 значительно возрастала относительно клеток, которые гиперэкспрессировали онкомаркер HER2/neu, что выражалось в ингибировании роста клеток на 58–63% при объемной активности РФЛП 5 МБк/мл (рис. 7), и не изменялась в отношении клеток MCF-7 с низким уровнем экспрессии HER2/neu. При этом цитотоксическая активность свободного 177Lu не зависела от времени инкубации с клетками. Таким образом, показано, что препарат на основе получаемого 177Lu обладает специфической цитотоксической активностью только относительно опухолевых клеток молочной железы человека линий BT-474 и SK-BR-3, гиперэкспрессирующих онкомаркер HER2/neu.
Рис. 6.
Цитотоксическая активность 177Lu в виде соли относительно опухолевых клеток рака молочной железы человека с высоким (BT-474, SK-BR-3) и низким (MCF-7) уровнем экспрессии онкомаркера HER2/neu при воздействии в течение 24 ч. Различия статистически достоверны (р < 0.05).
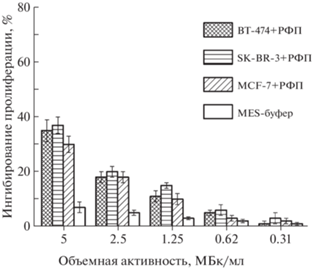
Рис. 7.
Цитотоксическая активность 177Lu в виде соли относительно опухолевых клеток рака молочной железы человека с высоким (BT-474, SK-BR-3) и низким (MCF-7) уровнем экспрессии онкомаркера HER2/neu при воздействии в течение 72 ч. Различия статистически достоверны (р < 0.05).
Разработанный метод получения 177Lu обеспечивает высокую степень химической и радионуклидной чистоты продукта, пригодность которого для синтеза прототипов РФЛП была показана в исследовании in vitro. Полученные результаты свидетельствуют о возможности применения получаемого 177Lu для синтеза различных РФЛП для нужд ядерной медицины.
ЗАКЛЮЧЕНИЕ
В представленном исследовании проведена наработка стартового для получения 177Lu материала на электромагнитном сепараторе С-2, в результате чего был получен оксид иттербия 176Yb2О3 с обогащением по целевому изотопу 99.85%, проведен химический и изотопный анализ полученного оксида.
Разработанная конструкция алюминиевых АУ для облучения мишеней в реакторе ИР-8 позволяет проводить стабильную наработку 177Lu, обеспечивая приемлемый технологический процесс вскрытия мишени для дальнейшей переработки.
Проведенные облучения мишеней из оксида иттербия 176Yb2О3 в вертикальном экспериментальном канале реактора ИР-8 с различной длительностью облучения позволили получить целевой радионуклид после переработки суммарной активности около 15 ГБк. При этом разработанная методика радиохимической переработки облученных мишеней позволяет получать раствор 177Lu без носителя и с высокой радионуклидной чистотой, что подтверждено измерениями активности и радионуклидного состава полученных образцов в аккредитованной лаборатории.
Список литературы
Кодина Г.Е., Красикова Р.Н. Методы получения радиофармацевтических препаратов и радионуклидных генераторов для ядерной медицины. М.: Издательский дом МЭИ, 2014. 282 с.
Chakravarty R., Das T., Dash A., Venkatesh M. // Nucl. Med. Biol. 2010. V. 37. P. 811. https://doi.org/10.1016/j.nucmedbio.2010.04.082
Каплан Г.Е., Силина Г.Ф., Остроушко Ю.И. Электролиз в металлургии редких металлов. М.: Государственное научно-техническое издательство литературы по черной и цветной металлургии. 1963. 370 с.
Artyukhov A.A., Golovachenko V.A., Deev S.M. et al. // Nanobiotechnology Reports. 2022. V. 17. P. 429. https://doi.org/10.1134/S2635167622030028
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии