Российские нанотехнологии, 2023, T. 18, № 4, стр. 528-532
Сравнительный анализ методов пассивного и активного формирования поля в лучевой терапии ионами углерода
А. Н. Соловьев 1, 2, *, И. А. Гулидов 1, А. П. Солдатов 3, П. В. Шегай 4, С. А. Иванов 1, 5, К. А. Сергунова 6, А. Д. Каприн 4, 5
1 Медицинский радиологический научный центр им. А.Ф. Цыба – филиал Национального медицинского исследовательского центра радиологии Министерства здравоохранения РФ
Обнинск, Россия
2 Обнинский институт атомной энергетики – филиал Национальный исследовательский ядерный университет “МИФИ”
Обнинск, Россия
3 Институт физики высоких энергий им. А.А. Логунова Национального исследовательского центра
“Курчатовский институт”
Протвино, Россия
4 Национальный медицинский исследовательский центр радиологии Министерства здравоохранения РФ
Обнинск, Россия
5 Российский университет дружбы народов им. Патриса Лумумбы
Москва, Россия
6 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: salonf@mrrc.obninsk.ru
Поступила в редакцию 17.01.2023
После доработки 17.01.2023
Принята к публикации 23.01.2023
Аннотация
Представлены сравнительные данные по облучению пациентов с онкологическими заболеваниями пучками ионов углерода с использованием пассивных средств модификации поля и активного метода формирования дозы на основе литературных и собственных данных. Приводятся оценки по физическим и радиобиологическим особенностям формирования активных и пассивных полей, непосредственные результаты лечения, а также рассмотрены дозы вне поля облучения при обоих методах.
ВВЕДЕНИЕ
Целью лучевой терапии является подведение оптимальной достоверной дозы излучения в опухолевый объем с минимизацией повреждения здоровых тканей, что обеспечивает уничтожение опухоли, улучшение качества и продление продолжительности жизни пациентов. Лучевая терапия ионами углерода, в свою очередь, является одним из эффективных методов дистанционной лучевой терапии, при котором успешно сочетаются физические преимущества в пространственном распределении дозы, так называемый пик Брэгга, и сравнительно более высокая относительная биологическая эффективность (ОБЭ) в мишени, нежели на входе пучка. В настоящее время в мире функционируют 13 медицинских центров с 38 кабинами, включая три системы гэнтри. Опыт использования ионов в медицинской практике был обобщен в публикации Международной комиссии по радиационным единицам и измерениям (МКРЕ) ICRU 93 [1], которая является основополагающим документом, описывающим процедуры подведения лечебного воздействия углеродными пучками различных характеристик.
МЕТОДЫ
Основной документ для анализа проблематики ионной терапии – [1]. Для дальнейшего поиска литературы использовали базу данных публикаций Scopus (ScienceDirect) с доступом к полнотекстовым версиям статей [2–21]. Собственные данные представлены в публикациях [15, 22–26].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В системах доставки широкого пучка модуляция поглощенной дозы по глубине достигается пассивными элементами канала формирования (гребенчатым фильтром или модулирующим кольцом). Такие элементы не меняются в процессе подведения конкретного поля и означают подведение фиксированной поглощенной дозы относительно глубины модуляции по всему полю. Затем подобное поле модифицируется компенсатором переменной толщины по всему сечению поля для того, чтобы “очертить” дальнюю границу планируемого объема мишени. Это в свою очередь является важным аспектом в моделировании терапии, так как спектр фрагментов может рассматриваться зависимым только от глубины проникновения и независимым от поперечного расположения мишени в поле. Следовательно, и линейная передача энергии (ЛПЭ), и ОБЭ могут рассматриваться только как функции от глубины. Более того, поскольку схема модуляции остается неизменной, это же можно сказать про всю фиксированную конфигурацию облучения с одного поля: поглощенную дозу, тип ткани, конечную точку эффективности лечения и т.п. Изменение этих параметров требует модификации самой системы пассивного подведения дозы. Таким образом, практическое применение систем доставки широкого пучка в клинике состоит в следующем:
– параметры ткани, конечные точки и режим фракционирования должны оставаться неизменными;
– вся концепция подведения дозы обеспечивается только в режиме доставки одного поля в день (т.е. если план облучения состоит из двух полей, облучение с этих полей должно происходить в разные дни). Подведение нескольких полей за один день будет означать разницу в поглощенной дозе и ЛПЭ и не обеспечит равномерный биологический эффект. При доставке дозы в разные дни процесс восстановления тканей может считаться завершенным, а сами поля независимыми.
Такой режим клинического использования широких пучков применяется на всех подобных установках [1]. Только в случае экстремального гипофракционирования (как подведение четырех полей в терапии рака легкого) возможно одновременное облучение в рамках одного дня. Действительно, более высокая поглощенная доза означает меньшее значение ОБЭ согласно классическим подходам линейно-квадратичной модели, что, в свою очередь, означает менее выраженную модуляцию ОБЭ-взвешенной дозы по глубине, которая должна быть примерно постоянной по всему объему опухоли.
Использование сканирующих пучков позволяет достичь лучшей вариабельности ОБЭ и обеспечивает большую степень свободы выбора режима модуляции поглощенной дозы. Основным преимуществом сканирующих пучков является возможность эффективно покрыть не только дальний край мишени, но и ближнюю границу опухолевого объема, обеспечив таким образом существенное снижение объема облучения здоровых тканей высокой дозой. Это достигается путем подбора пробегов ионов в каждой позиции лечебного поля, что обеспечивают более сильную модуляцию пика Брэгга в центральной части опухоли и меньшую модуляцию кривой в латеральных краях, где требуется меньшая глубина покрытия объема мишени. Для достижения этой задачи требуется модуляция флюенса в каждом индивидуальном пучке, чтобы получить равномерную ОБЭ-взвешенную дозу, но это означает и необходимость применения более сложных моделей описания биологического действия.
В задачах лучевой терапии ионами углерода для составления биологически-взвешенного плана облучения в Японии и на европейских установках используются различные модели. При этом надо понимать, что все европейские установки оснащались и продолжают оснащаться только сканирующей системой формирования поля, в то время как большинство Японских медицинских центров имеют пассивную систему вывода. Пересмотр радиобиологических моделей действия и уход от концепции нейтронной эффективной дозы в HIMAC (Heavy Ion Medical Accelerator in Chiba, Медицинский ускоритель тяжелых ионов в городе Чиба [2]) также сопровождались внедрением двух новых лечебных комнат уже со сканирующим пучком. В целом можно было бы предположить, что ОБЭ применяемых лечебных полей может различаться между активным и пассивным методами формирования по причине различий во фрагментации пучков и разного количества тканей на пути пучка. Однако сравнительные исследования, проведенные в наиболее сопоставимых условиях на пучках NIRS (National Institute of Radiological Sciences, Национальный институт радиологических наук, Чиба, Япония) и GSI (Gessellschaft fur Schwerionenforschung, Дармштадт, Германия) по критерию выживаемости клеток HSG in vitro [3] и по критерию регенерации кишечных крипт in vivo [4], показали практически одинаковые результаты. Был сделан вывод о том, что, несмотря на больший вклад фрагментов при пассивном облучении, он не приводит к существенной разнице в ОБЭ и о том, что значение ОБЭ преимущественно определяется эффектами первичного углеродного пучка.
Таким образом, в контексте моделей биологического действия в мире активно используются три модели: LEM I (англ. Local Effect Model, модель локального эффекта) в Европе [5], обновленный подход LBL (Lawrence-Berkley Lab, США), изначально для пучка HIMAC, который продолжает использоваться на всех пассивных Японских пучках [6], и обновленная модифицированная модель MKM (англ. Microdosimetric Kinetic Model, микродозиметрическая кинетическая модель) для сканирующих Японских пучков [7]. Отдельно стоит выделить подход к константному заданию ОБЭ по глубине на уровне 2.5 или 3, который используется в Китае на пучке в Ланжоу, однако только для опухолей, расположенных близко к поверхности [8]. Отметим, что нет прямого подхода, который позволил бы сравнивать клинические результаты, получаемые в этих различных институтах с использованием разных биологических моделей, как это возможно в традиционной фотонной терапии. Существуют подходы, например, описанные в [9], где используются эмпирические значения переходных множителей дозы, предписанных одной моделью, к дозе другой модели, оптимизации множественных полей [10], или пересчет эффективности действия органо-специфичных ОБЭ-взвешенных ограничений дозы [11].
Описание клинических результатов сравнения эффективности и безопасности пассивных и активных схем в литературе весьма скудно. Существуют лишь две специфичные публикации, посвященные непосредственному сравнению методов для двух конкретных локализаций – рака поджелудочной железы [12] и рака молочной железы [13]. В первом исследовании ретроспективно было отобрано 13 пациентов с неоперабельным раком поджелудочной железы (средний возраст 63 года), прошедших курс четырехпольного облучения пассивным методом в госпитале HIMAC с планом облучения, построенным на основе четырехмерной компьютерной томографии. Для этих пациентов были построены еще три варианта планов, а именно четырехпольное облучение сканирующим методом и трехпольные облучения с углов 150, 180, 210 обоими методами. Пассивный план трехпольного облучения не позволил получить допустимую максимальную дозу на спинной мозг и сразу был отброшен из рассмотрения. Из остальных планов именно четырехпольное сканирующее облучение позволило достоверно добиться снижения дозы на желудок и двенадцатиперстную кишку. В то же время трехпольное сканирующее облучение в целом позволяет снизить нагрузку на желудочно-кишечный тракт и влияние перистальтики кишечника на распределение дозы. Значимых различий в покрытии опухоли между активным и пассивным методами найдено не было, поэтому для поиска такой разницы облучение поджелудочной пассивным методом стало предметом проспективного клинического исследования в университетском центре в Гунме, Япония. Опубликованные [14] результаты по восьми пациентам (средний возраст 75 лет) в рамках конкретного метода посвящены сравнению точности ежедневного подведения дозы в зависимости от выбора базового метода совмещения – по костям или по опухоли – определяемого на ежедневных КТ-снимках. Метод совмещения по контуру опухоли был признан превосходящим метод совмещения по костям по показателям однородности покрытия целевого объема мишени в случаях, когда велики неопределенности положения опухоли.
В исследовании [13], в которое ретроспективно было включено 11 пациенток (средний возраст 66 лет), получивших терапию рака молочной железы пучком ионов углерода с пассивным методом формирования, сделан вывод о том, что в ряде случаев пассивное формирование может оказаться предпочтительным и по показателю итогового распределения дозы. По критерию D95 (доза по гистограмме доза–объем на уровне 95% объема мишени) примерно в 27% случаев пассивное облучение достоверно лучше, хотя для рассматриваемых 11 случаев опухоль даже не всегда покрывалась 95%-ной изодозой. Впрочем, ответ опухоли был достигнут у всех пациенток. Отметим, что планы для активного сканирующего пучка подготавливались другой системой планирования, и такие планы показывают достоверную разницу в снижении дозы на кожу, что, несомненно, может считаться фактором снижения риска лучевых повреждений.
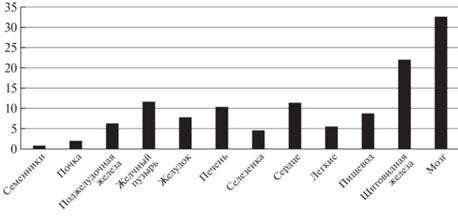
Важным аспектом обеспечения качества жизни пациентов является оценка величины рисков возникновения вторичных радиационно-индуцированных раков, обусловленных ненулевой дозой в органах вне поля облучения, которая возникает вследствие наличия нейтронного фона. Нейтроны образуются как в самом теле пациента, так и дополнительно могут возникать в устройствах пассивного формирования. В [15] была проведена оценка доз в различных органах тела пациента в случае облучения рака предстательной железы одним активным сканирующим полем с использованием воксельного фантома VisHum [16] и средства моделирования Fluka [17]. В [18] с использованием кода PHITS [19] и референсного фантома МКРЗ [20] проведена оценка доз в органах вне поля облучения для реалистичных случаев облучения предстательной железы с трех полей в режиме 57.6 Гр биологической дозы на пассивном пучке HIMAC [21]. На рис. 1 показано отношение величины превышения дозы при пассивном методе формирования поля над активным способом облучения с учетом усреднения показателей отдельных полей в [18] и средней величины ОБЭ 2.5 в качестве множителя для [15]. Видно, что по мере отдаления от целевого объема превышение все более и более существенное: например, для мозга, который находится в наибольшем отдалении от предстательной железы, доза при пассивном методе формирования в 32 раза выше, чем при сканирующем. Однако отметим, что даже с учетом взвешивающих факторов и большого ЛПЭ нейтронного излучения в этой зоне эквивалентная доза в мозге в типовом случае облучения предстательной железы пассивным пучком составляет 7.07 мЗв за весь курс [18].
ЗАКЛЮЧЕНИЕ
В России в рамках соглашения между НИЦ “Курчатовский институт” и ФГБУ “НМИЦ радиологии” Минздрава России реализуются собственные проекты углеродной лучевой терапии. В настоящее время проводятся [22] доклинические исследования на действующем пучке ускорительного комплекса У-70, в том числе работы по математическому моделированию действующих спектров компонент поля излучения [23] и прямые in vitro-эксперименты для подтверждения предсказательной силы моделей [24], а также исследования в области безопасности воздействия ионного пучка в области хвоста кривой Брэгга [25, 26]. В целом развитие направления ионной терапии в России представляется весьма перспективным, а большой научно-технический задел, полученный на данном этапе, позволит эффективно и качественно внедрить методику для рутинного клинического применения.
Список литературы
ICRU Report 93: Prescribing, Recording, and Reporting Light Ion Beam Therapy // J. ICRU. 2016. V. 16 (1–2).
Eiichi Takada // Nucl. Phys. A. 2010. V. 834 (1–4). P. 730c. https://doi.org/10.1016/j.nuclphysa.2010.01.132
Uzawa A., Ando K., Koike S. et al. // Int. J. Radiat. Oncol. Biol. Phys. 2009. V. 73. P. 1545. https://doi.org/10.1016/j.ijrobp.2008.12.021
Uzawa A., Ando K., Furusawa Y. et al. // J. Radiat. Res. 2007. V. 48. P. A75. https://doi.org/10.1269/jrr.48.A75
Scholz M., Kellerer A.M., Kraft-Weyrather W., Kraft G. // Radiat. Environ. Biophys. 1997. V. 36. P. 59. https://doi.org/10.1007/s004110050055
Kanai T., Furusawa Y., Fukutsu K. et al. // Radiat. Res. 1997. V. 147. P. 78. https://doi.org/10.2307/3579446
Inaniwa T., Furukawa T., Kase Y. et al. // Phys. Med. Biol. 2010. V 55. P. 6721. https://doi.org/10.1088/0031-9155/55/22/008
Li Q., Sihvel L. // Nucl. Instrum. Methods. B. 2011. V. 269 (7). P. 664. https://doi.org/10.1016/j.nimb.2011.01.125
Steinsträter O., Grun R., Scholz U. et al. // Int. J. Radiat. Oncol. Biol. Phys. 2012. V. 84. P. 854. https://doi.org/10.1016/j.ijrobp.2012.01.038
Fossati P., Molinelli S., Matsufuji N. et al. // Phys. Med. Biol. 2012. V. 57. P. 7543. https://doi.org/10.1088/0031-9155/57/22/7543
Molinelli S., Magro G., Mairani A. et al. // Radiother. Oncol. 2016. V. 120. P. 307. https://doi.org/10.1016/j.radonc.2016.05.031
Shiomi M., Mori S., Shinoto M. et al. // Radiother. Oncol. 2016. V. 119. P. 326. https://doi.org/10.1016/j.radonc.2016.04.026
Matsubara H., Karawasa K., Furuichi W. et al. // J. Radiat. Res. 2018. V. 59 (5). P. 1. https://doi.org/10.1093/jrr/rry052
Kubota Y., Okamoto M., Shiba S. et al. // Radiother. Oncol. 2021. V. 157. P. 85. https://doi.org/10.1016/j.radonc.2021.01.011
Fedorov V.V., Potetnya V.I., Moiseev A.S. et al. // Medical Radiology and Radiation Safety. 2020. V. 2. P. 57. https://doi.org/10.12737/1024-6177-2020-65-2-57-61
Zankl M., Fill U., Petoussi-Henss N., Regulla D. // Phys. Med. Biol. 2002. V. 47. P. 2367. https://doi.org/10.1088/0031-9155/47/14/301
Ballarini F., Battistoni G., Campanella M. et al. // J. Phys: Conf. Ser. 2006. V. 41. P. 151. https://doi.org/10.1088/1742-6596/41/1/014
Yonai S., Matsufuji N., Akahane K. // Physica Medica: Eur. J. Med. Phys. 2018. V. 51. P. 48. https://doi.org/10.1016/j.ejmp.2018.04.391
Sato T., Niita K., Matsuda N. et al. // J. Nucl. Sci. Technol. 2013. V. 50. № 9. P. 913. https://doi.org/10.1080/00223131.2013.814553
ICRP, 2009. Adult Reference Computational Phantoms. ICRP Publication 110. Ann. ICRP 39 (2).
Hirao Y., Ogawa H., Yamada S. et al. // Nucl. Phys. A. 1992. V. 538. P. 541. https://doi.org/10.1016/0375-9474(92)90803-R
Kaprin A.D., Galkin V.N., Zhavoronkov L.P. et al. // Radiation and Risk. 2017. V. 26 (2). P. 26. https://doi.org/10.21870/0131-3878-2017-26-2-26-40
Gordon K.B., Saburov V.O., Koryakin S.N. et al. // Bulletin of Experimental Biology and Medicine. 2022. V. 173. P. 281. https://doi.org/10.1007/s10517-022-05534-y
Solovev A., Troshina M., Pikalov V. et al. // Biomedical Physics Engineering Express. 2022. V. 8 (3). P. 035030. https://doi.org/10.1088/2057-1976/ac414f
Troshina M.V., Koryakina E.V., Potetnya V.I. et al. // J. Phys.: Conf. Ser. 2020. V. 1701. P. 012029. https://doi.org/10.1088/1742-6596/1701/1/012029
Koryakina E., Potetnya V.I., Troshina M. et al. // Int. J. Mol. Sci. 2022. V. 23 (12). P. 6765. https://doi.org/10.3390/ijms23126765
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии