Российские нанотехнологии, 2023, T. 18, № 6, стр. 793-800
Биологическая активность золотосодержащего нанокомпозита на основе сульфатированного полисахарида каррагинана
М. В. Зверева 1, *, Г. П. Александрова 1, Т. В. Фадеева 2
1 Иркутский институт химии им. А.Е. Фаворского СО РАН
Иркутск, Россия
2 Иркутский научный центр хирургии и травматологии
Иркутск, Россия
* E-mail: mlesnichaya@mail.ru
Поступила в редакцию 08.12.2022
После доработки 27.01.2023
Принята к публикации 14.02.2023
Аннотация
Представлены результаты синтеза биологически активной наноструктурированной полимерной системы на основе природного полисахарида κ-каррагинана, выступающего одновременно в качестве восстанавливающего и стабилизирующего агента для формирующихся наночастиц золота. Строение и наноморфологические характеристики полученного нанокомпозита (в частности, в водном растворе), представляющего собой κ-каррагинан стабилизированные наночастицы Au0, размер которых варьирует в интервале 6–20 нм, установлены посредством современных спектральных (ИК- и оптическая спектроскопия, динамические рассеяние света) и микроскопических (просвечивающая электронная микроскопия) методов исследования. Впервые установлено, что нанокомпозит Au0НЧ/κ-КГ-ДП обладает выраженной антикоагулянтной активностью, влияя на внутренний и внешний путь свертывания крови.
ВВЕДЕНИЕ
В течение многих десятилетий наночастицы благодаря своим уникальным размер-зависимым свойствам получают все большее распространение в различных областях науки и техники, в частности наиболее интенсивно в биологии и медицине, в том числе в сельском хозяйстве [1–3]. Одними из наиболее изученных нанообъектов являются наночастицы золота (Au0НЧ) и гибридные органо-неорганические нанокомпозиты на их основе. Au0НЧ обладают выраженной антимикробной [4], антималярийной [5], иммуномодулирующей [6] активностью, используются в терапии злокачественных новообразований [7], а также в качестве адъювантов [8] и доставщиков антигенов [9]. Возможные области практического использования Au0НЧ постоянно расширяются, что обусловливает необходимость детализированного исследования потенциальных механизмов их влияния на организм. Известно, что в случае попадания наночастиц в кровообращение они неизбежно взаимодействуют с клетками крови, белками и эндотелиальными клетками, а также ключевыми компонентами свертывающей системы крови, такими как тромбоциты и плазменные факторы свертывания, определяя коагуляционно-опосредованную токсичность [10]. Однако каких-либо однозначных выводов о влиянии Au0НЧ на систему свертывания крови в настоящее время нет. Согласно [11] цитрат-стабилизированные Au0НЧ размером 60 нм не усиливали агонист-индуцированную активацию тромбоцитов. Тогда как другие исследования показали, что Au0НЧ-усиленная активация тромбоцитов является размер-зависимой, в частности небольшие наночастицы (в сочетании с индукторами коагуляции) вызывали более жесткую активацию тромбоцитов по сравнению с наночастицами больших размеров [12, 13].
Вследствие того что Au0НЧ являются одними из наиболее изученных нанообъектов и обладают комплексом выраженных биологических свойств, обусловливающих перспективность их применения в биомедицинских приложениях, вопрос их токсичности остается открытым и требует детального изучения на примере конкретных биологических тест-систем. Поскольку биологическая активность Au0НЧ (в том числе токсичность) определяется их размером, формой, лигандным окружением и способом получения, весьма перспективным является использование для синтеза наночастиц природных нетоксичных соединений (растительные экстракты [14], полисахариды [15]), выполняющих одновременно функции восстановителя и стабилизатора Au0НЧ. В частности, в [16] получены и охарактеризованы нанокомпозиты золота на основе κ-каррагинана (κ‑КГ) – природного сульфатированного полисахарида красных морских водорослей. При этом полученные нанокомпозиты характеризуются как свойствами стабилизирующей полисахаридной матрицы (водорастворимость, гелеобразующие свойства, биологическая активность), так и физико-химическими свойствами Au0НЧ.
В настоящей работе представлены результаты синтеза и исследования влияния на свертывающую систему крови агрегативно устойчивого водорастворимого Au0НЧ-содержащего нанокомпозита, представляющего собой κ-КГ-стабилизированные Au0НЧ со средним размером 10.4 нм.
МЕТОДЫ
Материалы. В работе использовали κ-каррагинан марки WR-78 CP Celko, Дания. Элементный анализ, %: C – 34.7, H – 5.9, S – 6.9, Na – 0.96, K – 6.3. Этанол (Реахим), HAuCl4 (Sigma-Aldrich), NaOH (Реахим) были использованы без дополнительной очистки.
Методы исследования. Микрофотографии Au0НЧ в полисахаридной матрице κ-КГ получали на просвечивающем электронном микроскопе “Leo 906 Е” с использованием медных сеток с формваровым слоем в качестве подложки. Подготовку пробы анализируемого композита осуществляли в соответствии с описанной в [17] методикой. Измерение размера частиц выполняли в ручном режиме с использованием программы IPWin45. Статистически-значимая выборка наночастиц и надежность их полученного итогового размерного распределения обеспечивалась обработкой не менее 7–10 микрофотографий разных полей анализируемой подложки для получения данных о размере 900–1000 частиц.
Элементный состав нанокомпозита получен на сканирующем электронном микроскопе Hitachi ТМ 3000, оснащенном с X-ray детектором SDD XFlash 430-4, посредством рентгеновского энергодисперсионного микроанализа и на CHNS-анализаторе Flash 2000 фирмы Thermo Scientific.
Молекулярно-массовые характеристики деполимеризованного κ-КГ-ДП (используемого для синтеза нанокомпозита) и κ-каррагинана в составе синтезированного нанокомпозита Au0НЧ/κ-КГ-ДП определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на хроматографе Agilent 1100/1260 с использованием колонок Ultrahydrogel Linear (Waters, США). В качестве элюента использовали водный 0.1 н раствор нитрата натрия. Детекторами служили дифференциальный рефрактометр (RID10A, Shimadzu), установка многоуглового рассеяния света (Mini DAWN TriStar, Wyatt Technology Corporation, США) и спектрофотометрический детектор. Для калибровки колонки в качестве полимерных стандартов использовали узкодисперсные полиэтиленоксиды и пуллуланы PSS (Германия). Обработка результатов ВЭЖХ-анализа проведена с помощью компьютерной программы Astra. Детальное описание методики пробоподготовки образцов полисахарида и нанокомпозита на его основе, а также алгоритм проведения исследования и обработки результатов представлены в [18].
Гидродинамические радиусы (Rh) κ-КГ-ДП и его нанокомпозита Au0НЧ/κ-КГ-ДП (2.9% Au) определяли методом динамического рассеяния света (ДРС) на корреляционном спектрометре Photocor Compасt-Z (источник света – термостабилизированный полупроводниковый лазер мощностью 20 мВт с длиной волны λ = 638 нм) под углом 90°. Анализ корреляционной функции осуществляли с помощью программы обработки данных ДРС Dynals. Растворы для анализа готовили растворением при комнатной температуре в течение семи часов 5 мг образца в 5 мл дистиллированной воды, предварительно отфильтрованной через шприцевой фильтр. Время каждого измерения составляло не менее 200 с. Измерение проводили в трехкратной повторности.
Электрофоретическую подвижность наночастиц также измеряли на спектрометре Photocor Compасt-Z с использованием протокола PALS (Phase analysis light scattering). Преобразование полученного значения электрофоретической подвижности μE = ν/E в ζ-потенциал было проведено по уравнению Смолуховского μE = εεoζ/ηs, где ε и εo – диэлектрическая проницаемость растворителя и вакуума соответственно. Каждое измерение проводили в трехкратной повторности, результаты усредняли.
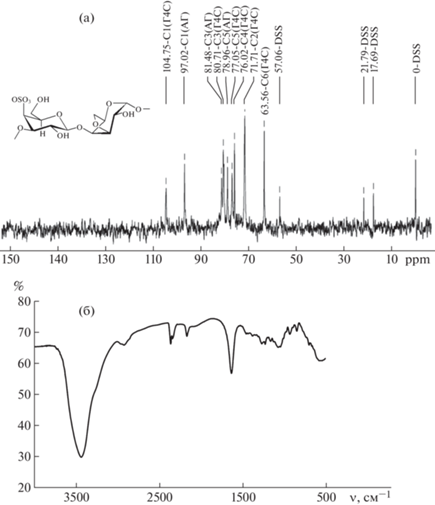
ИК-спектры регистрировали на ИК-Фурье-спектрометре (RAM II) Bruker Vertex 70 в таблетках KBr в диапазоне 4000–400 см–1. Спектры ЯМР 13С в D2O (концентрация составляла 2%) с добавлением CuAc в качестве релаксанта были измерены на “Bruker DPX-400”, работающем на частоте 100.13 МГц при 27°C. Химические сдвиги всех атомов углерода приведены относительно внутреннего стандарта DSS (d = 0.000 ppm).
ИК-спектр κ-КГ-ДП (см–1): 3449 (ν O–H), 2963, 2823 (ν C–H), 1640, (ν O–H), 1255, 1381 (сложноэфирная сульфатная группа), 934 (3,6-ангидрогалактоза – DA), 847 (галактоза-4-сульфат – G4S).
13C ЯМР κ-КГ-ДП (δ ppm): 104.7 (С-1 G4S), 97.0 (С-1 DA), 71.7 (С-2 G4S), 80.7 (С-3 G4S), 81.5 (С-3 DA), 76.0 (С-4 G4S), 80.6 (С-4 DA), 77.0 (С-5 G4S), 78.9 (С-5 DA), 63.5 (С-6 G4S).
Спектры оптического поглощения 0.1%-ного водного раствора нанокомпозита регистрировали на спектрофотометре Perkin Elmer Lambda 35 относительно дистиллированной воды в кварцевой кювете объемом 1 см3 в интервале длин волн 190–1000 нм.
Методика щелочной деполимеризации κ-КГ. Щелочную деполимеризацию κ-КГ осуществляли согласно протоколу, подробно представленному в [19], с незначительными изменениями. Кратко: к 170 мл 2.8%-ного водного раствора κ-КГ приливали 75 мл 1 N водного раствора NaOH. Смесь нагревали на водяной бане при температуре 85–90°С в течение 180 мин при интенсивном перемешивании на верхнеприводном перемешивающем устройстве ЭКРОС-8300 (Россия). По истечении указанного времени в реакционную смесь добавили 1 М водный раствор HCl до рН 6.0–7.0 с последующим высаживанием реакционной смеси в четырехкратный избыток EtOH. Полученный осадок отфильтровывали, промывали этанолом и высушивали на воздухе. Выход деполимеризованного полисахарида (κ-КГ-ДП) составил 84%. Элементный анализ, %: C – 33.1, H – 6.1, S – 6.8, Na – 3.36, K – 3.6.
Методика синтеза нанокомпозита Au0НЧ/κ-КГ-ДП (2.9% Au0). Синтез нанокомпозита осуществляли согласно протоколу, подробно описанному в [16], с незначительными изменениями. Кратко: к 50 мл 1.7%-ного водного раствора κ‑КГ-ДП при температуре 35°С и интенсивном перемешивании добавили 5 мл водного раствора, содержащего 1.36 ммоль HAuCl4. Смесь выдержали при температуре 35°С в течение 30 мин, после чего увеличили pH среды до 10.42 добавлением 1 N водного раствора NaOH и последующим повышением температуры реакционной среды до 70°C на водяной бане. Время синтеза – 25 мин. Выделение целевого нанокомпозита и очистку его от примесей проводили путем осаждения реакционной среды в четырехкратный избыток EtOH и многократной промывки сформировавшегося осадка фиолетового цвета этанолом с последующей сушкой на воздухе при комнатной температуре. Количественное содержание золота в полученном образце 2.9%. Элементный анализ, %: C – 32.6, H – 5.8, Au – 2.9, S – 6.3, Na – 3.0, K – 3.1.
Определение антикоагулянтной активности. Антикоагулянтную активность исходного κ-КГ, его деполимеризованного производного κ-КГ-ДП и нанокомпозита Au0НЧ/κ-КГ-ДП (2.9% Au0) исследовали in vitro по стандартным методикам определения коагуляционных показателей: АПТВ (активированное парциальное тромбопластиновое время) и ТВ (тромбиновое время) с использованием донорской крови человека. Для определения АПТВ смешивали раствор цитратной плазмы с тестируемыми образцами потенциальных антикоагулянтов с концентрацией 0.013, 0.025, 0.032% и выдерживали в течение 3 мин при 37°С. Далее добавляли 0.1 мл АПТВ – реагента, нагретого до 37°С, и инкубировали полученную смесь в течение 5 мин при 37°С. После этого добавляли 0.1 мл CaCl2 (0.025 моль/л) и фиксировали время свертывания. Для анализа TВ цитратную нормальную плазму смешивали с растворами тестируемых образцов потенциальных антикоагулянтов и выдерживали в течение 3 мин при 37°С, после чего добавляли экзогенный тромбин и фиксировали время свертывания. Эксперимент выполнен в 15 повторностях.
ОБСУЖДЕНИЕ
κ-КГ представляет собой водорастворимый сульфатированный полисахарид, макромолекулы которого состоят из регулярно чередующихся остатков 3-О-замещенной β-D-галактопиранозы с заместителем в виде сульфогруппы в положении 4 и 4-О-замещенной 3,6-ангидро-α-D-галактопиранозы. Степень сульфатирования при этом составляет ~6%, что соответствует приблизительно наличию одной сульфогруппы на дисахаридное звено макромолекулы κ-КГ [16] (рис. 1).
В целях увеличения водорастворимости посредством оптимизации молекулярно-массовых характеристик исходного κ-КГ в [18] была проведена его частичная щелочная деполимеризация, в результате которой получены образцы деполимеризованного каррагинана (κ-КГ-ДП) с Mw 1010 кДа, Mn 565 кДа, довольно широким молекулярно-массовым распределением и полидисперсностью 1.79, используемые в дальнейшем для синтеза нанокомпозита. Синтез Au0-содержащего нанокомпозита осуществляли в водной среде в соответствии с разработанной ранее методикой, в основе которой лежит использование природных полисахаридов (арабиногалактана, галактоманнана и κ-КГ) одновременно в качестве как восстановителя ионов металла (в частности Au+3) до нуль-валентного состояния, так и стабилизатора формирующихся наночастиц [20]. Сам синтез при этом запускается сдвигом рН реакционной среды в щелочную область с параллельным нагревом до 70°С реакционной среды. Полисахарид в нанокомпозите Au0НЧ/κ-КГ-ДП вследствие деструкционных процессов имеет молекулярную массу Мw 129 кДа и Mn 96 кДа и становится более узкодисперсным (1.35), чем взятый для синтеза исходный κ-КГ-ДП. Следует предположить, что κ-каррагинан достаточно легко подвергается деструкционному процессу щелочной деполимеризации вследствие наличия β-(1→4)-гликозидных связей и регулярного линейного строения [20]. При этом необходимость избытка гидроксид-анионов в реакционной среде для запуска синтеза нанокомпозита, вероятно, обусловлена их непосредственным участием в генерации дополнительных восстанавливающих фрагментов в результате параллельного протекания в реакционной среде при повышенной температуре реакции щелочного пилинга полисахарида с образованием молекул восстанавливающих моносахаров. Кроме того, весьма вероятно, что гидроксид-анионы участвуют в связывании протонов, выделяющихся в результате окислительно-восстановительной реакции [16, 20, 21]. Результатом данного одностадийного синтеза является получение нанокомпозита Au0НЧ/κ-КГ-ДП, представляющего собой наночастицы нуль-валентного золота (в количестве 2.9% от массы всего композита), стабилизированные полисахаридной матрицей κ-КГ-ДП.
Согласно данным просвечивающей электронной микроскопии (ПЭМ) нанокомпозит Au0НЧ/κ-КГ-ДП формируется в виде распределенных в полисахаридной матрице κ-КГ-ДП-частиц с формой, приближенной к сферической (рис. 2а). Размер наночастиц при этом варьирует в интервале 6–20 нм (рис. 2б) со средним значением 10.4 нм. Приближенность формы наночастиц к сферической, вероятно, обусловлена стремлением к самопроизвольному снижению поверхностной энергии формирующихся частиц и отсутствием в реакционной среде условий для их анизотропного роста [22, 23].
Рис. 2.
Микрофотография (а) и распределение дисперсности наночастиц в композите Au0НЧ/κ-КГ-ДП (2.9% Au) (б). Спектр поглощения 0.1%-ного водного раствора нанокомпозита Au0НЧ/κ-КГ-ДП (2.9% Au) (в). На вставке представлена спектральная зависимость его коэффициента поглощения в координатах Tauc.
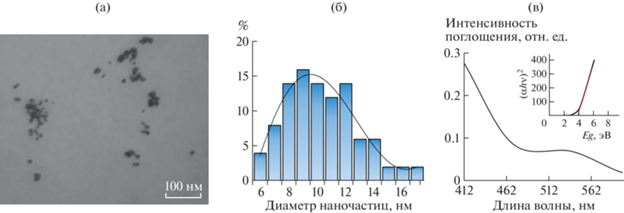
Спектр поглощения 0.1%-ного водного раствора полученного нанокомпозита Au0НЧ/κ-КГ-ДП характеризуется наличием одного интенсивного максимума плазмонного поглощения в области 540 нм, обусловленного коллективными колебаниями электронов проводимости наночастиц золота, свидетельствуя о сферической форме и нуль-валентном характере присутствующих в составе нанокомпозита частиц золота (рис. 2в).
Исследование водного раствора κ-КГ-ДП методом ДРС позволило установить, что этот коллоид в распределении интенсивности рассеяния характеризуется наличием одной фракции достаточно крупных (Rh 56-112 нм) частиц (рис. 3а). При этом переход к числовому распределению Rh частиц сопровождается сохранением мономодального характера распределения Rh в образце κ-КГ-ДП. Известно, что насыщенность макромолекул полисахаридов (в том числе, κ-КГ) гидроксильными группами способствует вовлечению их в образование водородных связей, а также их участию в ван-дер-ваальсовых взаимодействиях даже в хороших растворителях, что неизбежно приводит к образованию прочных ассоциатов и метастабильных агрегатов [24]. В данном случае присутствие в водном растворе κ-КГ-ДП достаточно крупных частиц со средним значением Rh 70 нм, вероятно, обусловлено агрегационными процессами между его макромолекулами в растворе [25]. Отметим, что характер распределения Rh частиц в полученном нанокомпозите Au0НЧ/κ-КГ-ДП (2.9% Au) кардинальным образом отличается от исходного κ-КГ-ДП, свидетельствуя о преобразовании макромолекул каррагинана в процессе синтеза нанокомпозита. Так, исследование водных растворов полученного нанокомпозита Au0НЧ/κ-КГ-ДП (2.9% Au) методом ДРС позволило установить, что этот коллоид в распределении интенсивности рассеяния частиц характеризуется наличием трех фракций (рис. 3б).
Рис. 3.
Распределение значений интенсивности и числовое распределение Rh частиц в образцах исходного полисахарида κ-КГ-ДП (а) и нанокомпозита Au0НЧ/κ-КГ-ДП (2.9% Au) (б).
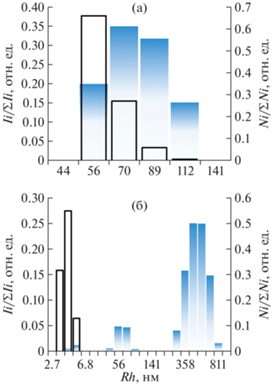
Предположительно, первая быстрая фракция частиц с Rh 4.3–5.4 нм соответствует либо индивидуальным наночастицам золота небольшого размера (6 нм согласно ПЭМ), стабилизированным слоем макромолекул κ-КГ-ДП, либо индивидуальным макромолекулам κ-каррагинана. Однако отсутствие быстрой фракции частиц с данным диапазоном Rh в распределении, полученном от исходного полисахарида κ-КГ-ДП, не позволяет в полной мере утверждать о принадлежности быстрой фракции частиц, выделенной в образце нанокомпозита, исключительно макромолекулам полисахарида. Фракция частиц со значением Rh 44–89 нм, в свою очередь, может соответствовать либо более крупным наночастицам золота (8–20 нм по данным ПЭМ в режиме темного поля), стабилизированным несколькими слоями полисахарида, либо небольшим ассоциатам полисахарид-стабилизированных наночастиц Au0 быстрой фракции. Медленная фракция частиц, Rh которых варьирует в интервале 280–811 нм, вероятно, соответствует присутствующим в растворе нанокомпозита агрегатам наночастиц, образовавшимся в водном растворе композита, вследствие активного вовлечения функциональных групп κ-КГ в образование водородных связей и ван-дер-ваальсовых взаимодействий как между “свободными” (не участвующими в стабилизации поверхности наночастиц) макромолекулами κ-каррагинана, так и макромолекулами на поверхности наночастиц.
Переход к числовому распределению Rh частиц идентифицируется присутствием только одной фракции мелких (Rh 3.4–5.4 нм) частиц, преобладающих в растворе. Отсутствие двух других фракций частиц, предположительно соответствующих κ-КГ-ДП-стабилизированным агломератам или скоплениям Au0НЧ, может быть обусловлено их небольшим количеством в объеме анализируемого образца [26].
ζ-потенциал водного раствора нанокомпозита исходного κ-КГ-ДП является достаточно высоким – 36.7 мВ, вероятно, вследствие его полианионной природы. Тогда как введение в его состав наночастиц Au0 с формированием нанокомпозита Au0НЧ/κ-КГ-ДП (2.9% Au) сопровождается увеличением ζ-потенциала до –48.7 мВ вследствие ионизации поверхности твердой фазы Au0 в водном растворе и формирования двойного электрического слоя на поверхности частиц, предотвращающего тем самым их агрегацию [27].
Влияние золотосодержащего нанокомпозита Au0НЧ/κ-КГ-ДП, а также κ-КГ и κ-КГ-ДП (для сравнения) на свертывающую систему крови исследовали измерением АПТВ и тромбинового времени, которые являются стандартизированными коагуляционными пробами, чувствительными к различным плазменным дефектам свертывания, особенно к дефициту XII, XI, IX, VIII факторов [28]. Определение АПТВ позволяет оценить общую сохранность функций факторов свертывания, выявить дефицит или нарушение функций некоторых факторов свертывания и контактных факторов внутреннего (VIII, IX, XI, XII, прекалликреина, высокомолекулярных кининогенов) и общего пути свертывания (включая факторы II, V, X и I) [29, 30]. Тогда как ТВ позволяет определить продолжительность превращения фибриногена в фибрин в цитратной плазме крови после добавления в нее экзогенного тромбина и кальция [31]. Скорость образования фибринового сгустка зависит главным образом от количества и функциональной полноценности фибриногена и присутствия в крови антикоагулянтов [32]. Увеличение значения АПТВ обусловлено торможением внутреннего пути свертывания цитратной бедной тромбоцитами плазмы, в то время как увеличение значения ТВ указывает на ингибирование активации фибриногена экзогенным тромбином. Для потенциального антикоагулянта необходимым является удлинение времени свертывания (АПТВ) в 2–2.5 раза по сравнению с контролем (в отсутствие антикоагулянта время свертывания – 28–34 с), а время образования сгустка (ТВ) под влиянием антикоагулянта должно вырасти в 4–5 раз при контрольных значениях 16–20 с [33, 34].
Согласно полученным данным все исследуемые образцы Au0НЧ/κ-КГ-ДП, κ-КГ и κ-КГ-ДП увеличивают значения АПТВ и ТВ, проявляя выраженное концентрационно-зависимое антикоагулянтное действие (рис. 4).
Рис. 4.
Диаграмма зависимости АПТВ (а) и ТВ (б) от концентрации нанокомпозита Au0НЧ/κ-КГ-ДП, κ‑КГ и κ-КГ-ДП.
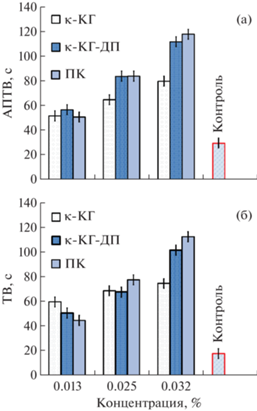
Выраженное изменение величин АПТВ и ТВ под действием κ-КГ, κ-КГ-ДП и Au0НЧ/κ-КГ-ДП, предположительно, свидетельствует об их влиянии как на внутренний, так и на внешний путь свертывания крови. Исследование концентрационной зависимости антикоагулянтной активности κ-КГ и κ-КГ-ДП и Au0НЧ/κ-КГ-ДП позволило определить адекватную концентрацию данных объектов, равную 0.025%, так как именно при этой концентрации наблюдались значения АПТВ и ТВ в диапазоне 65–84 и 68–78 с соответственно. В растворах с концентрацией 0.032% величины АПТВ и ТВ варьировали в интервале 80–118 и 68–113 с соответственно, т.е. время свертывания было удлинено более чем 2.5 и 5 раз, требуемого для потенциального антикоагулянта. При наименьшей концентрации растворов, равной 0.013%, удлинение величин АПТВ и ТВ оказалось меньше требуемого значения (рис. 3).
Известно, что антикоагулянтная активность полианионных сульфатированных полисахаридов во многом зависит от наличия и количества сульфатных групп в их составе, которые могут связываться с аминокислотными остатками гепаринсвязывающих протеинов. Также известно, что антикоагулянтная активность сульфатированных галактанов зависит от их структуры, в том числе от молекулярной массы, так как механизм их антикоагулянтного действия включает в себя стадию образования комплекса “ингибитор–тромбин”, при этом галактан выступает в качестве связующего компонента данного комплекса. Неизменность исходного количества отрицательно заряженных сульфоэфирных групп в составе и строении молекул κ-КГ-ДП и нанокомпозита Au0НЧ/κ-КГ-ДП по сравнению с κ-КГ определяет сохранение их антикоагулянтной активности. Тогда как имеющееся отличие величин молекулярной массы данных объектов, вероятно, носит несущественный характер и не обусловливает каких либо заметных изменений антикоагулянтной активности. Введение Au0НЧ в полисахаридную матрицу κ-КГ-ДП в количестве 2.9% не приводит к изменению его антикоагулянтной активности, что указывает на преимущественно полисахарид-опосредованность данного вида активности и безопасность его использования для синтеза наноматериалов.
ЗАКЛЮЧЕНИЕ
Таким образом, с использованием восстанавливающего и стабилизирующего потенциала природного сульфатированного полисахарида κ-каррагинана получена биологически активная наноструктурированная биополимерная система “Au0НЧ/полисахарид”. С использованием комплекса современных методов исследования охарактеризованы состав полученного нанокомпозита и его наноморфологические характеристики (размерное распределение, средний размер, форма наночастиц, тип распределения). Впервые установлено, что нанокомпозит Au0НЧ/κ-КГ-ДП проявляет выраженную антикоагулянтную активность, влияя на внутренний и внешний путь свертывания крови на уровне полисахаридной матрицы каррагинана без каких-либо эффектов Au0НЧ. Продемонстрировано, что перевод золота в нанодисперсное состояние и стабилизация его κ-каррагинаном приводят к расширению диапазона его биологической активности, что обусловливает перспективность применения наноматериалов на его основе в биомедицинских приложениях.
В экспериментах использовали материалы и оборудование БАЦКП Иркутского института химии им. А.Е. Фаворского СО РАН. Микрофотографии образца получены на оборудовании ЦКП “Ультрамикроанализ” Лимнологического института СО РАН.
Список литературы
Burketova L., Martinec J., Siegel J. et al. // Biotechnol. Adv. 2022. V. 58. P. 107929. https://doi.org/10.1016/j.biotechadv.2022.107929
Ahmad Z., Tahseen S., Wasi A. et al. // Nanomaterials. 2022. V. 12. P. 2667. https://doi.org/10.3390/nano12152667
Graily-Moradi F., Maadani Mallak A., Ghorbanpour M. Biogenic Synthesis of Gold Nanoparticles and Their Potential Application in Agriculture. Singapore: Springer, 2020. P. 11. https://doi.org/10.1007/978-981-15-2985-6_11
Shamaila S., Zafar N., Riaz S. et al. // Nanomaterials (Basel). 2016. V. 14. P. 71. https://doi.org/10.3390/nano6040071
Dutta P.P., Bordoloi M., Gogoi K. et al. // Biomed Pharmacother. 2017. V. 91. P. 567. https://doi.org/10.1016/j.biopha.2017.04.032
Elbagory A.M., Hussein A.A., Meyer M. // Int. J. Nanomedicine. 2019. V. 19. P. 9007. https://doi.org/10.2147/IJN.S216972
Rajeshkumar S. // J. Genet. Eng. Biotechnol. 2016. V. 14. P. 195. https://doi.org/10.1016/j.jgeb.2016.05.007
Dykman L.A. // Expert Rev. Vaccines. 2020. V. 19. P. 465. https://doi.org/10.1080/14760584.2020
Sayed-Pathan N.I., Jadon R.S., Gajbhiye K.R., Gajbhiye V. Tailored gold nanoparticles for improved control over drug release. Academic Press, 2022. P. 283. https://doi.org/10.1016/B978-0-12-824456-2.00008-4.10
Suh K.S., Lee Y.S., Seo S.H. et al. // Biol. Trace Elem. Res. 2013. V. 153. P. 428. https://doi.org/10.1007/s12011-013-9679-7
Deb S., Patra H.K., Lahiri P. et al. // Nanomedicine. 2011. V. 7. P. 376. https://doi.org/10.1016/j.nano.2011.01.007
Ilinskaya A.N., Dobrovolskaia M.A. // Nanomedicine (London). 2013. V. 8. P. 969. https://doi.org/10.2217/nnm.13.49
Akchurin G.G., Ivanov A.N., Kirichuk V.F. et al. // Plasmonics in Biology and Medicine. 2008. V. 13. P. 68690V. https://doi.org/10.1117/12.765076
Siddiqi K.S., Husen A. // Nanoscale Res. Lett. 2016. V. 11. P. 400. https://doi.org/10.1186/s11671-016-1607-2
Li N., Chen Y., Zhang Y.M. et al. // Sci Rep. 2014. V. 4. P. 4164. https://doi.org/10.1038/srep04164
Lesnichaya M.V., Sukhov B.G., Aleksandrova G.P. et al. // Carbohydr. Polym. 2017. V. 175. P. 18. https://doi.org/10.1016/j.carbpol.2017.07.040
Лесничая М.В., Сухов Б.Г. // Российские нанотехнологии. 2021. Т. 16. С. 222. https://doi.org/10.1134/S1992722321020096
Александрова Г.П., Боймирзаев А.С., Лесничая М.В. и др. // Журн. общей химии. 2015. Т. 85. С. 317. https://doi.org/10.1134/S107036321502022X
Лесничая М.В., Александрова Г.П., Сухов Б.Г. и др. // Химия природных соединений. 2013. Т. 49. С. 347. https://doi.org/10.1007/s10600-013-0625-x
Грищенко Л.А., Медведева С.А., Александрова Г.П. и др. // Журн. общей химии. 2006. Т. 76. С. 1159. https://doi.org/10.1134/S1070363206070189
Лесничая М.В., Александрова Г.П., Феоктистова Л.П. и др. // Докл. РАН. 2011. Т. 440. С. 639. https://doi.org/10.1134/S0012500811100065
Оленин А.Ю., Лисичкин Г.В. // Успехи химии. 2011. Т. 80. С. 635. https://doi.org/10.1070/RC2011v080n07ABEH004201v
Nguyen T.K., Maclean N., Mahiddine S. Mechanisms of nucleation and growth of nanoparticles in solution // Chem. Rev. 2014. V. 114. P. 7610. https://doi.org/10.1021/cr400544s
Casillo A., Fabozzi A., Russo Krauss I. et al. // Biomacromolecules. 2021. V. 12. P. 1445. https://doi.org/10.1021/acs.biomac.0c01659
Burchard W. Light Scattering from Polysaccharides as Soft Materials. Dordrecht: Springer, 2008. https://doi.org/10.1007/978-1-4020-4465-6_9
Хлебцов Б.Н., Хлебцов Н.Г. // Коллоидный журнал. 2011. Т. 73. С. 106.
Carneiro-da-Cunha M.G., Cerqueira M.A., Souza B.W.S. et al. // Carbohydrate Polymers. 2011. V. 5. P. 522. https://doi.org/10.1016/j.carbpol.2011.03.001
Capoor M.N., Stonemetz J.L., Baird J.C. et al. // PLoS One. 2015. V. 11. P. e0133317. https://doi.org/10.1371/journal.pone.0133317
Bronic A., Margetic S., Coen Herak D. et al. // Biochem Med (Zagreb). 2021. 15. P. 020708. https://doi.org/10.11613/BM.2021.020708
Rasmussen K.L., Philips M., Tripodi A. et al. // Eur. J. Haematol. 2020. V. 104. P. 519. https://doi.org/10.1111/ejh.13394
Levy J.H., Szlam F., Wolberg A.S. et al. // Clin. Lab. Med. 2014. V. 34. P. 453. https://doi.org/10.1016/j.cll.2014.06.005
Kong C., Xu B., Qiu G. et al. // Int. J. Nanomedicine. 2022. V. 17. P. 5391. https://doi.org/10.2147/IJN.S373282
Urban P., Liptrott N.J., Bremer S. // Wiley Interdiscip. Rev. Nanomed Nanobiotechnol. 2019. p. e1546. https://doi.org/10.1002/wnan.1546
de la Harpe K.M., Kondiah P.P.D., Choonara Y.E. et al. // Cells. 2019. V. 8. P. 1209. https://doi.org/10.3390/cells8101209
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии