Российские нанотехнологии, 2023, T. 18, № 6, стр. 801-809
Идентификация наночастиц алмаза детонационного синтеза и выявление их локализации в макрофагах человека и легких мышей
Е. К. Тарасова 1, *, М. В. Ерохина 1, 2, А. Г. Масютин 1, 2, И. В. Бочарова 1, Р. Ю. Яковлев 3, А. А. Кузьмин 4, Л. Н. Лепеха 1
1 Центральный научно-исследовательский институт туберкулеза
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 ООО “Смарт Полиморф Технолоджиз”, Инновационный центр “Сколково”
Москва, Россия
4 ЗАО “Алмаз Фарм”
Москва, Россия
* E-mail: shalioto6@gmail.com
Поступила в редакцию 19.09.2022
После доработки 23.11.2022
Принята к публикации 23.11.2022
Аннотация
Получены модифицированные функциональными группами наноалмазы для адресной доставки лекарственных препаратов. Определен набор методов для идентификации наноалмазов в биологическом материале и определена их локализация в макрофагах человека и клетках легких мышей. Показано, что в легких мышей через 7 сут после введения наноалмазы интернализуются эндотелиоцитами и интерстициальными макрофагами. Как в культуре макрофагов человека, так и в клетках легких наноалмазы локализуются в фагосомах/фаголизосомах. В макрофагах человека и клетках легких мышей наноалмазы не вызывают патологических изменений. Полученные результаты позволяют рассматривать наноалмазы в качестве перспективной платформы-носителя для доставки лекарственных препаратов в первую очередь в макрофаги интерстиция респираторного отдела легких, что является актуальным при таком заболевании, как туберкулез.
ВВЕДЕНИЕ
За последние годы существенно вырос интерес к такой области медицины, как адресная доставка лекарственных и биологически активных веществ [1]. Так называют процесс, при котором вещества закрепляются на особом носителе и доставляются непосредственно к целевому органу или ткани. Адресная доставка позволяет увеличить концентрацию лекарственного препарата в требующем лечения органе, продолжительность и эффективность действия лекарственного вещества и снизить его побочные эффекты. Данный подход особенно широко применяется в терапии опухолевых заболеваний [2] и является перспективным направлением для разработки препаратов противотуберкулезной терапии [3].
Одним из ключевых факторов эффективности адресной доставки лекарственного агента является правильный подбор платформы-носителя. Подходящими по физическим (размер, форма, заряд) и химическим параметрам (возможность функционализации поверхности) носителями для этой цели являются липосомы, полимерные и металлические наночастицы, дендримеры и другие объекты [4]. В их число входят и наноалмазы (НА), которые представляют особый интерес для исследователей благодаря своим физико-химическим свойствам.
Наноалмазы – это наноразмерные (4–100 нм) округлые частицы неправильной формы, имеющие кристаллическую структуру алмаза. Одним из преимуществ НА по сравнению с другими платформами является низкая токсичность для клеточных культур и живых организмов (мышей) [5, 6]. Другое привлекательное свойство НА – возможность направленно функционализировать поверхность частиц для дальнейшего закрепления на ней лекарственных и биологически активных веществ [7].
Функционализация – изменение химического состава поверхности НА – также может быть весьма разнообразна в зависимости от целей эксперимента [8]. Так, для адсорбции белков и нуклеиновых кислот могут использоваться НА диаметром как 80–100 нм [9], так и 5 нм [10].
Для биомедицинского применения рассматривают детонационные НА и НА, произведенные высокотемпературным методом при высоком давлении [11]. Первый метод низкозатратный и имеет высокий выход, получаемые наночастицы имеют размер менее 10 нм и имеют низкую интенсивность автофлуоресценции. Второй метод позволяет получать НА в широком диапазоне размеров (до сотен микрометров) с низкой плотностью дефектов кристаллической решетки, однако имеет низкий выход и весьма дорогостоящ [12].
Распределение НА в организме является важным объектом интереса для научного сообщества. Так, накопление НА в органах мыши исследовалось изотопно-индикаторным методом [5]. Через 2 ч после внутритрахейного введения суспензии НА (4 мг/кг) наночастицы обнаруживались в печени, сердце, селезенке и легких. Методом трансмиссионной электронной микроскопии высокого разрешения было показано, что через 30 мин после внутривенной инъекции раствора НА (20 мг/кг) мышам наночастицы выявляются преимущественно в печени и легких, а также в почках и селезенке [13].
Отдельно опубликованы исследования о накоплении, выведении и токсичности НА, выполненные на легких мышей [14]. В работе использовали детонационные НА диаметром 4 и 50 нм, полученные путем размалывания макрокристаллов, синтезированных высокотемпературным методом при высоком давлении. Было показано, что оба типа НА не токсичны для мышей при внутритрахейном введении и наночастицы обнаруживаются в легких даже спустя 28 дней после введения. Это позволило предположить, что носители лекарств на основе НА могут быть особенно эффективны при терапии легочных заболеваний. Однако в данной работе использовались методы световой микроскопии, которые при изучении наночастиц могут иметь низкую репрезентативность из-за малых размеров искомых объектов. Следовательно, вопрос локализации НА в легких нуждается в дальнейшем рассмотрении с применением более точных методов детекции НА. Такими, в частности, являются методы стандартной и аналитической электронной микроскопии.
Известно, что при поступлении в организм инородных частиц в первую очередь на них реагируют нейтрофилы и макрофаги, которые осуществляют фагоцитоз данных частиц и их последующее разрушение [15]. В норме в легких существуют две основных популяции резидентных макрофагов – бронхиальные/альвеолярные и интерстициальные (гистиоциты). Также в интерстиций мигрируют из крови макрофаги воспаления при развитии патологического процесса [16]. Для оценки точности адресной доставки необходимо быть уверенными, что после введения в организм потенциальная платформа-носитель выявляется и накапливается в органах и клетках-мишенях. Кроме того, взаимодействие НА с макрофагами человека нуждается в дополнительном изучении, в частности недостаточно данных о влиянии НА с положительным поверхностным потенциалом, так как большинство работ посвящено НА, функционализированным кислотными группами [17]. Таким образом, цель работы – идентифицировать НА детонационного синтеза и определить их локализацию в макрофагах человека и в клетках легких мышей в моделях in vitro и in vivo.
МАТЕРИАЛЫ И МЕТОДЫ
Наноалмазы. В работе использовали НА, произведенные методом детонационного синтеза – детонационный наноалмаз (ДНА) марки УДА-ТАН (ФГУП СКТБ Технолог, Санкт-Петербург, Россия). Для применения в биомедицинских целях компанией ЗАО “Алмаз Фарм” выполнена стандартизация ДНА. Стандартизация наночастиц заключалась в трех последовательных стадиях. На первой проводили дополнительную очистку ДНА. Она заключалась в последовательной промывке 1 М соляной кислотой и 1 М гидроксидом натрия для удаления с поверхности ионов железа, нитрат-анионов и серосодержащих соединений, в том числе сульфатов. После очистки наночастицы промывали большим количеством воды и высушивали [18].
На второй стадии проводили модифицирование поверхности частиц ДНА путем газофазной обработки порошка ДНА водородом при температуре 800°С в течение 2 ч. В результате обработки получали НА, имеющие бифункциональную поверхность из –ОН- и –Н-групп (ДНА-Н) [19].
На третьей стадии диспергировали ДНА-Н в воде с помощью ультразвукового диспергатора (Мэлфиз, Россия) и удаляли крупную фракцию агрегатов ДНА-Н центрифугированием при 6000 g в течение 10 мин.
По данным производителей первичные НА имеют размеры 4–6 нм, размеры агрегатов ДНА-Н в воде составляли 50 нм. Гидрозоль представлял собой непрозрачную серую жидкость. Гидрозоль на просвет был прозрачным, голубовато-коричневого цвета. Стандартизованный гидрозоль частиц ДНА-Н использовали в дальнейших биомедицинских исследованиях.
Культивирование клеток. В качестве модельного объекта использовали клеточную линию THP-1 (Российская коллекция клеточных культур, Санкт-Петербург, НИИ цитологии). Клетки культивировали в среде RРМI-1640 (PanEco company, Москва, Россия) с добавлением 2 мМ L-глутамина (PanEco company, Москва, Россия) и 10% эмбриональной телячьей сыворотки (HyClone, США). Инкубацию клеток проводили при 37°С и 5% СО2. Экспериментальная концентрация клеток составляла 500 000 клеток на 1 мл среды.
Макрофагальную дифференцировку индуцировали добавлением в среду культивирования 10–7 М форболового эфира (Sigma, США). Наночастицы в виде водной суспензии (50 мкг/мл) добавляли к клеткам через 72 ч дифференцировки согласно ранее полученным данным о фагоцитарной активности макрофагов ТНР-1 [20]. Клетки инкубировали с наночастицами в течение 10 сут.
Введение наночастиц экспериментальным животным. Была подготовлена гидрозоль ДНА-Н с концентрацией 4 мг/мл в физиологическом растворе. Введение выполняли на мышах линии BALB/c однократно, медленно, в латеральную хвостовую вену, в объеме 200 мкл на мышь. В экспериментальной группе было семь, в контрольной – пять животных. Выведение животных из эксперимента проводилось через 7 сут после введения наночастиц.
Трансмиссионная электронная микроскопия (ТЭМ). Для морфологического и химического анализа наночастиц, локализованных в макрофагах, клетки фиксировали 2.5%-ным глутаровым альдегидом (Ted Pella, INC) на 0.1 М фосфатном буфере в течение 2 ч, затем дофиксировали 1%-ным раствором тетраоксида осмия (OsO4) в течение 2 ч при +4°С. Обезвоживание образцов проводили в спиртах восходящей концентрации и ацетоне по стандартной методике [21]. После обезвоживания образцы заключали в эпоксидную смолу. Срезы с блоков получали на ультрамикротоме LEICA UCT 4 (Leica, Германия) и окрашивали по Рейнольдсу (полное контрастирование). Для первичного поиска наночастиц на ультратонких срезах отдельные образцы не подвергали контрастированию по Рейнольдсу (неполное контрастирование). Полученные препараты исследовали с помощью аналитического электронного микроскопа JEM-2100 (Jeol, Япония). Поиск наночастиц проводили в клетках респираторного отдела.
Дифракция электронов. Ультратонкие срезы клеток и легких анализировали с помощью электронного микроскопа JEM-2100, 200 кВ, non-corrected, катод LaB6 (Jeol, Япония). Использовали камеру Gatan FT1000 2k (Gatan, США). Глубина камеры – 20 см. Дифракцию электронов анализировали у выявленных электронно-плотных включений в клетках респираторного отдела.
Стандартная гистология. Образцы фиксировали в 10%-ном забуференном формалине (Биовитрум, Россия). Дегидратация гистологического материала осуществлялась по стандартному протоколу в серии спиртов от 70 до 96%, 100%-ный этанол был заменен на изопропиловый спирт. После изопропилового спирта образцы были заключены в парафин “Hystomix” (Биовитрум, Россия). Срезы толщиной 5 мкм получали на микротоме Leica (Германия). Препараты окрашивали гематоксилином (по Карацци) и эозином (0.1%-ный водный раствор) и заключали в канадский бальзам. В дальнейшем анализ изображений проводили на световом микроскопе Leica DM 1000 LED с объективами N Plan 4×, 20×, 40× и 100×/1.25 oil.
Полутонкие срезы. Для полутонких срезов использовали материал, подготовленный для электронной микроскопии. Срезы толщиной 1 мкм получали на ультратоме Leica EM UC7 и анализировали на световом микроскопе Leica DM1000 (Leica, Германия) с использованием дифференциальной интерференционно-контрастной микроскопии (ДИК).
РЕЗУЛЬТАТЫ
Характеристика наноалмазов. Методом ТЭМ были получены изображения скоплений и индивидуальных НА (рис. 1а). Наночастицы округлой, неправильной формы с характерной для кристаллических объектов исчерченностью (рис. 1б). Также была получена электронограмма НА (рис. 1в). Кольца на электронограмме четкие, соответствуют своим положениям, характерным для алмаза [22]. Размер наночастиц составил 3–10 нм (было измерено 50 наночастиц на ТЭМ-изображениях).
Рис. 1.
Экспериментальные НА: а – конгломерат частиц, б – индивидуальные наночастицы, в – дифракция электронов, стрелками показаны дифракционные кольца (ТЭМ).

Анализ захвата и локализации наноалмазов в макрофагах ТНР-1. Методом ДИК показано, что после инкубации макрофагов с НА в течение 10 сут клетки сохраняют свою морфологию – в культуре выявляются клетки округлой формы, веретеновидные и хорошо распластанные, в цитоплазме определяются многочисленные включения (рис. 2а, 2б).
Рис. 2.
Локализация наноалмазов в макрофагах ТНР-1: а – макрофаги ТНР-1 после трех суток дифференцировки, б – макрофаги ТНР-1 после 10 сут инкубации с НА, в – НА возле поверхности макрофага ТНР-1, г–е – НА в момент захвата макрофагом ТНР-1; а, б – ДИК, в–е – ТЭМ, в – полное контрастирование, г, е – неполное контрастирование.
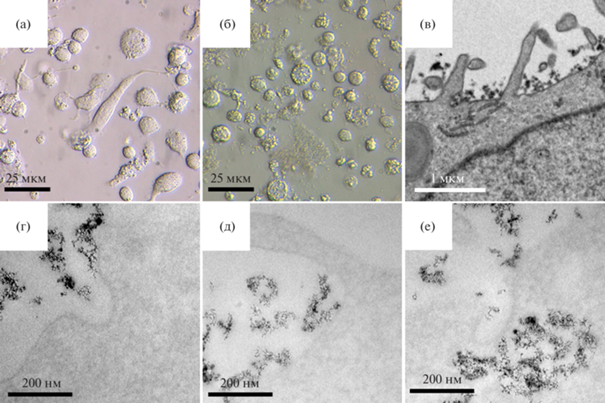
При анализе ультраструктуры макрофагов были обнаружены многочисленные филоподии, окружающие наночастицы (рис. 2в, 2д), и инвагинации плазматической мембраны (рис. 2г, 2е), внутри которых выявляются наночастицы. Присутствуют также скопления наночастиц, расположенные внеклеточно (рис. 2в, показано стрелкой).
Цитоплазма клеток содержит многочисленные фагосомы/фаголизосомы с наночастицами (рис. 3). Вариантов иной внутриклеточной локализации НА – в других органеллах или свободно в цитоплазме – выявлено не было.
Рис. 3.
Локализация наноалмазов в макрофагах ТНР-1: а – общий вид макрофага, стрелками показаны фагосомы с НА; б, в – фагосомы с НА, стрелками показаны границы фагосом. ТЭМ, полное контрастирование.

Отметим, что клетки сохраняют свои ультраструктурные особенности после инкубации с НА в течение 10 сут, и признаки патологических изменений на ультраструктурном уровне не были обнаружены.
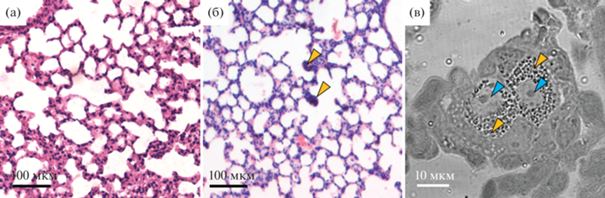
Анализ локализации наноалмазов в легких мышей. При гистологическом исследовании показано, что респираторный отдел легких экспериментальных животных сохраняет воздушность, не имеет признаков эмфиземы и ателектаза (рис. 4а, 4б). После введения наночастиц в легких мышей определяются очаговые кровоизлияния, выход отдельных эритроцитов во внутриальвеолярное пространство (рис. 4б, желтые стрелки). Межальвеолярные перегородки не утолщены. В интерстиции альвеол выявляются крупные скопления темного цвета (рис. 4б). На полутонких срезах при больших увеличениях такие скопления можно идентифицировать как НА (рис. 4в, желтые стрелки). При этом анализ при помощи световой микроскопии не позволяет точно идентифицировать клетки, в которых локализованы наночастицы, и подтвердить их химическую природу.
Рис. 4.
Респираторный отдел легких мыши после введения наноалмазов: а – контроль, б, в – темные включения в интерстиции респираторного отдела, 7 дней после введения. Желтыми стрелками показаны включения, голубыми – ядра гистиоцитов; а, б – окрашивание гематоксилин-эозином, в – ДИК-микроскопия, полутонкий срез.
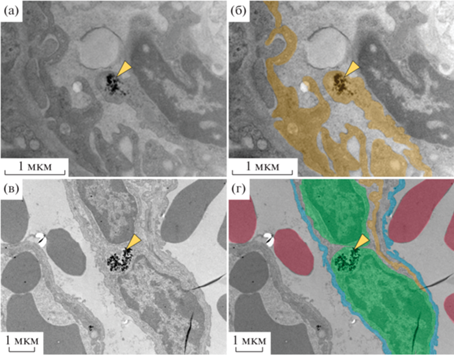
Проведенный ультраструктурный анализ показал, что наночастицы образуют электронно-плотные компактные агрегаты в эндотелиальных клетках и в гистиоцитах (интерстициальные макрофаги) (рис. 5).
Рис. 5.
Наночастицы в цитоплазме эндотелиальной клетки (а, б) и гистиоците, 7 дней после введения (в, г). Зеленым цветом показан гистиоцит, желтым –эндотелиоцит, красным – эритроциты, голубым – альвеолоцит. Стрелками показаны скопления наночастиц. ТЭМ, неполное контрастирование.
Детекция наноалмазов в макрофагах THP-1 и легких мышей. Детекция НА в биологических образцах сопряжена с определенным количеством трудностей. Из-за размеров НА – 3–10 нм – наночастицы можно различить только при помощи метода электронной микроскопии высокого разрешения. При исследовании на микрофотографиях скопления НА представляют собой электронно-плотные кластеры. Уточнить их природу возможно только с помощью метода дифракции электронов. На рис. 6 и 7 приведены примеры анализа кристаллической структуры и химической природы электронно-плотных включений, выявляемых в макрофагах (рис. 6) или в легких мышей (рис. 7) после введения НА. Все полученные электронограммы электронно-плотных включений внутри фагосом совпадают с эталонной электронограммой НА, приведенной на рис. 1в. Это подтверждает, что все выявленные включения в фагосомах/фаголизосомах являются НА.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Методами световой и электронной микроскопии установлено, что НА выявляются внутри фагосом/фаголизосом макрофагов человека и в клетках (эндотелии и гистиоцитах) легких мышей. В модели in vitro показано, что макрофаги человека захватывают наночастицы двумя способами. Первый заключается в образовании филоподий, второй – в формировании инвагинаций плазматической мембраны. Полученные результаты согласуются с данными [23] – макрофаги поглощают НА путем клатрин-зависимого эндоцитоза, для которого характерна электронно-микроскопическая картина с образованием инвагинаций плазматической мембраны. В то же время образование филоподий макрофагами и захват ими скоплений НА были продемонстрированы в [24]. В упомянутых работах использовались НА диаметром до 100 нм, полученные высокотемпературным методом. Таким образом, независимо от размера НА и способа их получения наночастицы могут накапливаться в макрофагах в результате эндоцитоза.
Известно, что в результате эндоцитоза (и его разновидности – фагоцитоза) слияние фагосом с лизосомами происходит достаточно быстро (в течение 10 мин) [25], что не позволяет в рамках данной работы отличить фагосомы от фаголизосом. Отметим, что других вариантов внутриклеточной локализации экспериментальных НА обнаружено не было. В [26] была показана локализация НА размером 5–10 нм в цитоплазме вне мембранных органелл клеток.
Как показано на модели in vivo, в легких мышей наночастицы выявлялись в эндотелиальных клетках и интерстициальных макрофагах спустя 7 дней после введения. Вариантов локализации НА в других клетках легких выявлено не было. Определить скопления наночастиц в ткани возможно на световом уровне: они представляют собой темные образования, выделяющиеся на общем фоне в интерстиции альвеолярных перегородок. При большом увеличении (более 1000 раз) методом ДИК возможно различить отдельные конгломераты наночастиц внутри таких скоплений, которые характеризуются специфическим блеском и светопреломлением.
Накопление наночастиц в макрофагах и эндотелиоцитах связано со способностью этих клеток к эндоцитозу/фагоцитозу. Эндотелиальные клетки способны к эндоцитозу самых разнообразных субстратов: апоптотических телец, холестериновых и фибриновых сгустков, латексных бусин [27], а также к трансцитозу [28].
На увеличение проницаемости сосудов легких в результате введения НА указывает выход эритроцитов в альвеолярное пространство. В эксперименте на клеточных культурах – первичной культуре неонатальных человеческих эндотелиоцитах микроциркуляторного русла [29] было показано, что НА могут изменять проницаемость монослоя, имитирующего эндотелий в культуре. Через 1 ч после контакта с НА между клетками экспериментальной модели эндотелия формировались бреши, количество которых прямо зависело от времени экспозиции и концентрации наночастиц и сопровождалось продукцией активных форм кислорода. Также вклад в увеличение такой проницаемости вносят поверхностные модификации НА – наибольшая проницаемость наблюдалась при использовании НА с аминогруппами, потенциал которых в водной среде положительный, наименьшая – с карбоксильными, потенциал которых в водной среде отрицательный. Это свойство НА предлагается использовать для повышения проницаемости сосудов в малигнизированной ткани для создания более высокой концентрации лекарственных препаратов.
В исследовании о накоплении, выведении и токсичности НА, выполненном на легких мышей (линия ICR, самцы), была использована модель внутритрахейного (хирургическим путем) введения НА (1 мг/кг в PBS) [14]. ДНА диаметром 4 нм выявлялись только на гистологических препаратах, окрашенных гематоксилином и эозином. Данный тип НА не приводит к появлению патологических изменений в легких мышей на гистологическом уровне ни через сутки, ни через 28 дней после введения. Анализ активности глутатиона (GSH) и малонового диальдегида (MDA) не выявил в эксперименте отличий от контрольных значений показателей. Это свидетельствует в пользу того, что НА в отличие от других углеродных наночастиц [30–32] не вызывают окислительный стресс в клетках легких. Отметим, что использованный в работе внутритрахейный метод введения наночастиц не обеспечивает достаточного проникновения наночастиц в альвеолы, в отличие от внутривенного, использованного в настоящей работе. Также делался акцент прежде всего на бронхиальные макрофаги как на клетки, в которых преимущественно выявляются наночастицы. Мы показали, что при однократном внутривенном введении через 7 сут наночастицы выявляются в клетках эндотелия и в интерстициальных макрофагах. Это свидетельствует, что НА захватываются из кровотока эндотелиоцитами, после чего поступают в интерстиций, где поглощаются гистиоцитами.
Известно, что легкие человека содержат в себе многочисленные включения разной природы [33]. Особенно это характерно для жителей городов и курильщиков. На электронных микрофотографиях визуально отличить такие включения от НА может быть затруднительно. Использованная в работе дифракция электронов показывает себя как единственный достоверный метод идентификации НА в биологическом материале. В то время как на гистологических срезах, изучаемых методом световой микроскопии и традиционной электронной микроскопии, скопления наночастиц могут быть неверно опознаны визуально, дифракция электронов подтверждает кристаллическую природу обнаруженных кластеров и надежно указывает на их принадлежность к НА в случае совпадения дифракционной картины.
ЗАКЛЮЧЕНИЕ
Имеющиеся сегодня данные позволяют предположить, что носители лекарств на основе НА могут быть безопасны при терапии легочных заболеваний. Для подтверждения этого тезиса необходимо провести оценку влияния НА на клетки легких, их накопления и выведения в течение длительного (90–180 дней) эксперимента как в норме, так и на фоне развития патологического процесса в модели in vivo. Такое исследование подтвердит безопасность использования НА как платформы для связывания лекарственных препаратов и позволит выявить их локализацию в клетках легких на фоне развития, в частности, туберкулезного воспаления. В дальнейшем необходимо будет ответить на вопрос о возможности связывания лекарственных веществ, применяемых при терапии легочных заболеваний, с НА, их влиянии на клетки легких и накоплении в разных их популяциях в зависимости от срока введения.
Авторы выражают благодарность сотрудникам межкафедральной лаборатории электронной микроскопии Биологического факультета МГУ им. М.В. Ломоносова за содействие в выполнении электронно-микроскопических исследований. Авторы хотят отметить вклад Николая Борисовича Леонидова, д.б.н., лауреата премии Правительства РФ, заслуженного изобретателя РФ, профессора кафедры фармацевтической технологии Рязанского государственного медицинского университета им. академика И.П. Павлова в развитие данного научного направления.
Работа выполнена в рамках государственного задания МГУ им. М.В. Ломоносова (проект № 121032300098-5); в рамках Соглашения о научном сотрудничестве № 1-2022 между МГУ им. М.В. Ломоносова и ЦНИИ туберкулеза, Договора о научном сотрудничестве № 1-2022 между ЦНИИ туберкулеза и ООО “Смарт Полиморф Технолоджиз”, инновационный центр “Сколково”.
Список литературы
Ashique S., Sandhu N.K., Chawla V., Chawla A.P. // Curr. Drug Deliv. 2021. V. 18. № 10. P. 1435. https://doi.org/10.2174/1567201818666210609161
Rosenblum D., Joshi N., Tao W. et al. // Nat. Commun. 2018. V. 9. P. 1410. https://doi.org/10.1038/s41467-018-03705-y
Mingalev P.G., Surmillo A.S., Lisichkin G.V. // Colloid J+. 2021. V. 83. P. 352. https://doi.org/10.1134/S1061933X2103011X
Hafeez N.M., Celia C., Petrikaite V. // Processes. 2021. V. 9. P. 1527. https://doi.org/10.3390/pr9091527
Zhu Y., Li J., Li W. et al. // Theranostics. 2012. V. 2. № 3. P. 302. https://doi.org/10.7150/thno.3627
Bondon N., Raehm L., Charnay C. et al. // J. Mater. Chem. B. 2020. V. 8. № 48. P. 10878. https://doi.org/10.1039/d0tb02221g
Jariwala D.H., Patel D., Wairkar S. // Mater. Sci. Eng. C. 2020. V. 113. 110996 https://doi.org/10.1016/j.msec.2020.110996
Weil T., Wu Y. // Phys. Sci. Rev. 2017. V. 2. P. 20160104. https://doi.org/10.1515/psr-2016-0104
Qin J., Yang X., Lv C. et al. // Mater. Des. 2021. V. 210. P. 110091. https://doi.org/10.1016/j.matdes.2021.110091
Schrand A.M., Huang H., Carlson C. et al. // J. Phys. Chem. B. 2007. V. 111. P. 2. https://doi.org/10.1021/jp066387v
Chang B., Lin H., Su L. et al. // Adv. Funct. Mater. 2013. V. 23. № 46. P. 5737. https://doi.org/10.1002/adfm.201301075
Zhang X., Lam R., Xu X. et al. // Adv. Mater. V. 23. № 41. P. 4770. https://doi.org/10.1002/adma.201102263
Yuan Y., Chen Y., Liu J. et al. // Diam. Relat. Mater. 2009. V. 18. № 1. P. 95. https://doi.org/10.1016/j.diamond.2008.10.031
Yuan Y., Wang X., Jia G. et al. // Diam. Relat. Mater. 2010. V. 19. № 4. P. 291. https://doi.org/10.1016/j.diamond.2009.11.022
Canton M., Sanchez-Rodriguez R., Spera I. et al. // Front. Immunol. 2021. V. 12. 734229 https://doi.org/10.3389/fimmu.2021.734229
Лепеха Л.Н. // Руководство “Респираторная медицина”. 2017. Т. 1. С. 159.
Нещадим Д.В., Архипов С.А., Шкурупий В.А. и др. // Фундаментальные исследования. 2015. № 2–6. С. 1222.
Яковлев Р.Ю., Соломатин А.С., Кулакова И.И. и др. Способ селективной доочистки наноалмаза. Пат. № 2506095 (Россия). 2014.
Кулакова И.И., Корольков В.В., Яковлев Р.Ю. и др. // Российские нанотехнологии. 2010. Т. 5. № 7–8. С. 66.
Kurynina A.V., Erokhina M.V., Makarevich O.A. et al. // Biochemistry. 2018. V. 83. № 3. P. 200. https://doi.org/10.1134/S0006297918030021
Кирпичников М.П., Онищенко Г.Е., Смирнова Е.А. и др. Выявление методами электронной микроскопии структурных изменений, вызываемых искусственными наночастицами в клетках животных и растений: Методические рекомендации МР 1.2.0047-11. М.: Федеральный Центр гигиены и эпидемиологии Роспотребнадзора, 2012. 46.
Baitinger E.M., Belenkov E.A., Brzhezinskaya M., Greshnyakov V.A. // Phys. Solid State. 2012. V. 54. № 8. P. 1715. https://doi.org/10.1134/S1063783412080057
Perevedentseva E., Hong S.-F., Huang K.-J. et al. // J. Nanopart. Res. 2013. V. 15. 1834 https://doi.org/10.1007/s11051-013-1834-8
Huang K.-J., Lee C.-Y., Lin C.-Y. et al. // J. Biophotonics. 2017. V. 10. № 10. P. 1315. https://doi.org/10.1002/jbio.201600202
Nguyen J.A., Yates R.M. // Front. Immunol. 2021. V. 12. 636078 https://doi.org/10.3389/fimmu.2021.636078
Faklaris O., Joshi V., Irinopoulou T. et al. // ACS Nano. 2009. V. 3. № 12. P. 3955. https://doi.org/10.1021/nn901014j
Rengarajan M., Hayer A., Theriot J.A. // PLOS Pathog. 2016. V. 12. № 5. e1005603 https://doi.org/10.1371/journal.ppat.1005603
Simonescu M., Popov D., Sima A. // Cell. Tissue Res. 2009. V. 335. P. 27. https://doi.org/10.1007/s00441-008-0688-3
Setyawati M.I., Mochalin V.N., Leong D.T. // ACS Nano. 2016. V. 10. P. 1170. https://doi.org/10.1021/acsnano.5b06487
Masyutin A.G., Erokhina M.V., Sychevskaya K.A. et al. // Bull. Exp. Biol. Med. 2016. V. 161. P. 125. https://doi.org/10.1007/s10517-016-3361-y
Sayes C.M., Marchione A.A., Reed K.L., Warheit D.B. // Nano Lett. 2007. V. 7. № 8. P. 2399. https://doi.org/10.1021/nl0710710
Gao S., Li T., Han D. et al. // Ecotoxocol. Environ. Saf. 2021. V. 212. 111980. https://doi.org/10.1016/j.ecoenv.2021.111980
Losacco C., Perillo A. // Environ. Sci. Pollut. Res. 2018. V. 25. P. 33901.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии




