Российские нанотехнологии, 2024, T. 19, № 1, стр. 81-87
Гидрогели на основе геллана и графт-сополимера пуллулана с боковыми группами поли(2-метил-2-оксазолина)
А. А. Лезов 1, *, В. Б. Рогожин 1, А. А. Лезова 1, Н. Г. Микушева 1, И. Ю. Перевязко 1, Г. Е. Полушина 1, А. С. Губарев 1, И. М. Зорин 1, Н. В. Цветков 1
1 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: a.a.lezov@spbu.ru
Поступила в редакцию 07.12.2023
После доработки 14.12.2023
Принята к публикации 14.12.2023
Аннотация
Получена трехкомпонентная система на основе геллана, графт-сополимера пуллулана с боковыми цепями поли(2-метил-2-оксазолином) и CaCl2, способная образовывать гели при контакте с водным раствором NaCl. Такая композиция может быть использована в медицинских целях, в частности для терапии офтальмологических заболеваний. Получены молекулярные характеристики исходных компонент геля, исследованы его вязкоупругие свойства. Установлено, что графт-сополимеры пуллулана с поли(2-метил-2-оксазолином) интегрируются в состав геля, при этом увеличение их доли уменьшает его упругие свойства. Полученные гели не разрушались при нагревании вплоть до температур ~70°С.
ВВЕДЕНИЕ
Благодаря широкому спектру физико-химических свойств, определяемых как составом, так и их строением, полисахариды широко применяются в пищевой химической промышленности, медицине, области косметики и множестве других направлений, как геле- и пленкообразователи, коагулянты, загустители и т.д. Многие полисахариды имеют биологическое происхождение, что, с одной стороны, облегчает их производство, с другой, обеспечивает биоразлагаемость материалов на их основе, а также в ряде случаев обусловливает их высокую биосовместимость, возможность применения в медицине. Благодаря пленкообразующим свойствам на базе пуллулана и других полисахаридов совершенствуются технологии создания растворимых оболочек для лекарств [1, 2]. На основе полисахаридов, склонных к гелеобразованию, в частности геллана, получают системы, обеспечивающие доставку и дозированное внедрение лекарств в организме. Так, за счет наличия заряженных групп в составе цепи появляется возможность контролировать процесс гелеобразования в геллане посредством введения в его раствор одно- и многозарядных катионов. Так как биологические жидкости содержат катионы натрия в значительной концентрации, это обусловливает возможность его применения как связующего агента в составе систем доставки лекарств при контакте с ними, а также свертывающего агента, ограничивающего кровопотери при контакте с поврежденными тканями организма.
Одним из многообещающих медицинских применений геллана оказывается доставка лекарств непосредственно на поверхность глаза. Так как многие лекарства плохо удерживаются, удаляясь вместе со слезами с поверхности глаза при моргании, возникает проблема более длительного их удержания [3]. Связующие свойства геллана, образующего гель в процессе взаимодействия с положительными ионами натрия в составе слезной жидкости, открывают возможность создания систем длительного удержания лекарств на его основе. В [4] была исследована геллановая камедь, химически модифицированная поли(2-этил-2-оксазолином). Ввиду того что химическая модификация геллана – достаточно трудоемкая процедура по причине его ограниченной растворимости в воде и сложностей с выделением продукта реакции, актуальной задачей является поиск альтернативных вариантов получения лекарственных препаратов, способных к гелеобразованию. Одно из путей решения указанной задачи заключается в создании систем, содержащих геллан как агент, способный к контролируемому гелеобразованию, и совместимый с ним полимер, обеспечивающий транспорт лекарственных препаратов. В качестве последнего может выступать пуллулан [2, 5], который значительно эффективнее подвергается химической модификации ввиду неионной природы и хорошей растворимости в воде.
В данной работе рассмотрим возможность создания систем из геллана и пуллулана, химически модифицированного биосовместимым поли(2-метил-2-оксазолином), пригодным для транспорта лекарственных препаратов. Процессы гелеобразования в исследованных системах регулируются за счет изменения содержания NaCl в присутствии многозарядных ионов Ca2+. Исследованы режимы формирования гелей при вариации содержания химически модифицированного пуллулана.
ИСПОЛЬЗУЕМЫЕ РЕАКТИВЫ И МАТЕРИАЛЫ
Порошок геллана (Гл) (Sigma-Aldrich) согласно данным количественного элементного анализа методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой, полученным на приборе ICPE-9000 Shimadzu (Япония), содержит следующие компоненты: Ca = 0.287%, Mg = = 0.032%, K = 2.56%, Na = 0.831%.
Азид-терминированный полиоксазолин (пМО). В виале смешивали 2 мл свежеперегнанного метилоксазолина, 2 мл свежеперегнанного сульфолана, 40 мг пара-нитрофенилсульфонилхлорида. Вакуумировали, насыщали аргоном (три цикла). Вакуумированную виалу помещали в баню с Т = = 95°С и оставляли при перемешивании на 30 ч. По окончании реакции выключали нагрев и прибавляли 1.5 мл насыщенного раствора азида натрия в диметилсульфоксиде (ДМСО) и оставляли на ночь. Очищали диализом против воды (мембрана MWCO 2000). Выход 1.75 г. Степень полимеризации, определенная из спектра ЯМР 1Н, как соотношение интегральных интенсивностей сигналов протонов концевой нитрофенильной группы (остаток инициатора) и боковых метильных групп звеньев цепи поли(2-метилоксазолина) оказалась равна 130, что соответствует молекулярной массе ММ = 11 000.
Пропаргил-пуллулан (Пу). Готовили раствор, содержащий 4.43 г КОН, 6.1 мл воды, 5.5 мл ДМСО. В этот раствор помещали 1.6 г пуллулана. После 10 мин перемешивания на магнитной мешалке, но не дожидаясь полного растворения, прибавляли порциями по 1 мл через 2 мин 4.0 см3 раствора 80 мас. % пропаргилбромида в толуоле (Acros Organics). Перемешивание реакционной смеси продолжали 24 ч. После этого реакционную смесь промыли спиртом дважды по 40 мл, затем водой до нейтральной реакции по индикаторной бумаге (не менее четырех порций по 30 мл) и снова спиртом дважды по 20 мл. Выход составил 1.08 г. Перед присоединением боковых цепей проводили фракционирование пропаргил-пуллулана дробным осаждением из воды этанолом. Были выделены три фракции с характеристическими вязкостями 0.7, 0.52 и 0.26 г/дл. Для дальнейшей модификации и исследований использовали образец с наибольшей характеристической вязкостью 0.7 г/дл.
Графт-сополимеры пулуллана с боковыми звеньями поли(2-метил-2-оксазолина) (Пу-пМО). К раствору пропаргил-пуллулана (20–50 мг) в воде или ДМСО добавляли поли(2-метил-2-оксазолин) с концевыми азидными группами (300–700 мг), аскорбат натрия и ацетат меди(II), раствор перемешивали на магнитной мешалке при комнатной температуре в течение нескольких дней. Затем продукт диализовали против воды (мембрана MWCO 12 000) и лиофилизировали. Продукт после диализа содержал некоторое количество непрореагировавшего полиоксазолина, который удалялся переосаждением из метанола в этилацетат.
Согласно данным ЯМР каждый десятый–одиннадцатый мальтотриозный остаток содержал по одной макромолекуле пМО. Более подробно вопросы синтеза графт-сополимеров пулуллана с боковыми звеньями поли(2-метил-2-оксазолина) описаны в [6].
МЕТОДЫ
Исследования исходных полимеров методом вискозиметрии проводили на микровискозиметре Lovis 2000 M (Anton Paar GmbH, Грац, Австрия). Работа прибора основана на принципе Гепплера. Для измерений использовали капилляр с внутренним диаметром 1.59 мм, внутри которого был размещен стальной шар, покрытый золотом. Диаметр шара составлял 1.5 мм. Время качения шара в капилляре измеряли, когда в нем находились растворы (tc) или растворители (t0), угол наклона капилляра составлял 45°. Величины характеристической вязкости [η] исследованных полимеров определяли из соотношения $\mathop {\lim }\limits_{c \to 0} \frac{{{{t}_{c}} - {{t}_{0}}}}{{{{t}_{0}}c}} = \mathop {\lim }\limits_{c \to 0} \frac{{\eta - {{\eta }_{0}}}}{{{{\eta }_{0}}c}} = \left[ \eta \right] + {{\left[ \eta \right]}^{2}}{{k}_{H}}$, где kH – константа Хаггинса [7], которая определяется термодинамическим качеством растворителя.
Исследования методом динамического рассеяния света (ДРС) проводили на установке “PhotoCor Complex” (фирма “Фотокор”, Россия) с коррелятором на 288 каналов (минимальное время задержки 10 нс) и одномодовым твердотельным лазером (λ0 = 654 нм).
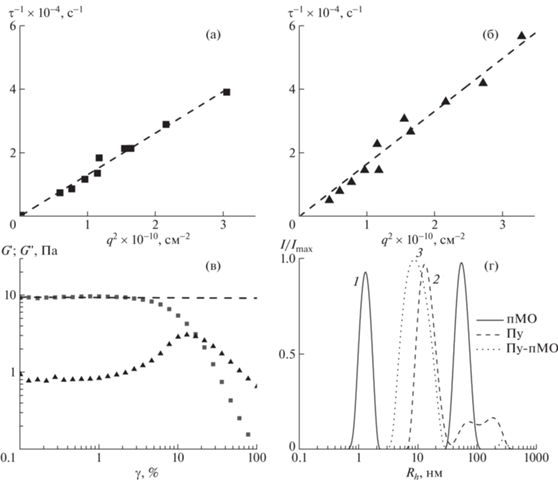
Автокорреляционные функции интенсивности рассеянного света обрабатывали с помощью программы “DynaLS” методом обратного преобразования Лапласа, что позволило получить функции распределения исследованных соединений в растворе по временам релаксации τ. Для всех исследованных систем зависимости обратного времени релаксации от квадрата волнового вектора рассеяния (q2 = (4πT/λsin(θ/2))2) проходили через начало координат в соответствии с выражением: ${{\tau }^{{ - 1}}} = D{{q}^{2}}$ рис. 1), что свидетельствует о диффузионном характере наблюдаемого процесса [8]. Углы рассеяния θ варьировали в пределах от 30° до 130°. Коэффициенты поступательной диффузии D0 исследованных макромолекул определяли из концентрационных зависимостей D(c) при их экстраполяции к бесконечному разбавлению в соответствии с выражением $D\left( c \right) = {{D}_{0}}\left( {1 + 2{{A}_{2}}сM + \ldots } \right)$, здесь A2 – второй вириальный коэффициент. Показатели преломления растворителей n измеряли в автоматическом рефрактометре Mettler Toledo (RM40, Швейцария). Для расчета гидродинамических радиусов использовали соотношение Стокса–Эйнштейна: ${{R}_{h}} = \frac{{kT}}{{6\pi {{\eta }_{0}}{{D}_{0}}}}$, здесь k – константа Больцмана, T – абсолютная температура, η0 – вязкость растворителя.
Рис. 1.
Зависимости обратного времени релаксации (τ–1) от квадрата волнового вектора рассеяния q2, полученные для быстрой (a) и медленной (б) мод рассеяния в водном растворе пМО при концентрации 1.06 г/дл; амплитудная зависимость модуля упругости G' ($\blacksquare $) и модуля потерь G" ($\blacktriangle $) Гл в воде при концентрации 0.1 г/дл с добавлением CaCl2 в концентрации 5 мM/л (в); нормализованные распределения интенсивности рассеянного света по гидродинамическим радиусам образцов Пу, Пу-пМО и пМО, полученные в воде методом ДРС при угле рассеяния θ = 90° (г).
Измерения плотности проводили на лабораторном плотномере DM40 (Mettler Toledo, Швейцария).
Эксперименты по аналитическому ультрацентрифугированию (АУЦ) проводили с использованием аналитической ультрацентрифуги “ProteomeLab XL-I Protein Characterization System” (Beckman Coulter, Inc., Бреа, США). Частота вращения ротора – 40000 об./мин. Седиментацию исследуемых образцов наблюдали с помощью рэлеевской интерференционной оптической системы, оснащенной красным лазером (длина волны 655 нм) в качестве источника света. Обработку экспериментальных данных проводили с помощью программы Sedfit, с использованием модели непрерывного распределения коэффициента седиментации c(s) [9]. Были определены коэффициенты седиментации образцов s, из концентрационной зависимости ${{s}^{{ - 1}}} = s_{0}^{{ - 1}}\left( {1 + {{k}_{s}}c + \ldots } \right)$ определены коэффициент Гралена ks и коэффициент седиментации при бесконечном разбавлении s0. Молекулярные массы образцов MsD были рассчитаны из значений коэффициента седиментации s0 и коэффициента диффузии D0 согласно уравнению Сведберга: ${{M}_{{sD}}} = \frac{{{{s}_{0}}}}{{{{D}_{0}}}}\frac{{kT{{N}_{{\text{A}}}}}}{{\left( {1 - \bar {v}{{\rho }_{0}}} \right)}}~$, где $\bar {v}$ – удельный парциальный объем исследуемой макромолекулы, было установлено, что он равен 0.650 см3/г для Пу, 0.804 см3/г для пМО и Пу-пМО и 0.597 см3/г для Гл. Коэффициент диффузии геллана вычисляли из данных АУЦ с использованием соотношения $D = \frac{{kT{{{\left( {1 - \bar {v}{{\rho }_{0}}} \right)}}^{{1{\text{/}}2}}}}}{{\eta _{0}^{{3{\text{/}}2}}\left( {9\pi \sqrt 2 } \right){{{\left( {f{\text{/}}{{f}_{0}}} \right)}}^{{3{\text{/}}2}}}{{{\left( {{{s}_{0}}\bar {v}} \right)}}^{{1{\text{/}}2}}}~}}$, здесь $(f{\text{/}}{{f}_{0}})$ – определяемое отношение коэффициента поступательного трения исследуемой макромолекулы к коэффициенту поступательного трения эквивалентной сферы.
Реологические свойства гелей исследовали на реометре MCR 702 TwinDrive (“Anton Paar” Австрия). Измерения проводили в геометрии “конус–плита”, диаметры верхней и нижней плиты составляли 50 мм, угол конуса – 2°. Объем анализируемого образца составлял 1.2 мл, исследованные образцы термостатировались с точностью 0.01 K.
Все исследования поводили при температуре 25°C.
РЕЗУЛЬТАТЫ
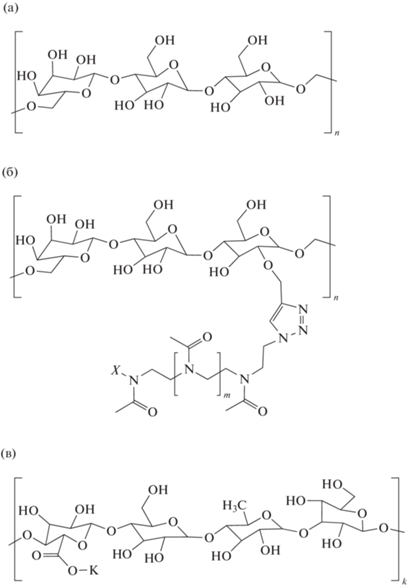
Образцы для формирования биосовместимых гелей исследовали методами ДРС, АУЦ и вискозиметрии. На рис. 2 представлены химические структуры пуллулана с боковыми группами поли(2-метил-2-оксазолина) (пМО) и геллана.
Рис. 2.
Химическая структура пуллулана (а), пуллулана, модифицированного поли(2-метил-2-оксазолином) (б) и геллана (в), X – остаток инициатора (–SO2–Ph–NO2).
В [5] было установлено, что Пу и Гл обладают хорошим сродством, что позволяет смешивать данные полимеры в широком диапазоне массовых отношений. Пу хорошо растворим в воде, как было установлено в [10], вода для данного полимера является хорошим растворителем. Гл в воде склонен к набуханию, а раствор становится гомогенным лишь после нагревания. В воде Гл формирует систему водородных и иных связей [11], из-за чего определить молекулярные характеристики Гл в этом растворителе не представляется возможным. В связи с этим в [12] использовали в качестве растворителя для Гл ДМСО с добавлением NaNO3. В данной работе использовали аналогичный растворитель ДМСО с NaNO3 в концентрации 0.2 M. В этом растворителе Гл хорошо растворяется, концентрационная зависимость приведенной вязкости имеет линейный характер. Присутствие низкомолекулярной соли NaNO3 экранирует электростатическое взаимодействие в цепях Гл.
При концентрации Гл 0.1% в воде этот раствор обладает хорошей текучестью при комнатной температуре. В [11] были исследованы гели на основе Гл, сформированные с использованием низкомолекулярных солей NaCl и CaCl2. Добавление в раствор Гл NaCl или CaCl2 приводило к тому, что раствор утрачивал текучесть и формировал однородную упругую массу. В настоящей работе использовали комбинацию из этих двух солей для получения гелей. На первом этапе к раствору Гл добавляли CaCl2 в такой концентрации, чтобы при температуре 25°С получившийся раствор оставался жидким в течение долгого (более 2 сут) срока, однако утрачивал текучесть при дальнейшем повышении концентрации CaCl2. Концентрация ионов кальция в получаемой системе при этом оказывалась такова, что на два мономерных звена Гл приходился один ион кальция, она составляла 5 мM. Затем к раствору добавляли раствор NaCl, что приводило к формированию геля.
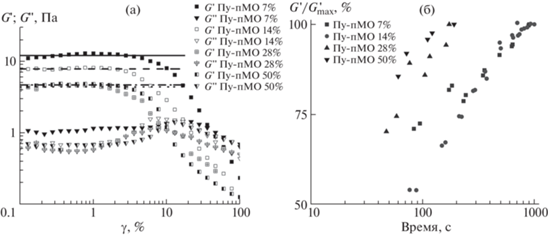
Величины модулей упругости G ' и потерь G " геля от амплитуды деформации γ при малых амплитудах являются постоянными, что свидетельствует о линейности механического поведения. Эта область постоянных значений достаточно протяженная, однако при достижении критического значения γ* происходили достаточно резкое падение G ' и рост G ", что указывает на переход от твердого к текучему состоянию геля (рис. 3). Данное поведение характерно для систем в состоянии геля [13].
Рис. 3.
Зависимости модуля упругости G ' и модуля потерь G " от амплитуды деформации γ, полученные для систем Гл с добавлением Пу-пМО (a). Зависимости G ' от времени, полученные при γ = 1% сразу после 100%-ной деформации для исследованных систем (б).
Заметных изменений свойств растворов Пу и гребнеобразного сополимера Пу-пМО в случае присутствия в воде двухвалентной соли CaCl2 не наблюдалось. Согласно данным ДРС, в воде образец пМО имел бимодальное распределение интенсивности рассеяния по гидродинамическим радиусам (рис. 1), первый пик соответствовал диффузии индивидуальных молекул. Массовая доля второй компоненты в растворе была незначительна, сопоставление вкладов обеих компонент было проведено согласно соотношению $I\sim cR_{h}^{\alpha }$ [13], здесь I – интенсивность рассеяния, c – массовая концентрация частиц, α – показатель степени, связывающий размеры частицы и его объем. Для оценки вклада второй компоненты были выбраны α = 3, что соответствует плотной сферической упаковке, и α = 5/3, что соответствует полимеру в хорошем растворителе. Оценка, сделанная на основе модели плотной сферы, дает вклад крупных частиц, близкий к нулю, а для модели полимера в хорошем растворителе – примерно 0.2%. По всей видимости, имеет место частичная агрегация цепей Пу, однако их массовая доля в растворе незначительна.
Образец Пу и гребнеобразный сополимер Пу-пМО, согласно данным ДРС, демонстрировали в растворе унимодальное распределение по гидродинамическим радиусам. Установлено, что после модификации макромолекул Пу боковыми цепями пМО молярная масса получаемого графт-сополимера Пу-пМО заметно падает (табл. 1). Вероятно, это связано с тем, что в процессе клик-реакции происходит частичная деградация Пу [6].
Таблица 1.
Молекулярные характеристики полимеров, исследованных в работе
| Образец | Растворитель | [η], дл/г |
D0 × 107, см2/с |
s0 × 1013, с-1 | MsD × 10–3, г/моль |
A0 × 1010, эрг/(К моль1/3) |
|---|---|---|---|---|---|---|
| Пу | Вода | 0.7 | 1.8 | 7.24 | 280 | 3.1 |
| Пу-пМО | Вода | 0.3 | 2.8 | 4.46 | 200 | 3.3 |
| пМО | Вода | 0.1 | 14.4 | 0.68 | 6 | 3.6 |
| Гл | ДМСО 0.2 NaNO3 | 16.1 | 0.19* | 1.38 | 520 | 3.0 |
Для всех исследованных полимеров вычислены значения гидродинамического инварианта согласно соотношению ${{A}_{0}} = {{\left( {{{M}_{{sD}}}\left[ \eta \right]} \right)}^{{1/3}}}{{\eta }_{0}}{{D}_{0}}{\text{/}}T$. Значения A0 лежат в диапазоне от 3.0 × 10–10 до 3.6 × 10–10 эрг/(К моль1/3), что характерно для гибкоцепных полимеров в хорошем или θ-растворителе.
Гели на основе геллана и пуллулана, модифицированного поли(2-метил-2-оксазолином). Подготовку гелей на основе Гл проводили следующим образом: к разогретому до 60°C раствору Гл в воде добавляли водный раствор Пу-пМО при постоянном перемешивании. Концентрация Гл в итоговой смеси составляла 0.1 г/дл. Концентрацию Пу-пМО в общей смеси варьировали в пределах от 7 до 50% от массы Гл. Далее к смеси добавляли водный раствор CaCl2, так чтобы его итоговая концентрация составляла 5 мM. В результате получалась смесь объемом 2 см3, визуально она обладала высокой текучестью. После добавления к смеси 1 см3 водного раствора NaCl с концентрацией 0.2 М происходило образование геля. Установлено, что при нагревании до 70°C образцы приобретают текучесть, а при охлаждении вновь формируют гель. Это свойство использовали при нанесении гелей на измерительные поверхности реометра.
Характер зависимостей G' и G", полученных для систем Гл с добавлением Пу-пМО, был подобен тому, который наблюдался для чистого Гл. Обнаружено, что рост концентрации Пу-пМО в составе геля приводит к понижению величины G', измеряемой на горизонтальном участке амплитудной зависимости (рис. 3). Снижение G', по-видимому, обусловлено уменьшением числа узлов сетки, формируемой двухвалентными ионами кальция и молекулами Гл. Также было обнаружено уменьшение прочности геля при увеличении доли Пу-пМО в его составе, величина γ* для исследованных систем уменьшалась с 4.6 до 1.7% при увеличении доли Пу-пМО c 7 до 28% (табл. 2).
Таблица 2.
Предельные деформации и времена восстановления гелей Гл с Пу-пМО
| Доля Пу-пМО в геле, % от массового содержания Гл |
g*, % | tвосст, с |
|---|---|---|
| 7 | 4.6 | 880 |
| 14 | 2.8 | 930 |
| 28 | 1.7 | 170 |
| 50 | 2.2 | 190 |
Падение упругости гелей при наличии в системе Пу-пМО от 7 до 28% свидетельствует, вероятно, о том, что данный полимер интегрируется в структуру геля и препятствует формированию кальциевых мостиков между мономерами Гл. При этом рост концентрации Пу-пМО в составе геля должен вести к увеличению степени гидратации геля. Как видно из экспериментальных данных, упругость перестает меняться при дальнейшем увеличении доли Пу-пМО, для систем с 28 и 50% Пу-пМО в составе геля амплитудные зависимости модулей G' и G" оказались близки. Возможно, это связано с тем, что в данной системе формируется устойчивая система связей между макромолекулами Гл неизменной концентрации, когда увеличение концентрации Пу-пМО в рассмотренном диапазоне уже неспособно повлиять на ее физико-химические свойства.
Оценка скорости восстановления геля после воздействия на него деформации γ = 100% показала, что свою структуру наиболее быстро восстанавливают гели с концентрацией Пу-пМО 28 и 50%, это происходит за время tвосст, примерно равное 3 мин. Гели с концентрацией Пу-пМО 7 и 14% восстанавливаются примерно за 15 мин. Такое увеличение скорости восстановления геля при увеличении доли Пу-пМО в смеси может быть связано с тем, что данный полимер со своим гидратным окружением выполняет роль пластификатора в составе геля. Тем самым он облегчает “подстройку” системы для формирования сети межмолекулярных связей. С другой стороны, абсолютные значения модуля упругости для систем с большим содержанием Пу-пМО (28 и 50%) в среднем в 2 раза ниже, чем для тех, где Пу-пМО мало (7 и 14%) (табл. 2), что также влияет на скорость восстановления геля.
ЗАКЛЮЧЕНИЕ
Получены трехкомпонентные системы на основе Гл и Пу-пМО с добавлением CaCl2, которые при контакте с раствором NaCl образуют гели. Это открывает перспективу их использования в качестве биоактивных агентов, способных при контакте с биологическими жидкостями переходить в состояние геля. В частности, такие системы применимы в офтальмологии.
Показано, что при такой концентрации ионов Ca2+, когда их суммарный заряд в растворе близок к суммарному заряду цепей геллана (при условии полной диссоциации), после добавления раствора NaCl происходит гелирование. Наличие в растворе Пу-пМО приводит к заметным изменениям упругих свойств гелей, свидетельствующим о том, что Пу-пМО интегрирован в структуру геля. Полученные гели не разрушались при нагревании вплоть до температур ~70°С, при том, что согласно [11] в присутствии только ионов Na+ с повышением температуры структура геля разрушается уже при температурах менее 30°С. Подобное поведение исследованных гелей демонстрирует возможность их практического применения для транспорта лекарств к тканям организма в присутствии биологических жидкостей в широком температурном диапазоне.
Исследование выполнено при поддержке Российского научного фонда (грант № 22-13-00187), https://rscf.ru/project/22-13-00187/. В работе использовано оборудование научного парка СПбГУ: “Центра диагностики функциональных материалов для медицины, фармакологии и наноэлектроники”, центра “Магнитно-резонансные методы исследования”, центра “Методы анализа состава вещества”.
Список литературы
Shih F.F., Daigle K.W., Champagne E.T. // Food Chem. 2011. V. 127. № 1. P. 118. https://doi.org/10.1016/j.foodchem.2010.12.096
Zhu G., Cheng L., Li J. et al. // Int. J. Food Sci. Technol. 2013. V. 48. № 12. P. 2683. https://doi.org/10.1111/ijfs.12235
Ashim K.M. // Ophthalmic Drug Delivery Systems. 2nd ed. / Boca Raton: CRC Press, 2003. 847 p. https://doi.org/10.1201/9780203912072
Lavikainen J., Dauletbekova M., Toleutay G. et al. // Polym. Adv. Technol. 2021. V. 32. № 7. P. 2770. https://doi.org/10.1002/pat.5298
Ding Y., Jiang F., Chen L. et al. // Carbohydr. Polym. 2020. V. 237. P. 116172. https://doi.org/10.1016/j.carbpol.2020.116172
Zorin I.M., Fetin P.A., Mikusheva N.G. et al. // Molecules. 2023. V. 28. (In Press)
Huggins M.L. // J. Am. Chem. Soc. 1942. V. 64. № 11. P. 2716.
Pike E.R. Photon Correlation and Light Beating Spectroscopy. 1st ed. / Ed. Cummins H. Springer US, 1974. 584 p.
Schuck P. // Biophys. J. 2000. V. 78. № 3. P. 1606. https://doi.org/10.1016/S0006-3495(00)76713-0
Pavlov G.M., Korneeva E.V., Yevlampieva N.P. // Int. J. Biol. Macromol. 1994. V. 16. № 6. P. 318. https://doi.org/10.1016/0141-8130(94)90063-9
Tako M., Sakae A., Nakamura S. // Agricultural and Biological Chemistry. 1989. V. 53. № 3. P. 771. https://doi.org/10.1080/00021369.1989.10869354
Kang D., Cai Z., Wei Y., Zhang H. // Polymer. 2017. V. 128. P. 147. https://doi.org/10.1016/j.polymer.2017.09.035
Mezger T. The Rheology Handbook: For users of rotational and oscillatory rheometers. Hanover: Vincentz Network, 2020. 528 p. https://doi.org/10.1515/9783748603702
Litmanovich E.A., Ivleva E.M. // Polym. Sci. A. 2010. V. 52. № 6. P. 671. https://doi.org/10.1134/S0965545X10060143
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


