Российские нанотехнологии, 2024, T. 19, № 1, стр. 88-95
Проводящий композит БЦ/ПЭДОТ : ПСС/графен как рецепторный элемент микробного биосенсора
А. Е. Китова 1, Ю. В. Плеханова 1, С. Е. Тарасов 1, Н. А. Кленова 2, А. Н. Решетилов 1, *
1 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, ФИЦ “Пущинский научный центр биологических исследований РАН”
Пущино, Россия
2 Самарский национальный исследовательский университет им. С.П. Королева
Самара, Россия
* E-mail: anatol@ibpm.pushchino.ru
Поступила в редакцию 28.05.2023
После доработки 27.09.2023
Принята к публикации 07.10.2023
Аннотация
В настоящее время актуален поиск новых материалов, обладающих высокой проводимостью и биосовместимостью, для использования в составе биосенсоров. Одним из перспективных материалов является бактериальная целлюлоза (БЦ) благодаря высокой площади поверхности, высокой пористости и биосовместимости. Для повышения проводимости БЦ была модифицирована с помощью проводящего геля ПЭДОТ : ПСС и углеродных наноматериалов. Композиция терморасширенный графит/БЦ/ПЭДОТ : ПСС/графен использована для иммобилизации клеток уксуснокислых бактерий Gluconobacter oxydans на поверхности печатного графитового электрода. Исследовано влияние отдельных компонентов композита на каталитическую активность бактерий в присутствии медиатора 2,6-дихлорфенолиндофенола. Внесение БЦ в состав композита обеспечивало более высокую стабильность электрода, падение сигнала в течение 35 дней составило 9%. При этом микробный биосенсор на основе композита ТРГ/ПЭДОТ : ПСС/графен/БЦ/G. oxydans демонстрировал лучшую чувствительность (24.43 мкА мМ–1 см–2) и нижний предел обнаружения (0.005 мМ) по сравнению с другими рассмотренными аналогами. Таким образом, БЦ, модифицированная проводящими добавками, может быть применена в качестве матрицы для иммобилизации бактерий в составе микробных биосенсоров и биотопливных элементов.
ВВЕДЕНИЕ
Бактериальная целлюлоза (БЦ) представляет собой натуральный полимер [1], который может быть использован в качестве матрицы для иммобилизации биокатализаторов в составе биосенсоров [2]. Бактериальная целлюлоза обладает уникальными физическими и механическими свойствами, а ее структура из микроволокон с высокой площадью поверхности обеспечивает высокую сорбционную способность и позволяет прочно удерживать микробные клетки как внутри слоя полимера, так и на его поверхности [3]. К преимуществам данного материала относятся также его высокая биосовместимость и легкость промышленного получения [4]. При этом низкая проводимость БЦ ограничивает ее применение в качестве компонента электронных устройств, в том числе биосенсоров [5]. Поэтому ее модифицируют другими проводящими компонентами – синтетическими полимерами, наноматериалами и т.д. [6]. К числу таких синтетических полимеров относится поли(3,4-этилендиокситиофен) : полистеренсульфоновая кислота (ПЭДОТ : ПСС), используемый при создании биомедицинских и биоэлектрохимических устройств [7]. Перенос электронов по цепочке полимера ПЭДОТ осуществляется системой сопряженных связей за счет реакций обмена электронами между соседними редокс-сайтами и сопровождается сопряженным перемещением анионов допанта (ПСС) вдоль полимерной цепи [8]. Одним из наиболее распространенных способов улучшения проводимости полимеров является добавление углеродных наноматериалов [9]. Было показано, что эффективное сочетание БЦ [10] и ПЭДОТ : ПСС [11] с наноматериалами, в том числе с графеном, по отдельности приводит к улучшению электрохимических свойств полученных композитов. К углеродным наноматериалам относится и терморасширенный графит (ТРГ), который может использоваться как материал биоанодов микробных топливных элементов [12] и рабочих электродов биосенсоров [13], позволяющий увеличить активную площадь поверхности и облегчить электронный перенос в системе.
В [14] было показано, что использование композита ТРГ–БЦ в составе амперометрических микробных биосенсоров позволяет создать эффективную матрицу для иммобилизации бактериальных клеток. С другой стороны, использование ТРГ в сочетании с гелем ПЭДОТ : ПСС и мембранными фракциями бактерий позволило обеспечить безмедиаторный перенос электронов от PQQ-зависимых дегидрогеназ на электрод при окислении глюкозы [15]. Представлялось интересным изучить возможность комбинирования двух полимеров и ТРГ, а также оценить влияние каждого компонента на электрохимическую активность бактериальных клеток в составе микробного биосенсора. Для улучшения аналитических параметров разработанного устройства использовался полимер ПЭДОТ : ПСС, дополнительно модифицированный электрохимически эксфолиированным графеном.
Цель данной работы – создание нового проводящего композита, содержащего бактериальную целлюлозу, ПЭДОТ : ПСС, графен и ТРГ, обеспечивающего надежную иммобилизацию бактериальных клеток в электрохимическом биосенсоре. В качестве модельного микроорганизма использовали уксуснокислые бактерии Gluconobacter oxydans sbsp. industrius ВКМ B‑1280, окисляющие глюкозу.
МАТЕРИАЛЫ И МЕТОДЫ
Реагенты. В работе использовали калий фосфорнокислый двузамещенный 3-водный, натрия гидроксид, натрий хлористый, уксусную кислоту, соляную кислоту, гидрофосфат натрия, этиловый спирт, лимонную кислоту (“Мосреактив”, Россия); натриевую соль 2,6-дихлорфенолиндофенола (ДХФИФ), хитозан низкомолекулярный, трет-бутиловый спирт, трис(гидроксиметил)аминометан, сорбит, глюкозу, дрожжевой экстракт, глутаровый альдегид, трис(гидроксиметил)аминометан, ПЭДОТ : ПСС/графен (“Merck”, Германия); сорбит, глюкозу, дрожжевой экстракт, агар-агар бактериологический, пептон (“Диа-М”, Россия). В качестве рабочих использовали 3-контактные электроды, полученные методом матричной печати (“КолорЭлектроникс”, Россия). В качестве модифицирующего материала использовали ТРГ, полученный по методике, описанной в [13].
Культивирование клеток микроорганизмов. В качестве биокатализатора использовали штамм Gluconobacter oxydans sbsp. industrius ВКМ B-1280 (Всероссийская коллекция микроорганизмов, Россия). Культивирование проводили по методике, описанной в [16], в течение 18–20 ч до достижения стационарной фазы роста, при которой количество жизнеспособных клеток близко к максимальному. Выращивание проводили в колбах Эрленмейера объемом 750 мл при перемешивании (200 об./мин, 28°С) в 50 мл среды, содержащей (%): сорбит – 10, дрожжевой экстракт – 0.2 (вода дистиллированная). Клетки отделяли центрифугированием при 10 000 g в течение 5 мин. Осадок отмывали дважды 25 мМ калий-фосфатным буферным раствором, рН 6.5. Культуру поддерживали на скошенной агаризованной среде, содержащей (г/л): сорбит – 100.0, дрожжевой экстракт – 5.0, агар-агар – 15.0.
Получение бактериальной целлюлозы. Культура Medusomyces gisevii, синтезирующая БЦ, была получена из чайного гриба методом очистки с помощью клонирования. Культивирование осуществляли при температуре 28°С в течение 3 сут на скошенной агаризованной среде следующего состава, г/л: глюкоза – 10.0, дрожжевой экстракт – 10.0, пептон – 7.0, агар-агар – 15.0, лимонная кислота – 0.2, уксусная кислота – 0.1, этанол – 10.0, рН 5.0–6.0. Для очистки пленку БЦ промывали в дистиллированной воде, затем помещали в 0.5%-ный раствор NaOH на 24 ч при температуре 25–27°С. После промывки в дистиллированной воде пленку помещали в 0.5%-ный раствор соляной кислоты на 24 ч, после чего промывали дистиллированной водой до получения реакции промывочных вод pH 6–7. Полученные пленки подсушивали на фильтровальной бумаге и хранили в 70%-ном этиловом спирте. Для использования в составе биосенсоров из образцов БЦ удаляли остатки этилового спирта путем их переноса из среды хранения в раствор фосфатного буфера на 24 ч, промывки дистиллированной водой до нейтральной реакции и высушивания до постоянной массы в течение 3 ч.
Формирование биосенсоров на основе электродов матричной печати. Печатный электрод представлял собой композицию вспомогательного и рабочего электродов, выполненных из графитовой пасты Electrodag 6017SS (Henkel, Германия), и электрода сравнения (Ag/AgCl). Диаметр рабочего электрода составлял 3 мм. При формировании печатных электродов, модифицированных ТРГ, на рабочем электроде печатного электрода прессованием под давлением в 150 бар закрепляли слой ТРГ толщиной 0.1 мм.
Иммобилизация на бактериальной целлюлозе. Для иммобилизации клеток использовали образец БЦ штамма-продуцента Gluconacetobacter sucrofermentas ВКПМ В-11267. На рабочий электрод биосенсора наносили 10–12 мг БЦ, предварительно промытой в дистиллированной воде, затем высушивали при комнатной температуре в течение 3 ч. На полученный электрод наносили 5 мкл биомассы (0.5 мг/мкл) и оставляли на ночь в холодильнике при +4°С. Либо на рабочий электрод с БЦ наносили 2 мкл смеси ПЭДОТ : ПСС/графен, оставляли на 10–12 ч в холодильнике при +4°С, а затем наносили 5 мкл биомассы (0.5 мг/мкл) и оставляли на ночь в холодильнике при +4°С. Также на контрольный печатный электрод и электрод, модифицированный ТРГ, наносили 5 мкл биомассы (0.5 мг/мкл) и оставляли на ночь в холодильнике при +4°С.
Условия измерений. Измерения проводили в кювете объемом 2 мл при температуре 25°С. В качестве базового раствора использовали 25 мМ калий-фосфатный буфер с рН 6.5, содержащий 10 мМ хлорида натрия. Для регистрации сигналов электрода использовали гальванопотенциостат IPCmicro (“Кронас”, Россия) или гальванопотенциостат-импедансметр VersaSTAT 4 (“Ametek Inc.”, США). Хроноамперометрические зависимости регистрировали при приложенном потенциале +200 мВ (vs Ag/AgCl) при добавлении медиатора электронного транспорта ДХФИФ (0.05 мМ). Циклические вольтамперограммы (ЦВА) регистрировали при скорости сканирования 3 мВ/с в диапазоне от –500 до +500 мВ. Значения параметров биосенсоров приведены как средние из пяти измерений. Импедансные характеристики измеряли при приложенном потенциале +200 мВ (vs Ag/AgCl) либо +400 мВ (vs Ag/AgCl) в диапазоне частот от 40 кГц до 0.2 Гц при амплитуде модуляции напряжения 10 мВ в присутствии 0.14 мМ ДХФИФ. Подходящую эквивалентную электрическую схему для каждой системы подбирали с помощью программы ZSimpWin (“EChem Electrochemystry Software”, USA). Схема считалась подходящей, если погрешность определения параметров была ниже 10%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для оценки изменения проводимости биоэлектродов на основе различных композитов использовали метод электрохимической импедансной спектроскопии (ЭИС). На рис. 1а представлены диаграммы Найквиста для электродов, модифицированных различными вариантами проводящего композита. Для интерпретации полученных импедансных спектров применяли модифицированную эквивалентную электрическую схему Рэндлса, представленную на вставке к риc. 1, где Rs – омическое сопротивление электролита, СPE – элемент постоянной фазы, отражающий емкость двойного слоя на поверхности электрода, Rct – сопротивление переноса заряда. Исходные коммерчески доступные электроды обладают достаточно высоким сопротивлением (до нескольких мегаом), поэтому для эффективного использования в качестве основы биосенсора рабочий электрод необходимо модифицировать проводящими материалами. Максимальное снижение сопротивления вызывает модификация электрода ТРГ, что соответствует данным [13] и может быть связано как с высокой проводимостью материала, так и с увеличением активной площади поверхности электрода. Введение геля ПЭДОТ : ПСС также вызывает снижение сопротивления переноса заряда электрода, но не такое заметное, как ТРГ. В то же время введение в композит БЦ и бактериальных клеток вызывает увеличение сопротивления (данные представлены в [14]). Чтобы нивелировать влияние БЦ на сопротивление, ее дополнительно пропитывали смесью ПЭДОТ : ПСС/графен, что приводило к значительному повышению проводимости композита (снижение сопротивления переноса заряда с 530 до 220 кОм). Таким образом, добавление проводящих углеродных наноматериалов (ТРГ и графен) позволяет улучшить общую проводимость системы, несмотря на высокое сопротивление отдельных ее компонентов (БЦ и бактериальные клетки).
Рис. 1.
Диаграммы Найквиста для печатного электрода с различными композициями (а) и для печатного электрода с ТРГ, ПЭДОТ : ПСС, графеном и БЦ при иммобилизации клеток и введении субстрата (3 мМ глюкозы) (б). Измерения проведены при приложенном потенциале +200 мВ (vs Ag/AgCl) в присутствии 0.14 мМ ДХФИФ.
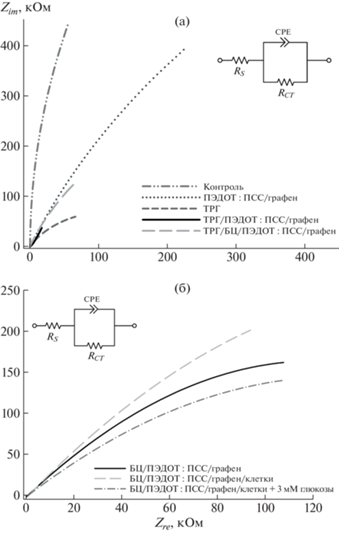
Композит ТРГ/БЦ/ПЭДОТ : ПСС/графен с иммобилизованными клетками бактерий также исследовали с помощью метода ЭИС в присутствии и в отсутствие субстрата (рис. 1б). Как видно из графика, введение в композит бактериальных клеток вызывает рост сопротивления электрода, которое снижается при введении в измерительную ячейку субстрата. Снижение общего импеданса системы при добавлении глюкозы показывает наличие процессов переноса электронов от активных центров ферментов на электрод с помощью редокс-медиатора в результате трансформации глюкозы клетками.
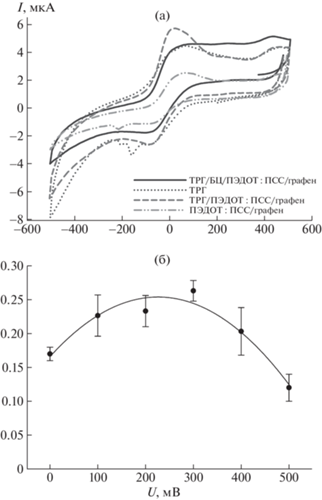
Влияние различных модификаций электрода на его электрохимические характеристики оценивали с помощью метода циклической вольтамперометрии. На рис. 2а представлены ЦВА полученных биоэлектродов. Измерения проводили в диапазоне от –0.5 до 0.5 В. На всех зависимостях наблюдаются характерные пики окисления/восстановления ДХФИФ, который использовали в качестве редокс-медиатора. Минимальные токи окисления/восстановления в присутствии медиатора и субстрата наблюдали для электрода, модифицированного клетками в проводящем геле ПЭДОТ : ПСС/графен. Модификация электрода ТРГ приводила к значительному возрастанию токов окисления/восстановления медиатора в процессе трансформации субстрата клетками, что коррелирует с данными ЭИС. На рисунке видно увеличение токов для электродов, модифицированных ТРГ и клетками как при иммобилизации на БЦ, так и без БЦ. Максимальное значение анодного тока составляло 5.7 мкА (при 30 мВ) для электрода, модифицированного ТРГ и гелем ПЭДОТ : ПСС/графен. Присутствие БЦ в составе композита приводило к сглаживанию пиков окисления, но в то же время анодный ток был выше, чем во всех других исследуемых композициях в более широком диапазоне от 0 до +500 мВ. Это дает возможность более эффективно использовать электроды на основе данной композиции в составе амперометрических биосенсоров при разных уровнях подаваемого напряжения, например при потенциале в 200 мВ, при котором происходит процесс окисления ДХФИФ [17]. На рис. 2б представлена зависимость откликов исследуемого биосенсора от величины приложенного потенциала (диапазон 0–500 мВ). Измерения проводили в присутствии ДХФИФ (0.05 мМ) при добавлении глюкозы (1.5 мМ).
Рис. 2.
ЦВА биосенсоров на основе G. oxydans при внесении глюкозы и ДХФИФ (а) и зависимость сигнала биосенсора от приложенного потенциала (б). Измерения проводили в присутствии ДХФИФ (0.05 мМ) при добавлении глюкозы (1.5 мМ).
Для исследования влияния модификации электрода на основные аналитические параметры биосенсоров были построены калибровочные зависимости сигналов биосенсоров от концентрации глюкозы (рис. 3). Численные значения параметров, полученные при обработке зависимостей, представлены в табл. 1. Композиция ТРГ/БЦ/ПЭДОТ : ПСС/графен/клетки (кривая 1) обеспечивала максимальные сигналы биосенсора и, как следствие, максимальную чувствительность клеток к глюкозе – 24.43 мкА мМ–1 см‒2. Нижний предел обнаружения для всех композиций был одинаков, а вот линейные диапазоны определения различались. Минимальный диапазон оказался у электродов, модифицированных отдельными компонентами композита – только гелем ПЭДОТ : ПСС/графен (без ТРГ) или только ТРГ; максимальный – у электрода, модифицированного ТРГ и БЦ. Чувствительность к глюкозе увеличивается в следующем ряду композиций: ТРГ/БЦ/G. oxydans < ПЭДОТ : ПСС/графен/ G. oxydans < ТРГ/G. oxydans < ТРГ/ПЭДОТ : : ПСС/графен/G. oxydans < ТРГ/БЦ/ПЭДОТ : ПСС/ графен/G. oxydans. Таким образом, сочетание БЦ, пропитанной ПЭДОТ : ПСС/графен, на электроде с ТРГ позволяет создать рабочий электрод биосенсора с наилучшими аналитическими характеристиками.
Рис. 3.
Калибровочные зависимости для биосенсоров на основе G. oxydans, модифицированных различными композициями.
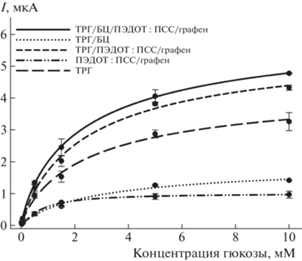
Таблица 1.
Параметры калибровочных зависимостей (рис. 3)
| Модификация биосенсора | Диапазон опреде-ляемых концентра-ций, мМ | Линейный диапазон определения, мМ | Нижний предел определения, мМ | Коэффициент чувствительности на линейном участке, мкА мМ–1 см–2 | Кажу-щаяся КM, мМ | Imax, мкА |
|---|---|---|---|---|---|---|
| ТРГ/G. oxydans | 0.025–10 | 0.10–1.5 | 0.025 | 13.57 | 2.79 | 4.46 |
| ПЭДОТ : ПСС/графен/G. oxydans | 0.025–0.8 | 9.40 | 0.74 | 1.00 | ||
| ТРГ/ПЭДОТ : ПСС/гра- фен/G. oxydans | 0.025–1.2 | 21.43 | 2.57 | 5.70 | ||
| ТРГ/БЦ/ПЭДОТ : ПСС/гра-фен/G. oxydans | 0.064–1.1 | 24.43 | 2.49 | 6.29 | ||
| ТРГ/БЦ/G. oxydans | 0.025 – 1.5 | 5.93 | 3.00 | 1.94 |
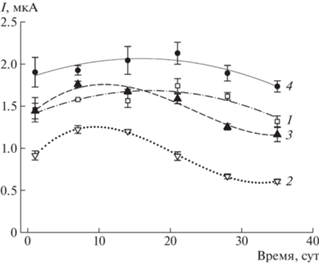
Известно, что клетки микроорганизмов могут сохранять свою каталитическую активность после длительного хранения при низких температурах без лиофилизации [18]. На рис. 4 представлены калибровочные зависимости сигналов биосенсоров от концентрации глюкозы для различных вариантов модификации электродов. В качестве биокатализатора использовали бактериальные клетки, хранившиеся при температуре –18°С в течение 4 мес. Численные значения аналитических параметров биосенсоров, полученные при обработке зависимостей, приведены в табл. 2. Как видно из представленных данных, соотношение значений параметров электродов в зависимости от используемой модификации сохраняется. Композиция ТРГ/БЦ/ПЭДОТ : ПСС/графен/клетки (кривая 1) обеспечивала максимальные сигналы биосенсора и, как следствие, максимальную чувствительность клеток к глюкозе – 18.71 мкА мМ‒1 см–2. Отметим, что для биосенсора на основе этой композиции нижний предел обнаружения составил 0.005 мМ. Возможно, это связано с тем, что бактериальные клетки после длительного голодания более чувствительны к низким концентрациям субстрата.
Рис. 4.
Калибровочные зависимости для биосенсоров на основе G. oxydans, модифицированных различными композициями через 4 мес хранения биокатализатора при –18°С.
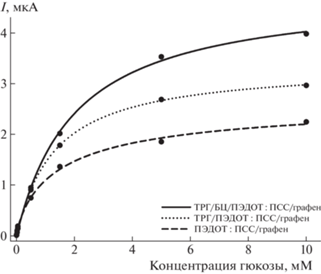
Таблица 2.
Параметры калибровочных зависимостей (рис. 4)
| Модификация биосенсора | Диапазон определяемых концентраций, мМ | Линейный диапазон определения, мМ | Нижний предел определения, мМ | Коэффициент чувствительности на линейном участке, мкА мМ–1 см–2 | Кажу-щаяся KM, мМ | Imax, мкА |
|---|---|---|---|---|---|---|
| ТРГ/БЦ/ПЭДОТ : ПСС/гра-фен/G. oxydans | 0.005–10 | 0.04–1.50 | 0.005 | 18.71 | 1.99 | 4.81 |
| ТРГ/ПЭДОТ : ПСС/гра-фен/G. oxydans | 0.05–10 | 0.09–1.22 | 0.050 | 17.29 | 1.32 | 3.36 |
| ПЭДОТ : ПСС/гра- фен/G. oxydans | 0.005–10 | 0.08–1.02 | 0.005 | 12.71 | 1.62 | 2.71 |
Аналитические характеристики разработанного микробного биосенсора на основе композита ТРГ/БЦ/ПЭДОТ : ПСС/графен/G. oxydans сравнили с описанными в литературе биосенсорами для определения глюкозы (табл. 3). Существуют модели как микробных, так и ферментных амперометрических биосенсоров, при этом могут использоваться как фермент глюкозооксидаза, так и глюкозодегидрогеназа. Для увеличения проводимости рабочих электродов биосенсоров и улучшения чувствительности устройств используют различные углеродные наноматериалы и проводящие полимеры. Отметим, что разработанный сенсор может обнаруживать более низкие концентрации глюкозы, чем большинство приведенных устройств, а его чувствительность находится на уровне мировых аналогов.
Таблица 3.
Основные аналитические параметры моделей биосенсоров для определения глюкозы с различным типом биокатализатора
| Биокатализатор | Материал электрода | Предел обнаруже- ния, мМ | Коэффициент чувствительности биосенсора, мкА мМ–1 см–2 | Линейный диапазон обнаруже-ния, мМ | Литература |
|---|---|---|---|---|---|
| G. oxydans | ТРГ/БЦ/ПЭДОТ : ПСС/графен/ | 0.005 | 24.43 | 0.04–1.50 | настоящая работа |
| G. oxydans | Многостенные углеродные нанотрубки/хитозан | 0.04 | 3.7 | 0.17–1.82 | [19] |
| G. oxydans | 10-[4H-дитиено(3,2-b : 2',3'-d)пиррол-4-ил]декан-1-амин | 0.081 | 13.48 | 0.19–50 | [20] |
| E. coli | Графит/полианилин/поливиниловый спирт | 0.3 | 4.464 | 0.3–1.12 | [21] |
| PQQ-зависимая глюкозодегидрогеназа | Золото с самособирающимися монослоями | 0.03 | 79 | 0.03–0.2 | [22] |
| ФАД-зависимая глюкозодегидрогеназа | Одностенные углеродные нанотрубки | 0.001 | 70 | 0.0025–3.2 | [23] |
| Глюкозооксидаза | ПЭДОТ : ПСС/Ti3C2/графеновые квантовые точки | 0.065 | 21.64 | 0.065–0.5 | [24] |
| Глюкозооксидаза | ПЭДОТ : ПСС/восстановленный оксид графена | 0.086 | 57.3 | 0.1–0.6 | [25] |
Одной из важнейших задач при создании биосенсоров является выбор метода иммобилизации, обеспечивающего поддержание активности биокатализатора на высоком уровне в течение длительного времени. Результаты изучения стабильности сигналов биосенсоров, основанных на различных композитах, приведены на рис. 5. Наиболее высокой стабильностью обладали клетки в составе композита ТРГ/БЦ/ ПЭДОТ : ПСС/графен (падение сигнала – 9%) и клетки, иммобилизованные на электроде, модифицированном только ТРГ (падение – 11%). Внесение ПЭДОТ : ПСС приводило к падению активности через 35 сут на 34%. Можно предположить, что гель ПЭДОТ : ПСС оказывает негативное влияние на жизнедеятельность бактерий при длительном контакте. Отметим, что полностью сформированный композит с ТРГ и БЦ позволяет обеспечить наиболее благоприятные условия для поддержания длительной активности бактериальных клеток, при этом используя положительные свойства ПЭДОТ : ПСС – высокую проводимость.
ЗАКЛЮЧЕНИЕ
В работе представлен новый композиционный материал, содержащий бактериальную целлюлозу, ПЭДОТ : ПСС, графен и ТРГ, для иммобилизации уксуснокислых бактерий Gluconobacter oxydans в составе микробного биосенсора. Данный композит благодаря биосовместимости и высокой проводимости за счет отдельных его компонентов обеспечивает высокий уровень сигнала от бактериальных клеток, высокую стабильность сигнала и чувствительность к глюкозе. Показано, что использование полимера ПЭДОТ : ПСС/графен и ТРГ снижает сопротивление переноса заряда коммерчески доступных печатных электродов, что положительно сказывается на аналитических характеристиках биосенсоров на их основе. Композиция ТРГ/БЦ/ПЭДОТ : ПСС/графен/ клетки обеспечивает максимальные сигналы биосенсора и максимальную чувствительность клеток к глюкозе – 24.43 мкА мМ–1 см–2. Использование бактериальной целлюлозы в качестве матрицы для иммобилизации бактерий позволило обеспечить стабильную работу рецепторных элементов биосенсоров в течение 35 дней (падение сигнала составило 9%). Таким образом, представленный композит может быть применен для иммобилизации бактериальных клеток в составе биоэлектрохимических устройств, а также для иммобилизации микроорганизмов в различных биотехнологических производствах.
Авторы выражают благодарность А.Г. Быкову за культивирование клеток Gluconobacter oxydans.
Исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации (Cоглашение № 075-15-2021-1051).
Список литературы
Рогова Е.А., Алашкевич Ю.Д., Кожухов В.А. и др. // Химия растительного сырья. 2022. № 4. С. 27. https://doi.org/10.14258/jcprm.20220411373
Zhao C., Wang G., Sun M. et al. // Fibers Polym. 2021. V. 22. P. 1208. https://doi.org/10.1007/s12221-021-0650-5
Keshk S.M.A.S. // J. Bioproces. Biotechn. 2014. V. 4. P. 150. https://doi.org/10.4172/2155-9821.1000150
Zhong C. // Front. Bioeng. Biotechnol. 2020. V. 8. P. 605374. https://doi.org/10.3389/fbioe.2020.605374
Kiesewetter D.V., Zhuravleva N.M., Reznik A.S. et al. // IEEE 3rd International Conference on Dielectrics (ICD). 2020. P. 245. https://doi.org/10.1109/ICD46958.2020.9341885
Troncoso O.P., Torres F.G. // Int. J. Mol. Sci. 2020. V. 21. P. 6532. https://doi.org/10.3390/ijms21186532
Zamani F.G., Moulahoum H., Ak M. et al. // Trends Analyt. Chem. 2019. V. 118. P. 264. https://doi.org/10.1016/j.trac.2019.05.031
Решетилов А.Н., Китова А.Е., Тарасов С.Е. и др. // РЭНСИТ. 2020. Т. 12. № 4. С. 471. https://doi.org/10.17725/rensit.2020.12.471
Hosseini H., Kokabi M., Mousavi S.M. // Carbohydr. Polym. 2018. V. 201. P. 228. https://doi.org/10.1016/j.carbpol.2018.08.054
de Assis S.C., Morgado D.L., Scheidt D.T. et al. // Biosensors. 2023. V. 13 (1). P. 142. https://doi.org/10.3390/bios13010142
Adekoya G., Sadiku R., Sinha Ray S. // Macromol. Mater. Eng. 2021. V. 306. https://doi.org/10.1002/mame.202000716
Rajendran J., Shetty B.H., Ganapathy D. et al. // J. Electrochem. Soc. 2022. V. 169. P. 017515. https://doi.org/10.1149/1945-7111/ac4b23
Plekhanova Y., Tarasov S., Kitova A. et al. // 3 Biotech. 2022. V. 12. P. 42. https://doi.org/10.1007/s13205-021-03107-w
Тарасов С.Е., Плеханова Ю.В., Китова А.Е. и др. // Прикладная биохимия и микробиология. 2022. Т. 58. № 4. С. 388. https://doi.org/10.31857/S0555109922040158
Kitova A., Tarasov S., Plekhanova Y. et al. // Biosensors. 2021. V. 11. № 5. P. 144. https://doi.org/10.3390/bios11050144
Решетилов А.Н., Плеханова Ю.В., Тарасов С.Е. и др. // Прикладная биохимия и микробиология. 2017. Т. 53. № 1. С. 115. https://doi.org/10.7868/S0555109917010160
Dawson R.M.C., Elliott D.C., Elliott W.H., Jones K.M. Data for biochemical research. 3rd edn. Oxford: Oxford Science Publications, OUP, 1986. 580 p.
Sanderson K.E., Zeigler D.R. // Methods Enzymol. 1991. V. 204. P. 248. https://doi.org/10.1016/0076-6879(91)04012-d
Plekhanova Y., Tarasov S., Bykov A. et al. // Biosensors. 2019. V. 9. 137. https://doi.org/10.3390/bios9040137
Cevik E., Cerit A., Tombuloglu H. et al. // Analyt. Lett. 2018. V. 52. № 7. P. 1138. https://doi.org/10.1080/00032719.2018.1521828
Dessie Y., Tadesse S. // Sensing and Bio-Sensing Res. 2022. V. 36. P. 100484. https://doi.org/10.1016/j.sbsr.2022.100484
Lokar N., Pečar B., Možek M. et al. // Biosensors. 2023. V. 13. P. 364. https://doi.org/10.3390/bios13030364
Hiratsuka A., Iwasa H., Uzawa H. et al. // ACS Omega. 2019. V. 4. P. 5776. https://doi.org/10.1021/acsomega.9b00060
Nashruddin S.N.A., Abdullah J., Mohammad Haniff M.A.S. et al. // Biosensors. 2021. V. 11. P. 267. https://doi.org/10.3390/bios11080267
Abd-Wahab F., Abdul Guthoos H.F., Wan Salim W.W.A. // Biosensors. 2019. V. 9. P. 36. https://doi.org/10.3390/bios9010036
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии