Нефтехимия, 2019, T. 59, № 1, стр. 64-68
Теоретическое изучение механизма реакции каталитического алкилирования адамантана продуктами крекинга 2,2,4-триметилпентана
Е. И. Багрий 1, *, Ю. А. Борисов 2, Ю. А. Колбановский 1, А. Л. Максимов 1
1 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: bagrii@ips.ac.ru
Поступила в редакцию 19.10.2017
После доработки 26.07.2018
Принята к публикации 28.03.2018
Аннотация
Проведены квантово-химические расчеты механизма реакции каталитического алкилирования адамантана продуктами крекинга изооктана методом функционала энергии от электронной плотности DFTB3LYP/6-31G*. Показано, что начальной стадией превращений является взаимодействие AlCl3 · HCl (как модели кислотного катализатора) с изооктаном. На первой стадии крекинга происходит перенос протона катализатора на изооктан (энергия активации вычислена равной 24.64 ккал/моль) с образованием интермедиата 1, который представляет собой три взаимодействующие между собой подсистемы: катион (СН3)3С+, анион ${\text{AlCl}}_{4}^{ - }$ и СН3–СН(СН3)2, т.е. изобутан. На второй стадии происходит перенос протона с карбкатиона (CH3)3C+ на ${\text{AlCl}}_{4}^{ - }$ с образованием олефина CH2=C(CH3)2. Энергия активации этой стадии вычислена равной 7.85 ккал/моль. Этой стадией заканчивается крекинг изооктана с образованием олефина и алкана меньшего размера, чем исходный. Рассмотрен механизм образования адамантил-катиона, который без энергии активации присоединяет олефин и образующийся комплекс, при депротонировании анионом катализатора, может образовать непредельный (побочный) продукт алкилирования адамантана – 1-изобутениладамантан, а при взаимодействии с другой молекулой адамантана образует конечный продукт – 1-изобутиладамантан. Последний может образоваться также при совместном действии на адамантил-катион изобутана и аниона катализатора, при этом энергия активации составляет 26.79 ккал/моль.
Взаимные превращения углеводородов (УВ) нефти в условиях кислотного катализа лежат в основе многих промышленных процессов, направленных на получение высококачественных топлив, смазочных масел, исходных соединений для тонкого органического и нефтехимического синтеза. Значительное место среди этих процессов занимают процессы, основанные на использовании реакций изомеризации, крекинга и алкилирования. В частности, давно известно, что одни и те же кислотные катализаторы наряду с крекингом используются и в реакциях алкилирования [1]. Изучение механизмов протекания этих процессов имеет важное научное и прикладное значение для повышения их эффективности, селективности и оптимизации технологических режимов.
В 60-е гг. 20 в. началось развитие химии УВ ряда адамантана. Было установлено, что, несмотря на насыщенный характер циклов адамантана, он оказался весьма активным во многих реакциях, в том числе и в реакции алкилирования. Эти реакции были осуществлены и изучены в условиях кислотного катализа. Было установлено, в частности, что взаимодействие адамантана с продуктами каталитического крекинга изооктана под действием галогенидов алюминия наблюдается уже при 20–50°С и приводит к образованию, преимущественно, 1-изобутиладамантана [2, 3]. В настоящей работе исследован механизм этой реакции с привлечением расчетных методов.
МЕТОДЫ РАСЧЕТОВ
Проведены квантово-химические расчеты изученных систем методом функционала энергии от электронной плотности DFTB3LYP/6-31G* с полной оптимизацией энергии и расчетом частот нормальных колебаний. Рассчитаны геометрические параметры соединений, электронные характеристики, распределение электронной плотности, полные энергии, энергии превращений, энтропии превращений, частоты нормальных колебаний. Оптимизация геометрического строения молекул и расчет частот нормальных колебаний проводились при использовании атомных базисов 6-31G*. Все расчеты с полной оптимизацией геометрии молекул и расчетом частот нормальных колебаний проводились по программе GAUSSIAN-09 [4] под операционной системой LINUX.
DFTB3LYP представляет собой сочетание метода Хартри–Фока и теории функционала плотности с применением градиентно-скорректированного функционального ряда Бекке с тремя параметрами (В3) [5, 6] и корреляционного функционального ряда Ли−Янга (LYP) [7]. Для каждой молекулы было оптимизировано геометрическое расположение атомов с использованием аналитических методов расчета. Путем расчета частот нормальных колебаний с использованием вторых производных было подтверждено, что точки стационарности, определенные при оптимизации геометрии, являются минимумами энергии.
Выполнены расчеты фрагментов потенциальной поверхности реакций. Переходные состояния реакций рассчитывались методами синхронного транзита QST2 и QST3 [8, 9]. Для установления соответствия полученных переходных состояний предполагаемой реакции использован метод IRC [10].
РЕЗУЛЬТАТЫ РАСЧЕТОВ
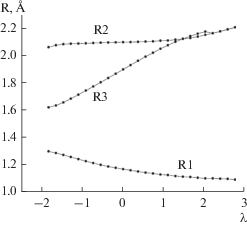
Каталитический крекинг изооктана. Рассчитаны фрагменты потенциальной поверхности взаимодействия AlCl3 · HCl и изооктана. На основе этих расчетов установлено переходное состояние при переносе протона каталитического кислотного центра AlCl3 · HCl на молекулу изооктана. Строение переходного состояния TS1 представлено на рис. 1. Этот процесс является первой стадией каталитического крекинга изооктана. Изучена зависимость полной энергии системы (изооктан плюс катализатор) от координаты реакции первой стадии λ. Эта зависимость получена при применении вычислительной процедуры IRC. При λ = 0 наблюдается максимальное значение энергии системы, что соответствует образованию первого переходного состоянияTS1. Из наших расчетных данных следует, что в ходе первой стадии полная энергия проходит через максимум, при этом расстояния R1 и R3 увеличиваются, а R2 уменьшается (рис. 1, 2). Увеличение R3 приводит к полному разрыву связи С–С в изооктане. Одновременно происходит перенос электрона с фрагмента системы (СН3)3С на остальную часть молекулы изооктана. Энергия активации первой стадии крекинга изооктана вычислена равной 24.64 ккал/моль.
Рис. 1.
Переходное состояние TS1 в результате переноса протона катализатора H+AlCl4– на молекулу изооктана.

На рис. 3 приведено строение первого интермедиата (INT_1) после полного переноса протона на первичный атом углерода, т.е. после первой стадии реакции крекинга изооктана при взаимодействии с кислотным катализатором. Фактически на рис. 3 представлены три взаимодействующие между собой подсистемы: катион (СН3)3С+, анион ${\text{AlCl}}_{4}^{ - }$ и СН3–СН(СН3)2, т.е. изобутан. В INT_1 имеется слабая водородная связь между катионом (CH3)3C+ и изобутаном. С обеими частицами взаимодействует анион ${\text{AlCl}}_{4}^{ - }$. Подсистемы катион (СН3)3С+ и анион ${\text{AlCl}}_{4}^{ - }$ могут подвергаться реакции переноса протона с (СН3)3С+ на анион, что является второй стадией реакции каталитического крекинга изооктана. На рис. 4 приведено строение переходного состояния TS2 этой стадии.
Рис. 3.
Интермедиат INT_1, образующийся при переносе протона катализатора H+${\text{AlCl}}_{4}^{ - }$ на молекулу изооктана.

Рис. 4.
Переходное состояние TS2 при переносе протона от ${\text{CMe}}_{3}^{ + }$ к аниону ${\text{AlCl}}_{4}^{ - }$.

Переходное состояние TS2 характеризуется значением R1 = 1.741 Å и R2 = 1.426 Å. Рассчитано, что энергия активации этой стадии реакции составляет 7.85 ккал/моль.
Образование 1-адамантил-катиона. Алкилирование адамантана, вероятнее всего, происходит в результате взаимодействия олефина с адамантил-катионом, возможные пути образования которого рассмотрены ниже. Одна из таких возможностей – реакция адамантана с карбкатионом (CH3)3C+:
(1)
$\begin{gathered} {\text{Ad--H}} + {{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{3}}{{{\text{C}}}^{ + }} \to {\text{A}}{{{\text{d}}}^{{\text{ + }}}} + {{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{3}}{\text{CH}}, \\ \Delta Н = - 9.40\,\,{{{\text{к к а л }}} \mathord{\left/ {\vphantom {{{\text{к к а л }}} {{\text{м о л ь }}{\text{.}}}}} \right. \kern-0em} {{\text{м о л ь }}{\text{.}}}}\quad \\ \end{gathered} $По нашим расчетам, эта реакция не требует энергии активации.
Непосредственное протонирование адамантана при взаимодействии с катализатором, по нашему мнению, существенно менее вероятно и требует достаточно большой энергии активации:
(2)
$\begin{gathered} {\text{Ad--H}} + {\text{AlC}}{{{\text{l}}}_{3}}{ \cdot HCl} \to {\text{Ad}}{\kern 1pt} --{\kern 1pt} {\text{H}}_{2}^{ + }{\text{AlCl}}_{4}^{ - }, \\ \Delta Н = + 16.61\,\,{{{\text{к к а л }}} \mathord{\left/ {\vphantom {{{\text{к к а л }}} {{\text{м о л ь }}}}} \right. \kern-0em} {{\text{м о л ь }}}}, \\ \end{gathered} $(3)
$\begin{gathered} {\text{Ad}}{\kern 1pt} --{\kern 1pt} {\text{H}}_{2}^{ + } \to {\text{ A}}{{{\text{d}}}^{{\text{ + }}}} + {{{\text{H}}}_{2}}, \\ \Delta Н = --7.10\,\,{{{\text{к к а л }}} \mathord{\left/ {\vphantom {{{\text{к к а л }}} {{\text{м о л ь }}}}} \right. \kern-0em} {{\text{м о л ь }}}}. \\ \end{gathered} $Судя по значениям ΔН этих реакций, реакция (1) предпочтительнее.
Взаимодействие 1-адамантил-катиона с изобутиленом. Изобутилен H2C=CMe2 образуется при каталитическом крекинге изооктана и присоединяется к адамантил-катиону без энергии активации по реакции:
(4)
$\begin{gathered} {\text{A}}{{{\text{d}}}^{{\text{ + }}}} + {{{\text{H}}}_{{\text{2}}}}{\text{C}} = {\text{CM}}{{{\text{e}}}_{2}} \to {\text{Ad}}{\kern 1pt} --{\kern 1pt} {{{\text{H}}}_{{\text{2}}}}{\text{С }}{\kern 1pt} --{\kern 1pt} {\text{С М е }}_{2}^{ + }, \hfill \\ \Delta H = --14.57\,{\text{к к а л /м о л ь }}{\text{.}} \hfill \\ \end{gathered} $Образовавшийся в этой реакции карбкатион может взаимодействовать с анионом катализатора ${\text{AlCl}}_{4}^{ - }$, что при переносе протона приводит к образованию 1-изобутениладамантана Ad–HС=СМе2. При взаимодействии этого карбкатиона может происходить перенос протона от него на анион ${\text{AlCl}}_{4}^{ - }$ по следующей реакции:
(5)
$\begin{gathered} {\text{Ad}}{\kern 1pt} --{\kern 1pt} {{{\text{H}}}_{{\text{2}}}}{\text{С }}{\kern 1pt} --{\kern 1pt} {\text{CMe}}_{2}^{ + } + {\text{AlCl}}_{4}^{ - } \to \\ \to {\text{Ad}}{\kern 1pt} --{\kern 1pt} {\text{HС }}\,{\text{ = С М }}{{{\text{е }}}_{{\text{2}}}} + {\text{ AlC}}{{{\text{l}}}_{3}} \cdot {\text{HCl}}, \\ \Delta H = --49.21{\text{ к к а л /м о л ь }}. \\ \end{gathered} $Строение Ad–HС=СМе2 показано на рис. 5.
Катион Ad–CH2-P+(CH3)2 может взаимодействовать с адамантаном, образуя межмолекулярный комплекс с водородной связью INT_2 по реакции (6); его строение показано на рис. 6:
(6)
$\begin{gathered} {\text{Ad--C}}{{{\text{H}}}_{{\text{2}}}}{\text{--}}{{{\text{C}}}^{ + }}{{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{2}} + {\text{H--Ad}} \to {\text{INT}}{\kern 1pt} \_2, \\ \Delta Н = --0.34\,\,{{{\text{к к а л }}} \mathord{\left/ {\vphantom {{{\text{к к а л }}} {{\text{м о л ь }}}}} \right. \kern-0em} {{\text{м о л ь }}}}. \\ \end{gathered} $Интермедиат INT_2 легко распадается на 1-изобутиладамантан и 1-адамантил-катион в результате реакции (7):
(7)
$\begin{gathered} {INT\_2} \to {\text{Ad--C}}{{{\text{H}}}_{{\text{2}}}}{\text{--CH}}{{\left( {{\text{C}}{{{\text{H}}}_{3}}} \right)}_{2}} + {\text{Ad}}\left( + \right), \\ \Delta Н = + 4.16\,\,{{{\text{к к а л }}} \mathord{\left/ {\vphantom {{{\text{к к а л }}} {{\text{м о л ь }}}}} \right. \kern-0em} {{\text{м о л ь }}}}. \\ \end{gathered} $Взаимодействие 1-адамантил-катиона с изобутаном. При переносе протона от изобутана к ${\text{AlCl}}_{4}^{ - }$ одновременно происходит сокращение расстояния между Ad+ и изобутаном и образуется переходное состояние TS3, которое изображено на рис. 7.
Рис. 7.
Строение переходного состояния TS3 взаимодействия 1-адамантил-катиона с изобутаном в присутствии аниона ${\text{AlCl}}_{4}^{ - }$.

По нашим расчетам энергия активации каталитической реакции присоединения изобутана к 1-адамантил-катиону составляет 26.79 ккал/моль, а ΔН = +1.86 ккал/моль.
Таким образом, в результате применения квантово-химических расчетов (метод функционала энергии от электронной плотности DFTB3LYP/6-31G*) для выяснения особенностей механизмов каталитической реакции алкилирования адамантана непредельными продуктами каталитического крекинга изооктана показано, что на первой стадии происходит перенос протона катализатора на изооктан с образованием интермедиата, а затем олефина. Образующийся третичный адамантил-катион без энергии активации присоединяет олефин, и образующийся комплекс при взаимодействии с анионом катализатора может образовать непредельный продукт алкилирования адамантана – 1-изобутениладамантан, либо при взаимодействии с другой молекулой адамантана образовать конечный продукт – 1-изобутиладамантан и новый адамантил-катион. В эксперименте при алкилировании адамантана пропиленом над алюмооксидным катализатором содержание в продуктах реакции непредельного углеводорода 1-пропениладамамантана в некоторых случаях достигало 29% [2, с. 159]. 1-Изобутиладамантан может образоваться также альтернативным путем: при совместном действии на 1-адамантил-катион изобутана и аниона катализатора, при этом энергия активации составит 26.79 ккал/ моль.
Список литературы
Лавровский К.П. Избранные труды. М.: Наука, 1976, С. 40, 59, 62, 75.
Багрий Е.И. Адамантаны: получение, свойства, применение. М.: Наука, 1989. 264 с.
Багрий Е.И., Фрид Т.Ю., Санин П.И. // Известия АН СССР. Сер. хим. 1970. № 2. С. 498.
Gaussian 09W, Version 7.0, Copyright 1995 -09 Gaussian, Inc.
Parr R.G., Yang Y. Density-Functional Theory of A-toms and Molecules. Oxford: Oxford Univ. Press, 1989.
Becke A.D. // Phys. Rev. A. 1988.V. 38. P. 3098.
Lee P., Yang W., Parr R.G. // Phys. Rev. B. 1988. V. 37. P. 785.
Gonzalez P., Schlegel H.B.// J. Phys. Chem. 1990. V. 94. № 14. P. 5523.
Schlegel H.B., Robb M.A. // Chem. Phys. Lett. 1982. V. 93. N 1. P. 43.
Schlegel H.B., Geometry optimization on potential energy surfaces, in Modern Electronic Structure Theory. Ed. Yarkony D.R. Singapore: World Scientific Publishing, 1995.
Дополнительные материалы отсутствуют.