Нефтехимия, 2019, T. 59, № 2, стр. 186-193
Влияние параметров процесса на гидротермальное ожижение микроводорослей, выращенных в городских сточных водах
J. Arun 1, S. J. Shreekanth 1, R. Sahana 1, M. S. Raghavi 1, K. P. Gopinath 1, *, D. Gnanaprakash 1, **
1 Department of Chemical Engineering, SSN College of Engineering, Rajiv Gandhi Salai (OMR)
Tamil Nadu, Kalavakkam, India
* E-mail: gopinathkp@ssn.edu.in
** E-mail: gnanaprakashd@ssn.edu.in
Поступила в редакцию 18.12.2017
После доработки 15.10.2018
Принята к публикации 17.04.2018
Аннотация
В настоящее время, в рамках концепции устойчивого развития акцент новых научных исследований смещается в сторону изучения альтернативных источников углеводородов. Биотопливо, получаемое из растительного сырья непищевого назначения, является одним из таких перспективных источников углеводородов. Благодаря высокому содержанию липидов, быстрому росту и простоте культивирования микроводоросли могут выступать в качестве перспективного исходного материала для получения биогенных углеводородов. В настоящем исследовании было проанализировано влияние параметров процесса гидротермального ожижения микроводорослей Scenedesmus obliques, выращенных в фотобиореакторе с использованием муниципальных сточных вод в качестве источника их питания. Были проведены серии сравнительных экспериментов по гидротермальному ожижению смесей микроводоросли S. obliques – вода в различных соотношениях (5/200, 10/200, 15/200 и 20/200 г/мл) в температурном диапазоне от 200 до 340°С в атмосфере азота при давлении 5 МПа. Изучено влияние загрузки катализатора − NaOH на выход биомасла путем варьирования загрузки щелочи в диапазоне 2.5−8 мас. %. Качественный и количественный состав полученного биомасла был охарактеризован с использованием методов хромато-масс-спектрометрии (ГХ-МС), газовой хроматографии (ГХ) и ИК-спектроскопии с преобразованием Фурье. Максимальный выход биотоплива 24.57 мас. % был достигнут при температуре 300°С, концентрации микроводорослей в исходном водном растворе 15 г/200 мл и содержании катализатора 2.5 мас. % за 60 мин реакции. Газообразные продукты содержали 22 об. % водорода, 18 об. % диоксида углерода, 27 об. % монооксида углерода, 22 об. % метана и небольшого количества сероводорода.
В течение последних двух десятилетий нарастает обеспокоенность по поводу истощения запасов ископаемого топлива, что влечет за собой интенсификацию разработок по использованию возобновляемых источников энергии. Одним из таких альтернативных источников энергии являются липиды, получаемые из масленичных культур, и отработанные пищевые жиры. Однако, возрастающие энергетические потребности человечества и острая проблема использования пахотных земель для выращивания растений на продовольственные нужды заставили обратить взгляды научного сообщества на микроводоросли [1]. Применение микроводорослей для очистки сточных вод с последующим их концентрированием и выделением может дать источник удобрений, кормов для животных, либо исходного материала для производства топлив биогенного происхождения [2]. Так, из липидной части микроводорослей может быть произведен биодизель, представляющий собой метиловый или этиловый эфир жирных кислот, полученный путем переэтерификации в кислой или щелочной среде [3].
Использование микроводорослей для производства биотоплива и химикатов обладает рядом преимуществ по сравнению с использованием наземных растений. Главные из них – возможность выращивания микроводорослей в различных акваториях, на территориях непахотных земель, а также более высокие темпы роста, чем у наземных растений [4]. За последнее время разработано несколько перспективных штаммов микроводорослей для культивирования в фотобиореакторах, обладающих высокими показателями по поглощению углекислого газа и, как результат, быстрым ростом микроводорослей [5]. Таким образом, применение микроводорослей для очистки сточных вод явялется одним из экологически безопасных и экономичных подходов, обеспечивающих секвестрацию диоксида углерода в природе и дающих сырье для производства биотоплива [6].
В [7] было показано, что в ходе пиролиза смеси циклогексана и бензола в сверхкритических условиях в проточном реакторе циклогексан подвергается крекингу в значительно большей степени, чем бензол. Термохимический процесс превращения биомассы в биотопливо является процессом гидротермального ожижения. Данный процесс намного предпочтительнее пиролиза, поскольку выход жидких продуктов значительно выше [8].
В ходе гидротермального ожижения биомакромолекул происходит их разложение в водной среде на более легкие молекулы, которые затем, при необходимости, могут быть переработаны в углеводородные компоненты топлив [9]. Акватермолиз может не только способствовать процессу висбрекинга тяжелых нефтяных фракций, но и улучшать пиролиз и удалять некоторые гетероатомы (S, O и N), что приводит к повышению качества получаемой продукции [10].
В настоящем исследовании муниципальные сточные воды были предварительно обработаны и использованы для культивирования микроводорослей S. obliques в аэрируемом фотобиореакторе. Для производства биомасла из микроводорослей проводилось гидротермальное каталитическое ожижение. Биомасло из продуктов реакции экстрагировали с помощью растворителя и анализировали методами хромато-масс-спектрометрии, газовой хроматографии и ИК-спектроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Источники микроводорослей и сточных вод. Микроводоросли S. obliques были выделены из водоема города Ченнай в соответствии со стандартными протоколами [9]. Выращивание микроводорослей проводили в 1-литровом стеклянном сосуде, содержащем 800 мл маточного раствора BG11 [6], при интенсивности света 2000 Лк с использованием флуоресцентных ламп при аэрировании углекислым газом 0.2 объем воздуха/объем культуры/мин (2.5%). При данных условиях микроводоросли культивировали в течение 12−15 дней при комнатной температуре 27 ± 3°С. Сточные воды брали непосредственно с очистных сооружений района Перугунди г. Ченнай. Перед использованием сточные воды предварительно обрабатывали и выдерживали при температуре 4°С. Эти сточные воды использовали для разработки микроводорослей; азот (N), фосфор (P) и химическая потребность в кислороде (ХПК) были разрешены с использованием протокола для каждого теста [11]. Основные свойства сточных вод приведены в табл. 1. Степень извлечения различных соединений гетероатомов: азотистых (N−NH4), фосфорных (P−PO4) и кислородсодержащих (С-ацетат) оценивались по стандартным методикам [11]. Характеристики роста водорослей и степени извлечения гетероатомов из сточных вод представлены в табл. 1.
Таблица 1.
Сравнительные данные по росту различных штаммов микроводорослей и степени извлечения гетероатомов (азотистых (N−NH3) и кислородсодержащих (С-ацетат) соединений) из сточных вод (способ культивирования миксотрофный)
| Сточные воды | Штамм микро-водорослей | Содержание микро-водорослей, г/л | Степень извлечения С-ацетат, % | Степень извлечения N−NH3, % | Ссылка |
|---|---|---|---|---|---|
| Искуственная смесь | C. sorokiniana | 1.97 | 94.7 | 100 | [12] |
| Агро-зоотехнические отходы | C. vulgaris CCAP 211/11b | – | Незначительно | 99.9 | [13] |
| Муниципальные отходы | C. vulgaris ESP-6, S. sobliques | 0.231 | 26.0 | 97.0 | [14] |
| Отходы свинофермы | C. pyrenoidosa | 0.3 | 55.4 | 91.2 | [15] |
| Отходы свинофермы | C. zofingiensis | 2.96 | 79.84 | 81.0 (КАС) | [16] |
| Отходы свинофермы после анаэробной обработки | C. vulgaris CY5, S. obliques | 4.25 | –** | КАС* <5 mg/L | [17] |
| Отходы свинофермы | C. vulgaris JSC-6, S. obliques | 2.35 | 70.0 | 91.3 | [18] |
| Муниципальные отходы | S. obliques | 3.8 | 76.5 | 91.8 | Настоящая работа |
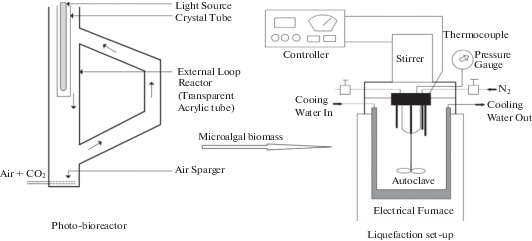
Культивирвоание и выделение микроводорослей. Микроводоросли S. obliques выращивались в миксотрофных условиях с использованием смеси сточных вод и питательной среды BG-11. Для ускорения роста микроводорослей в питательную среду добавляли 20 об. % агента f/2. Для культивирования микроводорослей использовался 5-литровый полипропиленовый фотобиореактор (рис. 1), освещенный белым флуоресцентным светом интенсивностью 200 Вт/м при постоянной подаче CO2, равной 0.2 объем воздуха/1 объем культуры/мин (2.5%). Контроль роста микроводорослей проводили каждый день с использованием УФ-спектрофотометра (с оптической толщиной OD680 нм) [19]. С целью варьирования рН растворов до 10, 10.5, 11, 11.5 и 12 в маточный раствор добавляли гидроксид натрия (NaOH). Навеску биомассы микроводорослей центрифугировали при частоте 50 об/мин в течение 15 мин и выдерживали для стабилизации. Степень флокуляции оценивали путем сравнения объемов сточных вод и всплывшего осадка, полученного после центрифугирования и седиментации при комнатной температуре в течение 30 мин и 24 ч [20]. Затем микроводоросли высушивали, тщательно гранулировали и выдерживали при –20°С.
Характеристика микроводорослей. Содержание влаги в микроводорослях определяли путем расчета убыли массы после выдерживания в печи при 103°C в течение 16 ч, в соответствии со стандартом ASTM E 871. Зольность измеряли согласно стандартному методу ASTM E 1755. Содержание жиров и белков в микроводорослях было проанализировано с помощью биохимических экспериментов.
Термогравиметрическое исследование. Термогравиметрический анализ микроводорослей был выполнен с использованием анализатора Shimadzu TGA 50H в атмосфере азота. Для исследования брали навеску (примерно 10 мг) микроводорослей и нагревали от 30 до 800°С при скоростях нагрева 10, 20, 30, 40 и 50°С/мин и выдерживали при конечной температуре в течение 10 мин [21].
Процесс ожижения. В качестве реактора использовали автоклав высокого давления из нержавеющей стали (рис. 1). Объем автоклава составляет 250 мл, внутренний диаметр 80 мм при высоте 100 мм. В ходе экспериментов использовали различные концентрации микроводорослей S. obliques (5/200, 10/200, 15/200 и 20/200 г/мл) в интервале температур от 200 до 340°С при загрузке катализатора 2.5−8 мас. % NaOH в атмосфере азота при давлении 5 МПа. Азот выделялся из воздуха с помощью азотной камеры. Время эксперимента составляло 60 мин во всех экспериментах. Гомогенизация раствора обеспечивалась с помощью мешалки при частоте вращения 720 об./мин. После эксперимента автоклав остужали на воздухе при комнатной температуре. Полученные твердый остаток и произведенный газ отправляли на анализ [22].
Выделение биомасла из микроводорослей. Для выделения липидной части водорослей использовали экстракцию как наиболее подходящий метод из известных, позволяющий достигать степени выделения масла 99.3−99.5% [23]. Основное влияние на процесс экстракции оказывает природа растворителя. Известно применение таких растворителей, как хлороформ, гексан, циклогексан, ацетон и бензол, как в чистом виде, так и в виде смесей [24]. Для данной работы в качестве растворителя был выбран гексан ввиду его низкой токсичности и стоимости [25]. Гексан добавлялся в автоклав с микроводорослями при постоянном перемешивании, после чего смесь фильтровали для удаления твердых остатков. Далее жидкий продукт разделялся на органическую и водную фазы в делительной воронке. Из органической фазы гексан выделяли методом перегонки. Выход масла (мас. %) определяли по следующему уравнению:
Характеристика продуктов. Для идентификации получаемых продуктов использовали газовую хроматографию (хроматограф Agilent 7890 GC, оснащенный автоматическим инжектором Agilent 7683B, колонка HP-5 (100 м × 320 мкм × 0.25 мкм), пламенно-ионизационный детектор ПИД). Для проведения анализа биомасло метилировали в метиловые эфиры соответствующих кислот с помощью гидроксида триметилсульфония. Также, для идентификации различных функциональных групп продуктов реакции использовали ИК-спектроскопию.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Были выявлены временные зависимости миксотрофного роста микроводорослей S. obliques. Наиболее интенсивный прирост биомассы наблюдался между девятым и десятым днями культивирования и составлял 3.8 г/л. Как и у других микроорганизмов, жизненный цикл микроводорослей подразделяется на пять стадий: адаптация, экспоненциальный рост, замедление роста, стационарное состояние и смерть [26]. Сбор микроводорослей после периода культивирования проводился методом флокуляции. На рис. 2 представлен выход массы микроводорослей 84.4%, достигаемый за 30 мин при рН среды 12. Снижение рН среды до 10 приводит к резкому уменьшению выхода осадка микроводорослей до 18%. При выдерживании раствора микроводорослей с флоккулирующим агентом при рН 10 в течение 24 ч выход массы микроводорослей составил 29%, при увеличении рН до 12 выход микроводорослей был равен 91.2%. В целом, увеличение рН среды приводит к увеличению скорости флокуляции биочастиц (белки, жиры и прочие), что влечет за собой захват зеленых клеток микроводорослей из объема и интенсификации седиментации [27].
Очистка сточных вод с использованием водорослей. При контактировании микроводорослей со сточными муниципальными водами наблюдалось существенное снижение содержания азота как в виде аммиачных, так и в виде нитратных соединений, что ранее также было обнаружено Ханом и др. [28]. Эксперименты, проведенные в аналогичных условиях Кширсагаром [29], показали что при использовании микроводорослей Chlorella vulgaris и Scenedesmus quadricauda за 15 дней степень удаления соединений азота составила 78.1 и 70.3%, соответственно. В настоящем исследовании на 7-й и 15-й дни наблюдалось удаление аммиачного азота на 86.9 и 91.8% соответственно, тогда как степень удаления нитратов составила 54.6 и 89.3%. Таким образом, в процессе роста микроводорослей и их последующей седиментации с целью переработки могут быть эффективно удалены соединения азота из маточного раствора [30]. В ходе культивирования микроводорослей S. obliques в разбавленных сточных водах наблюдается также значительное сокращение относительного содержания кислородсодержащих соединений (С-ацетат) в зависимости от условий до 20.6−88% [14]. В табл. 1 приведены сравнительные данные по степени извлечения различных соединений из сточных вод при помощи микроводорослей, в т.ч. S. obliques.
Характеристика микроводорослей. Влажность микроводорослей S. obliques, используемых для этого исследования, составляла 10.7 ± 0.2 мас. %, зольность около 11.5±0.3 мас. %, удельная теплота сгорания 18.2±0.4 МДж/кг. Следует отметить, что зольность и содержание азота в микроводорослях превышает эти показатели у наземных растений, а содержание кислорода наоборот меньше [31]. Это обусловлено наличием в составе клеток водорослей белков (51−58%), крахмала (12−17%), липидов (14−22%) и нуклеиновых кислот (4−5%). В этом исследовании содержание белка составляло 54.62%, а содержание липидов – примерно 12.32%.
Термогравиметрический анализ. На рис. 3 представлены кривые потери массы образцом микроводорослей S. obliques при различных скоростях нагрева в атмосфере азота. По кривым потери массы видно, что после 600°С остаток массы составляет соответственно 26.3, 21, 23, 23 и 24.5% для скоростей нагрева 10, 20, 30, 40 и 50°C/мин. Представленные кривые условно можно разделить на три стадии, где первичная стадия (40−200°C) демонстрирует небольшую потерю массы, вызванную прежде всего потерей влаги. Потеря массы на этом этапе составила 10.7 ± 0.2%, что эквивалентно определенной ранее влажности используемых микроводорослей. Вторая стадия (200−600°C) сопряжена со значительным снижением веса образца, когда происходит быстрый крекинг углеводородов клетки, а третья стадия (600−800°C) относится к медленному уплотнению и коксованию оставшегося после второй стадии углеродистого материала. Как видно из рис. 3, большая часть органических соединений подвергается разложению на второй стадии в интервале температур 200−350°С, аналогичные результаты были получены ранее для макроводорослей [32]. Потеря массы после 600°C может быть вызвана разложением липидов.
Процесс ожижения. Помимо биомасла, в процессе ожижения микроводорослей образуются газообразные и твердые продукты. Твердые частицы в основном представляют собой кокс или так называемый биоуголь. В настоящем исследовании выход биоугля составлял приблизительно 2 г/15 г водорослей. Выход и состав жидких и газообразных продуктов ожижения микроводорослей зависит от многих параметров, таких как температура, штамм микроводорослей, размер частиц превращаемых микроводорослей, скорость нагрева, рабочее давление и конфигурация реактора [33]. В нашей работе было обнаружено, что газ, образующийся в процессе ожижения, состоит из 22 об. % водорода, 18 об. % двуокиси углерода, 27 об. % монооксида углерода, 22 об. % метана и небольшого количества других газообразных компонентов (H2S). Значения состава реакционного газа были рассчитаны без учета азота, поскольку он был удален во время процесса ожижения.
Влияние температуры реакции. Эксперименты показали, что в интервале содержания катализатора в реакционной массе 2.5−8 мас. % наибольший выход биомасла наблюдается при загрузке катализатора 2.5 мас. %. Увеличение загрузки катализатора (5 и 8 мас. %) не привело к значительному увеличению выхода биомасла по сравнению с 2.5 мас. % загрузки (данные в работе не приводятся). Влияние температуры реакции на общий выход биомасла в ходе ожижения микроводорослей S. obliques изучалось при содержании микроводорослей в маточном растворе 15 г/200 мл, концентрации катализатора 2.5 мас. % NaOH, атмосфере азота и времени контактирования 1 ч. Результаты представлены на рис. 4, из которого видно, что увеличение температуры благоприятно сказывается на выходе биомасла, так нагрев с 200 до 340°С увеличивает выход биомасла более чем на 10%.
Влияние загрузки. На рис. 5 показано влияние содержания загружаемых в реактор микроводорослей на выход биомасла при температуре 340°С, содержании катализатора 2.5 мас. % NaOH и времени контактирования 60 мин при различных атмосферах. Из этого же рисунка видно, что увеличение количества загружаемых в реактор микроводорослей пропорционально увеличивает выход биомасла. Следует отметить, что оптимальной исходной концентрацией микроводорослей является 0.75 г/мл, при ее увеличении выход биомасла снижается из-за протеания побочных реакций циклизации и поликонденсации образующихся углеводородных фрагментов. Недавно Бисвас и др. [34] сообщили, что гидротермальное ожижение микроводорослей (Sargassum tenerrimum) в среде различных растворителей (вода, метанол и этанол) при разной температуре дает максимальный выход биомасла 23.8 мас. % при 300°С в растворителе – этаноле.
Характеристика биомасла. Физическо-химические свойства биомасла и продуктов его фракционирования представлены в табл. 2. Филатов и др. [35] сообщали, что при биогенном окислении высоковязкой нефти из Ашальчинского месторождения наблюдалось интенсивное разложение смол и асфальтенов, содержание которых в получаемом нами биомасле достигает 30%. Таким образом, можно использовать метод, предложенный Филатовым и др., для увеличения выхода топливных фракций из получаемого нами биомасла.
Таблица 2.
Физико-химические свойства биомасла
| Парaметр | Значение |
|---|---|
| Плотность, кг/м3 | 962.32 |
| Вязкость при 20°C, мПа с, | 2453 |
| Элементный состав, мас. % | |
| Углерод | 82.34 |
| Водород | 11.76 |
| Азот | 1.72 |
| Кислород | 2.55 |
| Сера | 1.63 |
| Фракционный состав, мас. % | |
| Масла (углеводороды) | 71.25 |
| Асфальтены | 13.32 |
| Смолы | 15.43 |
Согласно данным ИК-спектроскопии варьирование условий процесса ожижения микроводорослей не оказывает влияния на состав получаемого биомасла. ИК-спектры для всех экспериментов были идентичными. Полосы поглощения 1404.36 и 1554.15 см–1 могут отвечать дфеформационным колебаниям СН2- и СН3-групп, что характеризует наличие алканов в биомасле. Валентные колебания O−H, возникающие на частоте 3349.01 см–1, могут быть вызваны наличием примеси воды или спиртов. Полосы поглощения 595.48, 549.99, 487.18, 473.03, 465.49 и 459.21 см–1 могут быть обусловлены колебаниями С−Н в составе сложных эфиров и ароматических соединений. Полоса поглощения C=O в диапазоне 3349−1634.67 см–1 указывает на присутствие карбоновых кислот, кетонов или альдегидов. Таким образом, можно заключить, что в полученном биомасле присутствует значительное количество ненасыщенных углеводородов (алкены, алкины, арены). Тем не менее, для использования получаемого продукта в качестве топлива необходима его доработка.
ГХ-МС анализ биомасла. Метод газовой хроматографии и масс-спектрометрии (ГХ−МС) является одним из предпочтительных методов для качественной идентификации неполярных биологически активных, летучих эфирных масел, ненасыщенных жиров и липидов. В ходе проведения экспериментальных работ было проанализировано около двадцати образцов биомасла. В настоящей работе мы специально разработали ступенчатый нагрев колонки для идеального разделения хроматографических пиков при разумном времени анализа. В табл. 3 показано наличие даже ненасыщенных жиров, содержащих от 12 до 18 атомов углерода.
Таблица 3.
Идентификация компонентов биомасла методом хромато-масс-спектрометрии
| № | Время удерживания, мин | Площадь, % | Название | Формула | Молекулярная масса, г/моль |
|---|---|---|---|---|---|
| 1 | 4.866 | 0.1489 | Додекан | C12H26 | 170.34 |
| 2 | 5.098 | 0.1356 | 1-Этил-2-пиролидинон | C6H11NO | 113.16 |
| 3 | 5.190 | 0.1873 | 1,2-Циклопентадион | C5H6O2 | 98.1 |
| 4 | 5.371 | 0.278 | Тетрадекан | C14H30 | 198.34 |
| 5 | 5.538 | 84.73 | β-Иланген | C15H24 | 204 |
| 6 | 6.717 | 0.381 | β-Феландрен | C10H16 | 136.23 |
| 7 | 7.016 | 0.463 | Пентадекановая кислота | C15H30O2 | 242.4 |
| 8 | 7.548 | 0.203 | Пальмитиновая кислота | C16H32O2 | 256.42 |
| 9 | 7.914 | 0.153 | транс-Z-α-бизаболен эпоксид | C15H24O | 220.35 |
| 10 | 9.322 | 0.974 | Диоктилфталат | C24H38O4 | – |
| 11 | 12.256 | 0.325 | Δ-Кадинен | C15H24 | 204.35 |
| 12 | 13.449 | 0.656 | Не идентетифицировано | – | – |
| 13 | 13.915 | 0.597 | Доконексент | C22H32O2 | 328 |
| 14 | 14.245 | 0.129 | Не идентифицировано | – | – |
| 15 | 14.368 | 0.132 | Ацетат геранил | C12H20O2 | 196.29 |
| 16 | 14.711 | 0.211 | Стигмастенол | C29H52O | 416.73 |
| 17 | 15.488 | 0.49 | Не идентифицировано | – | – |
| 18 | 16.771 | 0.34 | Метилпальмитат | C17H34O2 | 270.45 |
| 19 | 16.924 | 0.183 | Не идентифицировано | – | – |
| 20 | 17.143 | 0.06 | Метилфенантрен | C15H12 | 173.9 |
Следует отметить присутствие стигмастанола в продуктах реакции, наличие которого характерно для различных видов макрорастений. Исследование алифатических фракций показало, что в этих фракциях имеются н-алканы. Анализ распределения н-алканов показал наличие углеводородов с количеством атомов углерода в цепи 12−14 и тяжелых парафинов с количеством атомов углерода 22−30. Обнаружено значительное количество высших парафинов, связанных через сложноэфирные и сульфидные мостики, которые широко представлены в составе тяжелой нефти [36].
Таким образом, показана перспективность использования микроводорослей S. obliques в качестве источника биомасла, включающего в состав широкий ряд промышленно важных соединений. Важными достоинствами предлагаемой разновидности микроводрослей является возможность с их помощью извлекать из муниципальных сточных вод 91.8% N−NH3 и 76.5% кислородсодержащих, а также их высокое содержание в маточном растворе, равное 3.7 г/л.
Были выбраны оптимальные условия гидротермального ожижения микроводорослей, заключающиеся в добавлении 2.5 мас. % катализатора (NaOH) к водном раствору микроводорослей с их содержанием 15 г /200 мл и проведении реакции при температуре 300°C в течение 60 мин, обеспечивающие выход биомасла 24.57%. Исследования методом ГХ-МС и ИК-спектроскопии показали, что биомасло в основном содержит альдегиды, фенолы, кетоны, алкены, жирные кислоты, сложные эфиры и азотсодержащие гетероциклические соединения.
Список литературы
Pittman J.K., Dean A.P., Osundeko O. // Bioresour. Technol. 2011. V. 102. P. 17.
Christenson L., Sims R. // Biotechnol. Adv. 2011. V. 29. P. 686.
Demirbas A. // Energy Policy. 2007. V. 35. № 9. P. 4661.
Zhao C., Bruck T., Lercher J.A. // Green Chemistry. 2013. V. 15. № 7. P. 1720.
Deschenes J.S., Boudreau A., Tremblay R. // Algal Research. 2015. V. 10. P. 80.
C. Alcantara, E. Posadas, B. Guieyss, and R. Munoz. Handbook of Marine Microalgae. Elsevier Inc., 2015. P. 439). http://dx.doi.org/10.1016/B978-0-12-800776-1.00029-7.
Zhou H., Gao X., Liu P., Zhu Q., Wang J., Li X. // Petrol. Chemistry. 2017. V. 57. № 1. P. 71.
Chen P., Min M., Chen Y., Wang L., Li Y., Chen Q., Wang C., Wan Y., Wang X., Cheng Y., Deng S., Hennessy K., Lin X., Liu Y., Wang Y., Martinez B., Ruan R. // Int. J. Agric. & Biol. Eng. 2009. V. 2. № 4. P. 1.
Mata T.M., Martins A.A., Caetano N.S. // Renewable and Sustainable Energy Reviews. 2010. V. 14. № 1. P. 217.
Chen G., Yuan W., Bai Y., Zhao W., Gu X., Zhang J., Jeje A. // Petrol. Chemistry. 2017. V. 57. № 5. P. 389.
DR/890 Colorimeter. Procedures Manual. Hach Company. 1997–2009, 2013. Loveland, Colorado, USA.
Lim C.Y., Chen C.-L., Wang J.-Y. // Bioresource Technology. 2013. V. 135. P. 175.
Franchino M., Comino E., Bona F.B., Riggio V.A. // Chemosphere. 2013. V. 92. P. 738.
He P.J., Mao B., Lu F., Shao L.M., Lee D.J., Chang J.S. // Bioresource Technology. 2013. V. 146. P. 562.
Wang H., Xiong H., Hui Z., Zeng X. // Bioresource Technology. 2012. V. 104. P. 215.
Zhu L., Wang Z., Shu Q., Takala J., Hiltunen E., Feng P., Yuan Z. // Water Research. 2013. V. 47. P. 4294.
Marjakangas J.M., Chen C.-Y., Lakaniemi A.-M., Puhakka J.A., Whang L.-M., Chang J.-S. // Bioresource Technology. 2015. V. 191. P. 369.
Wang Y., Guo W., Ye H.-W., Ho S.-H., Lo Y.C., Cheng C.-L., Ren N., Chang J.-S. // Bioresource Technology. 2015. V. 198. P. 619.
Nasir N. M., Bakar N.S.A., Lananan F., Hamid S.H.A., Lam S.S., Jusoh A. // Bioresource Technology. 2015. V. 190. P. 492.
Drira N., Piras A., Rosa A., Porcedda S., Dhaouadi H. // Bioresource Technology. 2016. V. 206. P. 239.
Thangalazhy-Gopakumar S., Adhikari S., Chattanathan S.A., Gupta R.B. // Bioresource Technology. 2012. V. 118. P. 150.
Teplyakov V.V., Shalygin M.G., Kozlova A.A., Chistyakov A.V., Tsodikov M.V., Netrusov A.I. // Petrol. Chemistry. 2017. V. 57. № 9. P. 747.
Harith Z.T., Yusoff F.M., Mohamed M.S., Din M.S.M., Ariff A.B. // African J. Biotechnology. 2009. V. 8. P. 5971.
Topare N.S., Rout S.J., Renge V.C., Khedkar S.V., Chavan Y.P., Bhagat S.L. // Int. J. Chem. Sci. 2011. V. 9. № 4. P. 1746.
Rajvanshi S., Sharma M.P. // J. Sustain. Bioenergy Syst. 2012. V. 2. № 3. P. 49.
Ryckebosch E., Muylaert K., Foubert I. // J. Am. Oil Chem. 2012. V. 89. P. 189.
Garcia-Pérez J.S., Beuckels A., Vandamme D., Depraetere O., Foubert I., Parra R., Muylaert K. // Algal Res. 2014. V. 3. P. 24.
Han X., Wong Y.S., Wong M.H., Tam N.F.Y. // J. Hazard. Mater. 2007. V. 146. P. 65.
Kshirsagar A.D. // Int. J. Life Sci. Biotechnol. Pharma Research. 2013. V. 2. P. 339.
Olguin E.J., Galicia S., Mercado G., Perez T. // J. Appl. Phycology. 2003. V. 15. P. 249.
McKendry P. // Bioresource Technology. 2002. V. 83. P. 37.
Kim S.-S., Ly H.V., Kim J., Choi J.H., Woo H.C. // Bioresource Technology. 2013. V. 139. P. 242.
Stephenson A.L., Kazamia E., Dennis J.S., Howe C.J., Scott S.A., Smith A.G. // Energy Fuels. 2010. V. 24. P. 4062.
Biswas B., Kumar A.A., Bisht Y., Singh R., Kumar J., Bhaskara T. // Bioresource Technology. 2017. V. 242. P. 344.
Filatov D.A., Krivtsov E.B., Sviridenko N.N., Golovko A.K., Altunina L.K. // Petrol. Chemistry. 2017. V. 57. № 8. P. 649.
Cheshkova T.V., Kovalenko E.Yu., Gerasimova N.N., Sagachenko T.A., Min R.S. // Petrol. Chemistry. 2017. V. 57. № 1. P. 31.
Дополнительные материалы отсутствуют.