Нефтехимия, 2019, T. 59, № 6-2, стр. 752-757
Алкилирование ароматических углеводородов 2-метил-2-винил-гем-дихлорциклопропаном на цеолитных катализаторах
А. В. Байбуртли 1, Г. З. Раскильдина 1, *, Н. Г. Григорьева 1, 2, С. С. Злотский 1
1 Уфимский государственный нефтяной технический университет
450062 Уфа, Россия
2 Институт нефтехимии и катализа УФИЦ РАН
450075 Уфа, Россия
* E-mail: graskildina444@mail.ru
Поступила в редакцию 26.09.2018
После доработки 02.02.2019
Принята к публикации 12.02.2019
Аннотация
В результате исследования каталитических свойств различных микропористых цеолитов (структурный тип FAU, BEA, MOR, MFI) и микро-мезо-макропористого цеолита H-Ymmm (FAU) в реакции алкилирования аренов (бензола II, толуола III) непредельным соединением (2-метил-2-винил-гем-дихлорциклопропаном I) установлено, что реакция идет с образованием хлоралкиларенов: [1-(2,2-дихлор-1-метилциклопропил)этил]бензола IV и 1-[1-(2,2-дихлор-1-метилциклопропил)этил]-4-метилбензола V. Наиболее селективно соединения IV и V образуются на цеолитных катализаторах H-Beta (до 82%) и H-Ymmm (до 79%) с высокой конверсией соединения I (от 90% до полной). Показано, что высокая селективность по хлоралкиларенам IV и V достигается при 100°С, мольном соотношении арен:непредельное соединение = 8:1, концентрации катализатора 20 мас.% на реакционную массу, продолжительности реакции 2 ч.
Винил-гем-дихлорциклопропаны, представляющие значительный интерес как полупродукты органического синтеза, легко образуются с количественными выходами при дихлоркарбенировании промышленно доступных диенов (дивинил, изопрен) [1–4].
Алкилирование ароматических структур винил-гем-дихлорциклопропанами может быть с успехом использовано для получения широкой гаммы малотоннажных продуктов, содержащих гем-дихлорциклопропановый фрагмент. Образующиеся замещенные бензолы представляют значительный интерес как присадки и добавки к топливам, маслам, полимерам [5].
Ранее изучено кислотно-катализируемое алкилирование бензола и толуола винил-гем-дихлорциклопропанами в присутствии концентрированной серной кислоты. Получены соответствующие алкиларены с низким выходом (до 34%). Показано, что соотношение о-, п-изомеров при алкилировании толуола винил-гем-дихлорциклопропанами составляет 1 : 4 в пользу п‑изомера [6]. Кроме низкого выхода целевого продукта, использованный метод характеризуется смолообразованием, использованием дорогих ор-ганических растворителей, а также многостадийностью – требует стадии нейтрализации и отмывки реакционной массы. Альтернативный метод, исключающий все вышеперечисленные недостатки – катализ с использованием гетерогенных катализаторов. Как признано в последние годы, наиболее эффективными гетерогенными каталитическими системами процессов алкилирования ароматических углеводородов (УВ) олефинами, в том числе промышленных, являются цеолитные [7–11].
В связи с этим, в настоящей работе изучена реакция аренов (бензола, толуола) с 2-метил-2-винил-гем-дихлорциклопропаном под действием различных цеолитных катализаторов: микропористых – H-Y (структурный тип FAU), H-Beta (BEA), H-MOR (MOR), H-ZSM-5 (MFI) и микро-мезо-макропористого – H-Ymmm (FAU).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали бензол (х. ч.) и толуол (х. ч.), выпускаемые фирмой АО “ЭКОС-1”. Исходные ароматические УВ были тщательно очищены и осушены по методике [12].
Непредельное соединение – 2-метил-2-винил-гем-дихлорциклопропан I был получен по методике [4].
Цеолит H-Y (мольное соотношение SiO2/Al2O3 = 5, степень декатионирования αNa = 0.95) получали ионным обменом в растворе NH4NO3 при 70°С цеолита Na-Y, синтезированного в Институте нефтехимии и катализа (ИНК РАН) по методике, описанной в [13]. Цеолит Beta (SiO2/Al2O3 = 18) синтезирован в ОАО “Ангарский завод катализаторов и органического синтеза” в ${\text{NH}}_{4}^{ + }$-форме, в H-форму его переводили термообработкой в атмосфере воздуха при 540°С в течение 3 ч. Цеолит H-ZSM-5 (SiO2/Al2O3 = 30) получен в ООО “Ишимбайский специализированный химический завод катализаторов”. Цеолит Na-MOR (SiO2/Al2O3 = 5.0) синтезирован в ИНК РАН по методике, описанной в [14], и переведен в Н-форму с помощью ионного обмена катионов Na+ на катионы ${\text{NH}}_{4}^{ + }$ с последующей термообработкой полученной аммонийной формы.
Способ приготовления микро-мезо-макропористого цеолита Ymmm в Н-форме (SiO2/Al2O3 = 7.2) описан в [15, 16] и основан на селективной кристаллизации в растворах силиката натрия при 96–98°С гранул, состоящих из высокодисперсного цеолита Na-Y и аморфного связующего материала (метакаолин). С помощью ионного обмена об-разца Na-Ymmm приготовлен образец цеолита H-Ymmm с αNa = 0.95.
Перед каталитическими испытаниями образцы цеолитов подвергали термообработке в атмосфере воздуха при 350°С в течение 4 ч.
Цеолитные катализаторы охарактеризованы с помощью рентгенофазового (РФА) и рентгеноструктурного анализа (РСА), адсорбционных методов, низкотемпературной адсорбции азота, ртутной порометрии, термопрограммированной адсорбции–десорбции аммиака (ТПД NH3) [17–20].
Общая методика С-алкилирования бензола и толуола 2-метил-2-винил-гем-дихлорциклопропаном. В стеклянную ампулу загружали расчетное количество цеолита, исходное ароматическое соединение (бензол II либо толуол III) и непредельное соединение (2-метил-2-винил-гем-дихлорциклопропан I) в мольном соотношении (2 : 1)–(8 : 1). После запаивания ампулу помещали внутрь металлического “пальчикового” автоклава объемом 17 мл, который нагревали при заданной температуре и непрерывном вращении в термостатируемом шкафу в течение определенного времени. Затем реакционную массу охлаждали, катализатор отфильтровывали и анализировали методом ГЖХ. Продукты реакции выделяли вакуумной перегонкой. По данной методике получены соединения IV, V.
Хроматографический анализ продуктов реакции выполняли на хроматографе с пламенно-ионизационным детектором (стеклянная капиллярная колонка длиной 25 м, фаза SE-30, температура анализа 50–280°С с программированным нагревом со скоростью 8°С/мин, температура детектора 250°С, температура испарителя 300°С, газ-носитель – гелий – 30 мл/мин). Масс-спектры получены на хромато-масс-спектрометре SHIMADZU GCMS-QP2010Plus (капиллярная колонка SPB-5 30 м × 0.25 мм, газ-носитель – гелий, температура программирования от 40 до 300°C со скоростью подъема 8°С/мин, температура испарения 280°C, температура ионного источника 200°C, энергия ионизации 70 эВ). Спектры ЯМР 1Н и 13С, гомо- и гетероядерные методики COSY, HSQC, HMBC регистрировали на приборах “Bruker Avance-400” (рабочая частота для 1Н – 400.13 МГц; для 13С – 100.62 МГц), растворитель – CDCl3.
Характеристики соединений:
[1-(2,2-дихлор-1-метилциклопропил)этил]бензол IV. Бесцветная жидкость, Ткип = 106°С (2 мм рт. ст.). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.31 (д, 3Н, СН3(5)), 1.79 (с, 3Н, СН3(6)), 2.45–2.65 (м, 2Н, СН2(2)), 2.99–3.08 (м, Н, СН (4)), 7.24 (с, Н, СН (10)), 7.32 (с, Н, СН (8, 12)), 7.34 (с, Н, СН (9, 11)). ЯМР 13С (CDCl3, δ, м.д.): 20.37 (С (5)), 21.17 (С (6)), 38.11 (С (4)), 38.21 (С (3)), 44.05 (С (2)), 126.36 (С (10)), 126.88 (С (8, 12)), 128.44 (С (9, 11)), 133.96 (С (7)), 146.11 (С1)). Масс-спектр m/e, Iотн, %: 228 (8) [M+]; 201 (8); 199 (13); 165 (16); 163 (46); 157 (10); 129 (10), 115 (10); 105 (100); 103 (9), 91 (17), 77 (16).
1-[1-(2,2-дихлор-1-метилциклопропил)этил]-4-метилбензол V. Бесцветная жидкость. Ткип = = 131°С (2 мм рт. ст.). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.28 (д, 3Н, СН3(5)), 1.79 (с, 3Н, СН3(6)), 2.36 (с, 3Н, СН3(13)), 2.45–2.65 (м, 2Н, СН2(2)), 2.96–3.02 (м, Н, СН (4)), 7.06 (с, Н, СН (9, 11)), 7.28 (с, Н, СН (8, 12)). ЯМР 13С (CDCl3, δ, м.д.): 20.21 (С (5)), 21.20 (С (6)), 21.28 (С (13)), 37.77 (С (4)), 38.11 (С (3)), 44.06 (С (2)), 126.72 (С (9, 11)), 127.08 (С (8, 12)), 134.00 (С (10)), 143.77 (С1)). Масс-спектр m/e, (Iотн, %): 242 (2) [M+]; 206 (8); 191 (2); 171 (3); 141 (2); 119 (51); 103 (19); 91 (9); 77 (4).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристика цеолитных катализаторов
В работе изучены каталитические свойства цеолитных катализаторов, отличающихся строением кристаллической решетки, кислотными свойствами и пористостью. Так, цеолиты Н-Y, Н-Beta, H-MOR и H-ZSM-5 имеют микропористую структуру, а цеолит Н-Ymmm – иерархическую структуру, образованную не только микро-, но также мезо- и макропорами [21, 22].
В ряду микропористых цеолитов наиболее широкими порами обладают цеолиты Y (полости с входным окном 0.74 × 0.74 нм) и Beta (прямолинейные каналы размером 0.66 × 0.67 нм и извилистые каналы размером 0.56 × 0.56 нм). Для пентасила ZSM-5 характерны более узкие поры (прямолинейные каналы размером 0.51 × 0.55 нм и извилистые каналы размером 0.53 × 0.56 нм). Цеолит H-MOR имеет одномерную канальную структуру (два вида каналов размером 0.70 × 0.65 нм и 0.26 × 0.57 нм) [23].
Физико-химические свойства исследованных цеолитных катализаторов представлены в табл. 1.
Таблица 1.
Физико-химические характеристики цеолитов
| Катализатор | Степень кристал-личности, отн. % |
Равновесная адсорбционная емкость (20°C и P/Ps = 0.8), см3/г, по парам: |
Sуд, м2/г | Кислотные свойства* | |||
|---|---|---|---|---|---|---|---|
| концентрация кислотных центров, мкмоль г–1 | |||||||
| H2O | C6H6 | СI | CII | С | |||
| Н-Y | 100 | 0.30 | 0.30 | 870 | 610 | 520 | 1130 |
| Н-Вeta | 100 | 0.26 | 0.32 | 470 | 530 | 340 | 870 |
| H-MOR | 100 | 0.18 | 0.16 | 393 | 651 | 349 | 1000 |
| Н-ZSM-5 | 100 | 0.14 | 0.15 | 320 | 270 | 190 | 460 |
| Н-Ymmm | 93 | 0.25 | 0.30 | 741 | 515 | 460 | 975 |
Согласно данным РФА и значениям адсорбционных характеристик цеолитов, для всех образцов микропористых цеолитов степень кристалличности близка к 100%. Для цеолита Н-Ymmm степень кристалличности составляет 93%, что связано с неполной кристаллизацией его аморфной составляющей.
По данным низкотемпературной адсорбции-десорбции азота и ртутной порометрии для образца цеолита Н-Ymmm, “кажущаяся” удельная площадь поверхности образцов по БЭТ составляет 741 м2/г, а удельная площадь поверхности вторичной пористой структуры, определяемая с помощью ртутной порометрии – 12.1 м2/г. Объемы микро-, мезо- и макропор составляют 0.28; 0.15 и 0.15 см3/г соответственно.
В спектрах ТПД NH3 микропористых цеолитов наблюдаются два пика: низкотемпературный, имеющий максимум в области 250–300°С, и высокотемпературный пик с максимумом в интервале 410–480°С. Это свидетельствует о присутствии в исследуемых образцах кислотных центров двух типов: “слабых”, которые характеризуются низкотемпературным пиком, и “сильных”, характеризующихся высокотемпературным пиком [18]. Концентрация наиболее важных для каталитических превращений “сильных” кислотных центров уменьшается в ряду: H-Y > H-MOR ≥ H-Beta > H-ZSM-5. Аналогично изменяется и суммарная концентрация кислотных центров.
В спектрах кислотности цеолита H-Ymmm присутствуют два пика, характеризующие слабые кислотные центры с температурным максимумом Тmax в области температур 250–280°С и сильнокислотные центры с Тmax в области температур 350–420°С. Концентрация “сильных” кислотных центров в цеолите Н-Ymmm ниже, чем в микропористом цеолите Н-Y.
Каталитические свойства микропористых цеолитов в синтезе алкиларенов
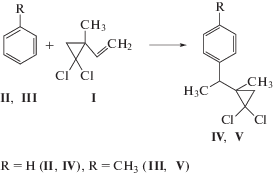
Алкилирование аренов II, III непредельным соединением I в присутствии исследованных цеолитных катализаторов проходит с образованием хлоралкиларенов IV, V (см. схему). Кроме них, в реакционной массе идентифицированы продукты трансформации исходного непредельного соединения I, обозначенные как “легкие” продукты.
Отметим, что при алкилировании толуола винилциклопропаном I в присутствии исследованных цеолитов образуется только п-изомер. Благодаря наличию двух хиральных центров в соединениях IV, V могут образоваться два диастереоизомера R*R* и R*S* конфигураций. Наличие диастереоизомерной пары в продуктах реакции подтверждается присутствием в спектре ЯМР 13С удвоенного набора сигналов с соотношением 2 : 3. К сожалению, провести прямую идентификацию преобладающего изомера затруднительно из-за отсутствия в соединениях IV, V функциональных групп, способных к селективному связыванию дериватизирующих реагентов сдвига.
Схема взаимодействия бензола и толуола с 2-метил-2-винил-гем-дихлорциклопропаном.
Наиболее селективно алкилирование идет в присутствии микропористого цеолита H-Beta и микро-мезо-макропористого цеолита H-Ymmm (табл. 2). Значения селективности образования алкиларенов IV, V близки и составляют 73–82%. На этих же катализаторах (H-Beta и H-Ymmm) наблюдали самую высокую конверсию винилциклопропана I.
Таблица 2.
Синтез [1-(2,2-дихлор-1-метилциклопропил)этил]бензола IV и 1-[1-(2,2-дихлор-1-метилциклопропил)этил]-4-метилбензола V в присутствии цеолитных катализаторов. Условия синтеза: 20 мас. % катализатора, Т = 100°C, мольное соотношение арен : I = 8 : 1, 2 ч
| Катализатор | Арен | Конверсия соед. I, % | Селективность, % | |
|---|---|---|---|---|
| IV, V | “легкие” продукты | |||
| H-Y | Бензол | 70 | 39 | 61 |
| H-MOR | 35 | 57 | 43 | |
| H-Beta | 100 | 82 | 18 | |
| H-ZSM-5 | 0 | 0 | 0 | |
| H-Ymmm | 90 | 79 | 21 | |
| H-Y | Толуол | 86 | 29 | 71 |
| H-MOR | 15 | 52 | 48 | |
| H-Beta | 97 | 81 | 19 | |
| H-ZSM-5 | 0 | 0 | 0 | |
| H-Ymmm | 96 | 73 | 27 | |
Высокая каталитическая активность и селективность цеолитов H-Beta и H-Ymmm обусловлена, по-видимому, характеристиками их пористой структуры, обеспечивающей хорошую доступность активных центров катализатора для реагирующих молекул и не создающей диффузионных ограничений для перемещения молекул реагентов и продуктов реакции. Более низкие значения селективности образования алкиларенов на цеолите H-Ymmm, по сравнению с цеолитом H-Beta (73 и 81%, соответственно, в реакции с толуолом), можно объяснить более высокой кислотностью цеолита H-Ymmm, что приводит к усилению реакций превращения винилциклопропана I, вследствие чего в продуктах повышается содержание “легких” соединений.
Этим же фактором – высокой концентрацией кислотных центров – объясняются и результаты, полученные на цеолитах H-Y и H-MOR. В реакционной массе, полученной в присутствии данных катализаторов, содержится значительное количество “легких” соединений, поэтому селективность образования алкиларенов IV, V ниже, чем на цеолите H-Beta. В то же время наблюдаемая на образцах H-Y и H-MOR существенная раз-ница в значениях конверсии винилциклопропана I связана, по-видимому, с особенностями строения кристаллической решетки этих цеолитов. Трехмерная широкопористая структура цеолита H-Y обеспечивает лучшую доступность активных центров для реагентов, чем одномерная пористая структура цеолита H-MOR, поэтому конверсия винилциклопропана I на цеолите H-Y в 2–5 раз выше по сравнению с цеолитом H‑MOR.
Цеолит H-ZSM-5 не проявил активности в реакции. Можно предположить, что это связано с низкой концентрацией кислотных центров в нем или с пространственными ограничениями, создаваемыми узкими каналами цеолита H-ZSM-5 для реагентов и продуктов реакции.
Полученные результаты свидетельствуют, что для получения алкиларенов IV, V с высоким выходом цеолитный катализатор должен обладать как широкопористой структурой, так и оптимальной концентрацией кислотных центров. Как низкая, так и высокая кислотность нежелательны, потому что в первом случае катализатор не активен, а во втором катализирует преимущественно превращения винилциклопропана I.
В присутствии наиболее активного из цеолитных катализаторов H-Beta изучено влияние реакционных параметров (температуры, мольного соотношения реагентов, концентрации катализатора, времени реакции) на конверсию винилциклопропана I и состав продуктов реакции.
Показано, что высокая конверсия винилциклопропана I (от 90% до полной) достигается при температуре 70–150°С (рис. 1). Максимальную селективность образования алкиларена V наблюдали при 100°С, дальнейшее повышение температуры приводит к увеличению выхода побочных продуктов.
Рис. 1.
Влияние температуры на конверсию I и селективность по 1-[1-(2,2-дихлор-1-метилциклопропил)этил]-4-метилбензолу V. Условия синтеза: мольное соотношение толуол : I = 5 : 1, 20 мас. % катализатора, 2 ч.

Увеличение содержания толуола в исходной реакционной смеси от 2 : 1 до 8 : 1 приводит к повышению селективности по целевому продукту V (рис. 2). При минимальном содержании толуола в реакционной смеси селективность по алкиларену низкая, так как идут преимущественно побочные реакции трансформации винилциклопропана I. Высокая селективность по алкиларену при практически полной конверсии винилциклопропана I достигается при мольном соотношении толуол : I = = 8 : 1.
Рис. 2.
Влияние мольного соотношения реагирующих веществ на конверсию I и селективность по 1-[1-(2,2-дихлор-1-метилциклопропил)этил]-4-метилбензолу V. Условия синтеза: 100°С, 20 мас. % катализатора, автоклав, 2 ч.

На конверсию винилциклопропана I и селективность по алкиларену V также оказывает влияние концентрация цеолитного катализатора (рис. 3). Наиболее селективно и с высокой конверсией винилциклопропана I алкилирование проходит в присутствии 20% катализатора в расчете на реакционную массу.
Рис. 3.
Влияние концентрации катализатора на конверсию непредельного соединения I и селективность по 1-[1-(2,2-дихлор-1-метилциклопропил)этил]-4-метилбензолу V. Условия синтеза: 100°С, мольное соотношение арен : I = 8 : 1, автоклав, 2 ч.

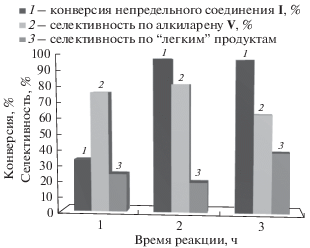
На рис. 4 показано влияние продолжительности реакции на степень превращения непредельного соединения I и селективность по 1-[1-(2,2-дихлор-1-метилциклопропил)этил]-4-метилбензолу V. Максимальная конверсия непредельного соединения и селективность по целевому продукту достигается после 2 ч. При дальнейшем проведении синтеза селективность по продукту V понижается.
Рис. 4.
Влияние времени реакции на конверсию непредельного соединения I и селективность по 1-[1-(2,2-дихлор-1-метилциклопропил)этил]-4-метилбензолу V. Условия синтеза: 100°С, мольное соотношение арен: I = 8 : 1, 20 мас. % катализатора.
Таким образом, в результате исследования каталитических свойств различных цеолитов в реакции алкилирования бензола и толуола 2-метил-2-винил-гем-дихлорциклопропаном установлено, что наиболее активными и селективными катализаторами синтеза алкиларенов являются цеолиты H-Beta (микропористый) и H-Ymmm (микро-мезо-макропористый). Селективность по [1-(2,2-дихлор-1-метилциклопропил)этил]бензолу IV и 1-[1-(2,2-дихлор-1-метилциклопропил)этил]-4-метилбензолу V на этих катализаторах достигает 82% при конверсии винилциклопропана I 90–100%.
Показано, что максимальный выход алкиларенов достигается при мольном соотношении арен : I = 8 : 1, температуре 100°С, в присутствии 20% мас. катализатора и времени реакции 2 ч.
БЛАГОДАРНОСТИ Авторы выражают благодарность зав. лаб. "Структурная химия" Института нефтехимии и катализа УФИЦ РАН, д.х.н., профессору Халилову Леонарду Мухибовичу за советы и участие в обсуждении спектров ЯМР.КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.ИНФОРМАЦИЯ ОБ АВТОРАХБайбуртли Алсу Ваидовна, аспирант, ORCID: https://orcid.org/0000-0002-6819-2198Раскильдина Гульнара Зинуровна, к.х.н., доцент, ORCID: https://orcid.org/0000-0001-9770-5434Григорьева Нелля Геннадиевна, д.х.н., в. н. с., ORCID: https://orcid.org/0000-0001-6451-9205Злотский Семен Соломонович, д.х.н., зав. каф., ORCID: https://orcid.org/0000-0001-6365-5010
Список литературы
Костиков Р.Р., Молчанов А.П., Беспалов А.Я. // Журн. орг. химии. 1974. Т. 10. С. 10.
Зефиров Н.С., Казимирчик И.В., Лукин К.Л. Циклоприсоединение дихлоркарбена к олефинам. М.: Наука, 1985. С. 152.
Арбузова Т.В., Хамидуллина А.Р., Злотский С.С. // Изв. вузов. Химия и хим. технология. 2007. Т. 50. Вып. 6. С. 15.
Арбузова Т.В., Злотский С.С., Рахманкулов Д.Л. // Башкирский хим. журн. 2005. Т. 12. № 2. С. 19.
Брусенцова Е.А., Колесов С.В., Воробьева А.И., Злотский С.С., Хамидуллина А.Р., Муслухов Р.Р., Спирихин Л.В., Заиков Г.Е. // Журн. орг. химии. 2008. Т. 78(140). Вып. 5. С. 783.
Хамидуллина А.Р., Брусенцова Е.А., Злотский С.С. // Известия вузов. Химия и хим. технология. 2008. Т. 51. Вып. 9. С. 106.
Horňáčeka M., Hudeca P., Smieškováa A., Jakubíkb T. // Acta Chimica Slovaca. 2009. V. 2. № 1. P. 31.
Пономарева О.А., Тимошин С.Е., Монахова Ю.В., Князева Е.Е., Ющенко В.В., Иванова И.И. // Нефтехимия. 2010. Т. 50. № 6. С. 438 [Petrol. Chemistry. 2010. V. 50. № 6. P. 427].
Gao N., Xie S., Liu S., Xin W., Gao Y., Wei H., Liu H., Xu L. // Microporous and Mesoporous Materials. 2015. V. 212. P. 1.
Боруцкий П.Н., Козлова Е.Г., Подклетнова Н.М., Гильченок Н.Д., Соколов Б.Г., Зуев В.А., Шатовкин А.А. // Нефтехимия. 2007. Т. 47. № 4. С. 276 [Petrol. Chemistry. 2007. V. 47. № 4. Р. 250].
You H., Long W., Pan Y. // Petroleum Science and Technology. 2006. V. 24. P. 1079.
Титце Л., Айхер Т. Препаративная органическая химия. М.: Мир, 1999. 704 с.
Хазипова А.Н., Павлова И.Н., Григорьева Н.Г., Кутепов Б.И., Павлов М.Л., Басимова Р.А. // Химические технологии. 2012. № 1. С. 5.
Горшунова К.К. Ахмед Канаан Рамадан, Травкина О.С., Павлова И.Н., Григорьева Н.Г., Павлов М.Л., Кутепов Б.И. // Нефтехимия. 2014. Т. 54. № 2. С. 136 [Petrol. Chemistry. 2014. V. 54. № 2. P. 132].
Басимова Р.А., Кутепов Б.И., Павлов М.Л., Павлова И.Н., Травкина О.С., Хазипова А.Н. // Патент РФ № 2456238. 2010. Б.И. 2012. № 20.
Кутепов Б.И., Травкина О.С., Павлова И.Н., Хазипова А.Н., Григорьева Н.Г., Павлов М.Л. // Журн. прикладной химии. 2015. Т. 88. № 1. С. 70.
Хазипова А.Н., Кутепов Б.И., Павлов М.Л., Григорьева Н.Г., Пашкина А.Н, Травкин Е.А., Шестопал Я.Л. // Журн. прикладной химии. 2007. Т. 80. № 11. С. 1815.
Ющенко В.В. // Журн. физ. химии. 1997. Т. 71. № 4. С. 628.
Плаченов Т.Г., Колосенцев С.Д. Порометрия. М.: Химия, 1988. 175 с.
Кельцев Н.В. Основы адсорбционной техники. М.: Химия, 1976. 512 с.
Басимова Р.А. Дис. … канд. хим. наук. ИНК РАН, Уфа. 2009. 122 с.
Хазипова А.Н., Павлова И.Н., Григорьева Н.Г., Кутепов Б.И., Павлов M.Л., Басимова Р.А. // Химические технологии. 2012. Т. 13. № 1. С. 5.
Baerlocher Ch, McCusker L.B., Olson D.H. // Atlas of Zeolite Framework Types. Amsterdam: 6th Edn. Elsevier, 2007.
Дополнительные материалы отсутствуют.