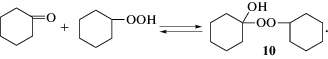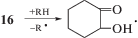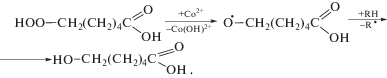Нефтехимия, 2019, T. 59, № 6-2, стр. 758-767
Каналы образования бифункциональных карбоновых кислот С6 в процессе окисления циклогексана
А. Л. Перкель 1, С. Г. Воронина 1, *
1 Кузбасский государственный технический университет им. Т.Ф. Горбачева,
Институт химических и нефтегазовых технологий
Кемерово, Россия
* E-mail: perkel2@rambler.ru
Поступила в редакцию 23.03.2018
После доработки 09.02.2019
Принята к публикации 12.02.2019
Аннотация
Изучена кинетика накопления основных и побочных продуктов при некатализированном и катализированном нафтенатом кобальта окислении циклогексана при 150°С. 6-Гидроксигексановая, 6-оксогексановая и адипиновая кислоты при окислении циклогексана, циклогексанона и 2-гидроксициклогексанона накапливаются параллельно. Критическое рассмотрение известных путей их образования и реакционной способности возможных предшественников свидетельствует о преимущественном образовании 6-гидроксигексановой кислоты на стадии окисления циклогексанола, адипиновой кислоты из 2-гидроксициклогексанола.
Бифункциональные карбоновые кислоты С6 (адипиновая, 6-гидрокси- и 6-оксогексановые) являются одними из основных побочных продуктов в процессе окисления циклогексана до циклогексанола и циклогексанона [1, 2]. Каналы их образования остаются предметом дискуссии. Предполагается [1, 3–5], что адипиновая и 6-оксогексановая кислоты образуются из циклогексанона. Путем измерения активности побочных продуктов в опытах соокисления меченного С14 циклогексана с добавкой не меченого циклогексанона и не меченого циклогексана с добавкой меченного С14 циклогексанона показано, что 86−95% адипиновой кислоты при окислении циклогексана образуется через циклогексанон [3]. Позднее на основании изучения кинетики накопления побочных продуктов на начальных стадиях некатализированного и катализированного ацетатами кобальта(II) и кобальта(III) окисления циклогексана авторы [6–8] пришли к выводу о преимущественном образовании адипиновой, 6-гидрокси- и 6-оксогексановой кислот из циклогексилоксильных радикалов. Это противоречит данным о существенном снижении селективности процесса окисления циклогексана даже при низкой конверсии вследствие вовлечения спирта и кетона в радикально-цепной процесс [1, 9]. Предлагаемые в работах [6–8] гипотетические механизмы включают внутримолекулярную изомеризацию (передачу цепи) через 7- и 9-членные переходные состояния, что маловероятно из-за возрастания энтропийного барьера при образовании свернутой конформации ациклической молекулы [10].
Настоящая работа посвящена изучению кинетики накопления целевых и основных побочных продуктов в некатализированной и катализированной нафтенатом кобальта реакции жидкофазного окисления циклогексана и обсуждению возможных каналов образования адипиновой, 6-гидрокси- и 6-оксогексановой кислот.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Циклогексан квалификации ч. очищали по методике [11]. Т. кип. 80.5°С (известное значение 80.738°С [11]).
Циклогексан окисляли кислородом в барботажном реакторе из нержавеющей стали при 150°C и давлении 1.47 МПа без катализатора и с 8.5 × × 10−4 моль/л нафтената кобальта(II). Точность поддержания температуры составляла ±1°С.
Суммарное содержание пероксидных соединений в окисленном циклогексане определяли иодометрическим титрованием [12, 13], а остальные продукты − методом ГЖХ. Для предотвращения искажающего влияния пероксидных соединений на результаты определения непероксидных продуктов, пробы непосредственно после отбора восстанавливали трифенилфосфином. 2-Гидроксициклогексанон анализировали после ацетилирования уксусным ангидридом в среде пиридина. Карбоновые кислоты, а также моноциклогексиладипинат перед определением переводили в метиловые эфиры обработкой диазометаном. Методики подготовки проб, условия определения и метрологические характеристики методов приведены в работах: циклогексанола и 2-гидроксициклогексанона [14], циклогексанона [15], соединений с карбоксильными группами [14], адипинового ангидрида [16].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В соответствии с поставленной задачей изучена кинетика накопления продуктов при некатализированном и катализированном нафтенатом кобальта окислении циклогексана при 150°С (рис. 1 и 2). Рассмотрение кинетической кривой накопления суммы продуктов окисления показывает, что в некатализированной реакции наблюдается индукционный период, после окончания которого циклогексан окисляется практически с постоянной скоростью (рис. 1).
Рис. 1.
Кинетические кривые накопления продуктов некатализированного окисления циклогексана при 150°С: 1 – пероксиды, 2 – циклогексанол, 3 – циклогексанон, 4 – 2-гидроксициклогексанон и 2-гидропероксициклогексанон, 5 – 6-гидроксигексановая кислота, 6 – 6-оксогексановая кислота, 7 – адипиновая кислота, 8 – адипиновый ангидрид, 9 – моноциклогексиладипинат, 10 – ε-капролактон, 11 – сумма продуктов окисления.

Рис. 2.
Кинетические кривые накопления продуктов окисления циклогексана при 150°С в присутствии нафтената кобальта(II). Обозначение кривых см. рис. 1.
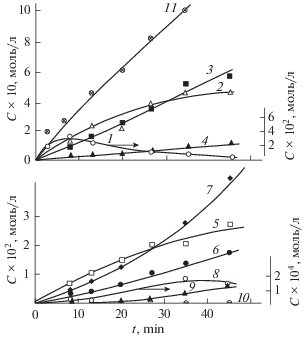
Ход аналогичной кривой в катализированной солью кобальта(II) реакции указывает на отсутствие индукционного периода; скорость окисления выше, чем в некатализированном процессе, но и в этом случае заметного автоускорения не наблюдается. Отсутствие автоускорения в обоих опытах не может быть объяснено постоянством скорости реакций вырожденного разветвления – гомолитического распада циклогексилгидропероксида.
Их роль, напротив, должна увеличиваться в результате накопления кислородсодержащих соединений (циклогексанола, циклогексанона, 2-гидроксициклогексанона и др.), существенно ускоряющих распад циклогексигидропероксида, в том числе и гомолитический [5, 17]. Очевидно, ускорение за счет увеличения скорости вырожденного разветвления компенсируется факторами, замедляющими радикально-цепной процесс. К их числу можно отнести изменение состава пероксильных радикалов из-за вовлечения в реакцию окисления циклогексанола, циклогексанона, 2-гидроксициклогексанона и др., а также уменьшение активности пероксильных радикалов вследствие их сольватации кислородсодержащими соединениями [5, 17].
Ход кинетических кривых накопления пероксидных соединений и суммы непероксидных продуктов (рис. 1 и 2) свидетельствует о преимущественном образовании последних из первых. Очевидно, необрывающие каналы рекомбинации пероксильных радикалов:
(1)
$2{\text{RO}}{{{\text{O}}}^{\centerdot }}\xrightarrow[{ - {{{\text{O}}}_{2}}}]{}2{\text{R}}{{{\text{O}}}^{\centerdot }},$Адипиновая, 6-гидрокси- и 6-оксогексановая кислоты на начальных стадиях некатализированного окисления накапливаются параллельно и в близких количествах (рис. 1). В катализированной нафтенатом кобальта реакции начальная скорость накопления 6-гидроксигексановой кислоты в 1.8 раза выше, чем адипиновой кислоты (рис. 2). Через 20 мин после начала окисления скорость образования 6-гидроксигексановой кислоты снижается, адипиновой кислоты, напротив, увеличивается и она становится основным карбоксилсодержащим продуктом реакции. Это не противоречит представлениям Германса и соавт. [6–8] об образовании 6-гидроксигексановой и адипиновой кислот из циклогексилоксильного радикала, но и не доказывает преимущественного образования адипиновой кислоты из 6-гидроксигексановой, поскольку предполагаемый промежуточный продукт такого превращения – 6-оксогексановая кислота в начале некатализированного и катализированного окисления накапливается параллельно с адипиновой кислотой (рис. 1 и 2).
Известно, что адипиновая, 6-гидрокси- и 6-оксогексановая кислоты могут получаться не только из циклогексилоксильного радикала [6–8], но и на стадиях окисления циклогексанола [1, 4, 5], циклогексанона [1, 4, 5, 20, 21] и 2-гидроксициклогексанона [5, 6, 19, 22]. Поэтому целесообразно критически рассмотреть все альтернативные каналы образования этих соединений.
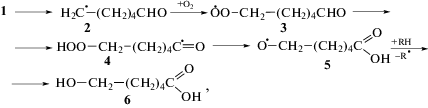
Образование бифункциональных кислот С6 из циклогексилоксильного радикала (1). Циклогексилоксильный радикал образуется при термическом, каталитическом и индуцированном свободными радикалами распаде циклогексилгидропероксида [1, 4, 5, 17]. Гомолитический распад последнего ускоряют кислородсодержащие соединения (спирты, кетоны, карбоновые кислоты и др.) [1, 5, 17]. Основное направление превращения 1 в среде окисляющегося циклогексана – дегидрирование субстрата с образованием циклогексанола [1, 4, 5]:
В существенно меньшей степени 1 подвергается деструктивному распаду с раскрытием циклогексанового кольца, приводящему к 6-оксогексильному радикалу 2 [4, 5]. При термическом распаде трет-бутилциклогексилпероксида в циклогексане при 140°С 56% циклогексилоксирадикалов превращаются в циклогексанол [4].
В работах [6–8] предполагается, что побочные продукты при окислении циклогексана (145°С, конверсия до 7.5%) образуются преимущественно в результате радикально-цепных превращений радикала 2. Согласно [6] 2 в среде окисляющегося циклогексана последовательно превращается в 6-гидроксигексановую (реакции (3)), 6-оксогексановую (реакции (4)) и адипиновую (реакции (5)) кислоты:
Нельзя отрицать принципиальную возможность превращения в процессе окисления циклогексана первичных гидрокси- и альдегидных групп в карбоксильные. Однако, вероятность протекания ряда стадий превращений (3)−(5) представляется низкой. Переход 3 в 4 и 4 в 5 должен происходить через 9 и 7-членные переходные состояния. Известно [10], что при образовании больших циклов по мере возрастания числа звеньев все менее вероятным становится образование циклического переходного состояния. Это связано с возрастанием энтропийного барьера для образования свернутой конформации ациклической молекулы [10]. При циклизации ω-бромкарбоновых кислот в лактоны
относительная скорость реакции (6) при 150°С составляет [10]:
| Число атомов в цикле | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| Относи- тельная скорость | 1.5 × 106 | 1.7 × 104 | 97.3 | 1.00 | 1.12 | 3.35 | 8.51 |
То, что внутримолекулярные превращения 3 в 4 и 4 в 5 мало конкурентоспособны с соответствующими межмолекулярными взаимодействиями свидетельствуют и данные работы [23], полученные при изучении направленности отрыва атомов водорода ω-формильными радикалами (табл. 1).
Таблица 1.
Влияние размера циклического переходного состояния на направленность отрыва атомов водорода ω-формильным радикалом (·(CH2)nCHO) (160°С, додекан, N2) [23]
| ·(CH2)nCHO) | Число атомов в переходном состоянии (N) | Направление отрыва атома Н, % | ||
|---|---|---|---|---|
| внутримолекулярный из –СНО | из растворителя | другие СН-связи радикала | ||
| n = 4 | N = 6 | 74 | 12 | 14 |
| n = 5 | N = 7 | 29 | 19 | 52 |
| n = 6 | N = 8 | 38 | 8 | 54 |
Селективность превращения 2 в 6-гидроксигексановую, 6-оксогексановую и адипиновую кислоты должны снижать и побочные реакции декарбонилирования (например, радикала 2 [5]) и декарбоксилирования [5], вероятность протекания которых в условиях окисления циклогексана достаточно велика. Окисление 6-оксогексановой кислоты по СН-связям в положении 5 приводит к муравьиной кислоте и 5-оксогексановой кислоте, обнаруженным в составе продуктов окисления циклогексана [24]:
Образование бифункциональных кислот С6 из циклогексанола и циклогексанона. Циклогексанол в условиях радикально-цепного процесса окисляется преимущественно по α-СН-связям (реакция (8)) [1, 5]. Цепь ведут преимущественно радикалы HO·2 (реакция (9)), и существуют подвижные равновесия между циклогексаноном и α-гидроксициклогексилпероксирадикалом (8) (реакция (8а)) [25], а также циклогексаноном и α-гидроксициклогексилгидропероксидом (9) [5, 17, 26].
(9)
${\text{HO}}_{2}^{\centerdot } + {\text{RH}} \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} + {{{\text{R}}}^{\centerdot }}.$При наличии в реакционной среде гидропероксидов, например, циклогексилгидропероксида или 2-гидропероксициклогексанона, происходит их обратимое присоединение к циклогексанону с образованием полуперкеталя (10) [1, 4, 5, 17].
Соединения 9 и 10, помимо диссоциации на циклогексанон и соответствующее пероксидное соединение, подвергаются гомолизу [4, 5, 17]:
1-Гидроксициклогексилоксильный радикал (11) при температурах ниже 80°С преимущественно отрывает атом водорода от субстрата с регенерацией циклогексанона (реакция (11)). При более высоких температурах возможна деструкция 11 с раскрытием цикла, приводящая к ω-карбоксиалкильному радикалу 12 [4, 5]:
Радикал 12 может дегидрировать субстрат с образованием гексановой кислоты или присоединять кислород, превращаясь в ω-карбоксигидропероксид, а затем и в 6-гидроксигексановую кислоту (реакция (12)) [4, 5].
Циклогексанон подвергается окислению по свободно-радикальному механизму преимущественно по α-СН-связям, реакционная способность которых существенно выше С−Н-связей в циклогексане [27], с образованием 2-гидропероксициклогексанона (13):
Превращение 13 в 6-оксогексановую кислоту может происходить через диоксетановый интермедиат 14 [5]:
13, также как циклогексилгидропероксид, может вступать в межмолекулярные взаимодействия с кислородсодержащими соединениями, которые будут ускорять его гомолитический распад. В окисляющемся циклогексаноне предпочтительна реакция с субстратом с образованием полуперкеталя 15, распадающегося с образованием 11 и 2-оксоциклогексилоксильного радикала 16 [1, 4, 5, 17]:
Радикал 16 превращается в 2-гидроксициклогексанон [5, 19, 20, 22, 28, 29]:
Возможны два направления превращения 2-оксоциклогексилоксирадикала 16 с деструкцией углеродной цепи. Направление 17а объясняет образование в процессе окисления циклогексанона 6-оксогексановой кислоты, моноперадипиновой и адипиновой кислот [1, 4, 5]:
Образование бифункциональных кислот С6 при окислении 2-гидроксициклогексанона. Окисление 2-гидроксициклогексанона происходит по радикально-цепному механизму по наиболее реакционноспособной α-С−Н-связи [5, 19, 20, 28]. Пероксильный радикал 18 либо отщепляет радикал ${\text{HO}}_{2}^{\centerdot }$, превращаясь в 1,2-циклогександион (19) [5] (реакция (18)), либо отрывает водород от субстрата с образованием 2-гидрокси-2-гидропероксициклогексанона 20 (реакция (19)):
Соединение 20 обратимо диссоциирует на 1,2-циклогександион и Н2О2 или подвергается деструкции по гомолитическому и негомолитическим механизмам [5, 28]. Гомолитический распад 20 происходит преимущественно с деструкцией углеродной цепи и в присутствии кислорода приводит к адипиновой кислоте (через стадию адипиновой монопероксикислоты 23) [5, 28]. В меньших количествах при этом образуется и 19 (реакция (20)):
При сопоставлении потенциального выхода пероксикислоты с выходом адипиновой кислоты при окислении 2-гидроксициклогексанона при 50°С, было найдено, что около 50% адипиновой кислоты образуется по реакции (20) [5, 28]. Вторая половина адипиновой кислоты образовывалась параллельно с адипиновым ангидридом в результате перициклической перегруппировки 20 через диоксетановый и оксирановый интермедиаты, соответственно [5, 28]. 2-Гидроксициклогексанон участвует не только в радикально-цепном окислении, но и взаимодействует с пероксидными соединениями. Эффективные константы скорости распада трет-бутилгидропероксида при 150°С в присутствии эквимолярных добавок циклогексанола, циклогексанона и 2-гидроксициклогексанона составляют (kэф × 104, с−1): 0.17, 0.20, 10.0, соответственно [5, 22]. Взаимодействие может включать присоединение пероксидного соединения по карбонильной группе 2-гидроксициклогексанона и приводить к 6-оксогексановой кислоте [5, 22, 28]:
При введении 2-гидроксициклогексанона в окисляющийся при 123°С метилэтилкетон наблюдалось практически полное торможение окисления последнего [22], возобновившегося после количественного превращения 2-гидроксициклогексанона в адипиновые ангидрид и кислоту (очевидно, через 20), 6-оксогексановую кислоту (реакции типа (21)), а также в 6-гидроксигексановую кислоту и ε-капролактон. Образование последних, наиболее вероятно, связано с гомолитическим распадом 24:
Таким образом, существует несколько параллельных и последовательно-параллельных каналов образования 6-гидроксигексановой, 6-оксогексановой и адипиновой кислот, разделить которые не всегда представляется возможным. По рис. 1 и 2 и литературным данным составлена табл. 2, в которой приведены сведения о влиянии конверсии и природы катализа на относительное содержание рассматриваемых кислот.
Таблица 2.
Влияние конверсии и катализаторов на относительное содержание 6-гидроксигексановой (ГГК), 6-оксогексановой (ОГК) и адипиновой (АК) кислот (мол. % от их суммы (ΣRCOOH)) при окислении циклогексана, циклогексанона и 2-гидроксициклогексанона
| Объект и условия окисления | ΣRCOOH = 0.05 моль/л | ΣRCOOH = 0.1 моль/л | ||||
|---|---|---|---|---|---|---|
| ГГК | ОГК | АК | ГГК | ОГК | АК | |
| Циклогексан, 150°С | 35.0 | 23.3 | 41.7 | 30.3 | 27.4 | 42.3 |
| Циклогексан + нафтенат кобальта(II), 150°С | 41.1 | 21.0 | 37.9 | 29.3 | 20.9 | 49.8 |
| Циклогексанон, 120°С, хлорбензол [21] | 1.7 | 40.0 | 58.3 | 3.9 | 28.8 | 67.3 |
| Циклогексанон + нафтенат кобальта(II), 120°С, хлорбензол [20] | 23.8 | 4.8 | 71.4 | 20.0 | 8.0 | 72.0 |
| Циклогексанон + нафтенат хрома(III), 120°С, хлорбензол [21] | 2.0 | 25.5 | 72.5 | 4.1 | 24.5 | 71.4 |
| 2-Гидроксициклогексанон, 123°С, метилэтилкетон [22] | 9.4 | 13.6 | 77.0 | |||
Из табл. 2 видно, что при переходе от опытов окисления циклогексана к окислению циклогексанона относительное содержание 6-гидроксигексановой кислоты существенно снижается. Это может свидетельствовать в пользу образования значительной части этого соединения из циклогексилоксильного радикала и(или) при окислении циклогексанола. Второй вариант предпочтительнее, поскольку 11 легче распадается с деструкцией С−С-связи, чем 1 [4, 5] и образование из него 6-гидроксигексановой кислоты требует меньшее число стадий. Обращает на себя внимание и повышение содержания 6-гидроксигексановой кислоты при окислении циклогексанона в присутствии кобальтового (но не хромового) катализатора (табл. 2). Поскольку в присутствии кобальтового катализатора одновременно с ростом содержания 6-гидроксигексановой кислоты снижается выход 6-оксогексановой кислоты, то можно предположить, что нафтенат кобальта не только стимулирует гомолитический распад 10 с образованием 11 (реакция (12)), но и способствует превращению 6-гидропероксигексановой кислоты в 6-гидрокси-, а не 6-оксогексановую кислоту:
Превращения типа (23) обеспечивают более высокий выход циклогексанола по сравнению с циклогексаноном в промышленном процессе окисления циклогексана [1, 5, 17].
При некатализированном и катализированном солью кобальта окислении циклогексана с увеличением глубины окисления наблюдается снижение относительного содержания 6-гидроксигексановой кислоты и одновременное увеличение относительного содержания адипиновой кислоты (рис. 1 и 2, табл. 2). Это не означает существенного значения последовательного превращения 6-гидроксигексановой кислоты в 6-оксогексановую и адипиновую кислоты. В окисленном циклогексане (рис. 1 и 2) присутствуют адипиновый ангидрид и моноциклогексиладипинат. Образование последнего связано исключительно с алкоголизом адипинового ангидрида циклогексанолом [29, 30]. Поэтому содержание сложного эфира отражает количество образовавшегося адипинового ангидрида. Последний образуется параллельно с адипиновой кислотой при радикально-цепном окислении 2-гидроксициклогексанона. При этом адипиновой кислоты, как правило, образуется больше, чем ангидрида [5, 19, 22, 28]. Кинетика накопления адипиновой кислоты и моноциклогексиладипината (рис. 1 и 2) свидетельствует, что значительное количество адипиновой кислоты даже при низкой конверсии циклогексана образуется из 2-гидроксициклогексанона.
Такое предположение подтверждает и оценочный расчет относительных скоростей взаимодействия продуктов окисления циклогексана с кумилпероксирадикалами и трет-бутилпероксирадикалами (табл. 3).
Таблица 3.
Расчетные значения относительных скоростей взаимодействия продуктов окисленного циклогексана (150°С, ΔRH = 0.6 моль/л) с кумилпероксирадикалом при 85°С
| Наименование продукта | $k_{{\text{p}}}^{{{\text{бр}}}},$ л/моль с | Без катализатора | С нафтенатом Сo2+ | ||
|---|---|---|---|---|---|
| Ci, моль/л | ${{{{W}_{i}}} \mathord{\left/ {\vphantom {{{{W}_{i}}} {{{W}_{{{\text{цг}}}}}}}} \right. \kern-0em} {{{W}_{{{\text{цг}}}}}}}$ | Ci, моль л–1 | ${{{{W}_{i}}} \mathord{\left/ {\vphantom {{{{W}_{i}}} {{{W}_{{{\text{цг}}}}}}}} \right. \kern-0em} {{{W}_{{{\text{цг}}}}}}}$ | ||
| Циклогексан | 0.21 [31] | 7.40 | 1.00 | 7.40 | 1.00 |
| Циклогексанол | 6.5 [31] | 0.21 | 0.88 | 0.30 | 1.25 |
| Циклогексанон | 0.58 [31] | 0.34 | 0.13 | 0.24 | 0.09 |
| 2-Гидроксициклогексанон | 41.7 [32] | 0.011 | 0.30 | 0.010 | 0.27 |
Таблица 4.
Расчетные значения относительных скоростей взаимодействия продуктов окисленного циклогексана (150°С, ΔRH = 0.6 моль/л) с трет-бутилпероксирадикалом
| Наименование продукта | Т, °С | $k_{{\text{p}}}^{{{\text{бр}}}},$ л/моль с | Без катализатора | С нафтенатом Сo2+ | ||
|---|---|---|---|---|---|---|
| Ci, моль/л | ${{{{W}_{i}}} \mathord{\left/ {\vphantom {{{{W}_{i}}} {{{W}_{{{\text{цг}}}}}}}} \right. \kern-0em} {{{W}_{{{\text{цг}}}}}}}$ | Ci, моль л–1 | ${{{{W}_{i}}} \mathord{\left/ {\vphantom {{{{W}_{i}}} {{{W}_{{{\text{цг}}}}}}}} \right. \kern-0em} {{{W}_{{{\text{цг}}}}}}}$ | |||
| Циклогексан | 60 | 0.046a | 7.4 | 1 | 7.4 | 1 |
| 150 | 2.2a [33] | 1 | 1 | |||
| Циклогексанол | 60 | 0.43 [27] | 0.21 | 0.26 | 0.30 | 0.38 |
| Циклогексанон | 60 | 0.22 [27] | 0.34 | 0.22 | 0.24 | 0.16 |
| 6-Гидроксигексановая кислота | 60 | 0.63 | 0.014 | 0.026 | 0.016 | 0.029 |
| 6-Оксогексановая кислота | 60 | 2.19b | 0.01 | 0.064 | 0.007 | 0.046 |
| 150 | 69.2b | 0.043 | 0.030 | |||
Скорость окисления органического соединения определяется уравнением ${{W}_{i}} = k_{{{\text{p}}i}}^{{{\text{бр}}}}[{{C}_{i}}][{\text{RO}}_{2}^{\centerdot }]$, а скорость, отнесенная к скорости окисления циклогексана, уравнением ${{{{W}_{i}}} \mathord{\left/ {\vphantom {{{{W}_{i}}} {{{W}_{{{\text{цг}}}}}}}} \right. \kern-0em} {{{W}_{{{\text{цг}}}}}}} = {{k_{{{\text{p}}i}}^{{{\text{бр}}}}[{{C}_{i}}]} \mathord{\left/ {\vphantom {{k_{{{\text{p}}i}}^{{{\text{бр}}}}[{{C}_{i}}]} {k_{{{\text{pцг}}}}^{{{\text{бр}}}}[{{C}_{{i{\text{цг}}}}}]}}} \right. \kern-0em} {k_{{{\text{pцг}}}}^{{{\text{бр}}}}[{{C}_{{i{\text{цг}}}}}]}},$ где $k_{{{\text{p}}i}}^{{{\text{бр}}}}$ и $k_{{{\text{pцг}}}}^{{{\text{бр}}}}$ – константы скорости реакции роста цепей i-го соединения и циклогексана, л/моль с; Ci и Сцг – концентрации продукта и циклогексана, моль/л.
Имеются сведения по $k_{{pi}}^{{{\text{бр}}}}$ для циклогексана и некоторых продуктов его окисления в реакциях с кумил- и с трет-бутилпероксирадикалами (табл. 3 и 4). Для 6-оксогексановой кислоты принята $k_{{pi}}^{{{\text{бр}}}}$ для бутаналя [34]. Для 6-гидроксигексановой кислоты данные с указанными радикалами отсутствуют [33]. Известно, что при 130°С парциальные константы скорости взаимодействия вторичного гексадецилпероксирадикала с α-СН-связями 2-октанола и 1-деканола составляют 20.7 и 15.1 л/моль с, соответственно [33]. Из этих данных отношение брутто-констант для первичного и вторичного спирта составит: 2 × 15.1/1 × 20.7 = = 1.46. Для оценки скорости окисления 6-гидроксигексановой кислоты была использована $k_{{pi}}^{{{\text{бр}}}}$, равная 1.46$k_{{pi}}^{{{\text{бр}}}}$ для циклогексанола.
Рассмотрение данных табл. 3 и 4 показывает, что при некатализированном и катализированном нафтенатом кобальта окислении циклогексана (ΔRH = 0.6 моль/л (∼6 мол. %)) присутствующий в реакционной среде 2-гидроксициклогексанон окисляется на порядок с более высокой скоростью, чем 6-гидрокси- и 6-оксогексановые кислоты (табл. 3 и 4). Следовательно, основное количество адипиновой кислоты при окислении циклогексана образуется из 2-гидроксициклогексанона.
Вклад реакций радикально-цепного окисления 6-гидрокси- и 6-оксогексановых кислот в образование адипиновой кислоты при окислении циклогексана остается недостаточно ясным. При окислении циклогексанона [20, 21] и 2-гидроксициклогексанона [21], также как и при окислении циклогексана (рис. 1 и 2), они накапливаются параллельно. Агабеков В.Е. и соавт. на основании изучения жидкофазного окисления 6-оксогексановой кислоты [35] пришли к выводу, что при окислении циклогексанона это соединение является не промежуточным, а конечным.
КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.ИНФОРМАЦИЯ ОБ АВТОРАХ Перкель Александр Львович, д.х.н., профессор, ORCID: https://orcid.org/0000-0002-1066-4914Воронина Светлана Геннадьевна, д.х.н., профессор, ORCID: https://orcid.org/0000-0002-6589-8961
Список литературы
Березин И.В., Денисов Е.Т., Эмануэль Н.М. Окисление циклогексана. М.: Изд-во МГУ, 1962. 302 с [The Oxidation of Cyclohexane. Oxford-London-Edinburgh-New York-Ontario: Elsevier, 2013. 304 p.].
Sheldon R.A., Franz G. In Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2012. V. 25. P. 543.
Duynstee E. F. J., Hennekens J. // Recueil des Travaux Chimiques des Pays-Bas. 1970. V. 89. № 7. P. 769.
Hendry D.G., Gould C.W., Schuetzle D., Syz M.G., Mayo F.R. // J. Org. Chem. 1976. V. 41. № 1. P. 1.
Перкель А.Л., Воронина С.Г., Фрейдин Б.Г. // Успехи химии. 1994. Т. 63. № 9. С. 793 [Russ. Chem. Rev. 1994. V. 63. № 9. P. 751].
Hermans I., Peeters J., Jacobs P.A. // J. Phys. Chem. A. 2008. V. 112. № 8. P. 1747.
Hermans I., Jacobs P., Peeters J. // Chem. A Eur. J. 2007. V. 13. № 3. P. 754.
Hermans I., Peeters J., Jacobs P.A. // Topics in Catalysis. 2008. V. 50. № 1−4. P. 124.
Пучков С.В., Непомнящих Ю.В., Козлова Е.С., Перкель А.Л. // Ползуновский вестник. 2013. № 1. С. 190.
Смит В.А., Бочков А.Ф., Кейпл Р. Органический синтез. Наука и искусство. М.: Мир, 2001. 573 с.
Вайсбергер А., Проскауэр Э., Риддик Дж., Тупс Э. Органические растворители. Физические свойства и методы очистки. М.: Изд-во иностр. лит., 1958. 520 с.
Перкель А.Л., Воронина С.Г. // Журн. аналит. химии. 1998. Т. 53. № 4. С. 343.
Перкель А.Л., Воронина С.Г. // Вестник КузГТУ. 2014. № 6. С. 80.
Перкель А.Л., Фрейдин Б.Г., Воронина С.Г. // Журн. аналит. химии.1993. Т. 48. № 10. С. 1697.
Перкель А.Л., Фрейдин Б.Г., Воронина С.Г., Перкель Р.Л. // Журн. аналит. химии. 1993. Т. 48. № 8. С. 1399.
Перкель А.Л., Фрейдин Б.Г. // Журн. аналит. химии. 1993. Т. 48. № 2. С. 353.
Denisov E.T., Afanas’ev I.B. Oxidation and Antioxidants in Organic Chemistry and Biology. Taylor and Francis, Boca Raton. 2005. 981 p.
Пучков С.В., Москвитина Е.Г., Непомнящих Ю.В., Перкель А.Л. // Журн. физ. химии. 2013. Т. 87. № 5. С. 751 [Russ. J. Phys. Chem. 2013. V. 87. № 5. Р. 737].
Акимов А.А., Пучков С.В., Непомнящих Ю.В., Перкель А.Л. // Кинетика и катализ. 2013. Т. 54. № 3. С. 282 [Kinet. and Catal. 2013. V. 54. № 3. P. 270].
Фрейдин Б.Г., Перкель А.Л. // Журн. приклад. химии. 1980. Т. 53. № 4. С. 861 [J. Appl. Chem. USSR. 1980. V. 53. Р. 1257].
Перкель А.Л., Фрейдин Б.Г., Бородина О.В. // Журн. приклад. химии. 1985. Т. 58. № 12. С. 2689 [J. Appl. Chem. USSR. 1985. V. 58. № 12. P. 2483].
Перкель А.Л., Богомольный Г.М., Негинская Р.В., Фрейдин Б.Г. // Журн. приклад. химии. 1987. Т. 60. № 7. С. 1590 [J. Appl. Chem. USSR. 1987. V. 60. № 7. P. 1493].
Druliner J.D., Kitson F.G., Rudat M.A., Tolman C.A. // J. Org. Chem. 1983. T. 48. № 25. P. 4951.
Котельникова Т.С., Воронина С.Г., Перкель А.Л. // Журн. приклад. химии. 2006. Т. 79. № 3. С. 424 [Russ. J. of Appl. Chem. 2006. V. 79. № 3. P. 416].
Москвитина Е.Г., Пучков С.В., Борисов И.М., Перкель А.Л. // Кинетика и катализ. 2013. Т. 54. № 5. С. 568 [Kinet. and Catal. 2013. V. 54. № 5. P. 538].
Пучков С.В., Бунеева Е.И., Перкель А.Л. // Журн. приклад. химии. 2002. Т. 75. № 2. С. 256 [Russ. J. of Appl. Chem. 2002. V. 75. № 2. P. 248].
Пучков С.В., Непомнящих Ю.В., Козлова Е.С., Перкель А.Л. // Кинетика и катализ. 2013. Т. 54. № 2. С. 148 [Kinet. Catal. 2013. V. 54. № 2. P. 139].
Перкель А.Л. // ЖПХ. 1989. Т. 62. № 5. С. 1111 [J. A-ppl. Chem. USSR. 1989. V. 62. № 5. P. 1038].
Котельникова Т.С., Ревков О.А., Воронина С.Г., Перкель А.Л. // Журн. приклад. химии. 2009. Т. 82. № 2. С. 293 [Russ. J. of Appl. Chem. 2009. V. 82. № 2. P. 287].
Котельникова Т.С., Ревков О.А., Воронина С.Г., Перкель А.Л. // Журн. приклад. химии. 2009. Т. 82. № 3. С. 472 [Russ. J. of Appl. Chem. 2009. V. 82. № 3. P. 466].
Тимохин В.И. Автореф. дис. ... докт. хим. наук. Львов, Львов. политехн. ин-т. 1991. 32 с.
Акимов А.А., Перкель А.Л. // Ползуновский вестник. 2009. № 3. С. 63.
Landolt-Bórnstein. Numerical Data and Functional Relationships in Science and Technology. New Series. Group II: Atomic and Molecular Physics. V.13. Radical Reaction Rates in Liquids. Subvol. d. Berlin: Springer-Verlag, 1984. 431 p.
Tavadyan L.A., Mardoyan V.A., Musaelyan M.V. // Int. J. Chem. Kinet. 1996. V. 28. № 8. P. 555.
Корсак И.И., Агабеков В.Е., Мицкевич Н.Н. // Изв. АН БССР. Сер. хим. наук. 1974. № 6. С. 28.
Дополнительные материалы отсутствуют.