Нефтехимия, 2019, T. 59, № 6-2, стр. 825-830
Взаимодействие 2-монозамещенных 1,3-диоксоланов с алюминациклопентанами
Т. Ф. Дехтярь 1, *, О. С. Вострикова 2, С. С. Злотский 2, А. А. Богомазова 1, Н. Н. Михайлова 2
1 Башкирский государственный университет Стерлитамакский филиал
453103 Стерлитaмак, Башкирия
2 Уфимский государственный нефтяной технический университет
450062 Уфа, Башкирия
* E-mail: dekhtyartf@mail.ru
Поступила в редакцию 05.10.2017
После доработки 15.12.2018
Принята к публикации 12.02.2019
Аннотация
Взаимодействие 2-монозамещенных 1,3-диоксоланов с 3-гексил-1-этилалюминациклопентаном приводит к расщеплению связи Al–C металлоцикла и образованию после гидролиза реакционной массы моноэфиров этиленгликоля. Каталитические количества ZrCl4, или Ni(acac)2 активируют процесс. При взаимодействии 2-монозамещенных 1,3-диоксоланов с 1-этил-3-нафтилалюминациклопентаном, образуется продукт расщепления экзоциклической связи алюминациклопентана Al-Et.
Взаимодействие циклических ацеталей и кеталей с простейшими алюминийорганическими соединениями находит широкое применение в органическом синтезе [1]. Использование для этих целей высших алюминийорганических соединений (АОС), ставших доступными в последнее время, изучено явно недостаточно [2, 3]. В тоже время привлечение таких АОС может оказаться весьма эффективным в плане синтеза производных высших моноэфиров гликолей [4], а кроме того, позволит углубить и расширить известные представления о механизмах реакций 1,3-диоксоланов. В связи с этим подробное изучение взаимодействия данных карбонильных субстратов с АОС различного строения представляется важной и актуальной задачей современного органического синтеза.
Алюминациклопентаны – пятичленные алюминийсодержащие гетероциклы, отличающиеся от триалкилаланов специфической реакционной способностью эндоциклических Al–C-связей, после разработки удобного метода их синтеза [5] на основе доступных продуктов нефтехимии стали объектами интенсивных исследований в ряде научных центров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Взаимодействие 3-гексил-1-этилалюминациклопентана (1) с 1,3-диоксоланами (2а−в) (общая методика). В атмосфере сухого аргона к раствору 40 ммолей соединения (1) в 10 мл безводного гептана при –20°С добавляли по каплям 20 ммолей диоксолана (2а–д). Температуру повышали до необходимой и перемешивали реакционную массу в течение 2 или 6 ч, после чего охлаждали до ‒20°С и разлагали 20 мл 10%-ной HCl. Органический слой отделяли, сушили MgSO4 и анализировали методом ГЖХ. Продукты реакции выделяли вакуумной перегонкой. Оксиэфиры (3а–в) идентифицированы в виде смеси региоизомеров (3) и (4). Соединение (5б) идентифицировано в индивидуальном виде, моноэфиры (5а, в) идентифицировали методом ГЖХ сравнением с известными образцами [6].
Взаимодействие 1,3-диоксоланов (2а–в) с 1‑этил-3-нафтилалюминациклопентаном (6) (общая методика). В атмосфере сухого аргона к 40 ммоль раствора алюминийорганического соединения (6) в 10 мл сухого CH2Cl2 при 0°С добавляли по каплям 20 ммолей диоксолана (2а–д). Температуру реакционной массы повысили до 20°С и перемешивали в течение 6 ч, после чего охладили до −20°С и разлагали 20 мл 10%-ного водного раствора HCl. Органический слой отделяли, сушили MgSO4 и анализировали методом ГЖХ. Продукт (5б) выделили вакуумной перегонкой, данный оксиэфир идентифицирован в индивидуальном виде. Моноэфиры (5а, в) идентифицировали методом ГЖХ сравнением с известными образцами [6].
Алюминациклопентан (1) и 1-этил-3-нафтил-алюминациклопентан (6) синтезировали согласно методике [5]. 2-Монозамещенные 1,3-диоксоланы (2а–в) синтезировали согласно методике [7], перегоняли в токе аргона над NaOH и хранили в инертной атмосфере. Их физико-химические константы совпадают с приведенными в литературе [8].
Спектры ЯМР 1Н и 13С регистрировали в СDCl3 на спектрометре Bruker АМ-300 с рабочими частотами 300.15 и 75.47 МГц, соответственно, причем, спектры ЯМР 13С – в режиме с модуляцией константы С–Н-взаимодействия (JMODCH). Хроматографический анализ реакционных смесей проводили на хроматографе Сhrom-5, колонка из нержавеющей стали 120 × 0.5 см, 5% SЕ-30 на хроматоне N-AW; детектор пламенно-ионизационный, газ-носитель – гелий.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Мы изучили взаимодействие 3-гексил-1-этилалюминациклопентана (1) с 1,3-диоксоланами (2а–в) [9], расщепление которых простейшими триалкилаланами (AlEt3 или Al-i-Bu3) приводит к образованию высших моноэфиров этиленгликоля [10]. В случае алюминациклопентанов, обладающих тремя неэквивалентными по активности связями Al−C, теоретически возможно образование из каждого ацеталя трех различных моноэфиров (3−5).
Мы установили, что в изучаемой реакции участвуют преимущественно эндоциклические радикалы алюминациклопентана. Так 2-монозамещенные 1,3-диоксоланы (2а–в) взаимодействуют с двойным избытком алюминациклопентана в мягких условиях (20°С, 2 ч), образуя смесь продуктов расщепления алюминийсодержащего гетероцикла (3а–в) и (4а–в) в соотношениях, зависящих как от строения исходных ацеталей, так и от условий проведения реакции (табл. 1). При эквимольном соотношении реагентов выход указанных продуктов реакции не превышает 3–5%, тогда как дальнейшее увеличение избытка алюминийорганического соединения заметного влияния на ход реакции не оказывает.
Таблица 1.
Взаимодействие 2-монозамещенных-1,3-диоксоланов с 3-гексил-1-этилалюминоциклопентаном (время реакции 2 ч, соотношение алюминациклопентан : ацеталь = 2 : 1)
| Исходный ацеталь | Растворитель | Катализатор, 3 мольн. % | Температура, °С | Суммарный выход продуктов реакции, % |
Соотношение (3/4) |
|---|---|---|---|---|---|
| 2а | Гексан | – | 20 | 3а + 4а (44) | 1.59 |
| 2а | Гексан | ZrCl4 | 20 | 3а + 4а (71) | 1.73 |
| 2а | Гексан | – | 60 | 3а + 4а (64) | 1.13 |
| 2а | Гексан | Ni(acac)2 | 20 | 3а + 4а (77) | 2.71 |
| 2а | CH2Cl2 | – | 20 | 3а + 4а (61) | 1.44 |
| 2а | CH2Cl2 | ZrCl4 | 20 | 3а + 4а (75) | 2.75 |
| 2б | Гексан | – | 20 | 3б + 4б (52) | 1.36 |
| 2б | Гексан | ZrCl4 | 20 | 3б + 4б (54) | 5.00 |
| 2б | Гексан | – | 60 | 3б + 4б (65) | 1.24 |
| 2б | Гексан | Ni(acac)2 | 20 | 3б + 4б (62) | 1.95 |
| 2б | CH2Cl2 | – | 20 | 3б + 4б (54) | 1.45 |
| 2б | CH2Cl2 | ZrCl4 | 20 | 3б + 4б (43) | 2.58 |
| 2в | Гексан | – | 20 | 3в + 4в (65) | 1.03 |
| 2в | Гексан | ZrCl4 | 20 | 3в + 4в (64) | 1.00 |
Металлокомплексные катализаторы оказывают заметное влияние на региоселективность процесса, и эффект (особенно ZrCl4), максимален в случае ацеталя (2б). Хлористый метилен, который значительно повышает выходы продуктов реакций 1,3-диоксоланов с простейшими АОС [11], влияет на ход реакции неоднозначно. Повышает суммарный выход продуктов реакции (3а) и (4а) в случае 2-фенил-1,3-диоксолана (2а), не изменяя ее региоселективности; и повышает региоселективность расщепления с участием 2-изопропил-1,3-диоксолана (2б), почти не повышая суммарного выхода оксиэфиров (3б) и (4б).
Интересно отметить, что соединение (1) взаимодействует с несимметричным ацеталем (2в) только по связи С2–О1 диоксоланового гетероцикла, образуя примерно равные количества оксиэфиров (3в, 4в), тогда как моноэфиры со вторичной группой –ОН в продуктах реакции не обнаружены. При этом региоселективность расщепления алюминациклопентана (1) оказалась самой низкой в наших опытах (табл. 1). Во всех случаях моноэфиры (5а–в) образуются только при увеличении времени реакции до 6 ч, однако их выходы не превышают 5–10%.
Повышение температуры реакции до 60°С приводит к некоторому увеличению суммарного выхода оксиэфиров (3а, б) и (4а, б), однако снижает селективность образования соединений (3а, б).
Ранее нами было показано, что при взаимодействии этилортоформиата с 1-этил-3-нафтил-алюминациклопентаном, содержащим весьма объемный арильный заместитель при С3-атоме гетероцикла в реакции участвует эндоциклический радикал алюминациклопентана [12].
Представлялось интересным вовлечь в реакцию с 1,3-диоксацикланами упомянутый выше алюминациклопентан. Так 1,3-диоксоланы (2а–в) взаимодействуют с двойным избытком 1-этил-3-нафтилалюминациклопентана (6), селективно образуя в мягких условиях (20°С, 6 ч) алюминаты, дающие после гидролиза реакционной массы оксиэфиры (5а–в) с выходом не более 20% за 6 ч.
При эквимольном соотношении реагентов выход указанных продуктов реакции не превышает 3–5%, причем дальнейшее увеличение избытка алюминийорганического соединения заметного влияния на ход реакции не оказывает.
Как выяснилось, радикалы различного строения, входящие в состав одного и того же алюминийорганического соединения, обладают различной реакционной способностью в данной реакции, оказалось, что в одинаковых условиях (20°С, 2 ч) алюминациклопентан (6) с циклическими ацеталями по эндоциклическому радикалу не реагирует, но увеличение продолжительности реакции до 6 ч приводит к образованию продуктов расщепления экзоциклической связи Al−Et в количестве не более 20%.
Структура всех полученных соединений установлена методами ЯМР 1Н и 13С-спектроскопии.
2-[(4-Метил-1-фенилдецил)окси]-1-этанол (3а). Т. кип. 120–125°С (1 мм. рт. ст.). Найдено (%): С 78.10; Н 11.00. C19H32O2. Вычислено (%): С 78.03; Н 10.94. Спектр ЯМР 1Н, δ, м.д., J/Гц: 0.88 д [3 H, H(11II), CH3, J = 6.7], 0.9 т [3 H, H(10II), CH3, J = 6.0], 1.15−1.45 м [11 H, H(4II)–Н(9II), CH2, СН], 1.65−1.75 м [2 H, H(3II), CH2], 1.75−1.95 м [2 H, H(2II), CH2], 2.17 уш. с. (1 H, ОH), 3.43 т [2 H, H(2), CH2O, J = 7.7], 3.70 т [2 H, H(1), CH2OН, J = 7.7], 4.20 т [1 H, H(1II), CH, J = 7.0], 7.20–7.40 м [5 H, H(2I)–Н(6I), СH, Ar]. Спектр ЯМР 13С, δ, м.д.: 13.99 [C(10II), CH3], 19.46 [C(11II), CH3], 22.55 [C(9II), CH2], 29.49 [C(7II), CH2], 29.65 [C(6II), CH2], 31.77 [C(8II), CH2], 32.58 [C(4II), CH], 32.67 [C(5II), CH2], 35.61 [C(2II), CH2], 36.73 [C(3II), CH2], 61.79 [C(1), CH2OH], 69.75 [C(2), CH2O], 83.15 [C(1II), CH], 126.48–128.28 [C(2I)–C(6I), СH, Ar], 142.42 [C(1I), C, Ar].
2-[(1-Фенилнонил-3-этил-)окси]-1-этанол (4а). Т. кип. 120–125°С (1 мм. рт. ст.). Найдено (%): С 78.10; Н 11.00. C19H32O2. Вычислено (%): С 78.03; Н 10.94. Спектр ЯМР 1Н, δ, м.д., J/Гц: 0.84 т [3 H, H(11II), CH3, J = 5.1], 0.86 т [3 H, H(9II), CH3, J = 6.0], 1.15–1.45 м [10 H, H(4II)–Н(8II), CH2], 1.45–1.55 м [2 H, H(10II), CH2], 1.65–1.75 м [2 H, H(2II), CH2], 1.75–1.95 м [1 H, H(3II), CH], 2.17 уш. с (1 H, ОH), 3.43 т [2 H, H(2), CH2O, J = 7.7], 3.70 т [2 H, H(1), CH2OН, J = 7.7], 4.32 т [1 H, H(1II), CH, J = 6.8], 7.20–7.40 м [5 H, H(2I)–Н(6I), СH, Ar]. Спектр ЯМР 13С, δ, м. д. : 10.45 [C(11II), CH3] 13.99 [C(9II), CH3], 22.55 [C(8II), CH2], 26.03 [C(5II), CH2], 26.84 [C(10II), CH2] 29.54 [C(6II), CH2], 31.77 [C(7II), CH2], 35.06 [C(3II), CH], 35.47 [C(4II), CH2], 42.19 [C(2II), CH2], 61.79 [C(1), CH2OH], 69.75 [C(2), CH2O], 80.90−80.98 [C(1II), CH], 126.48–128.28 [C(2I)–C(6I), СH, Ar], 142.34 [C(1I), C, Ar].
2-[(1-Изопропил-4-метилдецил)окси]-1-этанол (3б). Т. кип. 145–150°С (40 мм. рт. ст.). Найдено (%): С 73.36; Н 13.13. C16H34O2. Вычислено (%): С 74.36; Н 13.26. Спектр ЯМР 1Н, δ, м.д., J/Гц: 0.89 т [3 Н, Н(10II), СН3, J = 6.6], 0.9 д [3 Н, Н(11II), СН3, J = 5.2], 0.91 д [6 Н, Н(2I), Н(3I), СН3, J = = 6.7], 1.05–1.55 м [15 Н, Н(2II)–Н(9II) СН2, СН], 1.80–192 м [1 Н, Н(1I), СН], 2.25 уш. с (1 H, ОH), 2.97–3.07 м [1 Н, Н(1II), СН], 3.55 т [2 Н, Н(2), СН2O, J = 7.0], 3.72 т [2 Н, Н(1), СН2OН, J = 7.0]. Спектр ЯМР 13С, δ, м.д.: 14.06 [C(10II), CH3], 18.03 [C(2I), CH3], 18.23 [C(3I), CH3], 19.60, 19.71 [C(11II), CH3], 22.65 [C(9II), CH2], 27.01 [C(6II), CH2], 27.72 [C(2II), CH2], 29.63 [C(7II), CH2], 30.65 [C(4II), CH], 31.90 [C(8II), CH2], 32.76, 32.86 [C(3II), CH2], 32.90, 33.01 [C(1I), CH], 36.90 [C(5), CH2], 62.25 [C(1), CH2OH], 70.70 [C(2), CH2O], 85.37, 85.47 [C(1II), CH].
2-[(1-Изопропилнонил-3-этил)окси]-1-этанол (4б). Т. кип. 145–150°С (40 мм. рт. ст.). Найдено (%): С 73.36; Н 13.13. C16H34O2. Вычислено (%): С 74.36; Н 13.26. Спектр ЯМР 1Н, δ, м.д., J/Гц: 0,87 т [3 Н, Н(11II), СН3, J = 6.7], 0.91 д [6 Н, Н(2I), Н(3I), СН3, J = 6.7], 0.92 т [3 Н, Н(9II), СН3, J = 6.9], 1.05−1.55 м [15 Н, Н(2II)–Н(8II), Н(10II), СН2, СН], 1.80–1.92 м [1 Н, Н(1I), СН], 2.25 уш. с (1 H, ОH), 3.13–3.21 м [1 Н, Н(1II), СН], 3.55 т [2 Н, Н(2), СН2O, J = 7.0], 3.72 т [2 Н, Н(1), СН2OН, J = 7.0]. Спектр ЯМР 13С, δ, м.д.: 10.30, 10.78 [C(11II), CH3], 14.06 [C(9II), CH3], 17.66, 17.83 [C(3I), CH3], 18.13, 18.20 [C(2I), CH3], 23.02 [C(8II) CH2], 26.23 [C(5II), CH2], 27.01 [C(10II), CH2], 29.63 [C(6II), CH2], 30.61, 30.65 [C(3II) CH], 31.90 [C(7II), CH2], 33.72, 34.30 [C(4II), CH2], 35.59 [C(1I), CH], 37.08 [C(2II), CH2], 62.25 [C(1), CH2OH], 70.47 [C(2), CH2O], 82.80 [C(1II), CH2].
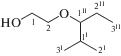
2-(2-Метил-1-этилпропокси)-1-этанол (5б). Т. кип. 72°С (10 Торр, $n_{{\text{D}}}^{{20}}$ 1.4357. Найдено (%): С 65.70; Н 12.20. С8Н18О2. Вычислено (%): С 65.71; Н 12.41. Спектр ЯМР 1Н (СDCl3, δ, м. д., J/Гц): 0.73 (д, 3 H, CH3, J = 6.8); 0.77 (д, 3H, CH3, J = 6.9); 0.8 (т, 3 H, CH3, J = 7.1); 1.25–1.42 (м, 2 H, CH2); 1.7 (oк, 1 H, CH, J = 6.6); 2.83 (к., 1 H, CHO, J = 6.5.); 3.0 (уш. с, 1 H, OH); 3.42 (т, 2 H, CH2O, J = 4.6); 3.56 (т, 2H, CH2O, J = 4.6). Спектр ЯМР 13С (СD-Cl3, δ, м.д.): 9.68 (CH3); 18.0 (CH3); 18.09 (CH3); 22.85 (CH2); 30.22 (CH); 61.82 (CH2OН); 70.86 (CH2O); 86.24 (CHO).
2-[(4-Метил-1-фенилдецил)окси]-1-пропанол (3в). Т. кип. 180–185°С (5 мм. рт. ст.). Найдено (%): С 78.40; Н 12.01. C20H34O2. Вычислено (%): С 78.38; Н 11.18. Спектр ЯМР 1Н, δ, м.д., J/Гц: 0.85 т [3 H, H(10II), CH3, J = 7.0], 0.90 д [3 H, H(11II), CH3, J = 5.7], 1.13 д [3 H, H(3), CH3, J = 5.8], 1.15–1.95 м [15 H, H(2II)–Н(9II), CH2, CH], 2.11 уш. с (1 H, ОH), 3.45 т [2 H, H(1), CH2ОН, J = 5.2], 3.50–3.60 м [1 H, H(2), CH2O], 7.20–7.40 м [5 H, Н(2I)–Н(6I), СH, Ar]. Спектр ЯМР 13С, δ, м.д.: 14.06 [C(10II), CH3] 17.56 [C(3), CH3], 19.55 [C(11II), CH3], 22.64 [C(9II), CH2], 29.57 [C(7II), CH2] 29.71 [C(6II), CH2], 31.86 [C(8II), CH2], 32.75 [C(4II), CH], 35.91 [C(5II), CH2], 36.04 [C(2II), CH2], 36.80 [C(3II), CH2], 65.65 [C(1), CH2OH], 74.27 [C(2), CH2O], 81.71 [C(1II), CH], 126.60–128.49 [C(2I)–C(6I), СH, Ar], 143.98 [C(1I), C, Ar].
2-[(1-Фенилнонил-3-этил)окси]-1-пропанол (4в). Т. кип. 180–185°С (5 мм. рт. ст.). Найдено (%): С 78.40; Н 12.01. C20H34O2. Вычислено (%): С 78.38; Н 11.18. Спектр ЯМР 1Н, δ, м.д., J/Гц: 0.85 т [3 H, H(11II), CH3, J = 7.1], 0.95 т [3 H, H(9II), CH3, J = 6.6], 1.13 д [3 H, H(3), CH3, J = 5.8], 1.15–1.95 м [15 H, H(2II)–Н(8II), Н(10II)CH2, CH], 2.11 уш. с (1 H, ОH), 3.49 т [2 H, H(1), CH2ОН, J = 6.6], 3.50–3.60 м [1 H, H(2), CH2 O], 7.20–7.40 м [5 H, Н (2I)–Н(6I), СH, Ar]. Спектр ЯМР 13С, δ, м.д.: 10.53 [C(11II), CH3], 14.06 [C(9II), CH3] 17.64 [C(3), CH3], 22.64 [C(8II), CH2], 26.05, 26.37 [C(10II), CH2] 26.11 [C(5II), CH2] 29.66 [C(6II), CH2], 31.86 [C(7II), CH2], 35.21 [C(3II), CH], 35.91 [C(4II), CH2], 42.71, 42.77 [C(2II), CH2], 65.75 [C(1), CH2OH], 74.45 [C(2), CH2 O], 79.49 [C(1II), CH], 126.60–128.49 [C(2I)–C(6I), СH, Ar], 143.90 [C(1I), C, Ar].
В спектрах соединений (3а, б, в–4а, б, в) наблюдалось удвоение некоторых сигналов углеродных атомов из-за образования диастереомерных продуктов.
Таким образом, взаимодействие 1,3-диоксоланов с 3-гексил-1-этилалюминациклопентаном может служить удобным методом синтеза 2-гидроксиэтиловых эфиров разветвленных вторичных и третичных высших спиртов, труднодоступных при получении другими методами. Влияние активирующих добавок на региоселективность реакции и выход целевых продуктов процесса неоднозначно и зависит от природы и расположения заместителей в исходных ацеталях.
КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.ИНФОРМАЦИЯ ОБ АВТОРАХ Дехтярь Татьяна Федоровна, к.х.н., доцент, ORCID: https://orcid.org/0000-0002-4870-8927Вострикова Ольга Сергеевна, к.х.н., ORCID: https://orcid.org/0000-0002-7715-8047Злотский Семён Соломонович, д.х.н., проф., ORCID: https://orcid.org/ 0000-0002-1869-7526Богомазова Анна Александровна, к.х.н., доцент, ORCID: https://orcid.org/0000-0003-2712-5869Михайлова Наталья Николаевна, к.х.н., доцент, ORCID: https://orcid.org/0000-0002-2913-047X
Список литературы
Yeh S.-M., Lee H., Wang Y., and Luh T.-Y., J. Org. Chem., 1997. V. 62. P. 8315.
Дехтярь Т.Ф., Вострикова О.С., Злотский С.С. // Башкирский химический журн. 2009. Т. 16. № 1. С. 52.
Вострикова О.С., Дехтярь Т.Ф., Злотский С.С. // Известия вузов: химия и химическая технология. 2005. Т. 48. № 5. С. 157.
Дехтярь Т.Ф., Вострикова О.С., Злотский С.С. // Башкирский химический журн. 2003. Т. 10. № 3. С. 38.
Джемилев У.М., Ибрагимов А.Г., Золотарев А.П. // Изв. АН СССР. Сер. хим. 1989. № 1. С. 207.
Renoll M., Newmann M.S. / Organic Synthesis. N. Y.: Coll. J. Wiley & Sons, 1955. Vol. 3. P. 502.
Bieltseins Handbook of Organic Chemisry / Ed. Luckenbach R., N. Y.: Springer, 1987. Vol. 19. Ch. 1, 6.
Гафарова Ю.Т. Автореф. ... дис. канд. хим. наук. Уфа, 2001. С. 24.
Дехтярь Т.Ф., Дехтярь Е.Ф., Вострикова О.С., Злотский С.С., Докичев В.А. // ЖОХ. 2004. Т. 74. № 6. С. 978.
Вострикова О.С., Гафарова Ю.Т., Докичев В.А., Злотский С.С. // Изв. PАН, Сер. хим. 1999. № 8. С. 1550.
Гафарова Ю.Т., Дехтярь Е.Ф., Дехтярь Т.Ф., Фатыхов А.А., Спирихин Л.В., Вострикова О.С., Злотский С.С., Докичев В.А. // Изв. PАН. Сер. хим. 2003. № 8. С. 951.
Дехтярь Е.Ф., Дехтярь Т.Ф., Вострикова О.С., Злотский С.С. // Башкирский химический журн. 2009. Т. 16. № 2. С. 93.
Дополнительные материалы отсутствуют.
Инструменты
Нефтехимия