Нефтехимия, 2020, T. 60, № 3, стр. 321-327
Полимеризация этилена в присутствии координационных соединений Ti+4, Zr+4 и V+5 с саленовыми лигандами
С. Ч. Гагиева 1, *, В. А. Тускаев 1, 2, А. С. Лядов 3, Р. У. Таказова 2, Б. М. Булычев 1
1 Московский государственный университет имени М.В. Ломоносова, Химический факультет
119991 Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, Россия
3 Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Россия
* E-mail: sgagieva@yandex.ru
Поступила в редакцию 12.11.2019
После доработки 15.11.2019
Принята к публикации 18.11.2019
Аннотация
Получены и охарактеризованы координационные соединения титана(IV), циркония (IV) и ванадия(V) с хиральными саленовыми лигандами и изучена их каталитическая активность в реакции полимеризации этилена. Показано, что в присутствии сокатализатора полиметилалюмоксана (МАО) активность каталитической системы, содержащей титан, достигает 944 кг ПЭ моль (Ti)–1 ч–1, и приводит к получению сверхвысокомолекулярного полиэтилена.
ВВEДEНИE
Полиолефины представляют собой самую большую группу полимерных материалов, объем мирового производства оценивается в 140 млн т в год и имеет устойчивую тенденцию к росту. В этой группе полимеров львиная доля приходится на полиэтилен (порядка 100 млн т в год), что, объясняется доступностью мономера – этилена, основного нефтехимического процесса в мире. Перспективной разновидностью полиэтилена (ПЭ) является сверхвысокомолекулярный полиэтилен (СВМПЭ), характеризующийся молекулярной массй от 1 до 10 млн г/моль и обладающий уникальным комплексом свойств. Известно что, если провести синтез СВМПЭ в суспензионном режиме с использованием специфических катализаторов, в частности постметаллоценовых, то в ряде случаев удается с высоким выходом получить насцентный реакторный порошок, морфология которого близка к морфологии монокристальных матов ПЭ. Для материалов такого типа возможна реализация непрерывного способа безрастворного твердофазного формования сверхвысокопрочных (разрывная прочность выше 2.5 ГПа) и сверхвысокомодульных (модуль упругости выше 150 ГПа) ориентированных нитей и волокон [1, 2]. СВМПЭ может быть получен в присутствии катализаторов на основе комплексов переходных металлов с саленовыми лигандами.
Салены – продукты конденсации салициловых альдегидов с различными, в том числе и хиральными, диаминами, являются одной из наиболее изученных групп органических лигандов. К очевидным преимуществам саленовых лигандов перед их другими типами можно отнести простоту синтеза, относительную устойчивость к нуклеофильным реагентам, легкость изменения геометрии и электронных характеристик, диктуемые необходимостью изменения свойств металлического центра, например при использовании саленовых комплексов в каталитических реакциях. Действительно, эти соединения широко используются в асимметрическом синтезе для катализа реакций Анри, Нозаки–Хияма–Киши, Байера–Виллигера, процессов циклоприсоединения, полимеризации с раскрытием цикла, активации CH-связи присоединения нуклеофилов к непредельным карбонильным соединениям [3, 4]. Примеры использования комплексов металлов 4 группы с саленовыми лигандами в качестве катализаторов полимеризации этилена, как ни странно, довольно редки (рис. 1). Так известно, что активность систем на основе титандихлоридных саленовых комплексов типа А (рис. 1) и полиметалалюмоксана (МАО) или Et2AlCl невелика и изменяется в пределах 30–88 кг ПЭ моль (Ti)–1 ч–1. При нанесении комплексов на магнийсодержащий носитель состава MgCl2(THF)0.32(Et2AlCl)0.36 активность возрастает до 412 кг ПЭ моль (Ti)–1 ч–1 [5]. Саленовые комплексы циркония, активированные Et2AlCl, олигомеризуют этилен с образованием продуктов С4–С10 и хорошей селективностью по линейным α-олефинам (ЛАО), значение TOF достигает 4.93 × 104 ч–1 [6]. Комплексы с салфеновыми лигандами (тип В, рис. 1) в присутствии МАО катализируют полимеризацию этилена с активностью до 21.5 кг ПЭ моль (Zr)–1 ч–1 [7].
Рис. 1.
Примеры комплексов с саленовыми и салфеновыми лигандами, активных в олиго- и полимеризации этилена.

Возможно, что дефицит интереса к этим соединениям обусловлен не только относительно низкой активностью систем, но и устоявшейся точкой зрения на то, что трансоидное расположение галогенов в саленовых прекатализаторах не благоприятствует формированию устойчивых каталитически активных частиц катионной природы [8]. Однако, как показывают литературные данные, потенциал саленовых комплексов в качестве прекатализаторов полимеризации этилена и α-олефинов далеко не исчерпан. Так, авторами работы [9] установлено, что активность циркониевых комплексов (тип С, рис. 1) увеличивается как с ростом длины углеродного линкера, достигая максимума при n = 6, так и с увеличением объема заместителя в орто-положении к фенольному гидроксилу. Увеличение температуры реакции полимеризации до 75°С приводит к резкому росту активности системы, достигая для прекатализатора С (R = адамантил, n = 6) невообразимого значения – 103 800 кг ПЭ моль (Zr)–1 ч–1 [9]. В ряде случаев на этих системах был получен высокомолекулярный или сверхвысокомолекулярный ПЭ с широким ММР.
Цель работы заключалась в получении новых координационных соединений металлов 4 и 5 групп с саленовыми лигандами и изучении их каталитической активности в реакции полимеризации этилена в присутствии МАО при варьировании условий проведения каталитического процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез комплексных соединений
Синтез комплексов проводили в атмосфере сухого аргона и в абсолютированных растворителях. Дихлорметан, толуол, гексан и этилацетат (все “х. ч.”) дополнительно очищали согласно известной методике [10]. Раствор полиметилалюмоксана в толуоле, TiCl4, VOCl3 (“Aldrich”) использовали без дополнительной очистки. Спектры ЯМР 1Н, 13C регистрировали на приборах “Bruker WP-300” и ”Bruker АМХ-400”. Рентгенофлуоресцентный анализ выполняли на приборе “VRA-30” (“CarlZeiss”). Калориметрические исследования проводили на калориметре DSC-822e (“Mettler-Toledo”) при скорости нагрева 10 град мин–1 на воздухе.
Хиральные тетрадентатные саленовые лиганды синтезировали взаимодействием соответствующих салициловых альдегидов с циклогександиамином в толуоле в присутствии п-тоуолсульфокислоты и дальнейшей кристаллизации полученных веществ 1L [11], 2L [12, 14], 3L [13]. Свойства полученных соединений полностью соответствовали литературным данным.
Лиганд 1L, $[{\text{a}}]_{0}^{{25}}$ –359° (с = 1, СНС13) [лит. [53] $[{\text{a}}]_{{\text{D}}}^{{25}}$ –359.5° (с = 1, СНСl3)]. Найдено: С, 74.69; Н, 6.97; N, 8.32, . Для C20H22N2O2 вычислено, %: С, 74.51; Н, 6.88; N, 8.69. Спектр 'Н ЯМР (CDCI3, м.д.): 1.69−1.90 (m, 8Н), 3.21−3.40 (t, 2Н), 6.93–7.35 (br, 8Н), 8.20 (s, 2Н, CH=N), 13.6 (s, 2Н, OH).
Лиганд 2L, Тпл 63–64°С $[{\text{ct}}]_{{\text{D}}}^{{25}}$[ –250° (с = 1, СНСl3). Найдено, %: С, 79.01; Н, 9.91; N, 5.10. Для C36H54N2O2 вычислено, %: С, 79.07; Н, 9.95; N, 5.12. Спектр 1Н ЯМР (CDCl3, м.д.): 1.20–1.42 (m, 36Н), 3.26 (s, 2Н), 3.66 (m, 6Н), 6.78–6.88 (m, 4Н), 8.22 (s, 2Н, CH=N), 13.21 (s, 2Н, OH).
Лиганд 3L, $[{\text{a}}]_{{\text{D}}}^{{25}}$ –288° (с = 1, СНС13). Найдено, %: С, 80.96; Н, 6.33; N, 5.86. Для C32H30N2O2 вычислено, %: С, 80.98; Н, 6.37; N, 5.90. Спектр 1Н ЯМР (СDС13): 2.21–2.45 (m, 8Н), 3.47–3.50 (m, 2Н), 7.51–8.24 (m, 18Н, Ar), 12.2 (s, 2Н).
Синтез комплексов осуществляли по следующей методике:
Комплекс 1. В пробирку Шленка, заполненную аргоном, поместили раствор лиганда 1L (0.32 г, 1 ммоль) в толуоле (10 мл), при перемешивании добавляли 0.23 г (1 ммоль) ТiCl2(OiPr)2 и перемешивали 20 ч. Затем раствор упарили в вакууме и полученное кристаллическое вещество перекристаллизовали из смеси толуол–гексан (1 : 1). Выход 0.38 г (87%). Тпл 250–300°С; [a]21 D + 390 (с = 0.033, СНСl3). Найдено, %: С, 54.67; H, 4.53; N, 6.32; Cl, 16.10; Ti, 10.86. Для C20H20Cl2N2O2Ti (438) вычислено, %: С, 54.70; H, 4.59; N, 6.38; Cl, 16.15; Ti, 10.90. ИК: νmax (Nujol) см–1, 1618 s, 1583 m и 1560 m; Спектр 1H ЯМР (CDCI3, м.д.): 1.72–1.88 (m, 8Н), 3.32–3.41 (t, 2Н), 6.98− 7.40 (br, 8Н), 8.14 (s, 2Н, CH=N). Спектр 13C ЯМР (CDC13): 24.1, 28.4, 29.8, 35.4, 122.2, 126.2, 133.5, 133.7, 137.6, 160.2, 161.7.
Комплекс 2. В пробирку Шленка, заполненную аргоном, поместили раствор лигана 2L (0.55 г, 1 ммоль) в толуоле (10 мл), при перемешивании добавляли 0.23 г (1 ммоль) ТiCl2(OiPr)2 и перемешивали 20 ч. Затем раствор упарили в вакууме и полученное кристаллическое вещество перекристаллизовали из гексана. Выход 0.56 г (84%); найдено, %: C, 65.10; H, 7.85; N, 4.17; Cl, 10.65; Ti, 7.19. Для C36H52Cl2N2O2Ti (662) вычислено, %: C, 65.16; H, 7.90; N, 4.22; Cl, 10.69; Ti, 7.21. ИК: νmax (Nujol) см–1, 1618, 1583 и 1560; Спектр 1HЯМР (CDCI3, м.д.): 1.29–1.47 (m, 36Н), 3.36 (s, 2Н), 3.78 (m, 6Н), 6.90–7.21(m, 4Н), 8.15 (s, 2Н, CH=N).
Комплекс 3. В пробирку Шленка, заполненную аргоном, поместили раствор лиганда 3L (0.47 г, 1 ммоль) в толуоле (10 мл), при перемешивании добавляли 0.23 г (1 ммоль) ТiCl2(OiPr)2 и перемешивали 20 ч. Затем раствор упарили в вакууме и полученное кристаллическое вещество перекристаллизовали из толуола. Выход 0.41 (69%); Найдено, %: C, 64.92; H, 4.70; N, 4.70; Cl, 11.91; Ti, 8.03. Для C32H28Cl2N2O2Ti (590) вычислено, %: C, 64.99; H, 4.77; N, 4.74; Cl, 11.99; Ti, 8.09. ИК: νmax (Nujol) см–1, 1620, 490, 547. Спектр 1H ЯМР (CDCl3, м.д.): 2.43–2.55 (m, 8Н), 3.41–3.59 (m, 2Н), 7.36–7.98 (m, 18Н, Ar).
Комплекс 4. В пробирку Шленка, заполненную аргоном, поместили раствор лиганда 2L (0.55 г, 1 ммоль) в толуоле (10 мл), при перемешивании добавляли 0.38 г (1 ммоль) ZrCl4 2THF и перемешивали при нагревании 24 ч. Затем раствор упарили в вакууме и полученное кристаллическое вещество перекристаллизовали из смеси толуол : гексан (2 : 1). Выход 0.61 г (87%). Найдено, %: C, 61.13; H, 7.36; N, 3.92; Cl, 9.97; Zr, 12.85. Для C36H52Cl2N2O2TiZr (704) вычислено, %: C, 61.16; H, 7.41; N, 3.96; Cl, 10.03; Zr, 12.90.
ИК: νmax (Nujol) см–1, 1623, 1589, 1562. Спектр 1H ЯМР (СDС13, м.д.): 1.32–1.40 (m, 36Н), 3.31 (s, 2Н), 3.62 (m, 6Н), 6.99–7.30 (m, 4Н), 8.11 (s, 2Н, CH=N).
Комплекс 5. В пробирку Шленка, заполненную аргоном, поместили раствор лиганда 2L (0.55 г, 1 ммоль) в толуоле (10 мл), при перемешивании добавляли 0.12 г (1 ммоль) VOCl3 и перемешивали 20 ч. Затем раствор упарили в вакууме и полученное кристаллическое вещество перекристаллизовали из гексана. Выход 0.56 г (84%). Найдено, %: C, 66.75; H, 8.05; N, 4.28; Cl, 5.42; V, 7.80. Для C36H52ClN2O3V (646) вычислено, %: C, 66.81; H, 8.10; N, 4.33; Cl, 5.48; V, 7.87. ИК: νmax (Nujol) см–1, 1628, 1583, 1560; 995. Спектр 1H ЯМР (CDCl3, м.д.): 1.49–1.52 (m, 36Н), 3.42 (s, 2Н), 3.81(m, 6Н), 6.65–7.17 (m, 4Н), 8.11(s, 2Н, CH=N).
Процесс осуществляли в толуоле в стеклянном реакторе объемом 100 мл при давлении этилена 2 атм. Предварительно реактор откачивали в течение 1 ч при 90°С (до 5 × 10–3 атм), охлаждали до ~20°C, добавляли при перемешивании 60 мл гептана, 6 × 10–4 молей триизобутилалюминия (ТИБА, санирующая и активирующая добавка) и этилен. Полимеризацию начинали через 15–20 мин после окончания подготовительных операций, разбивая в реакторе стеклянную ампулу с заранее приготовленным катализатором, и прекращали ее введением в реактор 10%-ного раствора HСl в этиловом спирте. Полимерный продукт отфильтровывали, многократно промывали водой и спиртом, сушили в вакууме при 50–60°C до постоянной массы.
Молекулярно-массовые характеристики (Mw, Mn, MMP) ПЭ измеряли для растворов полимеров в 1,2-дихлорбензоле при 135°С методом гель-проникающей хроматографии на приборе Waters 150-C, снабженном линейной HT-μ-styragel колонкой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
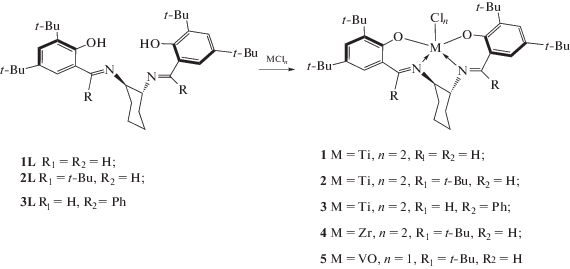
Лиганды, использованные в работе, получены взаимодействием салициловых альдегидов с циклогександиамином [11–14]. Взаимодействием L,L-бис-салицилиденциклогександиаминов с галогенидами титана(IV), циркония(IV) и ванадия(V) получены комплексы, представленные на схеме 1 .
Схема 1 . Синтез комплексов металлов 4 и 5 групп с лигандами ONNO-типа.
Исследование состава, строения и свойств исходных веществ и продуктов реакции, проведено методами элементного анализа, КР-, ИК- и ЯМР-спектроскопии. В присутствии воды и органических оснований или щелочи комплексы разлагаются с выделением исходного лиганда и образованием TiO2.
По данным 1H ЯМР комплексы 1–5 в хлороформе находятся в виде мономерных частиц с симметрией C2. Так, для комплексов 2, 4 характерный сигнал альдиминных протонов представляет собой синглет при 8.1 м.д., наблюдаются два сигнала трет-бутильных групп и три группы сигналов протонов циклогександиаминового фрагмента хирального лиганда. С2-симметрия хирального тетрадентатного саленового лиганда в комплексах 2, 4, 5 проявляется в спектрах кругового дихроизма в виде экситонного расщепления при длине волны около 350 нм. Известно, что электронный переход, возникающий при ~350 нм в электронных спектрах комплексов металлов с саленовыми лигандами, принадлежит π → π* переходу С=N-связи, сопряженной с ароматическим кольцом.
Использование соединений 1–5 в качестве прекатализаторов полимеризации этилена показало, что практически все полученные нами вещества в присутствии МАО проявляют каталитическую активность (см. таблицу).
Полимеризация этилена на координационных соединениях 1–5 (сокатализатор МАО, растворитель – толуол, суммарное давление этилена и паров толуола 1 атм, [Ti] = 10–6 моль, время полимеризации – 30 мин)
| № | Комплекс | AlMAO/M(Ti, Zr, V), моль/моль |
T, °C | Выход ПЭ, г | A,1 | Тпл, °С | Mw, Mn | Mw/Mn |
|---|---|---|---|---|---|---|---|---|
| 1 | 1 | 1000 | 30 | 0.67 | 268 | 140 | – | – |
| 2 | 1 | 2000 | 30 | 0.78 | 312 | 139 | – | – |
| 3 | 2 | 500 | 30 | 0.83 | 332 | 141 | 1.98 × 106, 4.85 × 105 |
4.08 |
| 4 | 2 | 1000 | 30 | 1.22 | 488 | 143 | 1.52 × 106, 2.96 × 105 |
5.13 |
| 5 | 2 | 1000 | 50 | 1.71 | 684 | 141 | – | – |
| 6 | 2 | 1000 | 70 | 1.67 | 668 | 138 | – | – |
| 7 | 2 | 2000 | 30 | 1.99 | 796 | 141 | 1.17 × 106, 1.92 × 105 |
6.10 |
| 8 | 2 | 2000 | 50 | 2.36 | 944 | 139 | 1.01 × 106, 1.28 × 105 |
7.89 |
| 9 | 2 | 2000 | 70 | 2.30 | 920 | 144 | 5.79 × 105, 3.71 × 104 |
15.60 |
| 10 | 3 | 1000 | 30 | 0.36 | 144 | 143 | – | – |
| 11 | 3 | 2000 | 30 | 0.89 | 356 | 142 | – | – |
| 12 | 4 | 1000 | 30 | 0.73 | 292 | 141 | 1.85 × 106, 5.66 × 105 |
3.26 |
| 13 | 4 | 2000 | 30 | 0.98 | 392 | 140 | 1.51 × 106, 3.59 × 105 |
4.20 |
| 14 | 5 | 1000 | 30 | 1.19 | 476 | 144 | – | – |
| 15 | 5 | 2000 | 30 | 1.31 | 424 | 142 | – | – |
Как видно из данных таблицы, с увеличением концентрации сокатализатора каталитическая активность систем за исключением системы с комплексом 5 растет. При этом максимальная каталитическая активность наблюдается для титанового комплекса при проведении процесса полимеризации при 50°С (944 кг ПЭ моль (Ti)–1 ч–1).
Неожиданно использование циркониевого комплекса 4 при прочих равных условиях приводит к некоторому уменьшению каталитической активности системы по сравнению с системой на основе комплекса титана 2. Видно также, что с увеличением концентрации МАО происходит уменьшение молекулярных масс полиэтилена c 1.98 × 106 до 1.17 × 106 . При этом на кривых ГПХ все более отчетливо проявляется несколько полос, что указывает на полимодальность полимера, т.е. на многоцентровость катализатора.
Полицентровость каталитических систем, формирующихся под действием МАО при температуре 30 и 70°С можно проиллюстрировать кривыми ГПХ, представленными на рис. 2. Кривая ГПХ образца ПЭ, полученного при температуре 70°С (опыт 9) тримодальна: основной пик (80% по площади, Mw/Mn = 2.06), низкомолекулярный пик (7%, Mn = 7000, Mw/Mn = 1.20) и высокомолекулярный пик (13%, Mn = 986800, Mw/Mn=2.12). Кривая ГПХ образца ПЭ, полученного при температуре 70°С, бимодальна: первый пик (62%, Mn = = 42 000, Mw/Mn = 3.52) и второй (39%, Mn = = 471 400, Mw/Mn = 3.80). Сравнение позволяет сделать заключение о том, что как в первой, так и во второй системе, основная масса ПЭ формируется на двух различных активных центрах. При этом, природа этих активных центров иная, чем у формирующихся при низкой температуре и продуцирующих сверхвысокомолекулярный ПЭ (опыт 7).
Рис. 2.
Кривые ГПХ образцов ПЭ, полученных на катализаторе 2 при температуре 30°С (соответствует опыту 7 таблицы) и 70°С (соответствует опыту 9)..

Причиной появления низкомолекулярного “горба” на кривой ГПХ Ti-полиэтилена, видимо, является обратимая координация триметилалюминия, присутствующего в МАО, временно переводящая катализатор в “спящее” состояние [5]. Реакция β-гидридного сдвига с передачей на мономер определяет меньшие молекулярные массы образцов ПЭ и приводит к появлению концевых винильных групп в полимере, что детектируется появлением полос поглощения 909 и 995 см–1 в ИК-спектрах образцов ПЭ. В качестве примера на рис. 3 приведено сравнение ИК-спектров образов полимера, полученных на системе с комплексом 2 (опыты 7 и 9).
Рис. 3.
ИК-спектры образцов полиэтилена, полученных на катализаторе 2 при температуре 70°С (9 соответствует опыту 9, табл. 1) и 30°С (7 соответствует опыту 7).

Таким образом, сопоставление данных полимеризации этилена на титановом катализаторе при активации МАО при различных температурах поставило вопросы о процессах дезактивации, проявляющихся на синтезированных катализаторах. Анализ данных молекулярно-массовых характеристик образцов ПЭ указывает на то, что, скорее всего, в синтезированных каталитических системах происходит модификация первичных нейтральных или катионных комплексов с образованием активных центров различного состава и строения. Это приводит к изменению скоростей роста и передачи цепи и их соотношения, или, иными словами, к изменению механизмов реакций передачи цепи.
Список литературы
Tuskaev V.A., Gagieva S.C., Maleev V.I., Borissova A.O., Solov’ev M.V., Starikova Z.A., Bulychev B.M. // Polymer. 2013. V. 54. P. 4455.
Tuskaev V.A., Gagieva S.Ch, Solov’ev M.V., Kurmaev D.A., Kolosov N.A., Fedyanin I.V., Bulychev B.M. // J. Organomet. Chem. 2015. V. 797. P. 159.
Cozzi P.G. // Chem. Soc. Rev. 2004. V. 33. P. 410.
Shaw S., White J.D. // Chem. Rev. 2019. V. 119. P. 9381.
Bialek M., Pietruszka A. // J. Polym. Sci.: Part A: Polym. Chem. 2009. V. 47. P. 6693.
Wang M., Zhu H., Jin K., Dai D., Sun L. // J. of Catalysis. 2003. V. 220. P. 392.
Repo T., Klinga M., Pietikäinen P., Leskelä M., Uusitalo A.M., Pakkanen T., Hakala K., Aaltonen P., Löfgren B. // Macromolecules. 1997. V. 30. P. 171.
Meppelder G.-J.M., Fan H.-T., Spaniol T.P., Okuda J. // Inorganic Chemistry. 2009. V. 48. № 15. P. 7378.
Ishii S., Mitani M., Saito J., Matsuura S., Furuyama R., Fujita T. // Science and Technology in Catalysis. 2002. V. 145. P. 49.
Беккер Х. Органикум. М.: Мир, 1992. Т. 2. 472 с. [Bekker H, Domchke Н., Fanghenel Е. Organikum, OrganischChemischesGrundpraktikum, VEB DeutscherVerlag der Wissenschaften, Berlin, 1990].
Belokon Y.N., Ikonnikov N.S., Moscalenko M.A., North M., Orlova S., Tararov V., Yashkina L.A. // Tetrahedron Asymmetry. 1996. V. 7. P. 851.
Pospisil P.J., Carsten D.-H., Jacobsen II E.N. // Chem. Eur. J. 1996. V. 2. P. 974.
PalukiM., Finney N.S., Pospisil P.J., Guler M.L., Ishida T., Jacobsen II E.N. // J. Am. Chem. Soc. 1998. V. 120. P. 948.
Larrow J.F., Jacobsen II E.N., Gao Y., Hong Y., Nie X., Zepp C.M. // J. Org. Chem. 1994. V. 59. P. 1939.
Дополнительные материалы отсутствуют.