Нефтехимия, 2020, T. 60, № 3, стр. 328-337
Дегидратация–дегидрирование этанола на алюмохромовых и алюмомагнетитных нанокомпозитных катализаторах
Dalia R. Abd El-Hafiz 1, *, Mohamed A. Ebiad 1, M. Riad 1, S. Mikhail 1
1 Egyptian Petroleum Research Institute (EPRI)
11727 Nasr city, Cairo, 1 Ahmed El-Zomor Street – El Zohour region, Egypt
* E-mail: dalia_epri@yahoo.com
Поступила в редакцию 15.12.2017
После доработки 24.08.2019
Принята к публикации 18.11.2019
Аннотация
Методом соосаждения при ультразвуковой обработке получены алюмохромовые и алюмогематитные нанокомпозитные материалы. Исследована каталитическая активность данных материалов в реакции конверсии этанола при температурах 200–500°C в реакторе с неподвижным слоем катализатора при объемной скорости подачи сырья (GHSW) 0.6 ч–1 в среде газа-носителя (O2 и/или N2) с расходом 40 мл/мин. Наноматериалы исследованы методами рентгенофазового анализа (РФА), диференциального термического анализа ДТА, термогравиметрического анализа, динамического рассеивания света, просвечивающей электронной микроскопией, термопрограммируемой десорбцией аммиака и другими поверхностными методами. Результаты физико-химических измерений свидетельствуют об образовании аморфного алюмохромового материала с низкой удельной поверхностью, широкими порами и низкой поверхностной кислотностью. Синтезированный же алюмогематитный материал обладает кристаллической структурой и характеризуется высокой удельной поверхностью, узкими порами и высокой поверхностной кислотностью. Результаты испытания их активности продемонстрировали, что основными продуктами превращения этанола являются ацетальдегид, этилен и диэтиловый эфир. При использовании алюмохромового наноматериала в токе газа-носителя азота при 500°C и конверсии этанола 74% доминируют продукты дегидратации (этилен и диэтиловый эфир). При использовании кислорода в качестве газа-носителя основным продуктом реакции является ацетальдегид с селективностью 38.5%. Алюмогематитный наноматериал демонстрировал ту же тенденцию в отношении образования продуктов дегидрирования (ацетальдегида) с селективностью 42% при 500°C в присутствии кислорода в качестве газа-носителя, при образовании продуктов дегидратации с селективностью 32.8%.
Этилен, диэтиловый эфир и ацетальдегид – крупнотоннажные химические соединения, которые рассматривают в качестве полупродуктов нефтехимической промышленности. Доступный этанол привлекает все большее внимание исследователей в качестве альтернативного химического сырья для производства данных химических соединений посредством реакций дегидратации и/или дегидрирования [1]. Для того, чтобы сделать конверсию этанола более рентабельным промышленным процессом, разработаны различные катализаторы, способствующие повышению выхода продукта и снижению температуры реакции [2]. Широко известно, что в качестве катализатора реакции дегидрирования этанола предпочтительно использование основных катализаторов, таких как Cu/ZrO2 и Ag/Li–Al2O3 [3], в то время как сильнокислотные катализаторы, такие как нанолистовой оксид графена или мезопористый Cr-MCM-41 ответственны за протекание реакции дегидратации [4–6].
Dutov V.V. и соавт. [7] изучали методы получения модифицированных серебром кристаллов структуры криптомелана и нанесенные на оксид кремния катализаторы OMS-2 (Ag/OMS-2 и Ag/OMS-2/SiO2), а также применяли эти системы в реакции селективного окисления этанола в ацетальдегид. Для синтеза катализаторов авторы использовали методы пропитки, соосаждения и последовательной пропитки. Было установлено, что модификация катализаторов OMS-2 и OMS-2/SiO2 серебром приводит к усилению окислительно-восстановительных свойств катализатора и увеличению скорости окисления этанола.
Использование системы Ag/OMS-2/SiO2 привело к большей, чем в работах [8, 9], селективности образования ацетальдегида при высоких температурах. Дегидратация этанола также изучалась в работе Alharbi W. и соавт. [10]. Эксперименты проводились в реакторе с неподвижным слоем катализатора при непрерывной подаче сырья на поверхности широкого ряда кислотных катализаторов, синтезированных на основе гетерополикислот структуры Кеггина, в температурном диапазоне 90–220°C. Образование диэтилового эфира свидетельствовало о том, что бренстедовские кислотные центры играют важную роль в реакции дегидратации этанола. Phung T. и соавт. [11] исследовали реакцию дегидратации этанола для получения этилена на таких коммерчески доступных катализаторах, как оксид алюминия и алюмосиликат, которые были приготовлены согласно промышленным методикам. При использовании Al2O3 общая конверсия этанола превосходила 99% при селективном образовании этилена (80%) [12]. Lee J. и соавт. [13] изучали реакцию дегидратации этанола на пластинках оксида алюминия в широком диапазоне температур (180–300°C). При низких температурах (180°C) ингибируется образование этилена и наблюдается образование эфира, а при высоких (260°C) скорость образования эфира возрастает.
Данная работа посвящена синтезу алюмохромовых и алюмогематитных нанокомпозитных материалов методом соосаждения при обработке ультразвуком. Каталитическую активность полученных материалов исследовали в реакции конверсии этанола в реакторе с неподвижным слоем катализатора при атмосферном давлении. Дополнительно в работе было оценено влияние применения кислорода и азота в качестве газа-носителя.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление нанокомпозитных материалов. Нанокомпозиты Cr–Al и Fe–Al синтезировали посредством растворения эквимолярного количества солей Al(NO3)3 · 9H2O и Cr(NO3)3 · 4H2O и/или Fe(NO3)2 · 6H2O в дистиллированной воде. Соосаждение проводили при непрерывном вводе водного раствора аммиака по каплям до достижения значения pH раствора 9.5 в ультразвуковом зонде мощностью 150 Вт и частотой 24 кГц (Xin-Zhi, JY92-2D, Ti-horn). Полученный осадок отделяли на центрифуге, промывали, сушили при 120°C, а затем прокаливали при 450°C в течение 4 ч.
Характеристики катализатора. РФА проводили на дифрактометре Shimadzu XD-1 (λ = 0.1542 нм) в диапазоне углов (2θ) 4°–80° со скоростью сканирования 0.7°/с. Для идентификации дифракционных пиков использовали базу данных The Joint Committee on Powder Diffraction Society (JCPDS).
ТГА выполняли на приборе SDTQ-600 (TGA-USA): навеску образца 10 мг нагревали до 1100°C со скоростью нагрева 10°C/мин в потоке воздуха (расход воздуха 100 мл/мин).
ДРС осуществляли с использованием Zetasizer Nano-ZS 90 (Malvern Instruments). Синтезированные материалы анализировали при длине волны 660 нм и величине угла детектирования равной 90°.
ПЭМ высокого разрешения и энергодисперсионную рентгеновскую спектроскопию (ЭРС) выполняли с помощью просвечивающего электронного микроскопа JEOL 2100F при ускоряющем напряжении 200 кВ.
Удельную поверхность образцов катализаторов определяли по методике Брунауэра–Эммета–Теллера (БЭТ), общий объем пор и распределение пор нанокомпозитов по радиусу – из соответствующих изотерм адсорбции/десорбции азота, полученных при –196°C с помощью прибора NOVA 3200 Unit.
ТПД проводили с помощью устройства для анализа катализаторов BELCAT II (версия 0.4.5.19). Навеску образца (около 53 мг) предварительно активировали в атмосфере He (50 см3/мин) при 200°C в течение 60 мин. После активации образец охлаждали до 100°C, в течение 30 мин насыщали аммиаком с помощью газовой смеси 7% NH3/He (расход около 30 см3/мин), затем переключали газ на He (расход 50 см3/мин) на 15 мин для удаления физически адсорбированного аммиака. Количество десорбированного аммиака измеряли при росте температуры до 700°C со скоростью 10°C/мин и выдержке в течение минуты, используя детектор по теплопроводности.
Испытание каталитической активности. Конверсию этанола исследовали в режиме непрерывной подачи сырья в реакторе с неподвижным слоем катализатора, находящимся под атмосферным давлением, в температурном диапазоне 200–500°C при объемной скорости подачи сырья (GHSW) 0.6 ч–1, используя O2 и/или N2 с расходом 40 мл/мин в качестве газа-носителя. Во всех экспериментах 0.5 г синтезированного материала смешивали с частицами кварца того же размера. Перед испытанием активности полученные Cr–Al и Fe–Al активировали при 400°C в течение 2 ч в потоке этанола, подаваемого в реактор с расходом 0.2 мл/ч.
Продукты реакции анализировали методом ГХ на газовом хроматографе Perkin-Elmer с пламенно-ионизационным детектором.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1а показаны дифрактограммы синтезированных и прокаленных образцов (Fe–Al и Cr–Al). На дифрактограмме высушенного наноматериала Fe–Al-наноматериала присутствуют пики при 2θ = 18.5°, 21°, 22°, 36°, 37.5° и 41°, которые характерны для Fe3O4 (магнетит, JCPDS 19-629). Широкие пики с малой интенсивностью при 2θ = 28°, 54° и 65° свидетельствуют об образовании метагидроксида алюминия (бемит, JPSD 76-1871).
Рис. 1.
Характеристика приготовленных образцов: (а) дифрактограммы образцов; (б) данные ТГА синтезированных материалов.
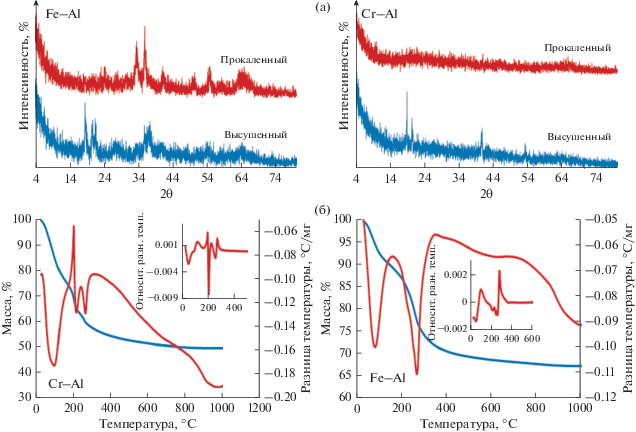
УЗО, как известно, может приводить к чрезвычайно высоким локальным температурам и давлениям в ходе акустической кавитации, которые обеспечивают достаточное количество энергии для создания зародышей кристаллической фазы. Такие условия благоприятствуют ускорению кристаллизации частиц Fe3O4 вместо образования гидроксида железа. Кроме того, УЗО способствует росту частиц бемита за счет дегидратации осажденного гидроксида алюминия [14]. На дифрактограмме прокаленного образца Fe–Al (рис. 1а) проявляются интенсивные пики при 2θ = 34°, 38°, 49°, 55° и 57°, которые связаны с образованием гематита Fe2O3 (JCPDS 33-664), образующегося в ходе окисления магнетита Fe3O4. Широкие пики при 2θ = 24.5°, 42° и 65° свидетельствуют о существовании в образце γ-фазы оксида алюминия (JCPDS 00-004-0880), образующейся при дегидроксилировании бемита в ходе прокаливания.
На дифрактограмме образца Cr–Al присутствовали пики при 2θ = 18.8°, 20.3°, 21.08°, 40.64° и 53.26°, свидетельствующие об образовании фазы Al(OH)3. Гидроксид алюминия (∆G = = 917.82 кДж/моль), как известно, является стабильным и медленно превращается в бемит (∆G = = 1149.80 кДж/моль) при комнатной температуре. При этом на дифрактограмме отсутствуют пики, свидетельствующие об образовании частиц хрома. Гидроксид хрома, который может быть осажден в аморфном состоянии, замедляет рост частиц бемита в ходе сонохимической реакции [15].
На дифрактограмме прокаленного образца Cr–Al (рис. 1a) проявляются слабые широкие пики при 2θ = 46°, 65° и 24°, свидетельствующие об образовании γ-оксида алюминия, иначе говоря, нанокомпозитный образец является аморфным. Данный результат позволил предположить, что оксид алюминия можно рассматривать в качестве “изолятора”, то есть он препятствует образованию частиц кристаллического оксида хрома [16].
На кривой ДТА образца Fe–Al (рис. 1б) видны два пика с отрицательным тепловым эффектом при температурах ~95 и ~275°C, которые подтверждают потерю влаги и процессы дегидратации-перекристаллизации частиц Fe3O4 в Fe2O3 соответственно [17], что согласуется с результатами РФА.
На кривой ТГА Fe–Al (рис. 1б) отчетливо проявляются три области снижения массы образца. Первая область (7%, при 25–100°C) вызвана удалением воды, адсорбированной поверхностью; вторая область (17%, при 100–275°C) свидетельствует о перекристаллизации Fe3O4 в Fe2O3; последняя область снижения массы (5.9% при 275–400°C) доказывает протекание реакции дегидроксилирования бемита в γ-фазу оксида алюминия. Железо и алюминий, как известно, являются трехвалентными элементами и обладают близкими значениями ионного радиуса, поэтому эти два оксида легко взаимодействуют с образованием стабилизированного нанокомпозита Fe–Al с общей потерей массы 32.7%. На кривой ДТА образца Cr–Al (рис. 1б) присутствуют один экзотермический и три эндотермических пика. Эндотермические пики обнаружены при ~100, 225 и 290°C. Первый эндотермический пик обусловлен удалением физически адсорбированной воды. Экзотермический пик при 200°C можно объяснить протеканием реакции дегидроксилирования гидроксида хрома с образованием CrOOH [18]. Эндотермический пик при 225°C относится к окислению CrOOH с образованием аморфного Cr2O3 [19]. Таким образом, можно отметить, что присутствие гидроксида алюминия способствует ускорению перехода гидроксида хрома в оксид при низкой температуре. С другой стороны, последний эндотермический пик при 290°C вызван дегидроксилированием Al(OH)3 в γ-оксид алюминия. Кривая ТГА образца Cr–Al (рис. 1б) свидетельствует о том, что общая потеря массы составляет 50.3%. Первая область снижения массы (20.2 мас. % при 50–150°C) соответствует удалению поверхностно адсорбированной воды и внутренней воды в гидроксиде хрома. Вторая область (14.5 мас. % при 150–230°C) вызвана полным дегидроксилированием оксигидроксида хрома в фазу оксида хрома. Третья область (16.6 мас. % при 230–600°C) отображает дегидроксилирование гидроксида алюминия и образование фазы оксида алюминия.
Результаты ДРС (рис. 2а) подтверждают, что частицы обоих синтезированных композитов являются наноразмерными. Большое количество вибрационной энергии, возникающее в ходе УЗО, способствует зарождению и росту наноразмерных частиц осадка. Поскольку замедляется агломерация наночастиц, наблюдается улучшение качества кристаллов образованного материала. Данные на рис. 2а свидетельствуют о том, что частицы Fe–Al обладают малым размером (d = 40 нм), что может быть вызвано предотвращением разделения частиц Fe3+ и Al3+ ввиду близких значений радиуса иона. Кроме того, оксид алюминия может предотвращать сильное спекание фазы магнетита. С другой стороны, частицы Cr–Al имеют большой размер (d ~ 140 нм). Причиной этого является меньший, чем у Al, размер радиуса иона Cr, который может быть внедрен в решетку оксида алюминия и вызывать тем самым разделение частиц [20].
Для того чтобы получить глубокое понимание морфологии частиц, была использована ПЭМ высокого разрешения. Микрофотография нанокомпозита Fe–Al (рис. 2б) демонстрирует присутствие сферических темных наночастиц Fe2O3 одинакового размера. Эти частицы распределены на темно-серой пластинке с морфологией, похожей на оксид алюминия, что согласуется с результатами ДРС. На микрофотографии нанокомпозита Cr–Al присутствуют кубические блоки спеченного Cr2O3, который внедрен в решетку оксида алюминия.
Для дополнительного исследования структуры синтезированных наноматериалов был использован метод энергодисперсионной рентгеновской спектроскопии (ЭРС). Согласно полученным результатам (табл. 1) значения массовой доли компонентов равны или очень близки к расчетным значениям массовых долей в синтезированных нанокомпозитных материалах.
Таблица 1.
Результаты энергодисперсионной рентгеновской спектроскопии синтезированных нанокомпозитных материалов
| Элемент | Мас. % | Мольн. % | Содержание оксида, % | Структурная формула | |
|---|---|---|---|---|---|
| Cr–Аl | Al | 24.5 | 22.5 | 46.3 | Al2O3 |
| Cr | 36.7 | 17.5 | 53.7 | Cr2O3 | |
| O | 38.8 | 60.0 | |||
| Fe–Al | Al | 29.5 | 27.6 | 55.7 | Al2O3 |
| Fe | 34.4 | 15.5 | 44.3 | FeO | |
| O | 36.1 | 56.9 | |||
На рис. 3а показаны изотермы адсорбции−десорбции азота для полученных нанокомпозитных материалов Cr–Al и Fe–Al.
Рис. 3.
Поверхностные текстурные свойства синтезированных нанокомпозитов: (а) изотермы адсорбции; (б) распределение пор по размерам.

В табл. 2 приведены текстурные свойства образцов, включая их удельную поверхность (БЭТ), распределение пор по радиусу (rh) и общий объем пор (VP). Изотерма образца Fe–Al соответствует изотерме IV типа классификации IUPAC, соответствующей материалу с микро- и мезопорами с петлей гистерезиса типа H3. Этот тип петли гистерезиса указывает на агломерацию пор в форме щели или пластины с неоднородным размером. Тем временем, образец Cr–Al не является пористым, поскольку на изотерме адсорбции−десорбции не наблюдается петли гистерезиса, что хорошо согласуется с микрофотографиями образца. Удельная поверхность (БЭТ) образца Cr–Al ввиду спекания и агломерации частиц очень мала (14 м2/г), также, как и суммарный объем пор (0.03 см3/г), а образующиеся поры характеризуются диаметром 19.4 нм. Согласно микрофотографии, морфология Cr–Al имеет блочную форму, что приводит к образованию большего расстояния между частицами. В то же время, образец Fe–Al обладает большей, по сравнению с Cr–Al, удельной поверхностью (184.5 м2/г), что согласуется с увеличением объема пор (0.4 см3/г) и снижением диаметра пор (17.8 нм) и соответствует уменьшению размера частиц (ДРС).
Таблица 2.
Текстурные свойства полученных образцов
| Метод БЭТ | Метод t-plot | Метод BJH | |||||||
|---|---|---|---|---|---|---|---|---|---|
| SA, м2/г | Vp сум, см3/г | средний rp, Å | Vмикропор, см3/г | SA(микропор), м2/г | SA(внешняя), м2/г | SA, м2/г | Vp, см3/г | rp, Å | |
| Cr/Al2O3 | 14.0 | 0.03 | 38.8 | 0.001 | 0.3 | 14 | 24 | 0.04 | 19.4 |
| Fe/Al2O3 | 184.4 | 0.42 | 45.8 | 0.000 | 0.0 | 184 | 264 | 0.45 | 17.8 |
Согласно зависимостям объема от толщины (рис. 3) синтезированный образец Fe–Al является мезопористым, что было установлено из отклонения графика толщины, начинающегося при ~0.75 Å при большом объеме адсорбата. В то же время образец Cr–Al является преимущественно микропористым (отклонение вниз при толщине ~ 0.8 Å) с низким объемом адсорбата на стенках пор и с неограниченной адсорбцией на внешней поверхности, что отражает неоднородность структуры пор и согласуется с микрофотографией поверхности. Дополнительно методом BJH, примененным к ветви десорбции, были получены данные о распределении пор по радиусу (рис. 3б). Зависимость свидетельствует о том, что у образца Cr–Al наблюдается бимодальное распределение размера пор в диапазоне мезо-макропор 20–100 нм. Первый максимум, приходящийся на 20 нм, доказывает существование в образце большого количества узких мезопор между частицами. В то же время, установлено малое содержание макропор (70 нм) в образце. Этот результат подтверждает внедрение частиц оксида хрома в решетку оксида алюминия, что вызывает расширение пор в соответствии с размером частиц и уменьшение удельной поверхности.
Концентрация и сила кислотных центров важны в данной работе, поскольку они дают информацию о механизме образования продуктов в реакции дегидратации/дегидрирования. По этой причине оба синтезированных катализатора Fe–Al и Cr–Al были проанализированы методом ТПД аммиака (рис. 4). На рис. 4 наблюдаются три температурных пика, возникающих при десорбции аммиака. Низкотемпературный пик (НП) находился в диапазоне 100–200°С, среднетемпературный пик (СП) – в диапазоне 200–400°С и высокотемпературный пик (ВП) – в диапазоне 600–700°С (см. также таблицу при рис. 4).
В результатах катализатора Cr–Al наблюдались НП и СП, что свидетельствует о присутствии только слабых поверхностных кислотных центров. В то же время, в спектре ТПД катализатора Fe–Al наблюдаются как СП, так и ВП, что связанно с сочетанием слабых поверхностных кислотных центров с сильными центрами Бренстеда и Льюиса [21]. В дополнение к этому, площадь под пиком Fe–Al была больше, чем у Cr–Al, что свидетельствует о большем общем количестве кислотных центров на поверхности катализатора Fe–Al. Можно заключить, что в случае Fe–Al большее количество сильных поверхностных кислотных центров отвечает за ускорение реакции дегидратации этанола.
Испытание каталитической активности. Конверсию этанола на образце Cr–Al изучали в температурном интервале 200–400°С в присутствии азота или кислорода в качестве газа-носителя при атмосферном давлении. Результаты (рис. 5) свидетельствуют о том, что при использовании кислорода в качестве газа-носителя основными продуктами реакции являются ацетальдегид, ацетон, диэтиловый эфир и этилацетат, в следовых количествах присутствуют этилен, уксусная кислота и ацеталь. Селективность образования ацетальдегида (продукта дегидрирования) снижается с ростом температуры в зоне реакции за счет роста селективности образования ацетона. При наименьшей температуре реакции (200°С) было достигнуто максимальное значение селективности образования ацетальдегида – 98%.
Рис. 5.
Селективность образования продуктов превращения этанола на синтезированных нанокомпозитах при использовании O2 или N2 в качестве газа-носителя.

Большой выход ацетальдегида в присутствии газообразного кислорода свидетельствует об основных свойствах образца Cr–Al и может быть объяснен следующими обстоятельствами:
• структурный кислород (образец оксид хрома−оксид алюминия) участвует в окислении этанола, а затем восстановленный образец повторно окисляется с пополнением вакантного положение кислородом из газовой фазы [22];
• присутствие окислительно-восстановительной пары Cr6+/Cr3+, Cr6+ действует как активный центр в реакции окислительного дегидрирования, в то время как ионы Cr3+ будут действовать как активные центры для повторного окисления поверхности;
• кроме того, эти центры производят кислородные радикалы (O2–) на поверхности катализатора, и это может способствовать диссоциативной адсорбции этанола с последующим дегидрированием в ацетальдегид, то есть стабилизировать образование адсорбированного формальдегида согласно следующим уравнениям реакции:
(1)
${\text{C}}{{{\text{H}}}_{3}}{\text{C}}{{{\text{H}}}_{2}}{\text{OH}} + {{{\text{O}}}^{{2 - }}} \leftrightarrow {\text{C}}{{{\text{H}}}_{3}}{\text{C}}{{{\text{H}}}_{2}}{{{\text{O}}}^{ - }}~~ + \,{{\,}^{ - }}{\text{OH}},$(2)
${\text{C}}{{{\text{H}}}_{3}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{ - }} + \,{{\,}^{ - }}{\text{OH}} \leftrightarrow {\text{C}}{{{\text{H}}}_{3}}{\text{CHO}} + {{{\text{H}}}_{2}} + {{{\text{O}}}^{{2 - }}}.~$Диэтиловый эфир, ацетон и этилацетат первоначально образуются с низким выходом, который непрерывно увеличивается с ростом температуры до 500°С. Из них преобладающим продуктом является ацетон (26.33 ммоль при 500°С). Кроме того, Ad El-Hafiz D.R. и соавт. [23] изучали конверсию этанола на синтезированных Mn–Al и Co–Al нанокомпозитных катализаторах. Согласно их результатам, основным продуктом превращения этанола является ацетон. Авторы подчеркнули, что образование ацетона связано с реакциями конденсации сильно адсорбированного на активных центрах нанокомпозита ацетальдегида.
При использовании азота в качестве газа-носителя основными продуктами реакции являются этилен и диэтиловый эфир (то есть продукты реакции дегидратации). Конверсия этанола последовательно увеличивается с ростом температуры, пока не достигнет 56% при 500°С. Кроме того, образец Cr–Al является селективным по отношению к образованию продуктов дегидратации (этилен – 50%, диэтиловый эфир – 25%) с суммарной селективностью по продуктам дегидратации равной 75% при температуре 500°С.
Согласно работе Phung T. c соавт. [24], дегидратация этанола на катализаторах оксид титана и оксид циркония (150–500°С в присутствии азота) протекает преимущественно на кислотных активных центрах. В образце Cr–Al существуют как льюсовские (центры Al3+ с тетраэдрическим окружением на краях и углах оксида алюминия), так и бренстедовские кислотные центры на оксиде хрома (Cr в высокой степени окисления). Кроме того, гидроксильные группы, связанные с поверхностью катализатора, разлагаются с образованием кислородных вакантных центров, которые вызывают формирование льюисовских кислотных центров и отвечают за каталитическую активность образца Cr–Al в реакции дегидратации. Азот ускоряет реакцию дегидратации с точки зрения активации кислотных центров в соответствии с дезактивацией основных.
С другой стороны, конверсия этанола также была проведена на образце Fe–Al в присутствии кислорода в качестве газа-носителя при температурах 200–500°С, а полученные результаты были сопоставлены с образцом Cr–Al. Основными продуктами были ацетальдегид, диэтиловый эфир и этилен, им сопутствовали ацетон, ацеталь и этилацетат. Согласно данным на рис. 5, выход продукта дегидрирования – ацетальдегида – возрастает с ростом температуры и достигает максимального значения 39% при 500°С, при том что Cr–Al обладает такой же конверсией при более низкой температуре (400°С).
Широкое распределение размера пор алюмохромового образца предотвращает накопление продуктов и, следовательно, облегчает десорбцию при такой температуре. В то же время, на поверхности образца Fe–Al основные центры присутствуют в виде ионов O2– (основания Бренстеда), пары Fe+3O–2 и связанных ОН-групп. Таким образом, активность в реакции дегидратации главным образом связана с ионами кислорода, расположенными вблизи к хорошо диспергированным наночастицам железа, которые могут ускорять образование этоксидного интермедиата посредством расщепления связи О–Н в молекуле этанола [25]. Такой интермедиат может легко потерять протон с образованием ацетальдегида или принять водород с образованием этанола, а затем разлагаться в ацетальдегид.
С другой стороны, образование продуктов дегидрирования, диэтилового эфира и этилена, достигает максимума (выход 15 и 17% соответственно) при 500°С на образце Fe–Al. В то же время, образец Cr–Al характеризуется небольшим образованием диэтилового эфира (10.5%) и следовыми количествами этилена (2.5%) при 500°С. Агломерированные частицы оксида хрома−оксида алюминия могут усиливать разложение продуктов на полярные молекулы, которые могут частично отравлять кислотные активные центры, ответственные за реакцию дегидратации. Кроме того, этот результат подтверждает, что нанокомпозит Fe–Al обладает более сильными, чем в Cr–Al, активными кислотными центрами, то есть имеет более связанные с поверхностью гидроксильные группы, что подтверждают данные ТПД аммиака. Селективность образования ацетальдегида на образце Fe–Al достигает максимального значения (97.5%) при 200°С и снижается с ростом температуры. Селективность по этилену и диэтиловому эфиру возрастает при росте температуры и становится равной 19.3 и 16.3% соответственно при температуре 500°С, то есть селективность образования продуктов дегидратации достигла 36%, что является большим значением по сравнению со значением, полученным на Cr–Al (13%).
Соответственно, нанокомпозит Fe–Al обладает способностью образовывать продукты дегидрирования и дегидратации при высокой температуре, что связанно со следующим:
• образец содержит как кислотные, так и основные центры в виде наночастиц оксида железа, кислородных вакантных центров и кислотных центров Льюиса в оксиде алюминия, что соответствует данным ТПД аммиака.
• десегрегация малых частиц и высокая удельная поверхность могут увеличивать доступность активных центров для каталитической реакции.
Таким образом, в данной работе изучалась конверсия этанола как в продукты дегидратации, так и в продукты дегидрирования на алюмохромовом и гематоалюминиевом нанокомпозитах в присутствии азота и кислорода в качестве газа-носителя. Методами РФА, ДРС, ПЭМ и ТПД аммиака определены физико-химические свойства образцов. Данные физико-химических исследований подтверждают образование аморфных, агломерированных частиц. Синтезирован алюмохромовый материал с широкими порами, малой удельной поверхностью и слабыми кислотными центрами. Также получен алюмомагнетит с высокой кристалличностью, узкими порами, большой удельной поверхностью и высокой поверхностной кислотностью. В присутствии кислорода алюмохромовый наноматериал был предпочтителен в качестве катализатора реакции дегидратации (образование ацетальдегида) при относительно низкой температуре 400°С по сравнению с 500°С, где при использовании N2 в качестве газа-носителя конверсия этанола была направлена на реакцию дегидратации (образование этилена и диэтилового эфира).
Алюмогематитный нанокомпозит показал высокую активность в реакциях дегидратации и дегидрирования в присутствии кислорода, что может коррелировать с высокой плотностью кислотных и основных центров на большой удельной поверхности материала.
Список литературы
Gobara H.M., Mohamed R.S., Khalil F.H., El-Shall M.S., Hassan S.A. // Egypt. J. Petrol. 2014. V. 23. P. 105.
Sato A.G., Biancolli A.L., Paganin V.A., da Silva G.C., Cruz G., dos Santos A.M., Ticianelli E.A. // Int. J. Hydrogen Energy. 2015. V. 40. P. 14716.
Janlamool J., Jongsomjit B. // Catal. Commun. 2015. V. 70. P. 49.
Cuesta Zapata P.M., Nazzarro M.S., Gonzo E.E., Parentis M.L., Bonini N.A. // Catal. Today. 2016. V. 259. № 1. P. 39.
Chen Z., Wei D., Li Q., Wang X., Yu S., Liu L., Liu B., Xie S., Wang J., Chen D., Hayat T., Wang X. // J. Cleaner Prod. 2018. V. 181. P. 745.
Mahmoud H.R. // J. Mol. Catal. A: Chem. 2014. V. 392. P. 216.
Dutov V.V., Mamontov G.V., Sobolev V.I., Vodyankina O.V. // Catal. Today. 2016. V. 278. № 1. P. 164.
Xin H., Li X., Fang Y., Yi X., Hua W., Chu Y., Zhang F., Zheng A., Zhang H., Li X. // J. Catal. 2014. V. 312. P. 204.
Gołąbek K., Tarach K., Filek U., Góra-Marek K // Spectrochim. Acta. A. Mol. Bimol. Spectrosc. 2018. V. 192. P. 464.
Alharbi W., Brown E., Kozhevnikova E., Kozhevnikov I. // J. Catal. 2014. V. 319. P. 1741.
Phung T., Lagazzo A., Crespo M., Escribano V., Busca G. // J. Catal. 2014. V. 311. P. 102.
Feng R., Hu X., Yan X., Yan Z., Rood M. Micropor. Mesopor. Mater. 2017. V. 241. P. 89.
Lee J., Szanyi J., Hun Kwak J. // Mol. Catal. 2017. V. 434. P. 39.
Chave T., Nikitenko S., Granier D., Zem T. // Ultrason. Sonochem. 2009. V. 16. P. 481.
Barta J., Pospisil M., Cuba V. // Mater. Res. Bull. 2014. V. 49. P. 633.
Basu T., Gupta K., Ghosh U.C. // Chem. Eng. J. 2012. V. 183. P. 303.
Papassiopi J.N., Vaxevanidou K., Christou C., Karagianni E., Antipas G.S.E. // J. Hazard. Mater. 2014. V. 264. P. 490.
Jibril B.Y. // Appl. Catal. A. 2004. V. 264. P. 193.
Liang S., Zhang H., Luo M., Luoe K., Li P., Xu H., Zhang Y. // Ceram. Intern. 2014. V. 40. P. 4367.
Gupta R.K., Mitchell E., Candler J., Kahol P.K., Ghoshc K., Dong L. // Powder Technol. 2014. V. 254. P. 781.
Wang A., He P., Yung M., Zeng H., Qian H., Song H. // Appl. Catal. B: Environ. 2016. V. 198. P. 480.
Santacesaria E., Carotenuto G., Tesser R., Di Serio M. // Chem. Eng. J. 2012. V. 179. P. 209.
Abd El-Hafiz D.R., Riad M., Mikhail S. // J. Nanostruct. Chem. 2015. V. 5. P. 393.
Phung T., Proietti Hernández L., Busca G. // Appl. Catal. A: Gen. 2015. V. 489. P. 180.
Freitas I.C., Damyanova S., Oliveira D.C., Marquesd C.M.P., Buenoa J.M.C. // J. Mol. Catal. A: Chem. 2014. V. 381. P. 26.
Дополнительные материалы отсутствуют.




