Нефтехимия, 2020, T. 60, № 4, стр. 433-441
Реакция Принса на гетерогенных катализаторах (обзор)
С. П. Беденко 1, *, К. И. Дементьев 1, В. Ф. Третьяков 1, А. Л. Максимов 1
1 Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Россия
* E-mail: bedenko@ips.ac.ru
Поступила в редакцию 16.07.2019
После доработки 29.01.2020
Принята к публикации 11.03.2020
Аннотация
В обзоре рассмотрены гетерогенные катализаторы реакции Принса. Показаны перспективы промышленной реализации процессов, основанных на данной реакции. Обсуждаются свойства (текстурные и кислотные) гетерогенного катализатора, оказывающие наибольшее влияющие на состав продуктов. Отмечены наиболее перспективные типы катализаторов для получения ненасыщенных спиртов и диеновых углеводородов.
Диеновые углеводороды (УВ) являются одним из важнейших классов мономеров для производства пластмасс: так, к 2018 г. объем мирового производства 1,3-бутадиена составлял 1.5 млн тонн в год [1] с прогнозом среднегодового темпа роста около 4.5–5% [2]. Рост спроса на диены связан, главным образом, с увеличением спроса на этилиденнорборнен и стирол-изопреновый каучук, а также с развитием новых областей применения полимеров на основе диеновых УВ, таких как 3D-печать [3].
Более 95% мирового производства диеновых УВ обеспечивается процессом пиролиза нафты, при том, что суммарный выход бутадиена и изопрена в этом процессе не превышает 5%. [4]. Небольшая часть диенов производится в процессах дегидрирования соответствующих алканов [5]. Очевидно, что растущий спрос на диены не может быть удовлетворен за счет этих процессов, что обуславливает необходимость разработки новых способов целенаправленного их производства (on-purpose).
К таким способам можно отнести реакции Лебедева и Остромысленского [6–8], основанные на превращениях этилового спирта, и реакцию Принса. Последняя представляется наиболее перспективным методом, поскольку необходимое для реакции сырье (олефины и формальдегид) могут быть получены как из нефтяного, так и из возобновляемого сырья [9–14]. Кроме того, процессы Лебедева и Остромысленского позволяют получать исключительно 1,3-бутадиен, в то время реакция Принса позволяет получать диеновые УВ различного строения.
Реакция Принса – катализируемый кислотами процесс присоединения формальдегида к олефинам, продуктами которого в зависимости от реакционных условий являются 1,3-диоксаны, 1,3-диолы и ненасыщенные спирты [15]. Впервые данная реакция была детально описана в 1917 г. Г.Я. Принсом [16], который изучал конденсацию стирола, камфена, цендрена, анетола и изосафрола с формальдегидом в системе серная кислота/ уксусная кислота. Известно, что реакция Принса используется в промышленных процессах получения изопрена [17] и нопола [18], а также применяется при получении различных продуктов тонкого органического синтеза (производных 1,3-диоксанов, диолов, замещенных пиранов и фуранов) [15].
Главным недостатком существующих промышленных процессов получения диенов по реакции Принса является использование гомогенных кислотных катализаторов, таких как протонные минеральные (серная, фосфорная), органические (уксусная кислота и уксусный ангидрид) кислоты и апротонные кислоты Льюиса (ZnCl2, BF3, SnCl4 и др.) [5, 19–25]. Как известно, применение таких катализаторов в промышленности характеризуются рядом существенных недостатков: высокая коррозионная активность, ограничение в повторном использовании, большое количество сточных вод, сложность контроля селективности процесса. Кроме того, существует потребность отделять и очищать реакционные продукты от катализатора, а для получения сопряженных диенов приходится вести процесс в две стадии, поскольку разложение замещенных диоксанов требует высоких температур (порядка 400°C). Все эти недостатки могут быть устранены при переходе на кислотные гетерогенно-каталитические системы, которые все больше и больше применяют во всех областях промышленной нефтехимии и органического синтеза [26, 27].
В данной работе предпринята попытка обобщения работ в области исследования реакции Принса в присутствии гетерогенных катализаторов, проанализировано влияние текстурных и кислотных свойств каталитических систем на состав продуктов и их строение, а также показаны возможности применения данной реакции в процессах получения важных полупродуктов нефтехимии.
ЗАКОНОМЕРНОСТИ РЕАКЦИИ ПРИНСА
На рис. 1 показан механизм реакции Принса на примере пропилена в присутствии гомогенных кислотных катализаторов. При проведении реакции с протонными кислотами на первой стадии образуется гидроксиметиленовый карбокатион I, который на второй стадии атакует свободную электронную пару атома углерода в молекуле олефина. В результате данной атаки образуется карбокатион II, превращение которого в зависимости от реакционных условий приводит к 1,3-диоксану IIIа, 1,3-диолу IIIб или к ненасыщенному спирту IIIв [23–25]; однако чаще всего в условиях гомогенного кислотного катализа основными продуктами реакции зачастую являются 1,3-диоксаны [28]. В случае Льюисовских кислотных катализаторов на первой стадии образуется поляризованных комплекс +CH2O-A–, который реагирует аналогично карбокатиону I [25].
При катализе серной кислотой низшие олефины с двойной связью у третичного атома углерода вступают в реакцию при 25–40°С: например, 2,3-диметилбутен-2 практически количественно реагирует с формальдегидом в присутствии серной кислоты концентрации 41% при 32°С с образованием 4,4,5,5-тетраметил-1,3-диоксана (рис. 2).
Превращение олефинов с двойной связью у первичного или вторичного атома углерода и высокомолекулярных третичных олефинов требует повышенной концентрации кислоты и/или более жестких условий; например, конденсация транс-2-пентена с формальдегидом с образованием 4-этил-5-метил-1,3-диоксана (рис. 3) уже требует использования кислоты с концентрацией свыше 80% [28].
Превращение олефинов в присутствии кислот Льюиса в безводных растворителях зачастую приводит к образованию ненасыщенных спиртов. В патенте [29] реакция конденсации изобутена с формальдегидом проводится в присутствии хлорида олова(II) в хлороформе при 20–25°С (рис. 4).
Основным продуктом реакции является 3-метилбут-3-енол-1, который на второй стадии превращется в изопрен. Высокая селективность по ненасыщенному спирту в данном случае связана не только с избирательностью катализатора, но также с концентрацией реагентов в исходном сырье: в реакциях, направленных на получение диоксанов, формальдегид обычно берется в избытке, в то время как для получения ненасыщенного спирта необходим избыток олефина в реакционной смеси [15]. Таким образом, важную роль в данной реакции играет мольное соотношение олефин/формальдегид в сырье и природа катализатора.
ГЕТЕРОГЕННЫЕ КАТАЛИЗАТОРЫ В РЕАКЦИИ ПРИНСА
Применение гетерогенных катализаторов позволяет избавить кислотно-катализируемые процессы от присущих им недостатков. Изучение реакции Принса на гетерогенных катализаторах началось более 50 лет назад: первые работы, в которых были исследованы закономерности реакции в присутствии ионнообменной смолы КУ-2 и морденита, были опубликованы в 60-х гг. 20 в. [19, 30]. Авторы [19] отмечают, что превращения олефинов и формальдегида на катионите КУ-2 при температурах 250–400°С протекают с образованием сопряженных диенов через реакцию Принса. При этом стоит отметить, что при низких температурах (90°С) на том же катализаторе основными продуктами реакции, как и в случае с гомогенными катализаторами, являются замещенные 1,3-диоксаны [28]. В работе [30] авторы изучили превращение смеси формальдегид–изобутен на цеолите H-MOR при 300°С. Основным продуктом реакции также был изопрен, а авторы предположили, что конденсация формальдегида с олефином приводит к образованию ненасыщенного спирта, который вступает в последовательную реакцию дегидратации с образованием изопрена.
Дальнейшие работы в области были связаны с изучением реакции на различных гетерогенных катализаторах: цеолитах, металлорганических каркасах, гетерополикислотах, оксидных, фосфатных и других катализаторах. Ввиду того, что конденсация олефинов с формальдегидом по Принсу является типичным примером реакции кислотного катализа, сила и природа кислотных центров оказывает большое влияние на активность катализатора, а селективность образования продуктов может контролироваться текстурой и строением пор. Таким образом, для установления закономерностей процесса необходимо подробно рассмотреть влияние этих двух факторов на каталитическую активность и избирательность в данной реакции.
ВЛИЯНИЕ СТРУКТУРНЫХ ХАРАКТЕРИСТИК КАТАЛИЗАТОРА
Влияние структурных свойств катализатора на выход продуктов в реакции Принса можно хорошо проследить на примере цеолитных катализаторов. Как было сказано ранее, конденсация формальдегида с изобутеном в присутствии цеолита H-MOR приводит к образованию изопрена при 300°С [30]. В патенте [31] предлагают проводить данную реакцию в воде в присутствии цеолитов MFI (HZSM-5), MEL (HZSM-11) и MTT (HZSM-23) при температурах 65–105°С и автогенном давлении в автоклавных реакторах. В данных условиях основными продуктами реакции являются 3-метилбутенолы и 3-метилбутандиолы, причем в присутствии MFI селективность образования 3-метилбутенолов превышает 50%. При проведении реакции в присутствии цеолита H-Y в проточном реакторе с высокой селективностью образуется 4,4-диметил-1,3-диоксан [32]. Группой Димитриу был проведен цикл работ, в которых изучалась конденсация изобутена с формальдегидом на цеолитах типов MFI (HZSM-5, H-Boralite и GaZSM-5), H-MOR, H-BEA, FAU (USY), и AFI(SAPO-5, AlPO-5) в реакторах с неподвижным слоем катализатора при температурах 200–350°С в импульсном режиме [33–36]. Авторами было установлено, что селективность образования кислородсодержащих продуктов реакции Принса сильно зависит от топологии цеолита; таким образом в ходе данной реакции на цеолитных катализаторах проявляется эффект конфигурационной селективности (shape selectivity), также наблюдаемый в результатах более ранних работ [30–32].
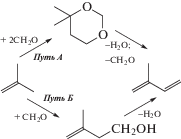
На рис. 5 показаны реакционные пути образования изопрена в результате реакции Принса: в присутствии широкопористых цеолитов (MOR, BEA, FAU) первичным продуктом реакции является 4,4-диметил-1,3-диоксан (Путь А), в то время как в присутствии среднепористого цеолита MFI (HZSM-5 и его модификаций) – 3-метилбут-3-енол-1 (Путь Б). Стоит отметить, что во всех случаях происходило превращение первичного продукта реакции Принса в изопрен, причем наибольшая селективность достигалась в присутствии цеолитов структуры MFI, благодаря сочетанию текстурных и кислотных характеристик данных цеолитов. Авторы [36] изучали конденсацию изобутена с формальдегидом в проточной системе в присутствии H-форм цеолитов структуры MFI, FAU и BEA. Их результаты подтвердили, что катализаторы MFI обладают оптимальной для получения изопрена геометрией поры.
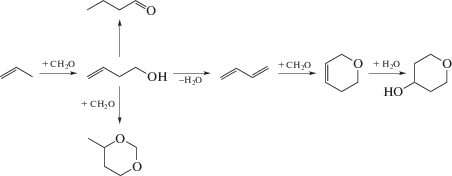
В работах [38, 39] авторы изучали конденсацию пропилена и изобутена с формальдегидом на цеолитах с различной структурой в автоклавных реакторах при низких температурах (до 150°С). Конденсация пропилена с формальдегидом изучалась на цеолитах структуры MFI, BEA, FER и CHA в H- и Zn-формах [38]. Цеолиты структуры FER и CHA, обладающие меньшим, чем MFI и BEA размером пор, не проявляли каталитической активности, что, по мнению авторов, связано с дезактивацией катализатора в виду быстрого коксования. Активность цеолитов MFI и BEA была примерно на одном уровне (степень превращения формальдегида до 56%), однако образцы характеризовались абсолютно разной избирательностью. В присутствии всех изученных авторами модификаций MFI основным продуктом реакции был 3-бутенол-1 (селективность до 75%), в то время как в присутствии BEA реакция протекала с образованием 5,6-дигидро-2Н-пирана (82.4%) – продукта конденсации бутадиена с формальдегидом по реакции гетеро-Дильса–Альдера (рис. 6). Как видно из схемы, при проведении реакции на широкопористом цеолите BEA протекает ряд побочных превращений 3-бутенола-1, в то время как в порах среднепористого MFI ряд данных реакций затруднен в виду стерических ограничений.
В работе [39] была рассмотрена реакция конденсации изобутена с формальдегидом на H-формах цеолитов MFI и BEA. Авторы установили, что цеолит BEA не проявляет высокой активности в данной реакции (конверсия 18%), однако позволяет с относительно высокой селективностью получать изопрен (44.1%). Главным продуктом является 3-метил-5,6-дигидро-2Н-пиран (55.9%), образование которого в данных реакционных условиях, как и в работе [38], обусловлено протеканием гетеро-реакции Дильса–Альдера. В тех же условиях MFI обладает довольно высокой активностью (конверсия до 50%) и селективностью по 3-метилбут-3-енолу-1 (селективность до 86%). При варьировании реакционных условий авторы смогли в присутствии MFI получить изопрен с довольно высокой селективностью (около 55%).
Авторы [40] оценили влияние размера поры цеолита на величину энергии стабилизации со-адсорбированного π-комплекса олефина с димером формальдегида на цеолитных катализаторах. Показано, что существует зависимость с двумя минимумами величины энергии стабилизации от размера пор, при которых протекание реакции конденсации димера формальдегида с олефинами становится наиболее интенсивным. При первом минимуме продуктом реакции является ненасыщенный спирт, при втором – 1,3-диоксан. Таким образом, за счет геометрии пор цеолита можно контролировать протекание реакции Принса в сторону желательных продуктов – ненасыщенных спиртов или 1,3-диоксанов.
Синтез сопряженных диенов возможен в присутствии ионнообменных смол. Так в патенте [41] предлагают получать бутадиен на ионнообменных смолах КУ-23, Amberlyst 36 WET и Lewatit 2620 в проточных реакторах в температурном интервале 120–140°С. Наиболее производительным катализатором был Lewatit 2620, в присутствии которого достигается выход 1,3-бутадиена составляет 15.5%.
В качестве катализаторов реакции конденсации изобутена и формальдегида с образованием 3‑метилбут-3-енола-1 могут быть использованы системы на основе мезопористых материалов [42, 43]. Так, авторами [42] показано, что система SnCl4–SiO2 обладает высокой активностью (конверсия 55%) и избирательностью по 3-метилбут-3-енолу-1 (92%) при проведении реакции в автоклаве при 100°C. В работе [43] вместо аморфного силикагеля был использован мезопористый силикагель MCM-48. При проведении реакции в среде уксусной кислоты при 140°C в присутствии системы SnCl4–MCM-48 с высокой селективностью (80.3%) получен 3-метилбут-3-енил-1-ацетат и 3-метилбут-3-енол-1 (10.3%) при степени превращения сырья 67.8%.
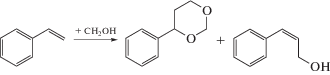
Ряд работ посвящен конденсации более крупных олефинов, таких как стирол и β-пинен. Авторами [44] изучалась конденсация стирола с формальдегидом в присутствии Al2O3 и H-форм цеолитов MFI, FAU, FER, BEA и MOR при кипячении в 1,4-диоксане. Авторы отмечают образование только двух продуктов реакции Принса – 4-фенил-1,3-диоксана и 3-фенилпроп-2-енола-1 (коричного спирта) (рис. 7). Согласно полученным данным, цеолит BEA с модулем 75 обладает наибольшей селективностью по обоим продуктам (41.4 и 6.2% соответственно) среди всех изученных образцов при конверсии субстрата 95%. По мнению авторов, высокая активность и избирательность данного цеолита связана с высокой концентрацией слабых кислотных центров и геометрией канала данного цеолита. В то же время, цеолит MFI обладает наименьшей активностью и избирательностью в данной реакции.
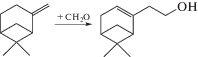
В работе [45] изучалась конденсация β-пинена и формальдегида (рис. 8) с образованием нопола в присутствии H-форм цеолитов (FAU, BEA, MOR и MFI) и мезопористых материалов (Al–MCM-41 и Zn–Al–MCM-41). Авторы установили, что использование мезопористого материала Zn–Al–MCM-41 приводит к 100% селективности по целевому продукту при конверсии сырья равной 83.8%. Среди цеолитов наибольший выход нопола обеспечивал FAU (селективность по нополу – 75.4%, конверсия – 58.3%). Высокая активность данных образцов связана с открытой структурой пор, которая снимает диффузионные ограничения, и оптимальной кислотностью, способствующей образованию целевого продукта.
Изучению данной реакции в присутствии иерархических цеолитов MMW (MCM-22 и MCM-36 и ITQ-2) посвящена работа [46]. Авторы отмечают, что БКЦ данных цеолитов способствуют изомеризации β-пинена, в то время как ЛКЦ управляют протеканием целевой реакции. Для устранения побочных реакций авторы предлагают использовать цеолиты в Na-форме, в которых БКЦ полностью нейтрализуются катионом Na+. Наибольшей селективностью по целевому продукту (около 100%) обладает цеолит Na–MCM-22 после 1 ч от начала реакции, однако степень превращения субстрата при этом составляет лишь 16%. Увеличение времени реакции до 20 ч приводит к относительно небольшому росту конверсии (24%) и падению селективности до 95%. При тех же условиях использование Na–ITQ-2 позволяет получать нопол с селективностью 87% при конверсии 60% после 1 ч. Авторы [47] изучали данную реакцию в присутствии цинк-ионобменных цеолитов FAU, BEA, MFI и MOR. Установлено, что наибольшие значения выхода нопола (85.5%) достигаются в присутствии BEA. По мнению авторов, высокая активность и избирательность данного цеолита связана как с топологией цеолита, так и с наличием ЛКЦ умеренной силы, которым является катион Zn2+.
Из результатов [45–47] очевидно, что для конденсации такого объемного субстрата, как β‑пинен, с формальдегидом необходимы твердые кислотные материалы с большим размером (мезопористый MCM-41 или цеолит FAU) или иерархической структурой пор (MMW). К таким материалам также можно отнести металлорганические каркасы, в присутствии которых реакция Принса между β-пиненом и формальдегидом изучалась в работе [48]. В данной работе реакция проводилась на коммерчески доступных металлорганических каркасах CuBTC, FeBTC, MIL-53(Al), ZIF-8, синтезированных авторами MIL-100(Fe) и MIL-100(Cr), а также цеолитах BEA, FAU и MFI (TS-1). Было установлено, что катализатор MIL-100(Fe) позволяет получать нопол с выходом 82%, что является наибольшим выходом целевого продукта, достигнутым в данной работе. В работе [49] авторы модифицировали MIL-100 с помощью внесения дополнительного узлового металла (Ni) и получили ряд биметаллических сит MIL-100(Fe-Ni), которые обладали 100%-ной селективностью по целевому продукту при конверсии 70–100%.
Очевидно, что применение того или иного типа гетерогенного катализатора зависит от размера субстрата, реакционных условий и желаемого продукта. В тех случаях, когда речь идет о конденсации низших олефинов, направленной на синтез ненасыщенных спиртов, наибольшей избирательностью характеризуются цеолиты MFI (H-ZSM-5, Boralite) со средним размером пор [31, 38, 39] и модифицированные мезопористые материалы [42, 43]. При получении сопряженных диенов высокой производительностью характеризуются среднепористые цеолиты [33–37]. Превращение крупных субстратов (арилалкенов и циклоалкенов) нуждается в катализаторах с крупными порами, как например цеолиты FAU (H-Y, USY) и BEA (H-Beta) [45–47], металлорганические каркасы [48, 49] или модифицированные мезопористые материалы [45]. Влияние геометрии цеолита на состав продуктов и активность связано с эффектом конфигурационной селективности, возникающей при катализе в поре цеолита, что подтверждается как практическими, так и теоретическими исследованиями данной реакции.
ВЛИЯНИЕ КИСЛОТНОСТИ
Согласно работам группы Димитриу [33–36] в реакции конденсации изобутена с формальдегидом природа кислотных центров катализатора сильно влияет на активность катализатора и состав продуктов. По мнению авторов, реакция Принса и превращение ее продуктов в изопрен контролируется слабыми БКЦ, в то время как на ЛКЦ и сильных БКЦ протекают побочные реакции: ароматизация изобутена и разложения формальдегида. В работе [34] было показано влияние модуля MFI и модификации цеолита фосфорной кислотой на выход изопрена. Было установлено, что зависимость выхода изопрена от модуля является кривой с максимумом при соотношении Si/Al, равном 300. По мнению авторов, цеолит MFI с данным значением модуля обладает оптимальной концентрацией необходимых для реакции БКЦ. Модификация цеолита фосфорной кислотой также приводит к увеличению выхода изопрена. Это явление авторы объясняют замещением мостиковых ОН-групп (сильных БКЦ) на терминальные, обладающие гораздо меньшей кислотностью и деалюминированием образца в ходе обработки. Данный эффект также проявился в работе [50], в которой была исследована конденсация изобутена с формальдегидом в присутствии цеолита H-MFI с модулем 300, модифицированным H3PO4. Было установлено, что оптимальная концентрация кислоты (5 мас. %) способствует увеличению конверсии сырья и селективности образования изопрена благодаря оптимальному значению кислотности образца. Авторы полагают, что сильные кислотные центры ответственны за образование кокса на поверхности катализатора, центры средней силы – за протекание побочных реакций, а образование изопрена протекает на слабых центрах. Кроме того, в работе отмечено, что ЛКЦ, также, как и БКЦ обладают каталитической активностью.
Авторы [37] исследовали поведение цеолитов H-BEA в реакции конденсации и-бутена с формальдегидом с разным составом анионного каркаса (Al, Nb, Zr, Sn). Активность изоморфнозамещенных цеолитов BEA коррелировала с концентрацией БКЦ и увеличивалась в ряду Zr < Sn < Nb < Al. Эти данные свидетельствуют о том, что ЛКЦ цеолитов не обладают каталитической активностью в целевой реакции. Данные результаты согласуются с работой [38], в которой цеолиты Zr-BEA и Sn-BEA не обладают какой-либо каталитической активностью в реакции пропилена с формальдегидом в более мягких условиях.
Изучению закономерностей реакции конденсации пропилена с формальдегидом на цеолитах и металлорганических каркасах посвящен цикл теоретических работ [51–54], в которых оценена возможность конденсации между пропиленом и формальдегидом с образованием 3-бутенола-1. Согласно расчетам, реакция на цеолитах протекает через образование со-адсорбированного π-комплекса формальдегид–олефин. В качестве катализаторов реакции авторы предлагают цеолиты структуры FAU с катионами Na+ [51], Cu+, Ag+ и Au+ [52], Mg2+ [53] и металлорганическим каркасом MOF-11 [54]. Согласно этим работам цеолиты Au-FAU и Mg-Y являются крайне перспективными катализаторами данной реакции, поскольку в их присутствии происходит снижение величины энергии активации более чем в 2 раза по сравнению с реакцией без катализатора (табл. 1).
Таблица 1.
Расчетные значения энергии активации реакции Принса между пропиленом и формальдегидом на гетерогенных катализаторах
Большим потенциалом в данном процессе обладают катализаторы на основе оксида кремния, модифицированного гетерополикислотами [55–57]. В работе [55] изучались закономерности синтеза изопрена посредством реакции Принса между изобутеном и формальдегидом в газовой фазе на гетерополикислотах H4SiMo12O40, H3PMo12O40, H4SiW12O40 и H3PW12O40. Было установлено, что наибольшей активностью обладает катализатор состава 20% H3PW12O40 на силикагеле, в присутствии которого выход изопрена по реакции составляет 47.6% при температуре 290°С. Авторами [56] отмечена высокая селективность образования изопрена (до 90%) в присутствие гетерополикислоты H4SiW12O40 при небольших степенях превращения субстрата (порядка 10%). В патенте [57] предложена система 53% H4SiW12O40 на силикагеле для получения бутадиена при температуре 275°С. Максимальный выход бутадиена в данных условиях достигает 31.7%. В процессе получения изопрена по реакции Принса можно использовать каталитическую систему на основе металлорганического сита MIL-101, модифицированного H4SiW12O40 [58]. В качестве исходного сырья в данной работе была взята смесь метил-трет-бутилового эфира (МТБЭ) и водный раствор формальдегида. В данной работе изобутен генерировался in situ в результате отщепления метанола от МТБЭ. Проведение реакции на катализаторе состава 60% H4SiW12O40–40% MIF-101 позволяет в одну стадию получать изопрен с выходом до 72%. В работе [59] изучали конденсацию изобутенана катализаторах Csх−H4 – хSiW12O40 в автоклавном реакторе при 150°С. Наибольший выход изопрена (74.4%) был получен на H4SiW12O40, увеличение доли цезия приводило как к падению активности катализатора, так и к снижению избирательности, что подтверждает роль БКЦ в данной реакции. Таким образом за счет введения катиона щелочного металла можно управлять активностью ГПК в данной реакции.
Высоким выходом изопрена (до 60%) в данной реакции характеризуется катализатор Cu/SiO2 [60]. Для данного катализатора крайне важна дисперсность частиц Cu+ на поверхности, поскольку в данной реакции именно эти центры являются каталитически активными кислотными центрами умеренной силы. Авторами [61] в качестве гетерогенных катализаторов синтеза изопрена по реакции Принса предложены фосфаты бора, алюминия, ниобия, титана и циркония. Наиболее активными по субстрату были фосфаты ниобия и циркония, наибольший выход по целевому продукту был получен на NbP и составил 57%. Данный катализатор позволяет получать изопрен в течение 30 ч без потери активности, что, по мнению авторов, связано с возможностью саморегенерации кислотных центров данного катализатора в ходе реакции. Также авторы отмечают, что образование изопрена протекает на БКЦ, а на ЛКЦ, помимо побочных превращений изобутена, также происходит разложение формальдегида до CO и H2.
В качестве эффективного катализатора конденсации β-пинена с формальдегидом рассмат-ривают фосфат циркония [62], при этом выход нопола по реакции после 4 ч при 80°С составляет 77% при конверсии 98%. Довольно перспективным катализатором синтеза нопола является твердый биметаллический Fe–Zn-цианидный катализатор [63]. В присутствии данного катализатора при 80°С достигается конверсия 31% и селективность по нополу 85%. Высокий выход нопола (88.4%) достигается в присутствии индийского монтмориллонита, пропитанного ZnCl2 [64]. Большой избирательностью по нополу характеризуются сульфатированные оксид циркония [65] и феррит цинка [66]. Первый катализатор позволяет получать нопол почти с количественным выходом (98%), в то время как феррит цинка обладает селективностью по целевому продукту близкой к 90%. Как видно из работ, посвященным синтезу нопола, катализаторы обладают слабой ЛКЦ, в отличие от цеолитных катализаторов синтеза сопряженных диенов.
Таким образом можно отметить, что сила и концентрация кислотных центров, как и текстурные характеристики катализатора, обладают ярко выраженным влиянием на распределение продуктов в реакции Принса. Очевидно, что тип кислотного центра для конкретного субстрата напрямую зависит от особенностей его строения. Согласно работам [33–38, 50, 55–57], для превращения низших олефинов в ненасыщенные спирты и сопряженные диены необходимы слабые БКЦ, в то время как превращение β-пинена в нопол селективно протекает на ЛКЦ [62–66]. По-видимому, это связано с различиями в механизме данной реакции, возникающими при переходе от алифатических олефинов, активация которых происходит преимущественно за счет слабых БКЦ, к циклоолефинам и арилолефинам, в случае которых образование активной частицы происходит на слабых ЛКЦ.
ЗАКЛЮЧЕНИЕ
Реакция Принса является перспективной основой для процессов синтеза сопряженных диенов. Применение гетерогенных катализаторов позволяет не только упростить реакционную схему до одного реакционного аппарата, но и понизить температуру процесса с 400 до 150°С при проведении реакции в присутствии цеолитов. Вариативность данной реакции позволяет использовать различные классы гетерогенных катализаторов (цеолиты, металлорганические каркасы, мезопористые материалы и др.) и получать не только диены, но и ненасыщенные спирты, замещенные диоксаны и другие гетероатомные соединения.
Наибольшим влиянием на состав продуктов реакции Принса в условиях гетерогенного катализа обладают геометрия поры и кислотные свойства катализатора. За счет структуры пор катализатора можно направить данную реакцию в сторону образования ненасыщенных спиртов, замещенных диоксанов, диенов или замещенных дигидропиранов в одних и тех же реакционных условиях. Природа кислотных центров главным образом влияет на активацию субстрата: реакции конденсации алкилолефинов с формальдегидом протекают преимущественно на слабых БКЦ, в то время как активация цикло- и арилолефинов происходит на слабых ЛКЦ. Наличие сильных кислотных центров во всех случаях приводит к протеканию нежелательных реакции разложения формальдегида, олигомеризации и циклизации олефинов, что приводит к дезактивации катализатора.
Список литературы
https://www.marketsandmarkets.com/PressReleases/ butadiene.asp.
https://www.statista.com/statistics/799009/us-isoprene-market-volume.
Lin L., Fang Y., Liao Y., Chen G., Gao C., Zhu P. // Adv. Eng. Mater. 2019. V. 21. № 6. P. 1801013.
White W.C. // Chemico-Biological Interaction. 2007. V. 166. P. 10
Платэ Н.А., Сливинский Е.В. Основы химии и технологии мономеров. М.: Наука, 2002. 696 с.
Qi Y., Liu Z., Cui L., Dai Q., He J., Dong W. // Catalysts. 2019. V. 9. № 1. 97.
Ezinkwo G.O., Tretyakov V.F., Aliyu A., Ilolov A.M. // ChemBioEngRev. 2014. V. 1. № 5. P. 194.
Makshina E.V., Dusselier M., Janssens W., Degreve J., Jacobs P.A., Sels B.F. // Chem. Soc. Rev. 2014. V. 43. P. 7917.
Rezaei P.S., Shafaghat H., Daud W.M.A.W. // Appl. Catal. A-Gen. 2014. V. 469. P. 490.
Zacharopoulou V., Lemonidou A.A. // Catalysts. 2018. V. 8. № 1. P. 2.
Khadzhiev S.N., Magomedova M.V., Peresypkina E.G. // Petrol. Chemistry. 2014. V. 54. № 4. P. 245.
Liu Y., Kirchberger F.M., Muller S., Eder M., Tonigold M., Sanchez-Sanchez M., Lercher J.A. // Nat. Commun. 2019. V. 10. P. 1462.
Pelaez R., Marin P., Ordonez S. // Appl. Catal. A-Gen. 2016. V. 527. P. 137.
Boucher M.B., Marcinkowski M.D., Liriano M.L., Murphy C.J., Lewis E.A., Jewell A.D., Mattera M.F.G., Kyriakou G., Flytzani-Stephanopoulos M., Sykes E.C.H. // ACS Nano. 2013. V. 7. № 7. P. 6181.
Pastor I.M., Yus M. // Curr. Org. Chem. 2007. V. 11. № 10. P. 925.
Prins H.J. // KNAW, Proceedings. 1919. V. 22. № 1. P. 51.
Weissemel K., Arpe H.-J. Industrial Organic Chemistry. Veinheim: Wiley. 2003, 491 p.
Seidel A. Kirk-Othmer Chemical Technology of Cosmetics. Hoboken: Wiley, 2013, 835 p.
Isagulyants V.I., Khaimova T.G., Melikyan V.R., Pokrovskaya S.V. // Russ. Chem. Rev. 1968. V. 37. № 1. P. 17.
Smissman E.E., Schnettler R.A., Portoghese P.S. // J. Org. Chem. 1965. V. 30. № 3. P. 797.
Blomquist A.T., Verdol J.A. // J. Am. Chem. Soc. 1955. V. 77. № 1. P. 78.
Watanabe S., Suga K. // Bull. Chem. Soc. Jpn. 1963. V. 36. № 11. P. 1495.
Dermer O.C., Hawkins J.J. // J. Am. Chem. Soc. 1952. V. 74. № 18. P. 4595.
Arundale E., Mikeska L.A. // Chem. Rev. 1952. V. 51. № 3. P. 505.
Волынский Н.П. Циклоолефины в реакции Принса. М.: Наука, 1975. 123 с.
Sheldon R.A., Arends I., Hanefeld U. Creen Chemistry and Catalysis. Veinheim: Wiley, 2007. 448 p.
Clark J.H. // Acc. Chem. Res. 2002. V. 35. № 9. P. 791.
Adams D.R., Bhatnagar S.P. // Synthesis. 1977. V. 10. P. 661.
Foster G., Johnson P. // Patent GB № 1205397A. Production of isoprene. 1968.
Venuto P.B., Landis P.S. // Adv. Catal. 1968. V. 18. P. 259.
Chang C.D., Lang W.H., Morgan N.J. // Patent EP № 0013600. Production of alkenols and alkanediols by condensation of aldehyde and ethylenically unsaturated compounds. 1980.
Hölderich W., Hesse M., Näumann F. // Angew. Chem. Int. 1988. V. 27. P. 226.
Dumitriu E., Gongescu D., Hulea V. // Stud. Surf. Sci. Catal. 1993. V. 78. P. 669.
Dumitriu E., Hulea V., Chelaru C., Hulea T. // Stud. Surf. Sci. Catal. 1994. V. 84. P. 1997.
Dumitriu E., On D.T., Kaliaguine S. // J. Catal. 1997. V. 170. № 1. P. 150.
Dumitriu E., Hulea V., Fechete I., Catrinescu C., Auroux A., Lacaze J.-F., Guimon C. // Appl. Catal. A-Gen. 1999. V. 181. № 1. P. 15.
Ponomareva O.A., Chistov D.L., Kots P.A., Ivanova I.I. // Petrol. Chemistry 2019. V. 59. № 7. P. 711.
Vasiliadou E.S., Gould N.S., Lobo R.F. // ChemCatChem. 2017. V. 9. P. 4417.
Vasiliadou E.S., Li S., Caratzoulas S., Lobo R.F. // Catal. Sci. Technol. 2018. V. 8. P. 5794.
Vakulin I.V., Pas’ko P.A., Talipov R.F., Talipova G.R., Kupova O. Yu. // Kinetics and Catalysis 2019. V. 60. № 3. P. 320.
Лиакумович А.Г., Ахмедьянова Р.А., Богачева Т.М., Милославский Д.Г., Юнусова Л.М., Голованова К.В., Забористов В.Н. // Патент РФ № 2561734. Способ получения бутадиена. 2014.
Ji M., Li X., Wang J., Zhu J., Zhou L. // Catal. Today. 2011. V. 173. P. 28.
Fei Z., Ai S., Zhou Z., Chen X., Tang J., Cui M., Qiao X. // J. Ind. Eng. Chem. 2014. V. 20. P. 4146.
Aramendia M.A., Borau V., Jimenez C., Marinas J.M., Romero F.J., Urbano F.J. // Catal. Lett. 2001. V. 73. № 2–4. P. 203.
Selvaraj M., Kawi S. // J. Mol. Catal. A: Chem. 2006. V. 246. № 1–2. P. 218.
Wang J., Jaenicke S., Chuah G.K., Hua W., Yue Y., Gao Z. // Catal. Commun. 2011. V. 12. № 12. P. 1131.
Marakatti V.S., Halgeri A.B., Shanbhag G.V. // Catal. Sci. Technol. 2014. V. 4. № 11. P. 4065.
Opanasenko M., Dhakshinamookthy A., Hwang Y.K., Chang J.-S., Garcia H., Cejka J. // ChemSusChem. 2013. V. 6. № 5. P. 865.
Gimenez-Marques M., Santiago-Portillo A., Navalon S., Alvaro M., Briois V., Nouar F., Garcia H., Serre C. // J. Mater. Chem. A. 2019. V. 7. P. 20285.
Xue Y., Yuewei Z., Bing L., Huiyong M., Yan W., Qiang B., Zhenlu W. // Chem. Res. Chin. Univ. 2018. V. 34. № 3. P. 485.
Sangthong W., Probst M., Limtrakul J. // J. Mol. Struct. 2005. V. 748. P. 119.
Wannakao S., Khongpracha P., Limtrakul J. // J. Phys. Chem. A. 2011. V. 115. P. 12 486.
Fu H., Xie S., Fu A., Ye T. // Comput. and Theor. Chem. 2012. V. 982. P. 51.
Choomwattana S., Maihom T., Khongpracha P., Probst M., Limtrakul J. // J. Phys. Chem. C. 2008. V. 112. P. 10 855.
Sushkevich V.L., Ordomsky V.V., Ivanova I.I. // Catal. Sci. Technol. 2016. V. 6. № 16. P. 6354.
Yu X., Zhu W., Zhai S., Bao Q., Cheng D., Xia Y., Wang Z., Zhang W. // React. Kinet. Mech. Cat. 2016. V. 117. № 2. P. 761.
Коц П.А., Артюшевский Н.А., Иванова И.И. // Патент РФ № 2688158. Способ получения 1,3-бутадиена. 2019.
Songsiri N., Rempel G.L., Prasassarakich P. // Catal. Lett. 2019. V. 149. № 9. P. 2468.
Songsiri N., Rempel G.L., Prasassarekich P. // Mol. Catal. 2017. V. 439. P. 41.
Zhang R., Zhu H., Xu S., Luo X., Zou G., Liu L. // React. Kinet. Mech. Cat. 2019. V. 128. № 1. P. 413.
Suchkevich V.L., Ordomsky V.V., Ivanova I.I. // Appl. Catal. A-Gen.2012. V. 441–442. P. 21.
Wang X., Wang T., Hua W., Yue Y., Gao Z. // Catal. Commun. 2014. V. 43. P. 97.
Patil M.V., Yadav M.K., Jasra R.V. // J. Mol. Catal. A: Chem. 2007. V. 273. № 1–2. P. 39.
Yadav M.K., Jasra R.V. // Catal. Commun. 2006. V. 7. № 11. P. 889.
Jadhav S.V., Jinka K.M., Bajaj H.C. // Appl. Catal. A-Gen. 2010. V. 390. № 1–2. P. 158.
Jadhav S.V., Jinka K.M., Bajaj H.C. // Catal. Today. 2012. V. 198. № 1. P. 98.
Дополнительные материалы отсутствуют.
Инструменты
Нефтехимия