Нефтехимия, 2020, T. 60, № 4, стр. 442-455
Синтез и изучение физико-химических свойств смешанных металл-оксидных наночастиц (CеNiO3, CeZrO4, CeCaO3) для применения в процессах адсорбции и каталитического окисления–разложения асфальтенов различной химической структуры
F. Dehghani 1, *, S. Ayatollahi 1, S. Bahadorikhalili 2, M. Esmaeilpour 3
1 Chemical and Petroleum Engineering Department, Sharif University of Technology
P.O. Box 11155–9465 Tehran, Iran
2 School of Chemistry, College of Science, University of Tehran
Tehran, Iran
3 Chemistry Department, College of Science, Shiraz University
P.O. Box 7134851154 Shiraz, Iran
* E-mail: fdehghani@che.sharif.ir
Поступила в редакцию 02.08.2019
После доработки 17.02.2020
Принята к публикации 11.03.2020
Аннотация
Данное исследование посвящено изучению каталитической активности смешанных металл-оксидных наночастиц с различной поверхностной кислотностью в процессе адсорбции асфальтенов с последующим каталитическим окислением−разложением. Синтезированы три разных типа металл-оксидных наночастиц (CeNiO3, CeCaO3 и CeZrO4), свойства которых (размер, структура и кислотные свойства) изучены методами автоэлектронной сканирующей микроскопии (АЭ-СЭМ), энергодисперсионной рентгеновской спектроскопии (ЭДРС), просвечивающей электронной микроскопией высокого разрешения (ПЭМ-ВР), рентгеновской спектроскопии (РС), низкотемпературной адсорбции азота (БЭТ) и термопрограммируемой десорбции аммиака (ТПД-NH3). Асфальтены были получены методом экстракции из различных образцов сырой иранской нефти (Kuh-e-Mond, индекс API = 12.8 и Bangestan, API = 23.8). Полученные изотермы адсорбции асфальтенов обоих типов на всех трех образцах смешанных металл-оксидных наночастиц хорошо описывались моделью Лэнгмюра. Результаты исследования свидетельствовали о том, что адсорбционная емкость и сродство наночастиц к обоим типам асфальтенов снижается в ряду CeNiO3 > CeCaO3 > CeZrO4. Для исследования каталитической активности асфальтены, адсорбированные на наночастицах, подвергались окислению−разложению с помощью термогравиметрического анализатора. Полученные данные свидетельствовали о том, что температура окисления−разложения асфальтенов в присутствии наночастиц снизилась на 155–180°C для асфальтенов месторождения Kuh-e-Mond и на 95–150°C для асфальтенов месторождения Bangestan, что свидетельствует об их каталитической активности.
Асфальтены – самая крупная, плотная, наиболее полярная и поверхностно-активная фракция нефти, которая растворяется в ароматических растворителях, таких как толуол, бензол или пиридин, но нерастворима в легких линейных алканах, таких как н-пентан (C5) и н-гептан (C7) [1, 2]. Асфальтеновая фракция является главным источником разнообразных проблем в нефте- и газоперерабатывающей промышленности как при транспортировке, так и в процессах переработки [3, 4]. Из-за особенностей структуры молекул асфальтены могут самоассоциироваться и агрегировать, что приводит к осаждению/наслоению на пористой среде и, как следствие, к повреждению и изменению смачиваемости пласта, закупорке пор породы и отложению асфальтенов в скважинах [5–7]. Кроме того, асфальтены являются природными поверхностно-активными веществами (ПАВ), которые стабилизируют нежелательные эмульсии типа “вода в масле”, чем затрудняют отделение нефти [8]. Также асфальтены могут наслаиваться и накапливаться в разнообразных аппаратах и узлах системы добычи и переработки [9, 10], тем самым увеличивая стоимость товарных нефтепродуктов.
Эти проблемы вызвали активность исследователей в вопросе изучения адсорбции асфальтенов на различных поверхностях для удаления из тяжелой нефти [11]. Адсорбенты могут удалить асфальтены из тяжелой нефти, тем самым облегчая ее извлечение и транспортировку. Тяжелые фракции собирают на поверхности твердых тел – адсорбентов, которые также могут обладать каталитической природой и использоваться для превращения этих тяжелых фракций в востребованные легкие дистилляты [12]. Поверхности, используемые в предыдущих адсорбционных исследованиях, включали: (а) металлические и металл-оксидные поверхности [13–15]; (б) поверхности минералов [16–21]; (в) углерода [22]; (г) стекла [23]. Как правило, исследователи считают, что основными силами, вызывающими адсорбцию асфальтенов на поверхности твердого тела, являются силы Ван-дер-Вальса, электростатические и водородные связи, а также перенос заряда и стерические взаимодействия, которые возникают между функционализированной группой асфальтенов (карбоксильной, пиррольной, пиридиновой, тиофеновой и суфльфогруппы) и поверхностью [24].
Нанотехнологии обладают потенциалом к применению в процессах добычи и переработки нефти [25–37]. Наноматериалы имеют чрезвычайно большую и функционализированную поверхность, поэтому предполагается, что они обеспечат необходимую активность и избирательность в отношении адсорбции и последующего разложения асфальтенов [38–43]. Кроме того, наночастицы эффективно транспортируются в пористых средах, поскольку они значительно меньше, чем поровое пространство породы коллектора.
Несмотря на большое разнообразие работ по исследованию адсорбции асфальтена на поверхности твердых тел, в настоящее время лишь несколько были посвящены влиянию кислотных и основных свойств на адсорбцию асфальтена. Nassar N.N. и соавт. [44] исследовали влияние поверхностной кислотности и основности оксидов алюминия на адсорбцию асфальтена с последующим окислением воздухом. Результаты этой работы свидетельствовали о том, что поверхностная кислотность сильно влияет на адсорбцию асфальтена, а адсорбционная емкость оксидов алюминия по асфальтенам снижалась в ряду кислотный > основный и нейтральный. Также была исследована термодинамика адсорбции асфальтенов на трех разных типах поверхностей оксидов/солей металлов: кислотных (WO3 и NiO), амфотерных (Fe2O3 и ZrO2) и основных (MgO и CaCO3) [45].
Оксид церия(IV) CeO2 является важным материалом для применения в катализе по причине увеличенной емкости адсорбции и освобождения кислорода благодаря окислительно-восстановительному циклу Ce4+/Ce3+ [46]. В последние годы исследователи в области нефтедобычи уделяют большое внимание CeO2 по причине широкого диапазона свойств. Adschiri T. c соавт. [47] сообщили о возможности каталитического крекинга канадских битуминозных песков в сверхкритической воде в присутствии наночастиц CeO2.
Церийсодержащие наноразмерные катализаторы, содержащие также металлы переходной валентности, в последние годы привлекают все большее внимание исследователей [48–52]. Различные исследования показали, что окислительно-восстановительные свойства CeO2 могут быть значительно усилены, если внедрить дополнительный элемент в кристаллическую решетку [53–56]. Кроме того, такое внедрение изменяет его адсорбционные свойства [57, 58].
В данной работе были синтезированы три разных типа смешанных металл-оксидных наночастиц с различной поверхностной кислотностью, их адсорбционная емкость и сродство с асфальтенами были изучены с помощью адсорбции двух разных типов асфальтенов с различной химической структурой из толуольных растворов. Также была изучена каталитическая активность синтезированных смешанных металл-оксидных наночастиц в реакции полного окисления−разложения адсорбированных асфальтенов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Химикаты высокой чистоты, включая нитрат церия(III) (гексагидрат Ce(NO3)3 · · 6H2O), нитрат никеля(II) (гексагидрат Ni(NO3)2 · · 6H2O), оксихлорид цирконила(IV) (октагидрат ZrOCl2 · 8H2O), нитрат кальция (тетрагидрат Ca(NO3)2 · 4H2O), аммиак водный (NH4OH (25%)), толуол, этанол (EtOH), были приобретены у фирмы Merck. Цетилтриметиламмоний бромид (CTAB) был приобретен у фирмы Carlo Erba.
Синтез и исследование физико-химических свойств смешанных металл-оксидных наночастиц. Три разных вида смешанных металл-оксидных наночастиц с различной поверхностной кислотностью были синтезированы методом простого соосаждения [59]: водные растворы солей металлов с концентрацией 0.04 М Ce(NO3)3 · 6H2O (1.3 г) и Ni(NO3)2 · 6H2O (0.87 г) – для CeNiO3; Ce(NO3)3 · 6H2O (1.3 g) и ZrOCl2 · 8H2O (0.97 г) – для CeZrO4; Ce(NO3)3 · 6H2O (1.3 г) и Ca(NO3)2 · · 4H2O (0.71 г) – для CeCaO3 были добавлены в водный раствор цетилтриметиламмоний бромида (CTAB) с концентрацией 0.016 М при интенсивном перемешивании (800−900 об./мин) до полного растворения. Затем 1 М водный раствор аммиака был по каплям добавлен к реакционной смеси при перемешивании до достижения значения pH = 10−11. Реакционную смесь продолжили перемешивать в течение 3 ч, а затем раствор центрифугировали 10 мин при 5000 об./мин. После этого образцы промывали этанолом, сушили при 384 К в течение ночи, затем прокаливали при 773 К в течение 5 ч в среде воздуха.
Состав и размер металл-оксидных наночастиц, приготовленных согласно описанной выше методике, определяли с помощью рентгеновской спектроскопии (РС, X’PertPROMPD, излучение CuKα, λ = 1.54060 Å) в диапазоне углов (2θ) 5°−80°. Исследование состава, размера и морфологии наночастиц проводили методами АЭ-СЭМ и ЭДРС на приборе Mira 3-XMU. Микрофотографии образцов, полученные методом ПЭМ-ВР, были сняты с помощью прибора Tecnai F 20 (FEI). Измерения удельной поверхности (БЭТ) и термопрограммируемой десорбции аммиака (ТПД-NH3) были выполнены с помощью газоанализатора NanoSORD 92 (SensIran LTD CO), снабженного детектором по теплопроводности (ДТП). Значения удельной поверхности были получены при температуре кипения жидкого азота путем адсорбции азота и использовании метода single-point.
Результаты ТПД-NH3 использовали для определения различия в кислотных свойствах поверхности образцов. Перед экспериментом образец (0.05 г) предварительно нагревали до 500°С в течение 30 мин в потоке воздуха (расход 10 мл/мин), затем охлаждали до 40°С в потоке воздуха и насыщали гелием в течение 30 мин для того, чтобы полностью десорбировать кислород. Насыщение аммиаком проводили в реакторе с потоком безводного аммиака в течение 30 мин при 100°С, затем продували образец потоком гелия (10 мл/мин) при 40°С и начинали десорбцию аммиака с помощью подъема температуры от комнатной до 850°С со скоростью нагрева 10°С/мин. Десорбированный аммиак определяли on line с помощью ДТП. Для определения количества десорбированного NH3 использовали калибровочную кривую с известным количеством газа.
Экстракция и изучение физико-химических характеристик асфальтенов. Асфальтены экстрагировали из двух разных образцов сырой иранской нефти (Kuh-e-Mond, API = 12.8 и Bangestan, API = 23.8) с помощью стандартного метода IP 143 [60]: навеску образца нефти смешивали с н-гептаном (Merck) в соотношении 1/40 г/мл. Смесь перемешивали со скоростью 650 об./мин в герметичной стеклянной бутылке в течение 6 ч при комнатной температуре. Образовавшийся осадок фильтровали через бумажный фильтр 2.5 мкм (Whatman № 42, UK) и промывали свежим н-гептаном до образования блестящих черных асфальтенов. Затем для дополнительной очистки применяли метод экстракции в экстракторе Сокслета, после чего сушили асфальтены при 60°С в течение 24 ч. В табл. 1 показаны результаты SARA-анализа обоих образцов сырой нефти. В дальнейшем образцы обозначены как нефти А и Б соответственно. Для фракционного SARA-анализа использовали стандартный метод гель-проникающей хроматографии (ASTM D2007-93).
Таблица 1.
Результаты SARA-анализа и значения плотности образцов нефти, использованных в данной работе, в градусах API
| Kuh-e-Mond (А) | Bangestan (Б) | |
|---|---|---|
| Насыщенные углеводороды, мас. % | 21.83 | 42.0 |
| Ароматические углеводороды, мас. % | 53.59 | 43.0 |
| Смолы, мас. % | 9.58 | 8.0 |
| Асфальтены, мас. % | 14.7 | 7.0 |
| Плотность, ° API | 12.8 | 23.8 |
Полный анализ обоих образцов асфальтенов с использованием связанного элементного анализа, ИК-Фурье спектроскопии и молекулярного моделирования был выполнен Amin J.S. с соавт. для определения химической структуры образцов [61]; структурный анализ проводили согласно процедуре, описанной в [62]. Полученные данные показаны в табл. 2. Представленные массовые значения концентрации элементов C, H, N, S и O были определены с использованием элементного анализа. Для этих целей был использован CHNSO-анализатор (Thermo Flash EA 1112 series). Также в табл. 2 представлены концентрации никеля (Ni) и ванадия (V). На основании элементного состава для каждого асфальтена была предложена молекулярная структура. Наличие функциональных групп в образцах было определено с помощью ИК-спектров (Shimadzu model 8300) [61].
Таблица 2.
Результаты элементного анализа образцов асфальтенов
| Образец | C | H | N | S | O | Ni, ppm | V, ppm | Структурная формула |
|---|---|---|---|---|---|---|---|---|
| Kuh-e-Mond (A) | 80.36 | 7.19 | 0.98 | 8.90 | 2.57 | 0.277 | 0.186 | C95H102O2N1S4 |
| Bangestan (БB) | 74.56 | 6.74 | 0.85 | 6.84 | 10.99 | 0.625 | 0.219 | C102H110O11N1S3 |
Для регистрации протонных 1H ЯМР- и углеродных 13C ЯМР-спектров в качестве растворителя использовали дейтерированный хлороформ (CDCl3). Оба спектра были использованы для определения соотношений атомов углерода и водорода в ароматических и алифатических фрагментах молекулы асфальтена. Полученные данные позволили оценить число алифатических цепей и ароматических колец, из чего можно было предсказать химическую структуру образцов. Результаты элементного анализа, наряду с ИК-спектрами, подтвердили наличие крупного хромофора, состоящего как минимум из семи сопряженных ароматических колец, и небольшого хромофора из двух колец в структуре обоих образцов.
На рис. 1 показаны предполагаемые молекулярные структуры асфальтенов типа А и Б, экстрагированных из нефти месторождения Kuh-e-Mond (А) и Bangestan (Б), основанные на результатах молекулярного моделирования и данных ИК-Фурье спектроскопии [61]. Из них асфальтен типа Б имеет наибольший хромофор, состоящий из 11 сопряженных ароматических колец. Асфальтены обоих типов содержат алифатические углеводородные цепи с тремя атомами углерода. Эти структурные особенности с большой вероятностью контролируют механизм осаждения и агрегации асфальтенов.
Рис. 1.
Предполагаемые молекулярные структуры асфальтенов, экстрагированных из нефти месторождения Kuh-e-Mond (а) и Bangestan (б).

Изучение адсорбции асфальтенов на поверхности металл-оксидных наночастиц. Для приготовления модельного раствора тяжелой нефти, необходимого для адсорбционных экспериментов в периодическом режиме, твердые асфальтены растворяли в толуоле. Таким образом был приготовлен исходный раствор с концентрацией асфальтенов 5000 мг/л, который затем разбавляли толуолом до концентрации 100−2500 мг/л, необходимой для адсорбционных измерений.
Адсорбционные исследования в периодическом режиме проводили путем добавления навески наночастиц к 10 мл раствора асфальтенов в толуоле при соотношении количества наночастиц к модельному раствору тяжелой нефти равному 5 : 1 (г/л). Виалы были плотно закрыты во избежание испарения толуола. Образцы встряхивали со скоростью 200 об./мин в инкубаторе при 25°С в течение 24 ч до тех пор, пока не установится равновесие. Зависимость адсорбции асфальтенов на наночастицах от времени пребывания была предварительно изучена при различных начальных концентрациях асфальтена в растворе, благодаря чему было установлено, что время контакта 24 ч является достаточным для достижения равновесия в присутствии всех смешанных металл-оксидных наночастиц. После установления равновесия смесь центрифугировали при 5000 об./мин в течение 30 мин. Жидкость над осадком декантировали и определяли концентрацию асфальтенов в данной жидкости с помощью УФ-видимого спектрометра T80+ (PG Instruments, Ltd., UK); для холостого опыта использовали толуол. Линейные калибровочные кривые зависимости поглощения УФ- и видимого спектров в области 309 нм для типа А и 420 нм для типа Б от концентрации асфальтена были получены с использованием стандартного раствора асфальтена в толуоле с известной концентрацией, что согласуется с литературным данным [25, 45]. Жидкости над осадком при необходимости разбавляли толуолом до величины поглощения в линейном диапазоне поглощения УФ- и видимого спектров.
Наночастицы, содержащие адсорбированные асфальтены, сушили при 60°С в течение 24 ч для удаления остаточного толуола. Твердые образцы помешали в термический анализатор.
Термогравиметрический анализ асфальтенов. Для изучения каталитической активности наночастиц в реакции окисления асфальтена использовали ТГА/ДСК анализатор (TGA/DSC 1, Mettler Toledo). Навеску (приблизительно 5 мг) наночастиц, содержащих адсорбированный асфальтен (из раствора концентрации 500 мг/л), помещали в тигель из оксида алюминия (объем 70 мкл) и нагревали до 1200°С в токе воздуха с расходом 50 мл/мин. Нагревание образцов проводили со скоростью нагрева 10°С/мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
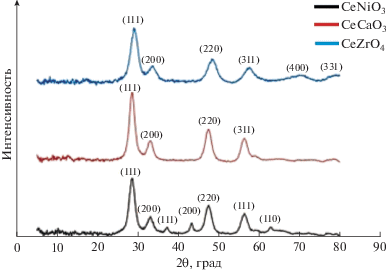
Физико-химическое исследование наночастиц. На рис. 2 показаны дифрактограммы предварительно прокаленных при 500°С в течение 5 ч синтезированных металл-оксидных наночастиц. Дифрактограмма CeNiO3 свидетельствует о наличии кристаллической структуры, характерной для CeN-iO3 (2θ: 28.61°, 33.16°, 37.29°, 43.31°, 47.54°, 56.39°, 62.89°, 69.47°, 76.69°). Также на дифрактограмме присутствуют рефлексы, характерные для кубической сингонии CeO2 (2θ = 28.61°, 33.16°, 47.54°, 56.39°), соответствующие кристаллическим граням (111), (200), (220) и (311) (JCPDS 81–0792). Рефлексы при 2θ = 37.29°, 43.31° и 62.89° соответствуют (111), (200) и (220) плоскостям кубического NiO (JCPDS 75–0197).
На порошковой дифрактограмме образца CeZrO4 наблюдаются шесть главных пиков (111), (200), (220), (311), (400) и (331) при соответствующих значениях 2θ: 29.16°, 33.73°, 48.43°, 57.60°, 70.68°, 78.10°, характерных для шпатоподобной кубической структуры CeZrO4 (JCPDS 38–1439) со стехиометрическим соотношением Zr/Ce). Согласно дифрактограмме, CeCaO3 обладает кристаллической структурой с рефлексами при 2θ: 28.61°, 33.13°, 47.49°, 56.36°, 59.01°, 69.33°, 76.64° и 78.61°. Также на дифрактограмме присутствовали сигналы кубического CeO2 при 2θ = 28.608°, 33.16°, 47.545°, 56.396°, которые соответствуют (111), (200), (220) и (311) кристаллическим плоскостям (JCPDS 81–0792). Дифрактограмма CeCaO3 полностью соответствует дифрактограмме, опубликованной Samantaray S. с соавт. [49].
Средний размер кристаллитов (D) оценивали по расширению пиков на дифрактограмме, используя уравнение Шеррера D = Kλ/β cos θ, где К – константа со значением 0.94, λ – длина волны CuKα1-излучения (в данной работе λ = 1.54056 Å), β – половина максимальной ширины дифракционного пика (FWHM), а θ – значение угла Брагга. Значения D равнялись 6.3 нм для CeNiO3, 7.5 нм для CeZrO4 и 5.7 нм для CeCaO3.
На рис. 3а−в показаны результаты энергодисперсионной рентгеновской спектроскопии (ЭДРС), совмещенной с АЭ-СЭМ прокаленных при 500°C образцов (CeNiO3, CeZrO4, CeCaO3), которые были использованы для дополнительного подтверждения структуры. ЭДРС-спектры, очевидно, свидетельствуют о наличии необходимых элементов в смешанных металл-оксидах с необходимой концентрацией без каких-либо дополнительных примесей.
На микрофотографиях (рис. 4) наночастиц CeCaO3 (a–в), CeZrO4 (г–е) и CeNiO3 (ж–и), полученных методом просвечивающей электронной микроскопии высокого разрешения (ПЭМ-ВР), видны частицы сферической морфологии с размером около 5 нм и частицы с размером 3−10 нм при разном увеличении.
Рис. 4.
Микрофотографии наночастиц CeCaO3 (a–в), CeZrO4 (г–е) и CeNiO3 (ж–и) при различном увеличении.

Метод автоэлектронной сканирующей микроскопии (АЭ-СЭМ) был использован для определения размера и морфологии синтезированных наночастиц при двух разных увеличениях (рис. 5). На микрофотографиях, полученных методом АЭ-СЭМ, четко видно присутствие агрегированных наночастиц. Полученные значения среднего размера частиц составляли 6, 7 и 8 нм для CeCaO3, CeNiO3 и CeZrO4 соответственно (рис. 5). Эти значения согласуются со значениями размера частиц, посчитанными по уравнению Шеррера.
В табл. 3 приведены значения удельной поверхности (БЭТ) смешанных металл-оксидных наночастиц. Все образцы, согласно изотермам адсорбции−десорбции азота, имеют значения удельной поверхности в диапазоне 76−81 м2/г.
Таблица 3.
Свойства поверхности и химической структуры смешанных металл-оксидных наночастиц
| Образец | Удельная поверхность по БЭТ, м2/г | Размер частицыа, нм | Размер частицыб, нм | Кислотностьс, мкмоль NH3/м2 |
|---|---|---|---|---|
| CeNiO3 | 79 | 6.3 | 7 | 2.15 |
| CeZrO4 | 76.5 | 7.5 | 8 | 1.98 |
| CeCaO3 | 81 | 5.7 | 6 | 2.06 |
На рис. 6 показаны кривые ТПД-NH3 для синтезированных наночастиц. Метод ТПД-NH3 является мощным инструментом для измерения силы кислотных центров твердых кислот. Молекулы NH3 десорбируются с центров слабой силы при низких температурах, а с сильных центров – при высоких [63]. Как показано на рис. 6, кривые ТПД-NH3 содержат три главных пика десорбции, соответствующих средним и сильным центрам, в температурном интервале 50−800°C.
Рис. 6.
Кривые термопрограммируемой десорбции NH3 для наночастиц CeNiO3 (а), CeZrO4 (б) и CeCaO3 (в).

На кривой десорбции NH3 образца CeNiO3 находятся четко разделенные пики при разных температурах (рис. 6, кривая а). Пики десорбции при 120, 210 и 270°C принадлежат молекулам NH3, адсорбированным на слабых и средних кислотных центрах, в то время как пик при 680°C относят к молекулам NH3, адсорбированным на сильных кислотных центрах. На кривой ТПД-NH3 образца CeZrO4 наблюдается широкий пик в диапазоне 100−320°C, следовательно, кислотные центры CeZrO4 являются слабыми и средними по силе (рис. 6, кривая б). Пики CeCaO3 обладали аналогичной с пиками образца CeNiO3 формой при низких температурах, характерных для слабых и средних кислотных центров: порядка 120, 200 и 260°C, и при 660°C – в области сильных кислотных центров (рис. 6, кривая в). Согласно значению температур пиков кривых ТПД-NH3 наночастиц (рис. 6), сила кислотных центров катализаторов снижалась в ряду CeNiO3$ \gg $ CeCaO3 > > CeZrO4.
Адсорбция асфальтенов на наночастицах. Адсорбция асфальтенов на поверхности твердых тел зависит от типа и силы взаимодействия между асфальтенами и поверхностными центрами, то есть зависит как от химических особенностей и заряда поверхности твердого тела, так и от функциональных групп и заряда асфальтеновых агрегатов. Эти межмолекулярные взаимодействия обычно разделяют на три основные категории: полярные (кислотно-основные), электростатические и ван-дер-вальсовы взаимодействия [24]. Полярные взаимодействия возникают за счет электростатических сил между локализованными зарядами, возникающими за счет постоянных или наведенных диполей. Полярные взаимодействия могут быть очень сильными и способны вызвать ассоциацию молекул, аналогичную слабой химической связи.
Электростатические взаимодействия контролируются зарядом поверхности в случаях взаимодействий твердое тело−вода/нефть и асфальтен−вода/ нефть. Ван-дер-вальсовы дисперсионные силы притяжения – силы, возникающие между спонтанно индуцированными ди- и мультиполями и они являются слабыми по своей природе [41].
Льюисовские кислотно-основные взаимодействия являются одним из типичных примеров полярных взаимодействий. Согласно кислотно-основной реакционной теории Льюиса, основания предоставляют электронную пару, а кислоты эту пару акцептируют. Таким образом, кислотой по Льюису является любое вещество, которое может акцептировать не образующую связь электронную пару, как например ионы металлов (M+n). Льюисовским основанием является любое вещество, которое способно предоставлять свободную электронную пару, как например атомы серы (S), кислорода (O) и азота (N), среди этих льюисовских оснований кислород является очень слабым ввиду высокой электроотрицательности. С другой стороны, поверхности металлических оксидов состоят из упорядоченного массива кислотно-основных центров. Катионные центры металла выступают в роли льюисовских кислотных центров, в то время как анионные кислородные центры – в качестве оснований по Льюису. Поверхностные гидроксильные группы способны быть как бренстедовскими кислотными центрами, так и основными центрами, поскольку они способны отдавать или акцептировать протон [64]. Как видно из кривых ТПД-NH3 (рис. 6), наночастицы состоят из льюисовских кислотных центров разной силы. С другой стороны, на рис. 7 показаны несколько типов льюисовских оснований в предложенных структурах молекул асфальтенов типа А и Б. Льюисовские кислотно-основные взаимодействия между этими центрами приводят к адсорбции асфальтенов на наночастицах.
Рис. 7.
Различные льюисовские основые центры в образцах нефти месторождения Kuh-e-Mondoil (А) и Bangestan (Б).
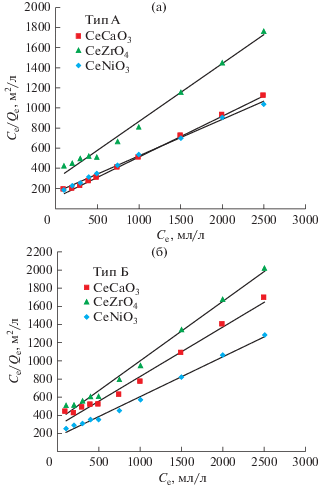
Изотермы адсорбции. Адсорбционные свойства образцов были изучены с использованием изотерм адсорбции, полученных при 25°C при различных значениях начальной концентрации асфальтенов в диапазоне 100−2500 мг/л. Границы данного диапазона ограничены значениями критической концентрации наноагрегаци и асфальтенов (100–200 мл/г) и значениями критической концентрации кластеризации (∼2000 мг/л) асфальтенов в толуоле [65]. С помощью методики, описанной Khodadadi A.A. с соавт. [45] было установлено, что оптимальным соотношением количества наночастиц к модельной смеси тяжелой нефти является 5 г/л.
Как видно на рис. 8, в присутствии всех образцов синтезированных наночастиц адсорбция асфальтенов резко возрастает при низкой равновесной концентрации асфальтенов и начинает выравниваться при дальнейшем увеличением концентрации. Такое поведение кривых адсорбции асфальтенов на наночастицах свидетельствует о монослойной адсорбции, что согласуется с ранее опубликованными данными об адсорбции асфальтенов на оксидах металлов [45].
Рис. 8.
Изотермы адсорбции асфальтенов типа А и Б при 25°C на поверхности трех разных типов смешанных металл-оксидных наночастиц.

Таким образом, для того чтобы согласовать данные об адсорбции асфальтенов, с целью дальнейшего изучения особенностей адсорбционных характеристик наночастиц, была применена модель изотермы Ленгмюра. Эта модель описывает адсорбцию молекулярного монослоя на однородной поверхности [66]. Модель изотермы Ленгмюра и ее линейная форма имеют вид уравнений (1) и (2) соответственно:
(1)
${{Q}_{{{\text{e}}~}}} = \frac{{{{Q}_{{{\text{max}}}}}{{K}_{L}}{{C}_{{\text{e}}}}}}{{1 + {{K}_{L}}{{C}_{{\text{e}}}}}},$(2)
$\frac{{{{C}_{{\text{e}}}}}}{{{{Q}_{{\text{e}}}}}} = \frac{1}{{{{K}_{L}}{{Q}_{{{\text{max}}}}}}} + \frac{{{{C}_{{\text{e}}}}}}{{{{Q}_{{{\text{max}}}}}}},$Таблица 4.
Расчетные параметры модели Ленгмюра при 25°C
| Константы Ленгмюра | ||||||
|---|---|---|---|---|---|---|
| Наночастицы | тип А | тип Б | ||||
| Qmax, мг/м2 | KL, л/мг | R2 | Qmax, мг/м2 | KL, л/мг | R2 | |
| CeNiO3 | 2.06 | 0.08 | 0.998 | 1.94 | 0.07 | 0.993 |
| CeZrO4 | 1.42 | 0.04 | 0.990 | 1.24 | 0.03 | 0.992 |
| CeCaO3 | 1.6 | 0.07 | 0.998 | 1.48 | 0.05 | 0.987 |
Как видно на рис. 8, значениe Qe в присутствии наночастиц снижается в ряду CeNiO3 > > CeCaO3 > CeZrO4 для обоих типов асфальтенов. Значения Qe не во всех случаях прямо пропорциональны значению удельной поверхности образцов, поскольку значениe удельной поверхности наночастиц по БЭТ снижалось в ряду CeCaO3 > > CeNiO3 > CeZrO4 (табл. 3). Данное расхождение может свидетельствовать о том, что тип и сила взаимодействий между асфальтенами и поверхностью образца играет значительную роль в адсорбции асфальтенов. Все изученные в данной работе наночастицы характеризуются большим значением адсорбционной емкости (Qmax) по обоим типам асфальтенов (1.42–2.06 для асфальтенов типа А и 1.24–1.94 для типа Б).
Путем сравнения полученных значений Qmax и KL было установлено, что CeNiO3 обладает наибольшей адсорбционной емкостью (Qmax) и сродством (KL) к обоим типам асфальтенов. По-видимому, наночастицы с более сильной поверхностной кислотностью характеризуются большей адсорбционной емкостью и сродством к асфальтенам, чем наночастицы со слабой поверхностной кислотностью. Результаты ТПД-NH3 свидетельствовали о том, что наночастицы характеризуются разной силой кислотных центров. Поверхностная кислотность образцов снижалась в ряду CeNiO3$ \gg $ $ \gg $ CeCaO3 > CeZrO4. По-видимому, кислотно-основные взаимодействия между адсорбатом и адсорбентом оказывают значительное влияние на адсорбцию асфальтенов. Образец CeNiO3 с наибольшей поверхностной кислотностью высокой силы обеспечивает наибольшую степень эффективных взаимодействий с асфальтенами, что приводит к наибольшему сродству (KL), а CeZrO4 ввиду наименьшей поверхностной кислотности и ее наименьшей силы обладает наименьшим адсорбционным сродством к асфальтенам.
Как показано на рис. 7, асфальтены типа А имеют четыре сильных основных центра для взаимодействия с кислотными центрами наночастиц, поэтому они имеют наибольшее сродство (KL) по сравнению с асфальтенами типа Б, у которых три основных центра. Поскольку атом кислорода является значительно менее основным по сравнению с азотом или серой, большое количество OH-групп в химической структуре асфальтенов типа Б не оказывают значительного влияния на адсорбцию асфальтенов на наночастицах.
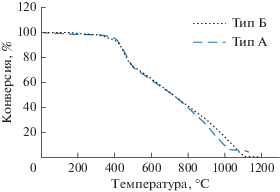
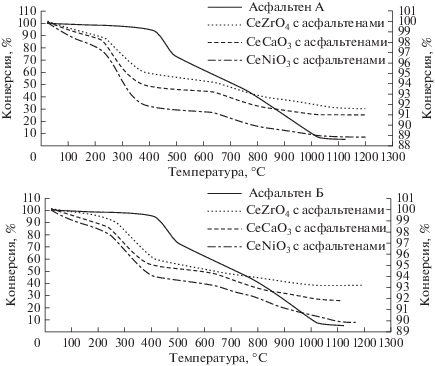
Каталитическое окисление−разложение асфальтенов, адсорбированных на наночастицах. Для того чтобы получить более полное представление о каталитической активности наночастиц в реакциях окисления и разложения асфальтенов, был проведен термогравиметрический анализ трех типов наночастиц, содержащих адсорбированные асфальтены, где определяли потерю массы образца в условиях линейного увеличения температуры в среде воздуха. Для сравнения также были проведены ТГА-анализы исходных асфальтенов. Окисление обоих типов асфальтенов в отсутствии наночастиц, как показано на рис. 9, характеризуется двумя областями: низкотемпературной, которая начиналась при 400°С и достигала максимальной скорости при 461°С для типа А и 459°С для типа Б, и высокотемпературной, которая начиналась при 520°С и достигала максимальной скорости при 915°С для типа А и при 922°С для типа Б соответственно.
На рис. 10 показана зависимость степени превращения двух разных типов асфальтенов от температуры в присутствии и отсутствии наночастиц. Из рисунка видно, что адсорбция асфальтенов на наночастицах значительно усилила процесс окисления; так процесс окисления в присутствии наночастиц, включающий термическое разложение, начинается уже при 40°C. Как показано на рис. 10, температура окисления асфальтенов снижается примерно на 155–180°C для асфальтенов типа А и на 95–150°C для типа Б в присутствии наночастиц. Снижение температуры окисления явно свидетельствует о каталитической активности наночастиц в реакциях окисления и разложения асфальтенов. Каталитическая активность наночастиц в окислении обоих типов асфальтенов снижалась в ряду CeNiO3 > CeCaO3 > > CeZrO4. Очевидно, что на каталитическую активность оказывает влияние кислотность поверхности наночастиц, наибольшая поверхностная кислотность привела к большей каталитической активности в реакции окисления−разложения асфальтенов.
Количество адсорбированных асфальтенов было определено с помощью УФ-видимой адсорбционной спектроскопии и ТГА. В табл. 5 показано сравнение результатов, полученных обоими методами. Результаты количественного определения адсорбированных асфальтенов, полученные с помощью УФ-видимой адсорбционной спектроскопии, согласуются со значениями, полученными с помощью ТГА.
Таблица 5.
Сравнение значений количества адсобированного пиридина, полученных с помощью УФ- и видимой адсорбционной спектроскопии ТГА
| Тип А | Тип Б | |||
|---|---|---|---|---|
| Образец | Адсорбированные асфальтены (УФ- и видимый спектры, %) | Адсорбированные асфальтены (ТГА, %) | Адсорбированные асфальтены (УФ- и видимый спектры, %) | Адсорбированные асфальтены (ТГА, %) |
| CeNiO3 | 12.1 | 11.2 | 11.4 | 10.3 |
| CeZrO4 | 7.4 | 8.5 | 6.2 | 6.8 |
| CeCaO3 | 8.8 | 9 | 7.9 | 8.1 |
Таким образом, в данной работе проведен синтез и исследованы физико-химические свойства трех разных типов смешанных металл-оксидных наночастиц с различной поверхностной кислотностью, которые были использованы для адсорбции и каталитического окисления−разложения двух разных типов асфальтенов с различной химической структурой. Все три образца наночастиц с различной поверхностной кислотностью эффективно адсорбируют асфальтены. Модель изотермы Ленгмюра хорошо описывает полученные изотермы адсорбции, что свидетельствует о монослойной адсорбции. Образец CeNiO3 при одинаковой температуре и равновесной концентрации обладает наибольшей адсорбционной емкостью (Qmax) и сродством (KL) к асфальтенам. Окисление асфальтенов обоих типов в отсутствие наночастиц характеризуется двумя температурными областями, которые описывают окисление разных типов атомов углерода в структуре асфальтенов. Присутствие наночастиц вместе с асфальтенами привело к значительному снижению температуры окисления−разложения асфальтенов: на 155–180°C для асфальтенов типа А и на 95–150°C для типа Б, что свидетельствует о каталитической активности наночастиц. Эта активность различных наночастиц снижалась в ряду CeNiO3 > CeCaO3 > > CeZrO4 для обоих типов асфальтенов. Очевидно, что на каталитическую активность влияет поверхностная кислотность наночастиц: наибольшая поверхностная кислотность привела к наибольшей каталитической активности в реакции окисления−разложения асфальтенов. Было обнаружено, что контролируемая деасфальтизация тяжелой нефти с помощью смешанных металл-оксидных наночастиц является начальной стадией модернизации нефтяных коллекторов in situ.
Список литературы
Andersen S.I., Speight J.G. // J. Petrol. Sci. Eng. 1999. V. 22. № 1−3. P. 53. https://doi.org/10.1016/S0920-4105(98)00057-6
Borton D., Pinkston D.S., Hurt M.R., Tan X., Azyat K., Scherer A., Tykwinski R., Gray M., Qian K., Kenttämaa H.I. // Energy Fuels. 2010. V. 24. № 10. P. 5548. https://doi.org/10.1021/ef1007819
Franco C.A., Nassar N.N., Ruiz M.A., Pereira-Almao P., Cortés F.B. // Energy Fuels. 2013. V. 27. № 6. P. 2899. https://doi.org/10.1021/ef4000825
Kokal S.L., Sayegh S.G. Asphaltenes: The Cholesterol of Petroleum. In Middle East Oil Show, 1995. P. 169.
Eskin D., Mohammadzadeh O., Akbarzadeh K., Taylor S.D., Ratulowski J. // Can. J. Chem. Eng. 2016. V. 94. № 6. P. 1202.
Drummond C., Israelachvili J. // J. Petrol. Sci. Eng. 2004. V. 45. № 1−2. P. 61.
Syunyaev R.Z., Balabin R.M., Akhatov I.S., Safieva J.O. // Energy Fuels. 2009. V. 23. P. 1230. https://doi.org/10.1021/ef8006068
McLean J.D., Kilpatrick P.K. / J. Colloid Interface Sci. 1997. V. 196. № 1. P. 23.
Akbarzadeh K., Hammami A., Kharat A., Zhang D., Allenson S., Creek J., Kabir S., Jamaluddin A., Marshall A.G., Rodgers R.P., et al. // Oilfield Review. 2007. V. 9. № 2. P. 22.
Alboudwarej H., Pole D., Svrcek W.Y., Yarranton H.W. // Ind. Eng. Chem. Res. 2005. V. 44. № 15. P. 5585. https://doi.org/10.1021/ie048948f
Adams J.J. // Energy Fuels. 2014. V. 28. № 5. P. 2831.
Nassar N.N. // Energy Fuels. 2010. V. 24. № 8. P. 4116. https://doi.org/10.1021/ef100458g
Abdallah W.A., Taylor S.D. // Nuclear Instruments & Methods in Physics Research. B. 2007. V. 258. № 1. P. 213.
Marczewski A.W., Szymula M. // Colloids Surf. A. 2002. V. 208. № 1. P. 259.
Ekholm P., Blomberg E., Claesson P., Auflem I.H., Sjöblom J., Kornfeldt A. // J. Colloid Interface Sci. 2002. V. 247. № 2. P. 342. https://doi.org/10.1006/jcis.2002.8122
González G., Middea A. // Colloids Surf. 1991. V. 52. P. 207.
Cosultchi A., Garciafigueroa E., Mar B., García-Bórquez A., Lara V.H., Bosch P. // Fuel. 2002. V. 81. № 4. P. 413. https://doi.org/10.1016/S0016-2361(01)00187-9
Pernyeszi T., Dékány I. // Colloids Surf. A. 2001. V. 194. № 1. P. 25.
Gaboriau H., Saada A. // Chemosphere. 2001. V. 44. № 7. P. 1633. https://doi.org/10.1016/S0045-6535(00)00527-0
Tong Z.X., Morrow N.R., Xie X. // J. Pet. Sci. Eng. 2003. V. 39. № 3. P. 351.
Alkafeef S.F., Algharaib M.K., Alajmi A.F. // J. Colloid Interface Sci. 2006. V. 298. № 1. P. 13. https://doi.org/10.1016/j.jcis.2005.12.038
Sakanishi K., Saito I., Watanabe I., Mochida I. // Fuel. 2004. V. 83. № 14. P. 1889.
Akhlaq M.S., Götze P., Kessel D., Dornow W. // Colloids Surf. A. 1997. V. 126. № 1. P. 25. https://doi.org/10.1016/S0927-7757(96)03947-7
Castro M., Mendoza de la Cruz J.L.M., Buenrostro-Gonzalez E., López-Ramírez S., Gil-Villegas A. // Fluid Phase Equilib. 2009. V. 286. № 2. P. 113. https://doi.org/10.1016/j.fluid.2009.08.009
Nassar N.N., Hassan A., Vitale G. // Appl. Catal. A. 2014. V. 484. P. 161.
Ezeonyeka N.L., Hemmati-Sarapardeh A., Husein M.M. // Energy Fuels. 2018. V. 32. № 2. P. 2213.
Eshraghian A., Husein M.M. // Fuel. 2018. V. 217. P. 409.
Mohammadi M., Akbari M., Fakhroueian Z., Bahramian A., Azin R., Arya S. // Energy Fuels. 2011. V. 25. № 7. P. 3150.
Igder M., Hosseinpour N., Biyouki A.A., Bahramian A. // Energy Fuels. 2018. V. 32. № 6. P. 6689.
Betancur S., Carmona J.C., Nassar N.N., Franco C.A., Cortés F.B. // Ind. Eng. Chem. Res. 2016. V. 55. № 21. P. 6122.
Kazemzadeh Y., Eshraghi S.E., Kazemi K., Sourani S., Mehrabi M., Ahmadi Y. // Ind. Eng. Chem. Res. 2015. V. 54. № 1. P. 233.
Shojaati F., Riazi M., Mousavi S.H., Derikvand Z. // Colloids Surf. A. 2017. V. 531. P. 99.
Wang J., Buckley J.S., Creek J.L. // J. Disper. Sci. Technol. 2004. V. 25. № 3. P. 287.
Setoodeh N., Darvishi P., Lashanizadegan A. // J. Disper. Sci. Technol. 2018. V. 39. № 3. P. 452.
Setoodeh N., Darvishi P., Esmaeilzadeh F. // J. Disper. Sci. Technol. 2018. V. 39. № 4. P. 578.
Setoodeh N., Darvishi P., Lashanizadegan A. // J. Disper. Sci. Technol. 2018. V. 39. № 5. P. 711.
Vargas V., Castillo J., Ocampo-Torres R., Lienemann C.-P., Bouyssiere B. // Pet. Sci. Technol. 2018. V. 36. № 8. P. 618.
Nassar N.N., Hassan A., Luna G., Pereira-Almao P. // Catal. Today. 2013. V. 207. P. 127. https://doi.org/10.1016/j.cattod.2012.04.054
Nassar N.N., Hassan A., Carbognani L., Lopez-Linares F., Pereira-Almao P. // Fuel. 2012. V. 95. P. 257. https://doi.org/10.1016/j.fuel.2011.09.022
Nassar N.N., Hassan A., Pereira-Almao P. // J. Therm. Anal. Calorim. 2012. V. 110. № 3. P. 1327.
Nassar N.N., Hassan A., Pereira-Almao P. // Colloids Surf. A. 2011. V. 384. № 1. P. 145.
Lozano M.M., Franco C.A., Acevedo S.A., Nassar N.N., Cortes F.B. // RSC Advances. 2016. V. 6. № 78. P. 74 630. https://doi.org/10.1039/c6ra17554f
Hashemi S.I., Fazelabdolabadi B., Moradi S., Rashidi A.M., Shahrabadi A., Bagherzadeh H. // Applied Nanoscience. 2016. V. 6. № 1. P. 71.
Nassar N.N., Hassan A., Pereira-Almao P. // J. Colloid Interface Sci. 2011. V. 360. № 1. P. 233.
Hosseinpour N., Khodadadi A.A., Bahramian A., Mortazavi Y. // Langmuir. 2013. V. 29. № 46. P. 14 135. https://doi.org/10.1021/la402979h
Trovarelli A. // Catal. Rev. 1996. V. 38. № 4. P. 439.
Dejhosseini M., Aida T., Watanabe M., Takami S., Hojo D., Aoki N., Arita T., Kishita A., Adschiri T. // Energy Fuels. 2013. V. 27. P. 4624. https://doi.org/10.1021/ef400855k
Chang H., Jong M.T., Wang C., Qu R., Du Y., Li J., Hao J. // Environ. Sci. Technol. 2013. V. 47. № 20. P. 11 692.
Samantaray S., Pradhan D.K., Hota G., Mishra B.G. // Chem. Eng. J. 2012. V. 193–194. P. 1. https://doi.org/10.1016/j.cej.2012.04.011
Daturi M., Finocchio E., Binet C., Lavalley J.-C., Fally F., Perrichon V., Vidai H., Hickey N., Kaspar J. // J. Phys. Chem. B. 2000. V. 104. № 39. P. 9186. https://doi.org/10.1021/jp000670r
Sanchez-Dominguez M., Liotta L.F., Di Carlo G., Pantaleo G., Venezia A.M., Solans C., Boutonnet M. // Catal. Today. 2010. V. 158. P. 35. https://doi.org/10.1016/j.cattod.2010.05.026
Jacobs G., Chenu E., Patterson P.M., Williams L., Sparks D., Thomas G., Davis B.H. // Appl. Catal. A. 2004. V. 258. № 2. P. 203.
Shan W., Luo M., Ying P., Shen, W., Li C. // Appl. Catal. A. 2003. V. 246. № 1. P. 1.
Tang C., Sun B., Sun J., Hong X., Deng Y., Gao F., Dong L. // Catal. Today. 2017. V. 281. P. 575.
Boudjahem A.-G., Monteverdi S., Mercy M., Bettahar M.M. // Langmuir. 2004. V. 20. № 1. P. 208. https://doi.org/10.1021/la035120
Boudjahem A.G., Monteverdi S., Mercy M., Bettahar M.M. // Catal. Lett. 2004. V. 97. № 3–4. P. 177. https://doi.org/10.1023/B:CATL.0000038581.80872.7b
Radfarnia H.R., Iliuta M. // Ind. Eng. Chem. Res. 2012. V. 51. № 31. P. 10 390.
Zhang X., Wang Q., Zhang J., Wang J., Guo M., Chen S., Li C., Hu C., Xie Y. // RSC Advances. 2015. V. 5. № 109. P. 89 976.
Cao J.-L., Wang Y., Zhang T.-Y., Wu S.-H., Yuan Z.-Y. // Appl. Catal. B. 2008. V. 78. № 1. P. 120.
Institute of Petroleum (Great Britain), I. IP Standards for Petroleum and Its Products: Methods for Analysis and Testing. 1985. V. 1. P.126−132.
Amin J.S., Nikooee E., Ghatee M.H., Ayatollahi S., Alamdari A., Sedghamiz T. // Appl. Surf. Sci. 2011. V. 257. № 20. P. 8341. https://doi.org/10.1016/j.apsusc.2011.03.123
Calemma V., Iwanski P., Nali M., Scotti R., Montanari L. // Energy Fuels. 1995. V. 9. № 2. P. 225.
Modrogan E., Valkenberg M.H., Hoelderich W.F. // J. Catal. 2009. V. 261. № 2. P. 177. https://doi.org/10.1016/j.jcat.2008.11.019
Glazneva T.S., Kotsarenko N.S., Paukshtis E.A. // Kinetics and Catalysis. 2008. V. 49. № 6. P. 859. https://doi.org/10.1134/S0023158408060104
Yudin I.K., Nikolaenko G.L., Gorodetskii E.E., Kosov V.I., Melikyan V.R., Markhashov E.L., Frot D., Briolant Y. // J. Pet. Sci. Eng. 1998. V. 20. № 3–4. P. 297. https://doi.org/10.1016/S0920-4105(98)00033-3
Dudášová D., Simon S., Hemmingsen P.V., Sjöblom J. // Colloids Surf. A. 2008. V. 317. № 1–3. P. 1. https://doi.org/10.1016/j.colsurfa.2007.09.023
Дополнительные материалы отсутствуют.