Нефтехимия, 2020, T. 60, № 5, стр. 693-700
Гетерогенно-каталитическое получение зингерона и дегидрозингерона
П. А. Чистякова 1, *, А. В. Чистяков 1, М. В. Цодиков 1
1 Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Россия
* E-mail: polina.zharova@mail.ru
Поступила в редакцию 26.03.2020
После доработки 05.05.2020
Принята к публикации 12.05.2020
Аннотация
В настоящей работе представлены результаты по одностадийному гетерогенно-каталитическому синтезу зингерона и дегидрозингерона. Показана перспективность предлагаемого подхода, выявлены основные кинетические закономерности протекания реакций. Найдены оптимальные условия получения зингерона и дегидрозингерона, обеспечивающие выход целевых продуктов 45.8 и 76.2% соответственно.
Зингерон и дегидрозингерон – биологически активные вещества, входящие в состав корня имбиря [1]. Находят широкое применение в пищевой и фармацевтической промышленности: в пищевой промышленности они используются в качестве ароматизаторов и консервантов [2]; в фармацевтической: дегидрозингерон – активный компонент противосудорожных препаратов, антиоксидант и антимутагенный агент [3], зингерон – антиоксидант, противовоспалительное средство, проявляет активность в подавлении энтеротоксинов (Escherichia coli), вызывающих диарею [4, 5] (этот тип диареи – основная причина детской смертности в развивающихся странах [6]).
Впервые зингерон и дегидрозингерон были выделены из корня имбиря в 1917 г. японским химиком Хироши Номурой [7]. Он же разработал синтетический метод синтеза зингерона гидрированием дегидрозингерона, получаемого путем конденсации ацетона и ванилина в присутствии щелочей (схема 1 ).
Схема 1 . Двухстадийный синтез зингерона.
Зингерон до сих пор [8] производится по двухстадийному способу, предложенному Номурой, что значительно увеличивает количество отходов и стоимость производства [9]. В настоящее время предпринимаются попытки поиска эффективных гетерогенных катализаторов для получения дегидрозингерона путем конденсации ацетона с ванилином. Одним из перспективных катализаторов процесса является гидротальцит, в присутствии которого за 4 ч реакции достигается выход дегидрозингерона 88% [3].
Ранее нами была обнаружена возможность проведения гетерогенно-каталитической кросс-конденсации первичных спиртов со вторичными [10]. Данный подход может быть использован для одностадийного получения зингерона из ванилина и изопропанола. Проведение синтеза в одну стадию в присутствии нанесенных катализаторов позволит исключить стадию гидрирования, а также отказаться от щелочи при проведении первой стадии конденсации ванилина с ацетоном.
Настоящая работа посвящена разработке гетерогоненно-каталитических методов получения ценных биологически активных веществ путем алкилирования ванилина ацетоном или изопропанолом. В настоящей работе представлены результаты по одностадийному гетерогенно-каталитическому синтезу зингерона и дегидрозингерона. Показана перспективность предлагаемого подхода, выявлены основные кинетические закономерности протекания реакций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Каталитические тесты по кросс-конденсации ванилина c ацетоном и изопропанолом в присутствии синтезированных систем были проведены на мультиреакторной автоклавной установке Parr 5000 series. Время эксперимента в стационарном режиме составляло 5 ч, перемешивание осуществлялось магнитной мешалкой со скоростью 1000 об./мин, газ в объеме автоклава – аргон с начальным давлением 1 атм. Ацетон и изопропанол брали в 15-кратном мольном избытке к ванилину.
Моно- и биметаллические катализаторы Cu/Al2O3, Ni/Al2O3, Ni–Cu/Al2O3, Fe–Cu/Al2O3, Co–Cu/Al2O3, с содержанием металлов 1 мас. % готовили методом пропитки по влагоемкости из растворов соответствующих нитратов (х. ч.), в качестве носителя использовали γ-Al2O3 (АО “Ангарский завод катализаторов и органического синтеза”, 160 м2/г, гранулы 0.5 мм). Полученные образцы сушили в вакууме при 80°С в течение 5 ч, после чего прокаливали в муфельной печи в течение 5 ч при 500°С в атмосфере аргона.
Качественный состав жидких органических продуктов определяли методом хромато-масс-спектрометрии на приборах “Agelent MSD 6973” (колонка HP-5MS) и “DelsiNermag Automass-150” (колонка CPSil-5) с EI равной 70 эВ. Количественное содержание жидких органических веществ определяли методом газо-жидкостной хроматографии на приборе “Varian 3600” (колонка Хромтэк SE-30, 0.25 × 250 см, Df = 0.3 мм, 50°С (5 мин), 10 град/мин, 280°С, Тинж = 250°С, Ринж = 1 бар, деление потока 1/200, ПИД).
Исследование кислотных свойств катализатора проводили методом температурно-программированной десорбции (ТПД) аммиака, используемого в качестве молекулы-зонда на анализаторе хемосорбции газов типа УСГА. Фракцию катализатора 0.25–0.5 мм массой ~0.1 г (навеску брали с точностью до 5 × 10–4 г) помещали в кварцевый реактор на слой кварца фракции 1–0.5 мм. Образец нагревали в токе гелия до температуры 500°С со скоростью 15 град/мин и прокаливали при этой температуре в течение 1 ч в токе гелия, после чего охлаждали до температуры 60°С. Далее насыщали образец аммиаком в течение 20 мин в токе осушенного аммиака, разбавленного азотом. Физически адсорбированный аммиак удаляли при 100°С в токе сухого гелия в течение 1 ч. После этого образец резко охлаждали в токе сухого гелия (30 мл/мин) до температуры 60°С. Условия анализа: подъем температуры со скоростью 8°С/мин до 600°С в токе гелия 30 мл/мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе изучены закономерности протекания двух реакций: конденсация ванилина и ацетона (схема 2 , реакция (1)) и ванилина и изопропанола (схема 2 , реакция (2)). В качестве катализаторов были выбраны моно- и биметаллические системы на основе γ-Al2O3 с нанесенными медными частицами и металлами триады железа, которые ранее зарекомендовали себя высоко активными и селективными в реакциях конденсации кислород содержащих соединений [11–13].
Схема 2 . Реакции конденсации ванилина с ацетоном с получением дегидрозингерона (1) и с изопропанолом с получением зингерона (2).
На рис. 1 представлены зависимости конверсии ванилина при фиксированной температуре (180°С) от природы нанесенных металлов. Из данных, представленных на рисунке, видно, что наиболее активными металлами являются медь и никель, обеспечивающие максимальное превращение ванилина. Катализаторы на основе железа и кобальта проявляют значительно меньшую активность в реакциях получения дегидрозингерона и зингерона, поэтому для дальнейших исследований были выбраны Ni/Al2O3- и Сu/Al2O3-катализаторы.
Рис. 1.
Конверсия ванилина в изучаемых реакциях в присутствии монометаллических катализаторов при температуре 180°С и времени контакта 3 ч.

Температурные зависимости выходов дегидрозингерона и зингерона, достигнутые в ходе конденсации ванилина с изопропанолом и ванилина с ацетоном, соответственно, представлены в табл. 1.
Найдено, что оптимальной температурой получения дегидрозингерона является 180°С, что обеспечивает его максимальный выход в присутствии изучаемых катализаторов. Выход дегидрозингерона в присутствии Ni/Al2O3 катализатора более чем на 10% превышает выход (при 180°С), достигаемый в присутствии катализатора Cu/Al2O3, что демонстрирует большую активность никель содержащей системы. Однако, в синтезе зингерона наблюдается обратная картина – в присутствии катализатора Cu/Al2O3 выход целевого продукта более чем на 10% превышает его выход, получаемый в присутствии Ni/Al2O3-катализатора (при 245°С).
Важно отметить, что при температуре 180°С выход зингерона на 40–50% меньше, чем выход дегидрозингерона, что вероятно, свидетельствует о различных лимитирующих стадиях реакций. При увеличении температуры до 245°С выход дегидрозингерона резко снижается ввиду интенсивного образования смолистых нелетучих соединений, вероятно являющихся продуктами поликонденсации ванилина и ацетона (схема 3 ).
Схема 3 . Путь возможной поликонденсации дегидрозингерона.
В присутствии Cu/Al2O3-катализатора увеличение температуры до 245°C приводит к увеличению на 10% выхода зингерона, получаемого из ванилина и изопропанола. В присутствии Ni/Al2O3-катализатора увеличение температуры незначительно увеличивает выход зингерона и при этом в продуктах реакции возрастает доля смолистых нелетучих соединений.
Таким образом, наиболее активным катализатором среди исследованных в синтезе дегидрозингерона оказался Ni/Al2O3-катализатор, обеспечивающий при температуре 180°С выход целевого продукта, превышающий 87%. Для синтеза зингерона из ванилина и изопропанола наиболее перспективным оказался катализатор Cu/Al2O3, в присутствии которого при 245°С достигнут максимальный выход зингерона, равный 45.8% (табл. 1).
Таблица 1.
Зависимость выхода дегидрозингерона и зингерона от температуры при катализе системами 1 мас. % Cu/Al2O3 и 1 мас. % Ni/Al2O3.
| Катализатор | Cu/Al2O3 | Ni/Al2O3 | Cu/Al2O3 | Ni/Al2O3 |
|---|---|---|---|---|
| температура, °С | выход дегидрозингерона, %* | выход зингерона, %** | ||
| 130 | 16.0 | 18.1 | 4.2 | 1.5 |
| 180 | 76.2 | 87.5 | 36.3 | 31.6 |
| 245 | 20.4 | 17.3 | 45.8 | 35.2 |
Принимая во внимание то, что в работе используются нанесенные катализаторы, были проведены каталитические тесты по определению каталитической активности носителя – γ-Al2O3 (табл. 2). Из данных, приведенных в табл. 2, видно, что оксид алюминия проявляет активность в превращении ацетона и ванилина в дегидрозингерон, при этом практически не проявляя активности в превращении изопропанола и ванилина в зингерон. Выход дегидрозингерона в присутствии оксида алюминия более низкий по сравнению с его выходом в присутствии металлсодержащих катализаторов. В то же время изменение выхода дегидрозингерона в присутствии Al2O3 имеет симбатную зависимость, которая представлена в табл. 1 для нанесенных катализаторов. Это позволяет предположить, что ключевым фактором в конденсации ацетона и ванилина является кислотность поверхности катализатора, при этом для синтеза зингерона конденсация не является лимитирующей стадией. Необходимо отметить, что согласно схеме 2 одной из начальных стадий получения зингерона является дегидрирование изопропанола в ацетон, которое вероятно затруднено в присутствии оксида алюминия без металлических компонентов. Кроме того, основным маршрутом превращения изопропанола в присутствии немодифицированного оксида алюминия является его дегидратация в пропилен и диизопропиловый эфир. С другой стороны, низкая активность оксида алюминия в синтезе зингерона может быть следствием конкурирующей хемосорбции изопропанола и ванилина.
Таблица 2.
Выход дегидрозингерона и зингерона в присутствии каталитического носителя Al2O3 при времени опыта 3 ч
| Температура, °С | Выход дегидрозингерона, % | Выход зингерона, % |
|---|---|---|
| 130 | 4.9 | 0.0 |
| 180 | 33.3 | 0.0 |
| 245 | 13.6 | 0.1 |
Известно, что немаловажным фактором, оказывающим влияние на протекание химических реакций, является кислотность катализатора [14–16]. С целью проверки влияния кислотно-основных свойств носителя на параметры изучаемых реакций, были проведены каталитические тесты по синтезу зингерона и дегидрозингерона в присутствии катализаторов на основе сибунита и оксида кремния (табл. 3).
Таблица 3.
Выход дегидрозингерона и зингерона в присутствии катализаторов на основе различных носителей
| Температура | 180°С | Температура | 245°С |
|---|---|---|---|
| катализатор | выход дегидрозингерона, % | катализатор | выход зингерона, % |
| Ni/Al2O3 | 87.5 | Cu/Al2O3 | 45.8 |
| Ni/SiO2 | 13.7 | Cu/SiO2 | 9.4 |
| Ni/C | 0.4 | Cu/C | 0.1 |
Обнаружено, что в присутствии катализатора на основе оксида кремния наблюдается резкое снижение выхода зингерона и дегидрозингерона, по сравнению c Ni/Al2O3-атализатором, а в присутствии катализатора на основе сибунита каталитическая активность практически отсутствует. Учитывая фактор поверхности, в настоящей работе мы протестировали каталитические носители со значениями удельной поверхности близкой (для SiO2 – 250–300 м2/г) либо превосходящих (для сибунита – 380–430 м2/г) поверхность оксида алюминия (180–230 м2/г). Таким образом, уменьшение каталитической активности в ряду Cu/Al2O3 > Cu/SiO2 > Cu/C вероятнее всего, связано с изменением кислотности поверхности.
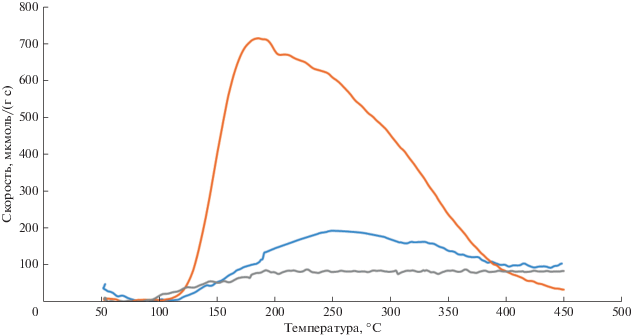
С целью выяснения кислотных свойств изучаемых катализаторов, были проведены исследования по ТПД аммиака, результаты которых представлены на рис. 2. Из данных рис. 2 видно, что поверхность оксида алюминия способна адсорбировать гораздо большее количество молекул-зондов аммиака, чем другие носители, что свидетельствует о наличии большего количества кислотных центров на ее поверхности. Катализатор на основе сибунита практически не обладает способностью к адсорбции аммиака. Таким образом, предложенная выше зависимость активности катализатора в реакции конденсации ацетона с ванилином в дегидрозингерон от кислотности катализатора находит полное подтверждение в проведенных исследованиях.
Рис. 2.
Зависимость скорости десорбции аммиака от температуры для оксида алюминия, оксида кремния и сибунита.
Следующим этапом работы стало изучение закономерностей получения зингерона и дегидрозингерона в присутствии биметаллических катализаторов. Использование биметаллических катализаторов является потенциально перспективным направлением катализа, т.к. существует вероятность проявления различными парами металлов синергетического эффекта, заключающегося в резком увеличении их каталитической активности и/или селективности в химических реакциях [17].
Результаты каталитических экспериментов показали, что введение железа или кобальта к Cu/Al2O3-системе приводит к уменьшению каталитической активности в получении как дегидрозингерона, так и зингерона (рис. 3). Использование биметаллической системы Ni−Cu/Al2O3 с различным соотношением активных компонентов для конденсации ванилина с ацетоном не приводит к видимым изменениям активности, более того, монометаллический никелевый катализатор проявляет очень близкую активность. Таким образом, вероятно, ключевым фактором в синтезе дегидрозингерона из ванилина и ацетона является кислотность носителя катализатора. Нанесение частиц никеля путем пропитки оксида алюминия нитратом никеля с последующей прокалкой, может приводить к образованию поверхностных частиц смешанного оксида NixAl2xO4, что, в свою очередь, может создавать благоприятный регион кислотности для протекания реакции конденсации. Следует отметить, что кривые ТПД аммиака “чистого” оксида алюминия и с нанесенными частицами никеля практически идентичны, что делает дальнейший анализ данным методом затруднительным.
Рис. 3.
Выход дегидрозингерона (при 180°С) и зингерона (при 245°С) в присутствии биметаллических катализаторов при времени опыта 3 ч.

При использовании биметаллических систем для синтеза зингерона было обнаружено, что максимальный выход целевого продукта достигается в присутствии системы Cu−Ni/Al2O3 с мольным соотношением компонентов 1 : 1 (рис. 3). В литературе известно большое количество примеров образования сплавов меди и никеля на поверхности пористых носителей [18–20]. Основным фактором, влияющим на каталитические свойства сплавов, как правило, является электронный фактор, т.е. изменение энергии d-зоны сплава по сравнению с индивидуальными металлами [21].
Полученные результаты показывают, что кислотность катализатора является основным фактором в реакции конденсации ацетона с ванилином, а при конденсации изопропанола с ванилином – гидрирующая−дегидрирующая активность нанесенных активных компонентов. Для подтверждения этого заключения был проведен кинетический анализ реакций с целью определения кажущихся энергий активации и их сопоставления.
На рис. 4 представлены кинетические кривые конверсии ванилина в ходе его взаимодействия с изопропанолом в присутствии катализатора Ni–Cu/Al2O3 (начальная концентрация ванилина 0.1 моль/л, молекулярный избыток изопропанола 13). На рис. 5 представлены кинетические кривые конверсии ванилина в ходе его взаимодействия с ацетоном в присутствии катализатора Ni–Cu/Al2O3 (начальная концентрация ванилина 0.1 моль/л, молекулярный избыток ацетона 13).
Рис. 4.
Кинетические кривые конверсии ванилина в ходе его взаимодействия с изопропанолом в присутствии Ni–Cu/Al2O3-катализатора (начальная концентрация ванилина 0.1 моль/л, молекулярный избыток изопропанола 13).
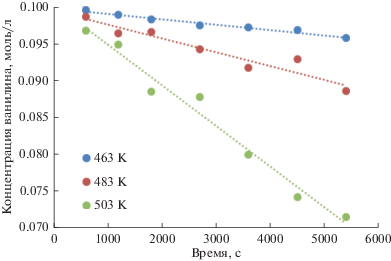
Рис. 5.
Кинетические кривые конверсии ванилина в ходе его взаимодействия с ацетоном в присутствии катализатора Ni–Cu/Al2O3 (начальная концентрация ванилина 0.1 моль/л, молекулярный избыток ацетона 13).

Расчет полученных кинетических кривых показал, что для конденсации ванилина с изопропанолом наблюдается псевдонулевой порядок по ванилину, а для конденсации ванилина с ацетоном – псевдопервый порядок реакции по ванилину. Полученные данные позволяют предположить, что в случае конденсации ванилина с ацетоном происходит хемосорбция ванилина и, вероятно, ацетона поверхностью катализатора, после чего происходит их химическое взаимодействие. При взаимодействии ванилина с изопропанолом псевдопервый порядок реакции по ванилину указывает, что вероятной лимитирующей стадией может являться дегидрирование изопропанола на поверхности катализатора.
Была вычислена энергия активации и предэкспоненциальный множитель для изучаемых реакций. Для получения дегидрозингерона значение кажущейся энергии активации составило 80.3 кДж/моль, значение предэкспоненциального множителя – 1.3 × 106. Для получения зингерона значение кажущейся энергии активации составило 92.4 кДж/моль, значение предэкспоненциального множителя – 7.8 × 107. Полученные значения энергии активации также указывают на высокую вероятность различных лимитирующих стадий при алкилировании ванилина ацетоном или изопропанолом.
ЗАКЛЮЧЕНИЕ
Проведенные исследования показали возможность осуществления гетерогенно-каталитических реакций алкилирования ванилина изопропанолом и ацетоном с получением ценных биологически активных веществ – зингерона и дегидрозингерона, входящими в состав корня имбиря. Продемонстрирован высокий потенциал никель-медных катализаторов в одностадийном синтезе зингерона из ванилина и изопропанола, без использования щелочей и растворителей. Обнаружено, что при конденсации ванилина с ацетоном главным фактором, оказывающим влияние на активность катализатора, является его кислотность, а при конденсации ванилина с изопропанолом основополагающую роль играет гидрирующая−дегидрирующая активность медьсодержащих активных компонентов. Кинетические исследования позволили определить порядок изучаемых реакций по ванилину и определить кажущиеся энергии активации. Для конденсации ванилина с ацетоном значение кажущейся энергии активации составило 80.3 кДж/моль, для конденсации ванилина с изопропанолом значение кажущейся энергии активации составило 92.4 кДж/моль. Повышение значения кажущейся энергии активации для конденсации ванилина с изопропанолом, вероятно, связано со сменой лимитирующей стадии, характеризующейся более высоким значением активационного барьера протекания реакции.
Список литературы
Mashhadi N.S., Ghiasvand R., Askari G., Hariri M., Darvishi L., Mofid M.R. // Int. J. Prev. Med. 2013. V. 4. № 1. P. 36.
Svetaz L.A., Di Liberto M.G., Zanardi M.M., Suárez A. G., Zacchino S.A. // Int. J. of Mol. Sci. 2014. V. 15. № 12. P. 22 042.
Bhanawase S.L, Yadav G.D. // Curr. Catalysis. 2017. V. 6. № 2. P. 105.
Shin S.G., Kim J.Y., Chung H.Y., Jeong J.C. // J. Agricul. and Food Chemistry. 2005. V. 53. № 19. P. 7617.
Mani V., Arivalagan S., Siddique A.I., Namasivayam N. // Mol. and Cellular Biochemistry. 2016. V. 421. № 1–2. P. 169.
Chen J.C., Huang L.J., Wu S.L., Kuo S.C., Ho T.Y., Hsiang C.Y. // J. Agricul. and Food Chemistry. 2007. V. 55. № 21. P. 8390.
Nomura H. LXIV. // J. Chem. Soc. Transactions. 1917. V. 111. P. 769.
Van der Schaft P. // Flavour Development, Analysis and Perception in Food and Beverages. Woodhead Publishing, 2015. P. 235.
Wang Z., Yin G., Qin J., Gao M., Cao L., Wu A. // Synthesis. 2008. V. 2008. № 22. P. 3675.
Chistyakov A.V., Zharova P.A., Nikolaev S.A., Tsodikov M.V. // Catal. Today. 2017. P. 124.
Chistyakov A.V., Nikolaev S.A., Zharova P.A., Tsodikov M.V., Manenti F. // Energy. 2019. V. 166. P. 569.
Zharova P.A., Chistyakov A.V., Tsodikov M.V., Nikolaev S.A., Rossi F., Manenti F. // Chem. Engineering Transactions. 2017. V. 57. P. 31.
Zharova P.A., Chistyakov A.V., Tsodikov M.V., Nikolaev S.A., Corbetta M., Manenti F. // Chem. Engineering Transactions. 2016. V. 50. P. 295.
Iliopoulou E.F., Antonakou E.V., Karakoulia S.A., Vasalos I.A., Lappas A.A., Triantafyllidis K.S. // Chem. Engineering J. 2007. V. 134. № 1–3. P. 51.
Kumar R., Sithambaram S., Suib S.L. // J. of Catalysis. 2009. V. 262. № 2. P. 304.
Benesi H.A., Winquist B.H.C. Surface Acidity of Solid Catalysts. Academic Press, 1978.
Эллерт О.Г., Цодиков М.В., Николаев С.А., Новоторцев В.М. // Успехи химии. 2014. Т. 83. С. 718.
Robertson S.D., McNicol B.D., De Baas J.H., Kloet S.C., Jenkins J.W. // J. of Catalysis. 1975. V. 37. № 3. P. 424.
Singh A.K., Xu Q. // ChemCatChem. 2013. V. 5. № 3. P. 652.
Sinfelt J.H. // Accounts of Chem. Research. 1977. V. 10. №. 1. P. 15.
Чоркендорф И., Наймантсведрайт Х. Современный катализ и химическая кинетика. Учебное пособие. Долгопрудный: Интеллект, 2013. 56 с.
Дополнительные материалы отсутствуют.