Нейрохимия, 2019, T. 36, № 2, стр. 170-176
Экспрессия фактора роста эндотелия сосудов в мозге крыс после перинатальной гипоксии и при фармакологической коррекции
В. И. Миронова 1, В. К. Акулова 1, Л. И. Хожай 1, А. В. Притворова 1, Н. Э. Ордян 1, В. А. Отеллин 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
Поступила в редакцию 07.06.2018
После доработки 20.07.2018
Принята к публикации 08.08.2018
Аннотация
В работе изучали роль фактора роста эндотелия сосудов (VEGF) в постгипоксическом повреждении мозга крыс и при фармакологической коррекции препаратом салифеном – производным ГАМК, рассматриваемым как потенциальный нейропротектор. Для этого методом количественной иммуногистохимии оценивали экспрессию VEGF в мозге (неокортексе и гиппокампе) крыс в ранние и отставленные сроки после перинатальной гипоксии и последующего введения салифена. Показано, что гипоксия увеличивает экспрессию фактора роста эндотелия сосудов в развивающемся мозге крыс, а инъекции салифена препятствуют повышению экспрессии VEGF, оставляя этот показатель на уровне контрольных значений. Таким образом, изменения экспрессии фактора роста эндотелия сосудов (VEGF) в мозге крыс после перинатальной гипоксии можно рассматривать как маркер нейропротективного эффекта салифена.
Современные экспериментальные онтогенетические исследования и клиническая неонатология уделяют существенное внимание периоду ранней новорожденности. В процессе родов и в первые дни после рождения крайне уязвимый организм новорожденных адаптируется к воздействию новых для него факторов среды, которые в значительной мере опосредуются гипоксически-ишемическими влияниями на все органы и их системы, и в первую очередь, на нервную систему. Гипоксия-ишемия плода и новорожденного является одной из основных причин возникновения патологии головного мозга, в частности, задержки моторного, психического, речевого развития, расстройства внимания, эмоций, сна [1, 2]. При этом наиболее тяжелые неврологические нарушения выявляются у недоношенных детей. Для расшифровки механизмов повреждающего воздействия гипоксии на развивающийся мозг и последующего поиска методов коррекции постгипоксических повреждений мозга у новорожденных необходимы фундаментальные исследования с применением моделей на лабораторных животных. В лаборатории онтогенеза нервной системы под руководством чл.-корр., проф. В.А. Отеллина была разработана экспериментальная модель одного из последствий перинатальной гипоксии – энцефалопатии новорожденных с учетом особенностей недоношенных детей. В этой модели было показано, что острая гипоксия у новорожденных крысят приводит к нарушению процессов становления структур головного мозга, поведенческих реакций и обучения в последующем онтогенезе, а также к повреждению микроциркуляторного русла головного мозга и гематоэнцефалического барьера [3–6]. Выявленные постгипоксические морфофункциональные нарушения мозга в период ранней новорожденности поддавались фармакологической коррекции отечественным препаратом салифеном, представляющим производное γ-амино-β-фенилмаслянной и салициловой кислот. Салифен рассматривается как перспективный нейропротектор, проявляет антигипоксический и эндотелиопротективный эффекты [5, 7, 8].
Известно, что фактор роста эндотелия сосудов (VEGF) активно участвует в ангиогенезе, в становлении и регуляции проницаемости внутримозговых капилляров – процессах, чрезвычайно важных для нормального развития мозга в пренатальном и раннем постнатальном периодах развития [9, 10]. Новейшие исследования фактора VEGF выявили также важную роль этого белка в нейрогенезе и нейропротекции в развивающемся мозге [11–14]. VEGF рассматривается также как нейротрофический фактор [15]. В свете новых представлений о функциях этого белка возникает вопрос о его участии в механизмах фармакологической коррекции последствий перинатальной гипоксии в мозге.
Настоящее исследование было предпринято для выяснения роли VEGF в постгипоксическом повреждении мозга и нейропротекции. Целью исследования было изучение экспрессии VEGF в структурах мозга (неокортексе и гиппокампе) крыс после перинатальной гипоксии и последующего введения салифена в ранние и отдаленные сроки после гипоксического воздействия.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на новорожденных крысах линии Вистар из коллекции Института физиологии им. И.П. Павлова РАН, содержащихся в пометах с матерями в стандартных условиях вивария без ограничения в доступе к воде и пище. При проведении экспериментов соблюдались требования, сформулированные в Директивах Совета Европейского сообщества (86/609/ЕЕС) об использовании лабораторных животных. Протоколы опытов были утверждены Комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН.
Непосредственно после рождения число крысят в помете выравнивали. Далее в возрасте 2-го постнатального дня жизни крысята были разбиты на 3 группы (по 5–6 крысят): 1) животные, подвергавшиеся в барокамере воздействию гипоксии и введениям салифена, подкожные инъекции которого начинали через сутки после воздействия гипоксии в дозе 15 мг/кг в течение 14 дней; 2) крысята, подвергавшиеся аналогичному гипоксическому воздействию и введению физиологического раствора в те же сроки, что и введение салифена; 3) контрольная группа крысят, которых помещали в барокамеру без гипоксического воздействия, а через сутки водили физиологический раствор в течение 14 дней. Эксперименты выполняли на самцах. Субстанция салифена любезно предоставлена чл.-корр. РАН И.Н. Тюренковым (Волгоградский государственный медицинский университет, г. Волгоград).
Воздействие гипоксии на новорожденных крысят осуществляли в течение 1 часа в барокамере, куда подавалась дыхательная смесь, содержащая 7.6–7.8% кислорода, 0.15–0.21% углекислого газа и 91.8% азота при температуре 21.3–23°С и нормальном общем атмосферном давлении. Для иммуноцитохимического анализа материала животных каждой группы декапитировали на 5‑й, 10-й и 20-й постнатальные дни. У крысят извлекали мозг, фиксировали его в 4% параформальдегиде в течение 48 ч при 4°С и после стандартной обработки (промывка, обезвоживание, проведение через порции ксилола) заливали в парафин. Изготавливали серии срезов мозга во фронтальной плоскости толщиной 6 мкм (Bregma 1.20–1.60 мм; Bregma –2.64…–2.92 мм) [16]. После стандартных процедур депарафинизации, регидратации и демаскировки антигена срезы инкубировали в течение 12 ч с первичными поликлональными кроличьими антителами к фактору роста эндотелия сосудов (Cloud-Clone Corp., США; 1 : 200) при температуре 4°С. Реакцию визуализировали авидин-биотиновым методом с применением диаминобензидина. Количественную оценку иммунореактивности производили с использованием системы анализа изображения, включающей световой микроскоп Olympus CX31 (Япония), цветную цифровую камеру VideoZavr Standard VZ-C31Sr и программное обеспечение Видеозавр Мультиметр 2.3 (разработка ООО “АТМ-практика”, Санкт-Петербург). Оценивали среднюю оптическую плотность окраски в иммунопозитивных нейронах коры головного мозга и гиппокампа. Подсчет производился на 4–5 срезах от каждого животного, анализировали одинаковое количество клеток для каждой исследуемой области мозга (коры и полей гиппокампа СА1, СА3, СА4, зубчатой извилины), затем подсчитывали средние значения оптической плотности в каждой группе животных. Статистическую обработку результатов проводили с использованием двухфакторного дисперсионного анализа (two-way ANOVA, пакет программ SPSS 9.0) с последующей оценкой межгрупповых различий с помощью post-hoc теста Тьюки. Различия между выборками считали статистически значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате иммуногистохимического исследования экспрессии фактора роста эндотелия сосудов (VEGF) в неокортексе крысят на 5-й, 10-й и 20-й постнатальные дни был выявлен различный паттерн распределения VEGF-иммунопозититвных нейронов в ходе онтогенеза, а также при воздействии гипоксии. Двухфакторный дисперсионный анализ данных иммуногистохимии выявил значимое влияние фактора времени (постнатальный день) на экспрессию VEGF для верхних слоев неокортекса [F8.44 = 15.95, р = 0.0002] и факторов времени [F8.44 = 98.8, р < 0.000000] и воздействия гипоксии [F8.44 = 6.03, р = 0.001] – для глубоких слоев коры. На ранних стадиях онтогенеза (5–10-й постнатальные дни) экспрессия фактора локализована преимущественно в нейронах верхних слоев коры (рис. 1а). На 10-й постнатальный день интенсивность окраски в VEGF-иммунопозитивных нейронах верхних слоев коры больше (значимая разница по средней оптической плотности, р = 0.013), чем на 5-й день, а на 20-й день наоборот уменьшается (р = 0.037) (рис. 1а). В более поздние сроки (20-й постнатальный день) интенсивность экспрессии фактора в VEGF-иммунопозитивных нейронах увеличивается в глубоких слоях коры (р = 0.0002) (рис. 1в). Анализ данных не выявил влияния перинатальной гипоксии на экспрессию VEGF в верхних слоях неокортекса, однако последующие post-hoc сравнения показали наличие значимых различий между контрольными животными и подвергавшимися гипоксическому воздействию. Гипоксия значимо увеличивает интенсивность экспрессии VEGF: в верхних слоях коры (II–IV слои) этот эффект более выражен на ранних стадиях онтогенеза (р = 0.009), тогда как в глубоких слоях коры (VI слой) эффект выражен на всех исследованных стадиях (5–20-й постнатальные дни, р < 0.01) (рис. 1а–в, рис. 2, рис. 3б). Введение салифена препятствовало повышению экспрессии VEGF в коре головного мозга крысят на всех исследованных сроках, и таким образом приводило этот показатель к уровню контрольных групп (рис. 1а–в, рис. 3в). Наиболее четко этот эффект наблюдался в глубоких слоях неокортекса.
Рис. 1.
Содержание фактора роста эндотелия сосудов (VEGF) в неокортексе крыс на 5-й, 10-й и 20-й постнатальные дни (пд) после перинатальной гипоксии и при фармакологической коррекции салифеном. а – II–IV слои неокортекса; б – V слой неокортекса; в – VI слой неокортекса. По оси абсцисс – постнатальные дни; по оси ординат – средняя оптическая плотность окраски в иммунопозитивных нейронах. Черные столбики – контрольные крысы; серые столбики – крысы, подвергавшиеся гипоксии; белые столбики – крысы, подвергавшиеся гипоксии и получавшие инъекции салифена. * Значимые различия между контрольными группами; # значимые различия между контрольными животными и подвергавшимися гипоксии; & значимые различия между контрольными животными и подвергавшимися гипоксии/получавшими инъекции салифена.
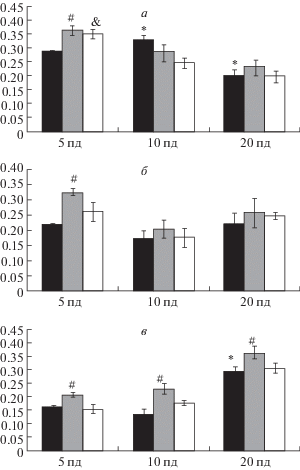
Рис. 2.
Содержание фактора роста эндотелия сосудов (VEGF) в гиппокампе крыс на 5-й, 10-й и 20-й постнатальные дни (пд) после перинатальной гипоксии и при фармакологической коррекции салифеном. а – область СА1; б – область СА3; в – область СА4; г – зубчатая извилина. Обозначения те же, что и на рис. 1.
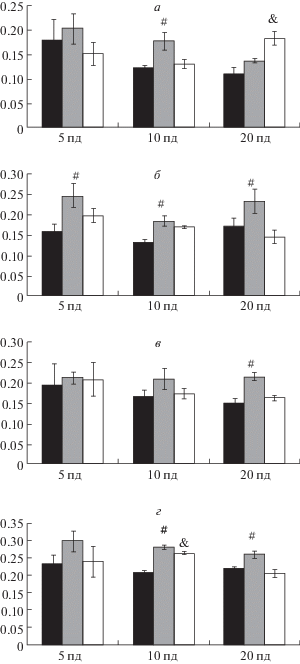
Рис. 3.
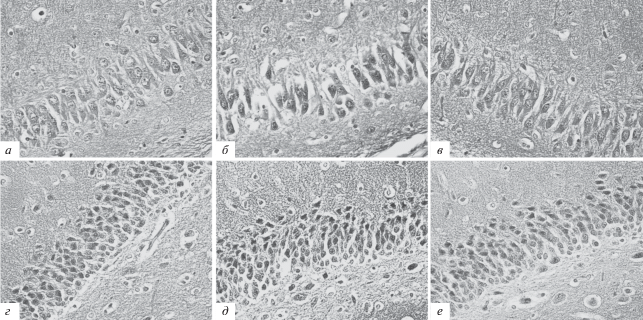
Микрофотографии, иллюстрирующие VEGF-иммунореактивность в неокортексе крыс после перинатальной гипоксии и последующих инъекций салифена на 5-й постнатальный день. а – контроль; б – гипоксия; в – гипоксия + + инъекции салифена. Увеличение: ок. 10×; об. 10×.

В гиппокампе паттерн экспрессии VEGF с 5‑го по 20-й постнатальные дни в норме, после гипоксического воздействия и введения салифена в целом повторял таковой в неокортексе: гипоксия увеличивала нейрональную экспрессию фактора, а салифен снижал этот показатель до уровня контрольных групп (с некоторой разницей по областям гиппокампа) (рис. 2а–г). Двухфакторный дисперсионный анализ данных иммуногистохимии выявил значимый эффект воздействия перинатальной гипоксии на экспрессию фактора роста эндотелия сосудов в гиппокампе. Наиболее четко эффект был выражен в поле СА3 [F8.44 = = 5.67, р = 0.007] (рис. 2б, 4а–в) и зубчатой извилине [F8.44 = 3.28, р = 0.01] (рис. 2г, 4г–е).
Таким образом, гипоксия приводит к повышению нейрональной экспрессии VEGF в мозге ювенильных крыс, тогда как введение салифена нивелирует этот эффект.
Рис. 4.
Микрофотографии, иллюстрирующие VEGF-иммунореактивность в гиппокампе крыс после перинатальной гипоксии и последующих инъекций салифена. а–в – область СА3, 10-й постнатальный день. а – контроль; б – гипоксия; в – гипоксия + инъекции салифена. г–е – зубчатая извилина, 20-й постнатальный день. г – контроль; д – гипоксия; е – гипоксия + инъекции салифена. Увеличение: ок. 10×; об. 40×.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В современной литературе накоплено значительное количество данных, как клинических, так и экспериментальных, о воздействии перинатальной гипоксии на развивающийся мозг. Тяжесть отдаленных неврологических последствий перинатальной гипоксии варьирует от минимальных отклонений в неврологическом статусе до органического поражения ЦНС [1, 2, 17, 18]. Заболевания нервной системы в детском возрасте в настоящее время представляют существенную медицинскую и социальную проблему, поэтому проведение фундаментальных и клинических исследований, направленных на углубленное исследование механизмов постгипоксических энцефалопатий и разработку новых нейропротективных средств, является наиболее актуальной задачей неонатологии и нейробиологии. Один из таких потенциальных нейропротекторов – отечественный препарат салифен, представляющий производное γ-амино-β-фенилмаслянной и салициловой кислот. В модели плацентарной гипоксии салифен оказывал эндотелиопротективное, антигипоксическое, антиоксидантное действие [7, 19], а также оказывал положительное действие на состояние микроциркуляторного русла после перинатальной гипоксии [8]. Эти данные позволили предположить, что салифен может оказаться эффективным нейропротектором в разработанной нами модели энцефалопатий новорожденных [3]. Ранее в этой модели нами было показано, что введение салифена со второго постнатального дня крысятам после воздействия перинатальной гипоксии оказывало корректирующее действие на рефлекторную деятельность и поведение крыс [4]. Нейропротективный эффект салифена был продемонстрирован в отдаленный период онтогенеза (80–90-е сут). В частности, было показано, что препарат препятствовал повреждающему действию гипоксии на развивающийся мозг, оказывая протективное действие на нейроны, их дифференцировку и синаптогенез [20].
Данная работа посвящена изучению роли фактора роста эндотелия сосудов (VEGF) – белка, стимулирующего ангиогенез и известного своими нейропротективными свойствами, а потому крайне важного для нормального развития мозга, – в постгипоксическом повреждении мозга и при фармакологической коррекции салифеном в развивающемся мозге крыс. Фактор роста эндотелия сосудов (VEGF) – клеточный митоген, который обеспечивает процессы васкуляризации и ангиогенеза [21–23]. Существует тесная связь между процессами нейро- и ангиогенеза в развивающемся мозге. Обе системы, нервная и кровеносная, в процессе развития, роста и становления регулируются одними и теми же клеточными сигналами и взаимно влияют друг на друга. Недавние исследования показали, что одни и те же клеточные каскады регулируют клеточную дифференцировку и развитие обеих систем. Факторы, регулирующие аксональный рост, также регулируют и ангиогенез, и наоборот, молекулы, регулирующие процессы формирования и роста сосудов, обеспечивают нейрогенез и рост аксонов [24, 25]. Одним из таких факторов является VEGF [26]. Известно, что VEGF не только стимулирует ангиогенез, но и проявляет нейротрофический и нейропротективный эффекты, обеспечивает нейрогенез, регулирует синаптогенез и синаптическую пластичность у новорожденных и взрослых животных [12, 27–29]. Показана пространственно-временная динамика экспрессии фактора в развивающемся мозге крыс, а именно: на ранних постнатальных сроках VEGF преимущественно локализован в нейронах, тогда как в более поздние сроки – в нейронах и нейроглии [30]. При этом авторы продемонстрировали, что нейрональная экспрессия VEGF коррелирует с ангиогенезом в развивающемся мозге крыс в норме и при гипоксии. Так, гипоксия вызывает усиленный ангиогенез, что рассматривается как компенсаторная реакция на недостаток кислорода в нервной ткани для предотвращения повреждения нейронов, и повышает экспрессию VEGF, фактора нейропротекции и нейрогенеза [30, 31]. Таким образом,VEGF в современной науке рассматривается как фактор, стимулирующий ангиогенез и нейрогенез, и эти процессы тесно взаимосвязаны в эмбриональном и развивающемся мозге.
В настоящем исследовании мы показали, что перинатальная гипоксия увеличивает экспрессию фактора VEGF в нейронах коры и гиппокампа ювенильных крыс в различные периоды постнатального развития (с 5-го по 20-й постнатальные дни). Это вполне согласуется с данными литературы. Гипоксия активирует экспрессию гипоксия-индуцибельных транкрипционных факторов семейства HIF, в частности HIF-1α, который, в свою очередь, активирует транкрипцию гена фактора VEGF [31, 32]. Введение салифена препятствовало повышению экспрессии VEGF в коре головного мозга и гиппокампе крысят, и таким образом приводило этот показатель к уровню контрольных групп. Наиболее четко этот эффект наблюдался в глубоких слоях неокортекса, состоящих из более дифференцированных нейронов, чем верхние слои, и гиппокампе (поле СА3, зубчатая извилина). Следует также заметить, что различный паттерн распределения VEGF-иммунопозититвных нейронов по слоям неокортекса в ходе онтогенеза, вероятно, связан с процессами созревания и дифференцировки нейронов.
Показано, что такие повреждающие факторы, как например гипоксия, инъекции дексаметазона, вызывающие усиленную гибель нейронов, увеличивают экспрессию фактора VEGF в мозге в период ранней новорожденности [33, 34]. VEGF в данном случае играет нейротрофическую и нейропротективную роль. Согласно новейшим исследованиям, VEGF рассматривается как потенциальный нейропротектор для улучшения когнитивной функции при некоторых нейропатологиях [28, 29]. Поэтому очевидно, что увеличение нейрональной экспрессии VEGF после повреждающих воздействий является частью адаптивной эндогенной ответной реакции организма. В нашем эксперименте введение салифена после воздействия перинатальной гипоксии нормализовало уровень экспрессии фактора VEGF в неокротексе и гиппокампе с повышенного (после воздействия перинатальной гипоксии) до контрольного уровня, что, вероятно, свидетельствует о снижении до контрольных значений процессов нейродегенерации в развивающемся мозге после инъекций салифена. В совокупности с продемонстрированным ранее нейропротективным эффектом препарата в отдаленный период онтогенеза [20], данные результаты можно расценивать как свидетельство нейропротективного эффекта салифена в модели энцефалопатии новорожденных, а изменения экспрессии в мозге фактора роста эндотелия сосудов VEGF можно рассматривать как маркер нейропротективного эффекта препарата.
Таким образом, в модели энцефалопатии новорожденных показано, что гипоксия увеличивает экспрессию фактора роста эндотелия сосудов VEGF в развивающемся мозге крыс (неокортексе и гиппокампе), а инъекции производного ГАМК салифена снижают экспрессию VEGF до уровня контрольных значений. Можно сделать заключение о том, что колебание уровня нейрональной экспрессии фактора роста эндотелия сосудов VEGF в развивающемся мозге крыс при фармакологической коррекции последствий перинатальной гипоксии является показателем нейропротективного эффекта салифена, а значит успешности данного терапевтического воздействия.
Список литературы
Игнатьева Р.К. // Перинатальные проблемы в России: мифы и реальность. Союз педиатров России. М., 2006. 112 с.
Пальчик А.Б., Шабалов Н.П. // Гипоксически-ишемическая энцефалопатия новорожденных. М.: МЕДпресс-информ, 2006. 256 с.
Отеллин В.А., Хожай Л.И., Ватаева Л.А. // Журн. эволюц. биохимии и физиологии. 2012. Т. 48. № 5. С. 467–473.
Ордян Н.Э., Акулова В.К., Миронова В.И., Отеллин В.А. // Бюлл. эксперим. биологии и медицины. 2017. Т. 164. № 8. С. 140–144.
Отеллин В.А., Хожай Л.И., Шишко Т.Т., Тюренков И.Н. // Журн. эволюц. биохимии и физиологии. 2017. Т. 53. № 1. С. 49–54.
Отеллин В.А., Хожай Л.И., Шишко Т.Т. // Журн. эволюц. биохимии и физиологии. 2015. Т. 51. № 5. С. 377–382.
Тюренков И.Н., Воронков А.В., Слиецанс А.А., Волотова Е.В. // Вестник РАМН. 2012. № 7. С. 50–57.
Отеллин В.А., Хожай Л.И., Тюренков И.Н. // Морфология. 2015. Т. 148. № 6. С. 34–37.
Breier G., Albrecht U., Sterrer S., Risau W. // Development. 1992. V. 114. № 2. P. 521–532.
Jakeman L.B., Armanini M., Phillips H.S., Ferrara N. // Endocrinology. 1993. V. 133. № 2. P. 848–859.
Cao L., Jiao X., Zuzga D.S., Liu Y., Fong D.M., Young D., During M.J. // Nat. Genet. 2004. V. 36. № 8. P. 827–835.
Calvo C.F., Fontaine R.H., Soueid J., Tammela T., Makinen T., Alfaro-Cervello C., Bonnaud F., Miguez A., Benhaim L., Xu Y., Barallobre M.J., Moutkine I., Lyytikkä J., Tatlisumak T., Pytowski B., Zalc B., Richardson W., Kessaris N., Garcia-Verdugo J.M., Alitalo K., Eichmann A., Thomas J.L. // Genes Dev. 2011. V. 25. № 8. P. 831–844.
Lange C., Storkebaum E., de Almodóvar C.R., Dewerchin M., Carmeliet P. // Nat. Rev. Neurol. 2016. V. 12. № 8. P. 439–454.
Wang L., Wang F., Liu S., Yang X., Yang J., Ming D. // Exp. Gerontol. 2018. V. 102. P. 93–100.
Nowacka M.M., Obuchowicz E. // Neuropeptides. 2012. V. 46. V. 1. P. 1–10.
Paxinos G., Watson C. // The Rat Brain in Stereotaxic Coordinates. Washington: Acad. Press, 2005.
Володин Н.Н., Корнюшин М.А., Горбунов А.В., Медведев М.И. // Журн. неврологии и психиатрии им. С.С. Корсакова. 2001. Т. 101. № 7. С. 4–8.
Herrera-Marschitz M., Neira-Pena T., Rojas-Mancilla E., Espina-Marchant P., Esmar D., Perez R., Muñoz V., Gutierrez-Hernandez M., Rivera B., Simola N., Bustamante D., Morales P., Gebicke-Haerter P.J. // Front. Neurosci. 2014. V. 8. P. 1–11.
Тюренков И.Н., Перфилова Т.А., Попова Л.Б., Иванова И.И., Прокофьев О.В., Гуляева Л.И., Штепа Л.А. // Бюлл. эксперим. биологии и медицины. 2013. Т. 155. № 3. С. 340–341.
Отеллин В.А., Хожай Л.И., Шишко Т.Т., Тюренков И.Н. // Морфология. 2016. Т. 150. № 6. С. 7–12.
Leung D.W., Cachianes G., Kuang W.J., Goeddel D.V., Ferrara N. // Science. 1989. V. 246. P. 1306–1309.
Breier G., Albrecht U., Sterrer S., Risau W. // Development. 1992. V. 114. № 2. P. 521–532.
Ferrara N., Davis-Smyth T. // Endocr. Rev. 1997. V. 18. № 1. P. 4–25.
Auterio M., De Smet F., Claes F., Carmeliet P. // Cardiovasc. Res. 2005. V. 65. № 3. P. 629–638.
Eichmann A., Le Noble F., Auterio M., Carmeliet P. // Curr. Opin. Neurobiol. 2005. V. 15. № 1. P. 108–115.
Ruiz de Almodovar C., Lambrechts D., Mazzone M., Carmeliet P. // Physiol. Rev. 2009. V. 89. № 2. P. 607–648.
Nowacka M.M., Obuchowicz E. // Neuropeptides. 2012.V. 46. № 1. P. 1–10.
Dumpich M., Theiss C. // Neural Regen. Res. 2015. V. 10. № 11. P. 1725–1726.
Wang L., Wang F., Liu S., Yang X., Yang J., Ming D. // Exp. Gerontol. 2018. V. 102. P. 93–100.
Ogunshola O.O., Stewart W.B., Mihalcik V., Solli T., Madri J.A., Ment L.R. // Dev. Brain Res. 2000. V. 119. № 1. P. 139–153.
Fan X., Heijnen C.J., van der Kooij M.A., Groenendaal F., van Bel F. // Brain Res. Rev. 2009. V. 62. № 1. P. 99–108.
Ke Q., Costa M. // Mol. Pharmacol. 2006. V. 70. № 5. P. 1469–1480.
Feng Y., Rhodes P.G., Liu H., Bhatt A.J. // Neuroscience. 2009. V. 158. № 2. P. 823–832.
Feng Y., Rhodes P.G., Bhatt A.J. // Brain Res. 2010. V. 1325. P. 1–9.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия


