Нейрохимия, 2020, T. 37, № 1, стр. 880-96
Закономерности изменения антител к белкам нервной ткани у пациентов с хронической ртутной интоксикацией в постконтактном периоде
Г. М. Бодиенкова 1, Е. В. Боклаженко 1
1 Федеральное государственное бюджетное научное учреждение “Восточно-Сибирский институт
медико-экологических исследований”
Ангарск, Россия
Поступила в редакцию 27.11.2018
После доработки 13.03.2019
Принята к публикации 07.04.2019
Аннотация
Цель исследования заключалась в выявлении закономерностей изменения уровней АТ к регуляторным белкам нервной ткани в динамике постконтактного периода у пациентов с различной степенью выраженности нейроинтоксикации парами металлической ртути. В связной выборке в динамике через 5 лет обследованы мужчины с хронической ртутной интоксикацией I-ой и II–III-ей стадиями. При повторном обследовании установлено нарастание АТ к белкам ДНК и MAG у лиц с ранними проявлениями нейроинтоксикации ртутью (I стадия). АТ к NF-200, GFAP, S-100, ОБМ, В-зав.Са-каналу, β2-ГП, Глу-Р, DA-Р, ГАМК-Р, Сер-Р, АХ-Р не изменялись в динамике и оставались повышенными относительно контрольных значений, что свидетельствует о сохраняющихся признаках изменений в нервной и иммунной системах, “заинтересованности” указанных белков в регуляторных процессах. У пациентов, страдающих ХРИ II–III стадии в динамике постконтактного периода, выявлено нарастание АТ к белку NF-200 и снижение к белкам S-100, MAG и GFAP, что может свидетельствовать об их значимости в механизмах реализации патологического процесса после прекращения контакта с токсикантом. Совокупность полученных данных позволила обосновать наиболее информативные биомаркеры тяжести течения ХРИ: АТ к белкам S-100, GFAP, MAG.
ВВЕДЕНИЕ
Работами последних лет доказано, что нарушения в нервной системе при нейроинтоксикациях сопровождаются изменениями в содержании целого ряда нейроспецифических белков (НСБ) и антител (АТ) к ним, которые могут служить уникальными биомаркерами развития и выраженности патологического процесса. Известно, что при воздействии как внешних, так и внутренних факторов изменения в нервной системе сопровождаются нарушениями в иммунной системе. При этом четкой закономерности в характере нарушений при воздействии тяжелых металлов и их динамики не прослеживается, что обусловлено пластичностью компенсаторных возможностей организма и особенностями параметрической популяционной оценки разнонаправлено меняющихся показателей иммунного статуса [1–4]. В формировании иммунной дисфункции и повреждении ткани мозга важную роль играют аутоиммунные реакции. Одним из стартовых моментов в патогенезе нейроинтоксикаций является активация аутоиммунных лимфоцитов. При различных формах поражения нейрональных структур (травмы мозга, нейродегенеративные заболевания, ишемия) наблюдается биохимическая селективность и избирательность поражения отдельных нейронов [5]. Важным моментом в идентификации нарушений в специализированных структурах нервной ткани является обнаружение АТ к антигенам нейроспецифических белков. При этом отдельные авторы [6] отмечают, что у пациентов с одной и той же патологией в зависимости от стадии заболевания маркеры могут быть разными, что делает крайне важным поиск определенного АТ в каждом конкретном случае [7]. В этой связи представляет интерес проанализировать изменения выработки АТ к антигенам нервной ткани и нейромедиаторам в динамике после прекращения контакта с токсикантом.
Цель исследования – выявить закономерности изменения уровней АТ к регуляторным белкам нервной ткани в динамике постконтактного периода у пациентов с различной степенью выраженности нейроинтоксикации парами металлической ртути.
МЕТОДЫ ИССЛЕДОВАНИЯ
В клинике института проведено проспективное обследование мужчин после прекращения контакта с парами металлической ртути в условиях производства. В том числе: 21 пациент с I стадией хронической ртутной интоксикации (ХРИ) в возрасте 47.05 ± 1.24 лет (на момент первичного обследования), стаж работы в контакте с ртутью составил 19.18 ± 1.08 лет и 32 пациента с ХРИ II–III стадиями в возрасте 53.38 ± 0.82 лет и стажем работы – 15.62 ± 0.8 лет. Постановка диагноза осуществлялась врачами профпатологами в соответствии с Международной классификацией болезней 10-го пересмотра (МКБ-10). Повторное обследование в связной выборке проведено через 5 лет. Группу сравнения составили 25 “условно здоровых” мужчин, сопоставимых по возрасту, общему трудовому стажу, не имеющих в профессиональном маршруте контакта с веществами нейротоксического действия.
В сыворотке крови методом твердофазного иммуноферментного анализа с помощью тест-систем производства BÜHLMANN anti-MAG ELISA (Швеция) определяли уровень АТ к миелин-ассоциированному гликопротеину (MAG, измеряемый в единицах титра – Bühlmann Titre Units). Согласно инструкции оценивали сывороточные концентрации АТ класса IgG, к белкам нервной ткани: нейрофиламентному протеину-200 (NF-200), глиальному фибриллярному кислому белку (GFAP), S-100, основному белку миелина (ОБМ), вольтажзависимому Са-каналу (В-зав. Са-канал), глутаматным рецепторам (Глу-Р), дофаминовым рецепторам (DA-Р), ГАМК – рецепторам (ГАМК-Р), серотониновым рецепторам (Сер-Р), холинорецепторам (Хол-Р), ДНК, β2 гликопротеину (Б2ГП) с использованием стандартных тест-систем ЭЛИ-Нейро-Тест (МИЦ “Иммункулус” г. Москва).
Статистическую обработку результатов проводили с помощью пакета прикладных программ “STATISTICA 6.0” (StatSoft, USA). Возраст и стаж работы обследованных пациентов представлены в виде средней (М) и ее ошибки (m). Результаты исследований представлены в виде медианы, верхнего (75%) и нижнего (25%) квартилей Ме (Q25–Q75). Для сравнения связанных групп применяли дисперсионный анализ по Фридмену. Достоверность различий оценивали с использованием непараметрических критериев – тест Вилкоксона и Манна–Уитни с учетом поправки Бонферонни. За уровень статистической значимости различий принимали p < 0.05. Дискриминантный анализ проводили в соответствии с пособием для врачей “Дискриминантный анализ в медико-биологических исследованиях (с применением пакета прикладных программ STATISTICA 6.1” [8]. Использовали модуль “Discriminant analysis”. Информативность анализируемых показателей оценивали шаговыми процедурами, граничным значением F включения выбрана величина F > 3.0; критерием классификации служила мера D2 Махаланобиса.
Обследование пациентов соответствовало этическим стандартам в соответствии с Хельсинской декларацией Всемирной медицинской ассоциации (2000) и “Правилами клинической практики в РФ”, утвержденными Приказом Минздрава РФ № 266 от 19.06.2003 г. Исследования выполнены с информированного согласия пациентов на участие в них и одобрено Этическим комитетом ВСНЦ ЭЧ СО РАМН (Протокол № 5 от 14.11.12).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее выполненные исследования [9, 10] позволили установить возрастание сывороточных концентраций АТ к ряду антигенов нервной ткани у работников с ранними проявлениями нейроинтоксикации ртутью и лиц с профессиональной ХРИ, что может свидетельствовать о нарушениях синтеза и/или разрушения задействованных молекулярных компонентов нервной ткани, на которые могут вырабатываться АТ [11]. Учитывая, что механизм действия вырабатываемых АТ при хроническом воздействии токсикантов в программируемой гибели нейронов недостаточно изучен, а изменения в их содержании могут быть как одним из саногенетических, так и патогенетических механизмов развития и течения заболевания, на следующем этапе наших исследований представляло определенный интерес выявить особенности изменений сывороточных концентраций АТ у лиц с нейроинтоксикацией после прекращения контакта с парами металлической ртути.
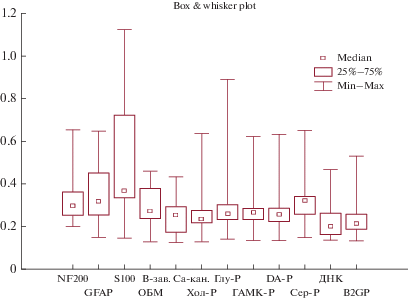
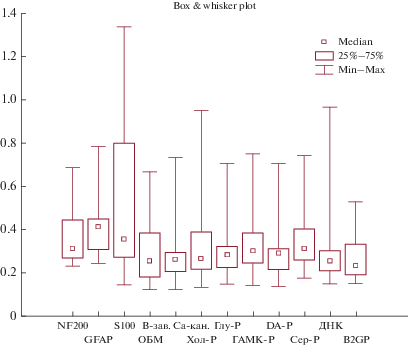
При повторном (через 5 лет) обследовании пациентов с ранними проявлениями нейроинтоксикации ртутью (I стадия), результаты которого представлены в табл. 1 и рис. 1, 2, установлено статистически значимое увеличение продукции АТ к ДНК до 0.254(0.211–0.303) у. е. по сравнению с первым обследованием (0.200(0.162–0.262) у. е.; p = 0.03) (рис. 1). Если учесть, что указанные АТ характеризуют общую активность иммунной системы и синтезируются в организме каждого здорового человека, участвуют в клиренсе от продуктов естественной гибели клеток в ходе апоптоза, то в нашем случае нарастание АТ к ДНК может свидетельствовать об интенсификации апоптоза клеток организма. Обращает на себя внимание компенсаторное возрастание АТ к MAG с 354.90 (308.40–378.30) BTU до 435.51 (366.54–549.16) BTU (p = 0.02) при повторном обследовании. АТ к остальным исследуемым регуляторным белкам нервной ткани (NF-200, GFAP, S-100, ОБМ, В-зав. Са-каналу, Глу-Р, DA-Р, MAG, ГАМК-Р, Сер-Р, АХ-Р и β2GP) статистически значимо не изменялись относительно первого обследования, однако оставались выше (p < 0.05) контрольных значений. Длительно сохраняющиеся повышенные уровни АТ могут свидетельствовать о нарастании дефицитности элиминационных механизмов и свидетельствовать о “заинтересованности” указанных белков в регуляции деятельности мозга.
Таблица 1.
Изменения уровней АТ у пациентов с ХРИ I ст. в динамике постконтактного периода, Ме(Q25–Q75)
| Ауто-АТ к: | Группа сравнения (n = 25) (1) |
Пациенты c ХРИ I ст. (n = 21) |
Р | |
|---|---|---|---|---|
| 1 обследование (2) |
2 обследование (3) |
|||
| MAG (BTU) | 309.44(300.5–327.9) | 342.5(314.4–368.8) | 429.77(376.36–612.47) | p1–2 = 0.001 p1–3 = 0.0008 p2–3 = 0.02 |
| NF-200 (у. е.) | 0.202(0.164–0.259) | 0.296(0.252–0.361) | 0.312(0.270–0.445) | p1–2 = 0.0007 p1–3 = 0.00001 p2–3 = 0.14 |
| ОБМ (у. е.) | 0.153(0.118–0.177) | 0.271(0.237–0.378) | 0.257(0.182–0.385) | p1–2 = 0.000002 p1–3 = 0.00003 p2–3 = 0.65 |
| ДНК (у. е.) | 0.145(0.121–0.168) | 0.200(0.162–0.262) | 0.254(0.211–0.303) | p1–2 = 0.000002 p1–3 = 0.007 p 2–3 = 0.03 |
| GFAP (у. е.) | 0.249(0.209–0.363) | 0.319(0.254–0.450) | 0.415(0.309–0.450) | p1–2 = 0.04 p1–3 = 0.0001 p2–3 = 0.17 |
| B-зав. Са-канал (у. е.) |
0.152(0.119–0.196) | 0.254(0.173–0.293) | 0.264(0.207–0.295) | p1–2 = 0.001 p1–3 = 0.0002 p2–3 = 0.61 |
| S-100 (у. е.) | 0.234(0.184–0.303) | 0.367(0.333–0.722) | 0.358(0.273–0.800) | p1–2 = 0.002 p1–3 = 0.01 p2–3 = 0.0.67 |
| Хол-Р (у. е.) | 0.176(0.140–0.224) | 0.234(0.217–0.275) | 0.268(0.218–0.390) | p1–2 = 0.01 p1–3 = 0.002 p2–3 = 0.0.31 |
| Глу-Р (у. е.) | 0.189(0.145–0.219) | 0.259(0.233–0.302) | 0.284(0.226–0.322) | p1–2 = 0.001 p1–3 = 0.0002 p2–3 = 0.57 |
| ГАМК-Р (у. е.) | 0.192(0.138–0.259) | 0.264(0.232–0.284) | 0.301(0.246–0.385) | p1–2 = 0.02 p1–3 = 0.001 p2–3 = 0.08 |
| DA-Р (у. е.) | 0.186(0.153–0.250) | 0.255(0.223–0.285) | 0.290(0.216–0.312) | p1–2 = 0.01 p1–3 = 0.002 p2–3 = 0.29 |
| Сер-Р (у. е.) | 0.244(0.202–0.303) | 0.320(0.257–0.340) | 0.315(0.260–0.404) | p1–2 = 0.04 p1–3 = 0.01 p2–3 = 0.59 |
| B2GP (у. е.) | 0.148(0.118–0.188) | 0.212(0.187–0.257) | 0.233(0.192–0.333) | p1–2 = 0.00003 p1–3 = 0.000002 p2–3 = 0.30 |
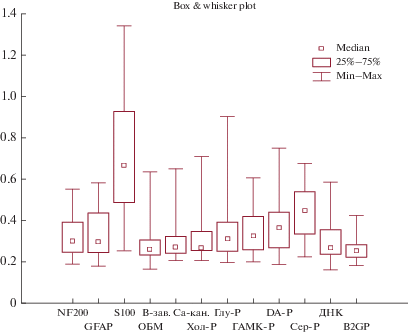
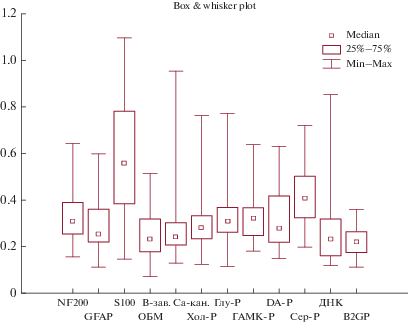
В результате повторного обследования пациентов с ХРИ II–III стадии (табл. 2, рис. 3, 4), выявлено возрастание сывороточных концентраций АТ к специфическому белку аксонов – NF-200 до 0.309 (0.253–0.389) у. е. по сравнению с первым обследованием (0.298(0.244–0.390) у. е.; p = 0.04) (рис. 3), и группой сравнения (0.202(0.164–0.259) у. е.; p = 0.003). Следует отметить, что гиперпродукция АТ к NF-200 с высокой долей вероятности может указывать на дегенеративные изменения в аксонах, включая их миелиновые оболочки (демиелинизация). Полученные результаты согласуются с исследованиями других авторов, которые также отмечали повышение АТ к NF-200 при ряде заболеваний (шизофрении, эпилепсии), сопровождающихся процессами нейроденегерации [12, 13]. Кроме того, при повторном обследовании у пациентов с ХРИ II–III стадии обнаружено снижение АТ к GFAP до 0.253(0.219–0.359) у. е. по сравнению с первым обследованием (0.296(0.243–0.435) у. е.; p = = 0.05). Установленные нами при первичном обследовании повышенные уровни АТ к GFAP по сравнению с группой контроля (0.249(0.209–0.363) у. е.; p = 0.0002) могут носить компенсаторный характер. В то время как длительное их повышение сопровождает пролиферативные процессы в астроцитарной глие головного мозга [14] и может свидетельствовать о нейрональных потерях. Также наблюдалось снижение в динамике АТ к белку S-100 (0.559(0.383–0.783) у. е.) относительно первого обследования (0.667(0.485–0.927) у. е.; p = 0.04). При этом значения указанных показателей оставались выше аналогичных в группе контроля (0.234(0.184–0.303) у. е.; p = 0.001 и p = 0.001 соответственно). Известно, что в мозге белок S-100 синтезируется глиальными клетками. Преимущественно (90%) они сосредоточены в астроцитах. В зависимости от концентрации белки S-100 оказывают трофическое или токсическое действие на нейроны и глиальные клетки. Ранее нами было зарегистрировано повышение АТ к белку S-100 у работающих без клинических проявлений и снижение исследуемых АТ с нарастанием тяжести патологического процесса при воздействии нейротоксикантов [15]. В данном случае длительно сохраняющиеся в динамике постконтактного периода высокие уровни АТ к S-100, по-видимому, могут свидетельствовать о прогрессировании изменений в нервной системе. С нарастанием тяжести течения ХРИ (II–III стадии) обнаружено снижение АТ к MAG с 523.0 (479.54–589.01) BTU до 398.79 (356.43–431.67) BTU (p = 0.007). При этом, значения указанного показателя как в первом, так и во втором случаях, оставались статистически значимо выше контрольных значений (309.44(300.50–327.90) BTU; p = 0.02, p = 0.0002, p = 0.001, p = 0.0003 соответственно). Важно отметить, что АТ к MAG являются медиаторами взаимодействий олигодендроглиоцитов между собой и с нейронами, а изменение в их содержании может свидетельствовать о миелинизации аксонов [16]. Результаты наших исследований согласуются с исследованиями других авторов, отмечающих также изменения в содержании указанных белков при других заболеваниях нервной системы [12, 13]. Полученные результаты дают основание полагать, что АТ к NF-200, S-100, MAG и GFAP играют важную роль в патогенезе ХРИ, свидетельствуют об аутоиммунном процессе в белом веществе головного мозга и развитии воспалительного процесса в нервной ткани, что усугубляет клиническую картину прогредиентного течения болезни. Наши данные согласуются с результатами экспериментальных и клинических исследований, которые показали, что особенностью токсической энцефалопатии в отдаленном периоде ХРИ является прогредиентное течение с формированием органических расстройств личности, в виде преимущественно умеренно выраженных когнитивных нарушений [17, 18]. Кроме того, установлена взаимосвязь между повышением АТ к белкам S-100, ОБМ, MAG с нарушением состояния афферентных проводящих путей, что может свидетельствовать о протекании общего процесса нейродегенерации в центральных структурах нервной ткани [19].
Таблица 2.
Изменения уровней АТ у пациентов с ХРИ II–III ст. в динамике постконтактного периода, Ме(Q25–Q75)
| Ауто-АТ к: | Группа сравнения (n = 25) (1) |
Пациенты c ХРИ II–III ст. (n = 31) |
Р | |
|---|---|---|---|---|
| 1 обследование (2) |
2 обследование (3) |
|||
| MAG (BTU) | 309.44(300.5–327.9) | 568.2(451.4–611.7) | 403.44(368.81–489.43) | p1–2 = 0.002 p1–3 = 0.004 p 2–3 = 0.007 |
| NF-200 (у. е.) | 0.202(0.164–0.259) | 0.298(0.244–0.390) | 0.309(0.253–0.389) | p1–2 = 0.0004 p1–3 = 0.002 p 2–3 = 0.04 |
| ОБМ (у. е.) | 0.153(0.118–0.177) | 0.261(0.232–0.304) | 0.231(0.178–0.318) | p1–2 = 0.00000 p1–3 = 0.002 p 2–3 = 0.2 |
| ДНК (у. е.) | 0.145(0.121–0.168) | 0.268(0.235–0.354) | 0.230(0.160–0.318) | p1–2 = 0.0008 p1–3 = 0.0001 p 2–3 = 0.44 |
| GFAP (у. е.) | 0.249(0.209–0.363) | 0.296(0.243–0.435) | 0.253(0.219–0.359) | p1–2 = 0.04 p1–3 = 0.0005 p 2–3 = 0.05 |
| B-зав. Са-канал (у. е.) |
0.152(0.119–0.196) | 0.272(0.240–0.322) | 0.241(0.206–0.303) | p1–2 = 0.0008 p1–3 = 0.0003 p 2–3 = 0.79 |
| S-100 (у. е.) | 0.234(0.184–0.303) | 0.667(0.485–0.927) | 0.559(0.383–0.783) | p1–2 = 0.002 p1–3 = 0.0007 p 2–3 = 0.01 |
| Хол-Р (у. е.) | 0.176(0.140–0.224) | 0.265(0.253–0.345) | 0.282(0.233–0.332) | p1–2 = 0.02 p1–3 = 0.002 p 2–3 = 0.79 |
| Глу-Р (у. е.) | 0.189(0.145–0.219) | 0.310(0.249–0.391) | 0.308(0.262–0.368) | p1–2 = 0.0009 p1–3 = 0.0003 p 2–3 = 0.30 |
| ГАМК-Р (у. е.) | 0.192(0.138–0.259) | 0.324(0.257–0.418) | 0.320(0.247–0.366) | p1–2 = 0.03 p1–3 = 0.0002 p 2–3 = 1.0 |
| DA-Р (у. е.) | 0.186(0.153–0.250) | 0.362(0.266–0.439) | 0.279(0.218–0.417) | p1–2 = 0.01 p1–3 = 0.003 p 2–3 = 1.0 |
| Сер-Р (у. е.) | 0.244(0.202–0.303) | 0.445(0.333–0.538) | 0.408(0.323–0.502) | p1–2 = 0.03 p1–3 = 0.00000 p 2–3 = 0.60 |
| B2GP (у. е.) | 0.148(0.118–0.188) | 0.253(0.221–0.282) | 0.219(0.174–0.263) | p1–2 = 0.00001 p1–3 = 0.006 p 2–3 = 1.0 |
Учитывая, что до настоящего времени недостаточно разработаны надежные методы оценки тяжести течения ХРИ, особенно в отдаленном постконтактном периоде, актуальным являлось обоснование новых объективных лабораторных показателей, специфичных относительно нервной системы. В результате многомерного дискриминантного анализа 12 показателей (АТ к белкам: NF-200, GFAP, S-100, ОБМ, В-зав. Са-канал, Глу-Р, DA-Р, MAG, ГАМК-Р, Сер-Р, АХ-Р и β2GP), выполненного в группах пациентов с ХРИ I и ХРИ II–III стадиями обоснованы наиболее информативные биомаркеры – АТ к белкам S-100, GFAP, MAG. Подтверждает информативность указанных показателей и тот факт, что в предыдущих исследованиях нами установлены сложные функциональные взаимосвязи между нервной и иммунной системами и вовлеченность аутоантител к белку S-100 в процессы высшей нервной деятельности у пациентов с ХРИ, о чем свидетельствовала выраженная корреляционная зависимость между уровнями АТ к белку S-100 и изменениями нейрофизиологических характеристик зрительных вызванных потенциалов мозга [20]. При этом другие исследователи также отмечают диагностическую значимость указанного белка при ряде неврологических расстройств [21, 22]. Также показано, что демиелинизирующие изменения центральных и периферических нервов у пациентов с ХРИ в постконтактном периоде сопровождаются возрастанием сывороточной концентрации АТ к MAG-белку, что указывает на его диагностическую значимость [23].
ЗАКЛЮЧЕНИЕ
Таким образом, у пациентов, страдающих ХРИ I стадии, после прекращения контакта с ртутью через 5 лет, установлено возрастание АТ к ДНК и MAG, а также сохранение в течении всего периода наблюдения повышенных уровней АТ к регуляторным белкам нервной ткани (NF-200, GFAP, белку S-100, ОБМ, В-зав.Са-каналу, β2-ГП, MAG) и нейромедиаторам (Глу-Р, DA-Р, ГАМК-Р, Сер-Р, АХ-Р), что может свидетельствовать о нарастании дефицитности элиминационных механизмов, сохраняющихся нейрохимических изменениях в специализированных структурах нервной ткани. У пациентов с ХРИ II–III стадии в динамике постконтактного периода установлено нарастание АТ к NF-200 и снижение к S-100, MAG и GFAP, что может свидетельствовать об их значимости в механизмах реализации патологического процесса после прекращения контакта с токсикантом. Совокупность полученных данных позволила обосновать наиболее информативные биомаркеры тяжести течения ХРИ: АТ к белкам S-100, GFAP, MAG.
Список литературы
Долгих О.В., Кривцов А.В., Бубнова О.А., Отавина Е.А., Безрученко Н.В., Колегова А.А., Мазунина А.А., Гусельников М.А. // Гигиена и санитария. 2017. Т. 96. № 1. С. 26–29.
Старкова К.Г., Долгих О.В., Эйсфельд Д.А., Аликина И.Н., Никоношина Н.А., Челакова Ю.А. // Гигиена и санитария. 2019. Т. 98. № 2. С. 178–182.
Streets D.G., Devane M.K., Lu Z., Bond T.C., Sunderland E.M., Jacob D.J. // Environ. Sci. Technol. 2011. № 45. P. 10485–91.
Takahashi T., Fujimura M., Koyama M., Kanazawa M., Usuki F. et al. // PLOS ONE. 2017. V. 12. № 1. P. 1–10.
Гомазков О.А. // Нейрохимия. 2007. Т. 24. № 2. С. 101–120.
Яковлев А.А. // Нейрохимия. 2015. Т. 32. № 2. С. 112–115.
Фоминых В.В., Фрей Е.А., Брылев Л.В., Гуляева Н.В. // Нейрохимия. 2018. Т. 35. № 4. С. 308–322.
Михалевич И.М., Юрьева Т.Н. Дискриминантный анализ в медико-биологических исследованиях (с применением пакета прикладных программ STATISTICA 6.1): пособие для врачей. И.: ИГМАПО, 2015. 43 с.
Бодиенкова Г.М., Катаманова Е.В., Боклаженко Е.В. // Российский аллергологический журн. 2011. № 4. Вып. 1. С. 54–56.
Бодиенкова Г.М., Боклаженко Е.В. // Соврем. пробл. науки и образ. 2016. № 2. С. 160.
Полетаев А.Б. Молекулярная диспансеризация (новые подходы к раннему проявлению патологических изменений в организме человека: методические рекомендации для врачей. М.: “Иммункулус”, 2014. 80 с.
Орлова В.А., Михайлова И.И., Минутко В.Л., Симонова А.В. // Социальная и клиническая психиатрия. 2015. Т. 25. № 4. С. 45–53.
Расулова Х.А., Азизова Р.Б. // Вестник РАМН. 2014. № 5–6. С. 111–116.
Полетаев А.Б. Иммунология и иммунопатология. М.: Медицинское информационное агентство, 2008. 207 с.
Бодиенкова Г.М., Алексеев Р.Ю. // Нейроиммунология. 2013. Т. XI. № 1–2. С. 25–26.
Andersson M., Yu M., Söderström M., Weerth S., Baig S., Solders G., link H. // Eur. J. Neurol. 2002. V. 9. № 3. P. 243–251.
Рукавишников В.С., Лахман О.Л., Соседова Л.М., Шаяхметов С.Ф., Кудаева И.В., Бодиенкова Г.М., Катаманова Е.В., Шевченко О.И., Русанова Д.В., Андреева О.К., Хомуев Г.Д., Маснавиева Л.Б., Якимова Н.Л., Титов Е.А. // Медицина труда и промышленная экология. 2010. № 10. С. 22–30.
Шевченко О.И., Катаманова Е.В., Лахман О.Л. // Доктор.Ру. 2015. № 8(109)–9(110). С. 59–64.
Русанова Д.В., Лахман О.Л., Бодиенкова Г.М., Купцова Н.Г. // Медицина труда и промышленная экология. 2017. № 1. С. 42–46.
Иванова Ю.В., Бодиенкова Г.М., Катаманова Е.В. // Бюллетень ВСНЦ СО РАМН. 2010. № 4. С. 91–94.
Eppensteiner J., Davis R.P., Barbas A.S., Kwun J., Lee J. // Frontiers in Immunology. 2018. 9. P. 190.
Canova C., Neal J.W., Gasque P. // J. Neuroinflammation. 2006. V. 3. P. 22–31.
Русанова Д.В., Бодиенкова Г.М., Лахман О.Л. // Сибирский медицинский журн. (Иркутск). 2015. Т. 134. № 3. С. 57–60.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия