Нейрохимия, 2020, T. 37, № 1, стр. 800-87
Нейропротекторная активность докозагексаеновой кислоты в центральной и периферической нервной системе при повреждении седалищного нерва
И. В. Манжуло 1, 2, А. А. Тыртышная 1, 2, О. С. Манжуло 1, 2, А. А. Старинец 1, 2, С. П. Касьянов 1, И. В. Дюйзен 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
Владивосток, Россия
2 Дальневосточный федеральный университет
Владивосток, Россия
Поступила в редакцию 15.11.2018
После доработки 31.12.2018
Принята к публикации 09.01.2019
Аннотация
Анальгетическая и нейропротекторная активность докозагексаеновой кислоты (ДГК, 22:6 n-3) изучалась при повреждении седалищного нерва крысы. В работе охарактеризовано морфо-химическое состояние дистального сегмента седалищного нерва и активность GFAP-позитивной астроглии и SP-ергических нервных волокон на 7 и 28 день поле операции. Установлено, что ДГК улучшает морфологическое состояние седалищного нерва, препятствует деградации основного белка миелина и стабилизирует уровень активности астроглии и SP-позитивных нервных волокон в поверхностных пластинах задних рогов спинного мозга. В целом, ДГК обладает комплексным влиянием на течение посттравматического процесса в центральной и периферической нервной системе, что свидетельствует о ее высоком терапевтическом потенциале.
ВВЕДЕНИЕ
Повреждение тканей, хроническое воспаление и ряд других патологий центральной и периферической нервной системы приводит к нарушению ноцицептивной пластичности нейронов с развитием нейропатической боли [1]. Важными проявлениями нейрогенной боли является спонтанная боль, аллодиния и гипералгезия [2]. Так, например, повреждение периферических нервов индуцирует воспаление, сенсибилизацию и активацию первичных сенсорных нейронов, а также увеличивает активность ноцицептивных нейронов второго порядка в спинном мозге. Кроме того, повреждение периферического нерва приводит к активации глиальных клеток спинного мозга, включая астро- и микроглию [3]. После активации глиальные клетки продуцируют ряд провоспалительных цитокинов (интерлейкин (ИЛ)-1β, ИЛ-6, TNF-α) которые активируют и сенсибилизируют чувствительные нейроны в спинном мозге, усиливая ноцицептивную нейротрансмиссию. Эти сложные нейро-глиальные взаимодействия приводят к повышению чувствительности ноцицептивных нейронов спинного мозга (центральная сенсибилизация), снижению порога активации ноцицептивных нейронов (периферическая сенсибилизация) и вызывают спонтанное возбуждение ноцицепторов [4, 5].
Существующий арсенал анальгетиков и препаратов с нейропротекторными свойствами для лечения нейропатической боли обладает рядом недостатков, связанных с низкой эффективностью, высоким риском развития побочных эффектов и неселективностью в отношении патофизиологии болевого процесса, что требует формирования сложных многокомпонентных динамических схем для обеспечения выздоровления пациента [6]. Для комплексной терапии данного патологического состояния значительный интерес представляют вещества из группы полиненасыщенных жирных кислот (ПНЖК), демонстрирующие противовоспалительную и антиоксидантную активность [7]. Среди омега-3 ПНЖК выраженные нейротропные эффекты имеет докозагексаеновая кислота (ДГК, 22:6 n-3), которая является одним из важнейших структурных липидов нервной ткани [8, 9]. Результаты, полученные в наших предыдущих экспериментах, демонстрируют, что применение ДГК снижает интенсивность и продолжительность развития нейрогенной боли, приводит к более ранней стабилизации распределения веса, предотвращает развитие холодовой аллодинии и дистрофических изменений в ткани денервированной конечности. А также ингибирует активацию микроглии и синтез проапоптотического белка р53 в спинномозговых ганглиях [10, 11].
В настоящем исследовании мы предположили, что анальгетическая и нейропротекторная активность ДГК реализуется за счет модуляции нейрональной и глиальной активности в центральной и периферической нервной системе.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика экспериментального материала. Исследование выполнено на 2–3 месячных самцах крыс линии Вистар (240 ± 20 г), животные размещались парами и имели свободный доступ к пище и воде, содержались при постоянной температуре (23 ± 2°C) и влажности (55 ± 15%) с 12-часовым циклом “день/ночь”. Все экспериментальные манипуляции с животными одобрены комиссией по биомедицинской этике Национального научного центра морской биологии им. А.В. Жирмунского ДВО РАН.
Повреждение седалищного нерва для моделирования нейропатического болевого синдрома проводили, как описано Дж. Беннетом и У. Xью [12], путем наложения трех тугих шелковых лигатур (с интервалом приблизительно 2 мм) на седалищный нерв правой задней лапы крысы. Развитие нейропатического болевого синдрома сопровождается появлением ряда патологических симптомов, поддающихся количественной оценке [13]. В предыдущем исследовании при использовании тестера инвалидности и теста холодной пластины установлена динамика основных болевых феноменов, развивающихся у модельных животных (холодовая аллодиния и моторный дефицит) [10]. Поэтому оценка нейрохимических перестроек в дистальном сегменте поврежденного седалищного нерва и поверхностных пластинах спинного мозга проводилась в те сроки, которые соответствовали инициации нейропатического болевого синдрома (7 дней после операции) и его становлению (28 дней после операции). Животные были разделены на три группы (n = 35): “контроль” (n = 7) – интактные крысы, “боль” (n = 14) – крысы с повреждением седалищного нерва и “боль + + ДГК” (n = 14) – крысы с повреждением седалищного нерва получающие ДГК в дозе 4.5 мг/кг подкожно в течение 2 нед. после операции в объеме 150 мкл (1 раз в сут, ежедневно). Запатентованный препарат ДГК полученный из пищеварительной железы Berryteuthis magister, был предоставлен для исследования, сотрудниками лаборатории фармакологии ННЦМБ ДВО РАН.
Животных анестезировали путем внутрибрюшинного введения смеси, содержащей Золетил 100 (Virbac) + Рометар (Bioveta) в соотношении 1 : 4 (из расчета 10 мг/кг), затем перфузировали 4% раствором параформальдегида, приготовленном на 0.1 М фосфатном буфере (рН 7.2) и извлекали материал.
Гистологические методы исследования. Для общеморфологического анализа использовали парафиновые срезы дистального сегмента седалищного нерва толщиной 10 мкм, залитые в парафин по стандартной методике. После депарафинирования срезы окрашивали гематоксилином 15 мин (BioOptica, Италия), промывали проточной водой 20 мин, последовательно опускали в раствор эозина (BioOptica, Италия) и три порции спиртов, обрабатывали ксилолом в течение 10 мин и заключали в монтирующую среду (Dako, CS705, США).
Иммуногистохимические методы исследования. Для оценки морфо-химического состояния дистального сегмента поврежденного седалищного нерва, медиаторного профиля нервных волокон и активности астроглии спинного мозга использовали метод иммунопероксидазной реакции выявления ОБМ (основной белок миелина), субстанция Р (медиатор афферентных нервных волокон) и GFAP (глиальный фибриллярный кислый белок, маркер астроглии). Использованный в работе иммуногистохимический метод состоит из следующих этапов: фиксация кусочков ткани (4% параформальдегид, приготовленный на 0.1 М фосфатном буфере, рН 7.2) в течение 12 ч и их последующая промывка; заливка седалищного нерва в парафин по стандартной методике и заключение поясничного сегмента спинного мозга в криопротекторную среду (NEG 50, Thermo Scientific, США); получение серийных парафиновых (10 мкм) и криостатных (50 мкм) срезов; прединкубация в растворах, блокирующих эндогенную пероксидазную активность и неспецифическое связывание антител; обработка срезов в растворе первичных антител (4°C, 24 ч); обработка вторичными антителами в течение 1 ч при комнатной температуре и постановка иммунопероксидазной реакции. В качестве отрицательного контроля использовали препараты без первичных антител. В работе использованы первичные поликлональные кроличьи антитела против ОБМ (Thermo Scientific, RB-1460-A, США, 1 : 200) и моноклональные мышиные антитела против субстанции P (Abcam, ab14184, США, 1 : 2000), GFAP (Vector Laboratories, G805, США, 1 : 500). Вторичные антитела, меченные пероксидазой хрена (Vector Laboratories, PI-1000 (anti-rabbit), PI-2000 (anti-mouse), 1 : 200), использовались в соответствии с инструкциями фирмы-производителя. Для проведения иммунопероксидазной реакции использовали хромоген (Thermo Scientific, TL-060-QHD, США). После окрашивания срезы тщательно отмывали в дистиллированной воде или 0.1 М фосфатном буфере (рН 7.2), обезвоживали и заключали в монтирующую среду (Dako, CS705, США). Полученные препараты просматривали в световом микроскопе Axio Imager Z2 (Carl Zeiss, Германия) и фотографировали при помощи цифрового фотоаппарата AxioCam HRc (Carl Zeiss, Германия). После фотографирования все фотографии сохранялись в формате TIF и имели размер 1088 × × 813 пикселей.
Количественная обработка данных. Оценку площади иммуногистохимического окрашивания основного белка миелина в дистальном сегменте поврежденного седалищного нерва, а также субстанция Р-позитивных нервных волокон и GFAP-позитивной астроглии поверхностных пластин задних рогов спинного мозга (ипсилатеральная сторона) проводили в каждом пятом серийном срезе с использованием пакета программ ImageJ 1.41 (NIH, США). С помощью плагина IHC Toolbox создавали статистическую модель обнаружения цвета, основанную на визуально выбранных цветных пикселях, выделение цвета используется для выбора и резервирования положительных цветовых пикселей, в то время как пиксели цвета фона исключаются. Все полученные микрофотографии обрабатывали путем вычитания фона с использованием данной статистической модели определения цвета, затем проводилась автоматическая бинаризация и измерение площади окрашивания исследуемых маркеров (данные выражались в процентах относительно общей площади исследуемой области).
Оценку достоверности различий данных полученных с помощью иммуногистохимических методов исследования проводили с использованием Two-way Anova (Bonferroni post test). Все данные были проверены на нормальность распределений с использованием теста Колмогорова–Смирнова. Данные выражали как среднее ± SEM, p < 0.05 было принято как статистически значимое. Все статистические тесты выполнялись с использованием программного обеспечения GraphPad Prism 4.00.
РЕЗУЛЬТАТЫ
Морфологическая характеристика седалищного нерва в норме и при нейротравме. Морфологическое состояние седалищного нерва интактных животных без видимых патологий (рис. 1а). Тогда как повреждение периферического нерва вызывает местное воспаление, которое приводит к отеку, повреждению и дезорганизации нервных волокон. В дистальном сегменте отмечалось большое количество новообразованных кровеносных сосудов, инфильтраты моноцитов, нейтрофилов и фибробластов, а также многочисленные кровоизлияния в области воспаления (рис. 1б, в). Применение ДГК приводит к уменьшению степени развития данных патофизиологических процессов (рис. 1г, д).
Рис. 1.
Морфологическое состояние дистального сегмента седалищного нерва в норме (а), при травматическом повреждении через 7 и 28 дней после операции (б, в) и терапии ДГК через 7 и 28 дней после операции (г, д). Окраска гематоксилин-эозином.

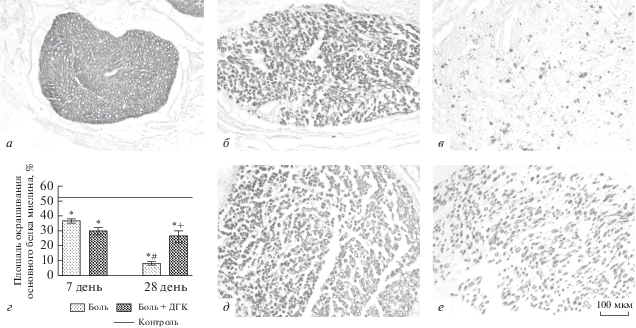
Содержание основного белка миелина как показатель сохранности структуры дистального сегмента поврежденного нерва. Количественный анализ содержания основного белка миелина (ОБМ) в нервной ткани – один из способов оценить степень морфологической и функциональной сохранности поврежденного нерва. Параметры распределения ОБМ, с одной стороны, демонстрируют выраженность демиелинизирующего процесса, а с другой – свидетельствуют об активности механизмов регенерации и ремиелинизации [14]. При проведении иммуногистохимической реакции на препаратах интактного нервного волокна ОБМ-позитивные структуры выявляются глыбками, расположенными в виде колец вокруг нервных волокон; толщина миелиновой оболочки прямо пропорциональна диаметру погруженного в нее нервного волокна. Основной белок миелина ровно контурирует аксоны среднего и крупного калибра, вокруг волокон мелкого диаметра он отсутствует (рис. 2а). При повреждении седалищного нерва, во всех экспериментальных группах, к 7 дню ОБМ создает прерывистый контур вокруг нервных волокон и выявляется не так четко (рис. 2б). К 28 дню основное количество ОБМ-позитивных структур представлено в виде мякотных шаров – глыбчатых скоплений конгломератов фрагментов миелина, беспорядочно расположенных в нервной ткани. В группе «боль» наблюдается практически полная деградация основного белка миелина (рис. 2в), при применении препарата докозагексаеновой кислоты деградация ОБМ-позитивных структур менее выражена (рис. 2д, е). Количественная оценка данного процесса демонстрирует, что на 7-е и 28-е сут в группе “боль” площадь окрашивания ОБМ-позитивных структур на срезах дистального сегмента седалищного нерва снижается (36.9 ± 1.4% и 8.3 ± 1.1% соответственно), по сравнению с интактными животными (53.2 ± 1.4%). В сходных точках наблюдения в группе “боль + ДГК” площадь окрашивания ОБМ-позитивных структур уменьшается (29.9 ± ± 2.5% и 26.4 ± 3.7% соответственно) (рис. 2г).
Рис. 2.
Основной белок миелина в дистальном сегменте седалищного нерва при травматическом повреждении. Группа “контроль” (а), группа “боль” через 7 и 28 дней после операции (б, в) и группа “боль + ДГК” через 7 и 28 дней после операции (д, е); динамика активности основного белка миелина (г). * Достоверные различия с группой “контроль” (при р < 0.05). + Достоверные различия между группой “боль” и “боль + ДГК” (при р < 0.05). # Достоверные различия в группе “боль” на 7 и 28 день после операции.
Активность SР-ергических нервных волокон в задних рогах спинного мозга после перевязки седалищного нерва и терапии ДГК. Субстанция Р (SP) в качестве медиатора сосуществует в более 90% терминалей высокопороговых сенсорных волокон, содержащих глутамат [15]. Терминали, содержащие SP, локализуются, преимущественно, в желатинозной субстанции задних рогов спинного мозга на нейронах, организующих “воротный” механизм болевого контроля [16]. На препаратах спинного мозга животных всех экспериментальных групп в поверхностных пластинах задних рогов наблюдается скопление плотно переплетающихся SР-позитивных волокон (рис. 3). В группе “боль” к 7 дню после операции в волокнах задних рогов спинного мозга наблюдается снижение (22.7 ± 0.9%) экспрессии SР, однако к 28 дню этот показатель увеличивается (43.4 ± 1.2%) по сравнению с интактными животными (33.5 ± 1.3%) (рис. 3б–г). В сходных точках наблюдения у животных группы “боль + ДГК” в поверхностных пластинах задних рогов спинного мозга площадь окрашивания субстанция Р-позитивных волокон (25.6 ± 1.1% (7 день); 38.45 ± 1.4% (28 день)) более приближено к уровню интактного контроля, что указывает на выраженное анальгетическое действие препарата (рис. 3г–е).
Рис. 3.
Субстанция P-позитивные нервные волокна в поверхностных пластинах задних рогов спинного мозга при развитии нейропатической боли. Группа “контроль” (а), группа “боль” через 7 и 28 дней после операции (б, в) и группа “боль + ДГК” через 7 и 28 дней после операции (д, е); динамика активности SP-позитивных нервных волокон (г). *Достоверные различия с группой “контроль” (при р < 0.05). + Достоверные различия между группой “боль” и “боль + ДГК” (при р < 0.05). # Достоверные различия в группе “боль” на 7 и 28 день после операции. & Достоверные различия в группе “боль + ДГК” на 7 и 28 день после операции.

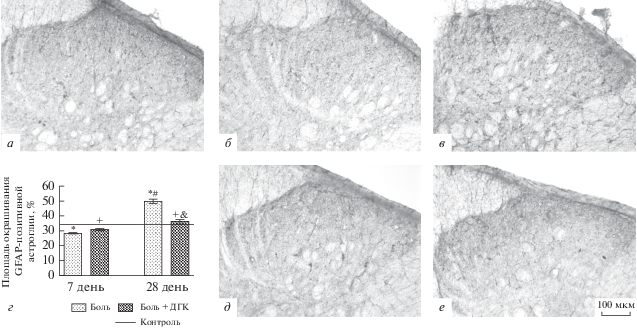
Реакция астроцитов спинного мозга на травму седалищного нерва и терапию ДГК. Типичной реакцией астроцитов на повреждение (травмы, ишемические и геморрагические инсульты) является астроглиоз, морфо-химическим проявлением которого принято считать увеличение основного белка промежуточных филаментов – глиального фибриллярного кислого белка (GFAP) [17]. Активация астроцитов сопровождается экспрессией ряда нейро- и иммуномодулирующих веществ, действие которых на окружающие нервные клетки приводит к сенсибилизации (или десенситизации) последних, сдвигам ионного гомеостаза в их волокнах и изменению метаболических и нейротрансмиттерных свойств [18]. Астроциты в спинном мозге интактных животных распределены достаточно плотно, располагаясь как в пределах серого вещества, так и в спинномозговых канатиках. В поверхностных пластинах заднего рога отмечается максимальная площадь окрашивания астроглии – здесь она занимает от 30 до 38% от общей площади исследуемой области (рис. 4а). На 7 день после перевязки седалищного нерва в группе “боль” площадь окрашивания GFAP-позитивных астроцитов в поверхностных пластинах спинного мозга уменьшается (28.3 ± 0.7%), к 28 дню данный показатель увеличивается (49.9 ± 1.5%) по сравнению с интактными животными (33.8 ± ± 1.6%) (рис. 4б–г). В группе “боль + ДГК” на всех сроках наблюдения площадь GFAP-позитивных астроцитов в поверхностных пластинах спинного мозга не отличается от контрольной группы (рис. 4г–е).
Рис. 4.
GFAP-позитивная астроглия в поверхностных пластинах задних рогов спинного мозга при развитии нейропатической боли. Группа “контроль” (а), группа “боль” через 7 и 28 дней после операции (б, в) и группа “боль + ДГК” через 7 и 28 дней после операции (д, е); динамика активности астроглии (г). *Достоверные различия с группой “контроль” (при р < 0.05). + Достоверные различия между группой “боль” и “боль + ДГК” (при р < 0.05). # Достоверные различия в группе “боль” на 7 и 28 день после операции. & Достоверные различия в группе “боль + ДГК” на 7 и 28 день после операции.
ОБСУЖДЕНИЕ
В наших предыдущих исследованиях установлено, что лигирование седалищного нерва у крыс сопровождается развитием холодовой аллодинии, формированием асимметрии в распределении веса и дистрофическими изменениями в тканях денервированной конечности. Применение ДГК снижает интенсивность и продолжительность развития нейрогенной боли, приводит к более ранней стабилизации распределения веса, предотвращает развитие холодовой аллодинии и дистрофических изменений в ткани денервированной конечности [10]. Повреждение седалищного нерва сопровождается патохимическими, патофизиологическими и патоморфологическими процессами в нервных волокнах и спинном мозге. В дистальном сегменте седалищного нерва травмированных животных наблюдается увеличение диаметра нервных волокон, их дезорганизация, воспалительная клеточная инфильтрация и деградация миелин-позитивных клеточных структур. Активация астроглии и увеличение активности нейрокининовой трансмиссии в задних рогах спинного мозга регистрируется в поздний период развития болевого синдрома.
Высвобождение субстанции Р из терминалей первичных афферентов связано с возникновением и поддержанием ощущения боли. В нашем исследовании показано, что активность нейрокининовой системы в задних рогах спинного мозга при развитии нейропатического болевого синдрома имеет неравномерную динамику. При повреждении нерва на ранних сроках у животных группы “боль” наблюдается снижение экспрессии субстанции Р в волокнах задних рогов спинного мозга, а повышение данного показателя происходит к 28 дню после операции. Подобная ситуация зарегистрирована другими авторами на иных экспериментальных моделях. Так, в ранний послеоперационный период после частичного повреждения седалищного нерва [19], а также на 8 день после наложения лигатуры на подглазничный нерв [11], авторы наблюдали снижение экспрессии SР в соответствующих ноцицептивных центрах. Такое явление можно объяснять разными механизмами. Во-первых, нейрокининовая система работает в сенсорных центрах по циклическому принципу – при гиперактивности SP-ергических механизмов наблюдается интернализация соответствующих нейрокининовых рецепторов с последующим ослаблением высвобождения медиатора из афферентных волокон [20]. Во-вторых, активация апоптоза в сенсорных нейронах ганглиев [10] может сопровождаться уменьшением запаса медиатора в их центральных терминалях. Последующее нарастание активности нейрокининовой сигнализации связано с развитием механизмов периферической сенситизации, и в первую очередь – активацией неуправляемого роста аксонов в месте повреждения, выработки ими нейротрофических факторов и формирования невром [21].
В аспекте проведенного нами исследования можно заметить, что активация нейрокининовой нейротрансмиссии динамически согласована с активацией астроцитарной глии в задних рогах спинного мозга. Насколько взаимомодулирующим или однонаправленным, прямым или опосредованным является взаимодействие SP-ергической системы и астроцитов спинного мозга, еще предстоит выяснить. Однако астроциты имеют на своей поверхности нейрокининовые рецепторы и получают прямые проекции от SP-ергических афферентов [22] и, соответственно, могут быть активированы афферентным нейрокининовым сигналом. В свою очередь, высвобождение SP из аксонов и активность нейрокининовой системы при боли может находиться под влиянием астроцитов – фармакологическое ингибирование их активности сопровождается снижением болевого синдрома за счет угнетения синтеза и высвобождения SP [23]. В нашей работе не удалось зафиксировать прямую связь астроцитарной и нейрокининовой активности в задних рогах спинного мозга с установленной ранее выраженностью болевого поведения экспериментальных животных (по тестам на холодовую аллодинию и инвалидности) [10]. Активация к 28 дню обоих маркеров может быть причастна к развитию другого патологического симптома – тактильной аллодинии. Так как другими исследователями было показано, что фармакологическая регуляция активности астроцитарной глии, а также угнетение SP-ергической нейротрансмиссии способно обеспечивать антиболевой эффект именно в отношении тактильных болевых расстройств [24].
Нейропротекторное действие ДГК в дистальном сегменте поврежденного седалищного нерва, очевидно, ориентировано на поддержание морфологического и функционального гомеостаза Шванновских клеток. Большинство авторов объясняют данный эффект ДГК реализацией системного антивоспалительного и антиоксидантного механизмов действия препарата, осуществляемых непосредственно в области повреждения периферического нерва [8, 25].
Использование ДГК в нашем эксперименте стабилизирует активность исследуемых медиаторных систем спинного мозга на всех сроках наблюдения. Ранее в спектре эффектов ДГК выявлены также специфические нейротрансмиттерные взаимодействия, обеспечивающие подавление болевого сигнала – активация эндогенных опиоидных [26] и неопиоидных [27] механизмов анальгезии. Важными факторами, обеспечивающими стабилизацию SP-ергического афферентного потока у животных, получающих ДГК, можно считать также периферические эффекты препарата, зафиксированные в настоящем исследовании – уменьшение демиелинизации седалищного нерва, ингибирование астроцитоза в задних рогах спинного мозга, а также – снижение уровня апоптоза в нейронах спинальных ганглиев [10]. Ранее установлено, что субстанция Р выступает в качестве медиатора нейрогенного механизма воспаления за счет стимуляции выброса цитокинов (ИЛ-1β, ИЛ-6, TNF-α) в поврежденных периферических тканях [28]. Докозагексаеновая кислота, в свою очередь, может снижать экспрессию данных провоспалительных цитокинов и хемокинов, путем образования высокоактивного метаболита нейропротектина D1 [29]. В нашей предыдущей работе на культуре клеток астроглии, мы также показали, что добавление ДГК приводит к увеличению активности антиоксидантного фермента супероксиддисмутазы, что может способствовать снижению уровня развития нейрогенной боли [30].
Список литературы
Colloca L., Ludman T., Bouhassira D., Baron R., Dickenson A.H., Yarnitsky D., Freeman R., Truini A., Attal N., Finnerup N.B., Eccleston C., Kalso E., Bennett D.L., Dworkin R.H., Raja S.N. // Nat. Rev. Dis. Prim. 2017. V. 3. P. 17002.
Woolf C.J., Mannion R.J. // Lancet. 1999. V. 353. P. 1959–1964.
Obata H., Sakurazawa S., Kimura M., Saito S. // Brain Res. 2010. V. 1363. P. 72–80.
Ji R.-R., Chamessian A., Zhang Y.-Q. // Science. 2016. V. 354. P. 572–577.
Pinho-Ribeiro F.A., Verri W.A., Chiu I.M. // Trends Immunol. 2017. V.38. P. 5–19.
Arcos M., Palanca J.M., Montes F., Barrios C. // J. Invest. Surg. 2013. V. 26(3). P. 109–117.
Farooqui A.A., Horrocks L.A., Farooqui T. // J. Neurochem. 2007. V. 101. P. 577–599.
Bazan N.G. // Curr. Opin. Clin. Nutr. Metab. Care. 2007. V. 10. P. 136–141.
Nakamoto K., Nishinaka T. // Biol. Pharm. Bull. 2010. V. 33. P. 1070–1072.
Manzhulo I.V., Ogurtsova O.S., Lamash N.E., Latyshev N.A., Kasyanov S.P., Dyuizen I.V. // Acta Histochem. 2015. V. 117. P. 659–666.
Xu Z.Z., Liu X.J., Berta T., Park C.K., Lü N., Serhan C.N., Ji R.R. // Ann. Neurol. 2013. V. 74(3). P. 490–495.
Bennett G.J., Xie Y.K. // Pain. 1988. V. 33. P. 87–107.
Nakazato-Imasato E., Kurebayashi Y. // Life Sci. 2009. V. 84. P. 622–626.
Campana W.M., Myers R.R., Rearden A. // Glia. 2003. V. 41. P. 213–223.
Liu H., Mantyh P.W., Basbaum A.I. // Nature. 1997. V. 386. P. 721–724.
Wu L., Xu H., Ko S.W., Yoshimura M., Zhuo M. // Mol. Pain. 2005. V. 1. P. 34–36.
Ren K. // Japan. Dental Sci. Rev. 2010. V. 46. P. 86–92.
Hald A., Nedergaard S., Hansen R.R., Ding M., Heegaard A.M. // Eur. J. Pain. 2009. V. 13. P. 138–145.
Garrison C.J., Dougherty P.M., Carlton S.M. // Brain Res. 1993. V. 607. P. 205–214.
Coutinho S.V., Urban M.O., Gebhart G.F. // Eur. J. Pharmacol. 2001. V. 429. P. 319–325.
Zimmermann M. // Eur. J. Pharm. 2001. V. 429. P. 23–37.
Yihong Z., Tamada Y., Akai K., Suwa F. // Okajimas. Folia Anat. Jpn. 2006. V. 83. P. 91–96.
Guo M., Stockert L., Akbar M., Kim H.Y. // J. Mol. Neurosci. 2007. V. 33. P. 67–73.
Nichols M.L., Allen B.J., Rogers S.D., Ghilardi J.R., Honore P., Luger N.M., Finke M.P., Li J., Lappi D.A., Simone D.A., Mantyh P.W. // Science. 1999. V. 286. P. 1558–1561.
Cunnane S.C., Plourde M., Pifferi F., Bégin M., Féart C., Barberger-Gateau P. // Prog. Lip. Res. 2009. V. 48. P. 239–256.
Nakamoto K., Nishinaka T., Ambo A., Mankura M., Kasuya F., Tokuyama S. // Eur. J. Pharmacol. 2011. V. 666. P. 100–104.
Mathieu G., Denis S., Langelier B., Denis I., Lavialle M., Vancassel S. // Neurochem. Int. 2010. V. 56. P. 94–100.
Wei T., Guo T., Li W., Hou S., Kingery W.S., Clark J.D. // J. Neuroinflam. 2012. V. 9. P. 181.
Lukiw W.J., Cui J.G., Marcheselli V.L., Bodker M., Botkjaer A., Gotlinger K., Serhan C.N., Bazan N.G. // J. Clin. Invest. 2005. V. 115. P. 2774–2783.
Manzhulo I., Tyrtyshnaia A., Kipryushina Y., Dyuizen I., Ermolenko E., Manzhulo O. // Neurosci. Lett. 2018. V. 672. P. 6–14.
Дополнительные материалы отсутствуют.


