Нейрохимия, 2020, T. 37, № 1, стр. 150-23
Нейрорецепторный профиль и поведение субпопуляций мышей CD-1, различающихся устойчивостью внимания
Г. И. Ковалёв 1, Р. М. Салимов 1, Н. А. Сухорукова 1, Е. А. Кондрахин 1, Е. В. Васильева 1
1 ФГБНУ “НИИ фармакологии им. В.В. Закусова”
Москва, Россия
Поступила в редакцию 13.03.2019
После доработки 02.04.2019
Принята к публикации 15.04.2019
Аннотация
С помощью радиолигандного связывания проведен анализ нейрорецепторного профиля в структурах мозга субпопуляций мышей аутбредной CD-1, которые различаются по устойчивости внимания к объектам новой среды в тесте обогащенного закрытого крестообразного лабиринта. У субпопуляции мышей со сниженным вниманием к новым объектам в префронтальной коре головного мозга плотность (Bmax, фмоль/мг белка) дофаминовых рецепторов D2-подтипа оказалась на 25% выше, а ГАМКВ – на 34% ниже, чем у мышей с нормальным вниманием. Связывание с NMDA-рецепторами в гиппокампе и префронтальной коре по показателям Kd и Bmax не обнаруживало статистически значимых отличий между субпопуляциями мышей. В дополнительном исследовании поведение мышей в обогащенном закрытом крестообразном и приподнятом крестообразном лабиринтах оценивали с помощью корреляционного и факторного анализа. Показатель внимания к объектам обогащенного лабиринта коррелировал и имел существенные факторные нагрузки c показателями исследовательской активности (время в центре, число вертикальных стоек) в приподнятом лабиринте, но не имел с показателями тревожности.
ВВЕДЕНИЕ
Cиндром дефицита внимания (СДВ, ADD) и поиск методов его возможной терапии является актуальной проблемой здравоохранения. Основными проявлениями синдрома являются нарушения концентрации внимания в виде трудностей его удержания, снижения избирательности и выраженными частыми переключениями внимания. Для пациентов с подтвержденным диагнозом характерны расстройства социальной адаптации, обучения и поведения [1].
На сегодняшний день существуют различные нейроморфологические, генетические, нейрофизиологические, биохимические, социально-психологические концепции, которые пытаются объяснить механизмы развития данной патологии [2, 3]. Одним из перспективных направлений исследований является изучение изменений в нейроцепторном профиле ряда отделов центральной нервной системы и соотношение их функциональной активности у пациентов с СДВ. К таким отделам относятся, в частности, префронтальная кора, которая участвует в планировании двигательных реакций и формировании целенаправленного акта. Поражение префронтальной коры у животных приводит к снижению концентрации внимания (нарушению способности удерживать информацию более чем на несколько секунд), а также к изменению двигательной активности и эмоциональной реактивности [4].
В современной психофармакологии для оценки эффективности препаратов применяется ряд трансляционных моделей синдрома СДВ с использованием линий животных различного генетического статуса [5]. В лаборатории радиоизотопных методов исследований НИИ фармакологии им. В.В. Закусова предложен новый экспериментальный тест для оценки дефицита внимания у грызунов – “обогащенный закрытый крестообразный лабиринт” (Enrichment Discrimination test) [6, 7]. Преимуществами метода являются простота выполнения экспериментов, его неинвазивность и отсутствие необходимости предварительного научения животных. Тест базируется на врожденном стремлении к ознакомлению с объектами новой обстановки.
Целью настоящего исследования являлась оценка нейрохимических особенностей по показателям радиолигандного связывания у субпопуляций мышей, различающихся по устойчивости внимания к объектам новой обстановки. Кроме того, с помощью корреляционного и факторного анализа предполагалось оценить возможность взаимосвязи между уровнем внимания к объектам среды и показателями двигательной активности и тревожности в обогащенном закрытом крестообразном и приподнятом крестообразном лабиринтах.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Организация экспериментов соответствовала этическим нормам, регламентирующим эксперименты на животных (Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях: EST № 123 от 18 марта 1986 г., Страсбург; Правила надлежащей лабораторной практики”, утвержденные приказом Министерства здравоохранения РФ № 199н от 01.04.2016.). Все экспериментальные установки были поставлены ООО “НПК Открытая Наука” (Россия).
В настоящем исследовании использовали 303 самца мышей CD-1, масса тела 20–25 г., полученных из питомника лабораторных животных “Пущино”. Эта аутбредная линия была использована в связи с тем, что для нее известно влияние наличия элементов обогащенной среды на исследовательское поведение в крестообразном лабиринте [8].
В первом эксперименте участвовало 228 мышей, которые были отобраны по результатам теста исследовательского поведения в обогащенном закрытом крестообразном лабиринте (Enrichment Discrimination test). При этом формировали 2 субпопуляции мышей, которые характеризуются низкой (ED-low, ED-ratio < 100, 114 голов) и высокой (ED-high, ED-ratio > 120, 114 голов) устойчивостью внимания к объектам новой среды. Данные субпопуляции мышей в течение недели использовались в исследовании радиолигандного связывания в структурах мозга.
Во втором эксперименте исследования изучали поведение 75 интактных мышей в 2-х последовательных тестах – обогащенном закрытом крестообразном и приподнятом крестообразном лабиринтах. Каждое животное с интервалом 1–2 мин участвовало в обоих тестах в указанной последовательности.
Тест исследовательского поведения в обогащенном закрытом крестообразном лабиринте (ОЗКЛ) (Enrichment Discrimination test). Лабиринт состоял из 4-х закрытых тупиковых отсеков размером 12 × × 12 × 12 см, соединявшихся между собой через квадратное отверстие размером 7 × 7 см с таким же по размерам закрытым центральным отсеком. В качестве объектов для привлечения и удерживания внимания использовали небольшие стеклянные колбы, помещенные в 2-х противоположных тупиках лабиринта, расположение которых в тупиках чередовали для каждого следующего животного.
Мышь помещали в центральный отсек лабиринта, позволяя свободно перемещаться внутри аппарата, сверху лабиринт накрывали прозрачной крышкой. Регистрировали последовательность переходов из одного отсека в другой и время пребывания в них с помощью программы Enriset. Критерием захода в отсек лабиринта считалось наличие всех четырех лап животного внутри этого помещения. Тест заканчивался, когда происходило 12 таких переходов в течение 5 мин [7].
Последующий компьютерный анализ записи позволял выделить ряд показателей поведения [9]:
1) латентный период и продолжительность 1-го захода в рукав (F_ChTm), уровень настороженности животного в новой обстановке – может рассматриваться как показатель баланса между любопытством и тревогой животного в новой обстановке;
2) “длину” первого цикла патрулирования (F_PtrN) (т.е. посещения всех его четырех отсеков хотя бы один раз), исчисляемую числом заходов в тупики; чем меньше данный показатель, тем больше эффективность обхода тупиков лабиринта; данный показатель отражает эффективность ориентации в пространстве и рассматривается как один из видов когнитивной деятельности, не связанной с собственно двигательной активностью и не требующей предварительного обучения;
3) время, прошедшее до завершения животным 12 заходов в тупики (T_Tm), отражает уровень двигательной активности животного;
4) количество дефекаций во время пребывания в лабиринте (Defc_N). Этот показатель обычно отражает эмоциональность животного и может быть дополнительно использован в оценке уровня тревожности;
5) индекс внимания по отношению к объектам (ED-ratio); отражает соотношение времени, проведенного животным в обогащенных и пустых отсеках лабиринта. Для вычисления данного индекса используется формула:
в которой Tenriched определяется как время, проведенное животным в рукавах установки, содержащих объекты, а Tempty – как время в пустых рукавах соответственно. В случае отсутствия различий во времени Tenriched/Tempty значение индекса ED-ratio было равным 100. Животные, проводившие большее время за изучением объектов в обогащенных отсеках, имели показатель (ED-ratio) более 100 баллов [6, 7].
Тест приподнятого крестообразного лабиринт (ПКЛ) (Elevated Plus-Maze test). Для оценки связи показателя устойчивости внимания к объектам новой среды с показателями тревожности и двигательной активности провели регистрацию поведения группы интактных мышей последовательно в тестах ОЗКЛ и ПКЛ.
В ПКЛ длина рукавов лабиринта составляла 30 см, ширина 5 см, высота стенок 15 см. Два противоположных рукава закрыты с боков и торцов прозрачными стенками; два других – освещены и открыты [10]. Лабиринт был приподнят над полом на высоту 40 см. Мышь помещали в центр лабиринта головой к открытому рукаву, позволяя свободно перемещаться внутри аппарата в течение 5 минут. При этом регистрировали:
1) латентный период до 1-го захода в один из рукавов (F_ChLat);
2) число заходов в рукава (Vis_N);
3) время в открытых рукавах (Open_Tm);
4) время в центре лабиринта (Cen_Tm).
Дополнительно отмечали количество заглядываний за пределы пола открытого рукава (свешиваний, HANG), вставаний на задние лапы (REAR) и число дефекаций (Def_N). Регистрацию поведения мышей осуществляли с помощью видеосистемы и компьютерной программы Smart Junior (Panlab, Испания).
Радиолигандный анализ. После поведенческой сессии в закрытом обогащенном крестообразном лабиринте у мышей извлекали структуры головного мозга и замораживали в жидком азоте для последующего радиолигандного анализа с D2-дофаминовыми рецепторами, глутаматными NMDA-рецепторами и ГАМКB-рецепторами.
Связывание с NMDA-рецепторами. Выделение плазматических мембран префронтальной коры и гиппокампа проводили по модифицированным методам [11, 12]. После декапитации ткань немедленно замораживали в жидком азоте и хранили в низкотемпературном холодильнике при –85°С. Гиппокампы и префронтальную кору размельчали в гомогенизаторе Поттера “тефлон–стекло” в 10 объемах буфера № 1 (5 мМ НЕРЕS, 4.5 мM Tris, 0.32 M Сахароза, рН 7.6). Гомогенат разбавляли 50 объемами буфера № 2 (5 мМ НЕРЕS, 4.5 мM Tris, рН 7.6) и центрифугировали при 1000 g 10 мин на ультрацентрифуге Optima L-70K (Beckman Coulter). Супернатант сливали и вновь центрифугировали при 25 000 g 20 мин. Для увеличения выхода белка эту операцию проводили дважды. Полученный осадок ресуспендировали в 50 объемах буфера № 2 и центрифугировали при 8000 g 20 мин. Супернатант и верхний коричневый осадочный слой сливали и центрифугировали при 25 000 g 20 мин. Осадок ресуспендировали в 50 объемах буфера № 3 (5 мМ НЕРЕS, 4.5 мM Tris, 1 мM Na4EDTA, рН 7.6) и троекратно центрифугировали при 25 000 g 20 мин. Полученный осадок ресуспендировали в 50 объемах буфера № 2 и однократно центрифугировали при 25 000 g 20 мин. Конечный осадок сохраняли в 5 объемах буфера № 2 и замораживали в криопробирках в жидком азоте. В день анализа ткань размораживали, разбавляли в 10 объемах буфера № 2, центрифугировали при 25 000 g 20 мин. Осадок ресуспендировали в необходимом количестве буфера № 2. Концентрация белка в образцах мембран составляла 2–3 мг/мл.
Для радиолигандного анализа NMDA рецепторов использовали меченный тритием МК-801(+), с удельной активностью 210 Кюри/ммоль. Реакционная смесь (конечный объем 0.5 мл) содержала 200 мкл буфера № 2, 50 мкл меченного лиганда (в диапазоне концентраций от 0.1 до 30 нМ) и 250 мкл белкового раствора. Неспецифическое связывание определяли в присутствии 50 мкл немеченого лиганда (+)МК-801 (1 μМ), которое составляло 12–14% от общего. Реакционную смесь инкубировали при комнатной температуре в течение 2 ч.
Связывание с дофаминовыми рецепторами D2-подтипа. Изучение радиорецепторного связывания [3H]-сульпирида с рецепторами дофамина проводили по методу [13] с модификациями. После декапитации ткань немедленно замораживали в жидком азоте и хранили в низкотемпературном холодильнике при –85°С. В день экcперимента структуры гомогенизировали в 10 мл ледяного (0–4°C) 50 мМ Tris-HCl буфера (рН 7.4 при 4°C), используя гомогенизатор “тефлон–стекло”. Полученную суспензию центрифугировали при 40 000 g в течение 20 мин в ультрацентрифуге Optima L-70K (Beckman Coulter). После центрифугирования супернатант сливали, осадок ресуспендировали повторной гомогенизацией в том же объеме буфера, затем вновь центрифугировали. Процедуру отмывки проводили трижды, полученный осадок ресуспендировали в 10 мл 50 мМ Tris-HCl инкубационного буфера (рН 7.4 при 37°C) с добавлением солей (120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2–2H2O, 1 мМ MgCl2–6H2O) и использовали по 250 мкл в процедуре связывания [3H]-сульпирида.
При радиолигандном анализе мембранную фракцию инкубировали с [3H]-сульпиридом (95 Ки/моль), который добавляли в инкубационную смесь в объеме 50 мкл в диапазоне конечных концентраций 0.1–40 нМ и инкубировали в течение 20 мин при температуре 37°C (Sun, 2003) с использованием твердотельного термостата “Термит” (НПО “ДНК-технология”). Неспецифическое связывание определяли в присутствии 50 мкл немеченого лиганда (20 мкМ), которое составляло 25–30% от общего. Объем инкубационной смеси составлял 500 мкл. Процесс связывания останавливали путем добавления 2 мл ледяного 50 мМ Tris-HCl буфера и быстрой фильтрации через стекловолоконные фильтры типа GF/B (Whatman) с последующей промывкой ледяным буфером общим объемом 14 мл.
Связывание с рецепторами ГАМКB-подтипа. Приготовление мембранных препаратов, содержащих ГАМКB-рецепторы префронтальной коры мозга крыс проводили по модифицированным методам [14, 15]. После декапитации ткань немедленно замораживали в жидком азоте и хранили в низкотемпературном холодильнике при –85°С. В день эксперимента фронтальную кору размельчали в гомогенизаторе Поттера “тефлон–стекло” в 10 объемах ледяного буфера (0.32 M Сахароза; pH 7.4). Образовавшийся гомогенат центрифугировали при 1000 g 10 мин. Супернатант повторно центрифугировали при 20 000 g 20 мин. Затем полученный осадок ресуспендировали в дистиллированной воде и вновь центрифугировали 20 мин при 8000 g. Образовавшийся супернатант и верхний надосадочный слой центрифугировали 20 мин при 48 000 g, а осадок суспендировали и вновь центрифугировали в 50 мМ Tris-Сitrate буфере (pH 7.4) 2 раза по 20 мин при 48 000 g, после чего замораживали при –85°С. В день эксперимента мембраны размораживали при комнатной температуре и ресуспендировали в 20 объемах буфера (50 мМ Tris-HCl, 2.5 мM CaCl2, pH 7.4), затем центрифугировали при 8000 g 20 мин. Полученный осадок суспендировали в 20 объемах буфера (50 мМ Tris-HCl, 2.5 мM CaCl2, pH 7.4) и центрифугировали при 20 000 g 20 мин, последнюю процедуру повторяли еще один раз. Конечный осадок ресуспендировали в свежем буфере.
Для проведения радиолигандного анализа использовали меченый тритием (–)Баклофен с удельной активностью 49.7 Кюри/ммоль. Инкубационная смесь (конечный объем 0.5 мл) содержала 50 мкл [G-3H](–)Баклофен, 250 мкл буфера и 200 мкл белковой суспензии мембран, для неспецифического связывания добавляли 50 мкл немеченного лиганда ((–)Баклофен, 1 мМ). Реакционную смесь инкубировали при 4°С в течение 20 мин.
Жидкостно-сцинтилляционная спектрометрия. По окончании инкубации пробы фильтровали через стекловолокнистые фильтры GF/B (Whatman), предварительно смоченные в 0.3% полиэтиленимине в течение 2 ч при комнатной температуре. Каждую пробирку промывали два раза холодным буфером, затем фильтры промывали два раза тем же объемом буфера. Фильтры просушивали на воздухе, переносили в сцинтилляционные флаконы и заливали 5 мл сцинтилляционной жидкости на основе толуола (4 г PPO, 0.2 г POPOP на 1 л толуола). Радиоактивность проб определяли на счетчике Tri-Carb 2900TR (Perkin Elmer) с эффективностью счета 42–46%.
Обработка и представление результатов. Для обработки результатов радиолигандного связывания использовали программу GraphPad Prism 7 Demo и Statistica 6.0. Концентрацию белка измеряли по стандартной методике Лоури (1951). Результаты представлены в виде “mean ± S.E.M”.
Результаты радиолигандного анализа в экспериментах ex vivo оценивали с помощью рассчитанных величин Кd и Bmax, отражающих степень сродства рецептора к лиганду (нМ) и количество мест связывания лиганда (фмоль/мг белка), соответственно. Для анализа насыщения и получения характеристик связывания Bmax и Kd измеряли специфическое связывание для NMDA-рецепторов в диапазоне концентраций от 1.25 до 20 нM, для ГАМКВ-рецепторов – от 2.5 до 20 нМ, для D2-рецепторов – от 1.25 до 20 нМ. Специфическое связывание рассчитывали как разницу между общим и неспецифическим связыванием. Для построения кривых насыщения радиоактивных лигандов каждая концентрация исследуемого вещества была взята в 2-х повторностях.
Статистическую обработку поведенческих данных проводили с помощью программы Statistica 10.0. Различия между субпопуляциями мышей по изучаемым показателям оценивали по 2-стороннему критерию Стьюдента и критерию Манн–Уитни. Для оценки взаимосвязи показателей поведения из разных тестов использовали корреляционный и факторный анализ (метод главных факторов с процедурой вращения осей Varimax normalized). Вычисляли коэффициент корреляции Пирсона, собственные значения выявленных факторов, доли объясняемого ими разнообразия и факторные нагрузки для измеренных показателей. Выбор числа выявленных факторов осуществляли на основе правила Кайзера – по величине собственных значений факторов >1 и правила Кэттелла.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Показатели поведения мышей с низкой (ED-low) и высокой (ED-high) устойчивостью внимания в тесте ОЗКЛ представлены в табл. 1 и находятся в соответствии с ранее полученными данными для изучаемых субпопуляций мышей линии CD1 [7].
Таблица 1.
Показатели поведения субпопуляций мышей аутбредной CD-1 в тесте ОЗКЛ (представлены средние арифметические величины и их стандартные ошибки)
| Экспериментальная группа/показатель | ED-low (n = 114) | ED-high (n = 114) |
|---|---|---|
| F_PtrN | 7 ± 0.2 | 6.8 ± 0.2 |
| F_ChTm | 9.1 ± 0.4 | 9.6 ± 0.8 |
| T_Tm | 126.2 ± 6.2* | 109.6 ± 3.3 |
| Obj_tR# | 57.1 ± 2.8 | 385.2 ± 16.2 |
| Def_N | 0.7 ± 0.1 | 0.4 ± 0.1 |
При определении концентрации мест связывания [G-3H]МК-801 с NMDA рецепторами гиппокампа и префронтальной коры не было обнаружено статистически значимых отличий между подтипами экспериментальных животных как в величине Bmax, так и Kd (табл. 2).
Таблица 2.
Показатели радиолигандного связывания с рецепторами в структурах мозга субпопуляций мышей CD-1 (m ± S.E.M.)
| Радиолиганд | Структура мозга | Субпопуляции мышей CD-1 | |||
|---|---|---|---|---|---|
| ED-high | ED-low | ||||
| параметры связывания | параметры связывания | ||||
| Bmax, фмоль/мг белка | Kd, нМ | Bmax, фмоль/мг белка | Kd, нМ | ||
| [G-3H](+)МК-801 | Префронтальная кора | 1979 ± 100 | 6.8 ± 0.5 | 2216 ± 99 | 7.5 ± 0.8 |
| Гиппокамп | 2685 ± 86 | 6.7 ± 0.5 | 2927 ± 105 | 6.3 ± 0.5 | |
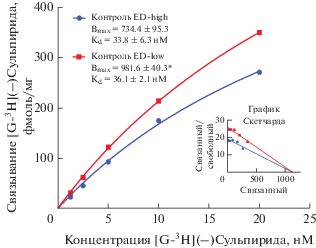
| [ G-3H](–)Сульпирид | Префронтальная кора | 734 ± 95 | 33.8 ± 6.3 | 982 ± 40* | 36.1 ± 2.1 |
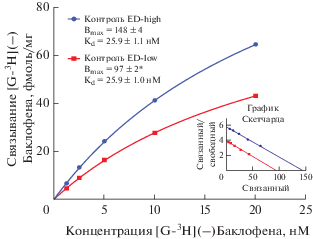
| [G-3H](–)Баклофен | Префронтальная кора | 148 ± 4 | 25.9 ± 1.0 | 97 ± 2* | 25.9 ± 1.1 |
Относительно же плотности мест связывания [G-3H](–)Сульпирида с D2-рецепторами префронтальной коры было установлено, что у животных фенотипа ED-low Bmax на 25% больше по сравнению с фенотипом ED-high (рис. 1).
Рис. 1.
Характеристики радиолигандного связывания [G-3H](–)Сульпирида с D2-рецепторами префронтальной коры субпопуляций мышей CD-1. Примечание: * – статистически значимое отличие между субпопуляциями (F – критерий Фишера, p < 0.05).
При определении концентрации мест связывания [G-3H](–)Баклофена с ГАМКВ-рецепторами префронтальной коры было установлено, что у животных фенотипа ED-low Bmax на 34% меньше по сравнению с фенотипом ED-high (рис. 2). Показатели Kd для рецепторов данных подтипов в выбранных структурах мозга у обеих субпопуляций не различаются статистически значимо.
Рис. 2.
Характеристики радиолигандного связывания [G-3H](–)Баклофена с ГАМКB-рецепторами префронтальной коры субпопуляций мышей CD-1. Примечание: * – статистически значимое отличие между субпопуляциями (F – критерий Фишера, p < 0.05).
Существуют убедительные доказательства в пользу того, что как дофамин (DA), так и норадреналин (NA) вносят вклад в патофизиологию СДВГ, а также в механизм терапевтического действия таких психостимулирующих препаратов, как метилфенидат, амфетамин и пемолин [16].
Эти результаты показывают, что модифицированные катехоламиновые сигналы могут играть решающую роль в патофизиологии СДВГ и терапевтическом ответе на лекарства против СДВГ [17]. Одно из первых клинических исследований, касающихся рецептора D2 при СДВГ, было опубликовано [18], в котором не леченые дети с данным синдромом имели в мозге более высокую плотность дофаминовых D2-рецепторов. Поэтому предполагалось, что высокий уровень этих рецепторов является следствием низкого уровня внеклеточного дофамина, что подтверждает гипотезу о дефиците дофамина, связанную с дефицитом внимания [19].
С другой стороны, гамма-аминомасляная кислота (ГАМК) также может быть вовлечена в патофизиологию синдрома: доклинические исследования указывают на связь между изменениями ГАМК-системы в префронтальной коре мозга и поведенческими признаками у крыс [20], в частности, уменьшением внеклеточной ГАМК [21]. Аналогичные результаты получены в клинических условиях как у детей [22], так и у взрослых [23]. При этом сведений о состоянии ГАМК-рецепторов в мозге, тем более о рецепторах метаботропного ГАМКВ-типа, в научных источниках нами не обнаружено. Следовательно, представленные в нашей работе данные о существенном снижении величины Bmax для связывания [G-3H](–)Баклофена мембранами префронтальной коры мозга мышей с дефицитом внимания к новым объектам являются приоритетными и отражают компенсаторную реакцию на уменьшенное количество синаптической ГАМК.
Поскольку в данном эксперименте были выявлены различия между изучаемыми субпопуляциями мышей по плотности D2- и ГАМКВ-рецепторов и, учитывая, что установлено участие D2- и ГАМКВ-ергических регуляторов в регуляции двигательной активности и тревожности у мышей с тестах исследовательского поведения и приподнятого крестообразного лабиринта [24, 25], в дополнительном эксперименте с помощью корреляционного и факторного анализа оценивали связь в уровне внимания к объектам среды с показателями двигательной активности и тревожности в обогащенном закрытом крестообразном и приподнятом крестообразном лабиринтах.
При анализе поведения мышей в тестах ОЗКЛ и ПКЛ факторное решение выявило 4 фактора, собственные значения которых превышали 1. При этом существенные нагрузки факторов на изучаемые показатели поведения находились в соответствии с наличием статистически значимых корреляций между показателями поведения (табл. 3 и 4). Выявленные 4 фактора объясняли 59% общего разнообразия оценивавшихся признаков.
Таблица 3.
Треугольная матрица коэфициентов корреляции Пирсона между показателями поведения субпопуляции мышей в обогащенном закрытом крестообразном лабиринте (ОЗКЛ) и приподнятом крестообразном лабиринте (ПКЛ) (n = 75)
| Группа | Тест | F_PtrN | F_ChTm | T_Tm | ED-ratio | Defc_N | F_ChLat | Open_Tm | Cen_Tm | Vis_N | HANG | REAR |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ОЗКЛ | ПКЛ | |||||||||||
| F_ChTm | ОЗКЛ | –0.05 | ||||||||||
| T_Tm | 0.23 | 0.19 | ||||||||||
| ED-ratio | 0.27 | –0.04 | –0.11 | |||||||||
| Defc_N | –0.12 | 0.17 | 0.43 | 0.03 | ||||||||
| F_ChLat | ПКЛ | –0.04 | 0.44 | 0.28 | –0.1 | 0.08 | ||||||
| Open_Tm | –0.09 | –0.2 | –0.22 | –0.02 | –0.28 | –0.05 | ||||||
| Cen_Tm | –0.03 | –0.21 | –0.09 | 0.31 | –0.01 | –0.08 | –0.29 | |||||
| Vis_N | –0.28 | –0.32 | –0.49 | –0.09 | –0.19 | –0.36 | 0.21 | 0.11 | ||||
| HANG | –0.2 | –0.34 | –0.32 | –0.06 | –0.27 | –0.16 | 0.55 | 0.04 | 0.65 | |||
| REAR | –0.05 | –0.31 | –0.14 | –0.22 | –0.26 | –0.16 | 0.01 | –0.1 | 0.59 | 0.4 | ||
| Def_N | 0.2 | 0.25 | 0 | –0.04 | –0.08 | 0.14 | –0.14 | –0.04 | –0.38 | –0.37 | –0.34 | |
Таблица 4.
Факторные нагрузки на показатели поведения мышей в обогащенном закрытом крестообразном лабиринте (ОЗКЛ) и приподнятом крестообразном лабиринте (ПКЛ) (n = 75)
| Показатели поведения | Тест | Фактор 1 | Фактор 2 | Фактор 3 | Фактор 4 |
|---|---|---|---|---|---|
| F_PtrN | ОЗКЛ | 0.09 | –0.10 | 0.04 | –0.89 |
| F_ChTm | –0.73 | 0.16 | –0.06 | 0.14 | |
| T_Tm | –0.21 | 0.20 | –0.73 | –0.39 | |
| ED-ratio | 0.03 | –0.81 | –0.01 | –0.21 | |
| Defc_N | –0.18 | –0.12 | –0.78 | 0.15 | |
| F_ChLat | ПКЛ | –0.62 | 0.21 | –0.15 | 0.09 |
| Open_Tm | 0.03 | 0.02 | 0.17 | 0.01 | |
| Cen_Tm | 0.23 | –0.64 | 0.06 | 0.23 | |
| Vis_N | 0.68 | 0.10 | 0.22 | 0.49 | |
| HANG | 0.49 | 0.04 | 0.14 | 0.33 | |
| REAR | 0.70 | 0.50 | 0.09 | 0.10 | |
| Def_N | –0.53 | 0.02 | 0.49 | –0.30 | |
| Факториальная дисперсия в % от общей дисперсии | 21% | 12% | 13% | 13% | |
Фактор 1 имел значительные нагрузки в основном на показатели поведения в ПКЛ – исследовательскую активность (число заходов рукава, свешиваний и стоек), а также на показатели “тревожности” или осторожности при исследовании данной среды [8] – латентный период первого захода в рукав ПКЛ и ОЗКЛ и число дефекаций в ПКЛ). Знак указанных факторных нагрузок указывает на реципрокные отношения исследовательской активности и тревожности и соответствует известным данным [26]. В целом фактор 1 можно охарактеризовать как “исследовательская активность в ПКЛ”.
Фактор 2 имел значительные нагрузки на индекс внимания в ОЗКЛ, а также на время в центре и число стоек в ПКЛ. Данный фактор не имел нагрузок на показатели тревожности и двигательной активности в обоих тестах [8] (латентный период первого захода в рукав ПКЛ и ОЗКЛ и число дефекаций), в связи с чем его можно охарактеризовать как “внимание в обстановке”.
Фактор 3 имел значительные нагрузки на подвижность (общее время теста) и число дефекаций в ОЗКЛ, а также на число дефекаций в ПКЛ. С учетом знаков нагрузок он свидетельствует, что особи, которые в ОЗКЛ характеризуются подвижностью и эмоциональностью, в ПКЛ демонстрируют более выраженную эмоциональность. Последнее может объясняться наличием в ПКЛ открытых рукавов.
Фактор 4 имел значительные нагрузки на показатели ориентации и подвижности в ОЗКЛ, а также исследовательской активности в ПКЛ. Знаки нагрузок указывают, что “эффективная” ориентация (малое число заходов в рукава до посещения всех рукавов хотя бы раз) и высокая подвижность (малое общее время теста) в ОЗКЛ сочетаются с высокой исследовательской активностью в ПКЛ (число заходов рукава и свешиваний). Следовательно, данный фактор характеризует когнитивную активность, направленную на ознакомление с взаимным расположением частей среды, подобно тому, как это происходит в природе при осмотре грызуном норы.
ЗАКЛЮЧЕНИЕ
Таким образом, корреляционный и факторный анализ свидетельствует об отсутствии связи внимания к объектам новой среды в тесте ОЗКЛ с показателями двигательной активности, тревожности и эмоциональности. Данный результат позволяет предположить, что различия в плотности D2-дофаминовых и ГАМКВ-рецепторов, выявленные между субпопуляциями мышей с разными уровнями внимания, по-видимому, связаны собственно с когнитивным доменом нейронального контроля внимания.
Список литературы
Faraone S.V., Biederman J., Weber W., Russell R.L. // J. Am. Acad. Child. Adolesc. Psychiatry. 1998. T. 37. № 2. C. 185–193.
Banaschewski T., Becker K., Scherag S., Franke B., Coghill D. // Eur. Child. Adolesc. Psychiatry. 2010. T. 19. № 3. C. 237–57.
Cortese S. // Eur. J. Paediatr. Neurol. 2012. T. 16. № 5. C. 422–33.
Баркер Р., Барази С., Нил М. // Наглядная неврология / Скворцова В.И., ред. М.: ГЭОТАР-Медиа, 2006. 136 с.
Davids E., Zhang K., Tarazi F.I., Baldessarini R.J. // Brain. Res. Brain. Res. Rev. 2003. T. 42. № 1. C. 1–21.
Salimov R.M., Kovalev G.I. // J. Behav. Brain. Sci. 2012. T. 2. № 4. C. 479–484.
Salimov R.M., Kovalev G.I. // J. Behav. Brain. Sci. 2013. T. 3. № 2. C. 210–216.
Aujnarain A.B., Luo O.D., Taylor N., Lai J.K.Y., Foster J.A. // Behav. Brain. Res. 2018. T. 16. № 342. C. 43–50.
Ковалёв Г.И., Васильева Е.В. Салимов Р.М. // Журн. высш. нервн. деят. им. И.П. Павлова. 2019. Т. 69. № 1. С. 123–130.
Pellow S., Chopin P., File S.E., Briley M. // J. Neurosci. Methods. 1985. T. 14. № 3. C. 149–167.
Zhou L.M., Gu Z.Q., Costa A.M., Yamada K.A., Manssone P.E. // J. Pharmacol. Exp. Ther. 1997. V. 280. № 1. P. 422–427.
LaPage K.T., Ishmael J.E., Low C.W., Traynelis S.F., Murray T.F. // Neuropharmacology. 2005. V. 49. P. 1–16.
Imafuku J. // Brain Res. 1987. T. 402. № 2. C. 331–338.
Bowery N.G., Hill D.R., Hudson A.L. // Neuropharmacology. 1985. V. 24. № 3. P. 207–10.
Szekely A.M., Barbaccia M.L., Costa E. // J. Pharmacol. Exp. Ther. 1987. V. 243(1). P. 155–9.
Kollins S.H. // Curr. Med. Res. Opin. 2008. T. 24. № 5. C. 1345–57.
Madras B.K., Miller G.M., Fischman A.J. // Biol. Psychiatry. 2005. T. 57. № 11. C. 1397–409.
Ilgin N., Senol S., Gucuyener K., Gokcora N., Sener S. // Dev. Med. Child. Neurol. 2001. T. 43. № 11. C. 755–60.
Montgomery A.J., Asselin M.C., Farde L., Grasby P.M. // J. Cereb. Blood Flow Metab. 2007. T. 27. № 2. C. 369–77.
Pezze M., McGarrity S., Mason R., Fone K.C., Bast T. // J. Neurosci. 2014. T. 34. C. 7931–7946.
Sterley T.L., Howells F.M., Russell V. // Brain Res. 2013. T. 1541. C. 52–60.
Edden R.A.E., Crocetti D., Zhu H., Gilbert D.L., Mostofsky S.H. // Arch. Gen. Psychiatry. 2012. T. 69. C. 750–753.
Schür R.R., Draisma L.W.R., Wijnen J.P., Boks M.P., Koevoets M.G.J.C., Joëls M., Klomp D.W., Kahn R.S., Vinkers C.H. // Hum. Brain Mapp. 00. 2016.
Radl D., Chiacchiaretta M., Lewis R.G., Brami-Cherrier K., Arcuri L., Borrelli E. // Proc. Natl. Acad. Sci. USA. 2018. T. 115. № 1. C. 198–203.
Partyka A., Kłodzińska A., Szewczyk B., Wierońska J.M., Chojnacka-Wójcik E., Librowski T., Filipek B., Nowak G., Pilc A. // Pharmacol. Rep. 2007. T. 59. № 6. C. 757–62.
Montgomery K.C. // J. Comp. Physiol. Psychol. 1955. T. 48. № 4. C. 254–260.
Дополнительные материалы отсутствуют.


