Нейрохимия, 2020, T. 37, № 1, стр. 5-14
Роль аквапоринов в функционировании нервной системы в норме и при патологии
М. Е. Щепарева 1, М. Н. Захарова 1
1 ФГБНУ “Научный центр неврологии”
Москва, Россия
Поступила в редакцию 13.02.2019
После доработки 05.04.2019
Принята к публикации 10.04.2019
Аннотация
Аквапорины представляют собой трансмембранные белки. Основной их функцией в нервной системе является осуществление транспорта воды. Кроме того, некоторые из них способны к транспорту глицерола, мочевины, некоторых газов, а также участвуют в формировании глиального рубца, миграции астроцитов, передаче нервного импульса. Имеются данные о том, что аквапорины принимают участие в патогенезе отека, новообразований головного мозга, аутоиммунных процессов, пароксизмальных состояний. При оптикомиелите – аутоиммунном демиелинизирующем заболевании центральной нервной системы – аквапорин 4 (AQP4) является мишенью для специфических антител (AQP4-IgG). На данном основании аквапорины рассматриваются в качестве терапевтических мишеней. В данном обзоре рассмотрены строение, функции аквапоринов в норме, а также их роль в развитии неврологических заболеваний.
ВВЕДЕНИЕ
Аквапорины (AQP) – семейство интегральных мембранных водных белков-переносчиков, формирующих водные каналы, основной функцией которых является облегчение движения воды через клеточные мембраны по осмотическим градиентам.
Первым в 1991 г. американским терапевтом и микробиологом Питером Огрэем (Peter Agre) был открыт аквапорин 1 (AQP1), по этому поводу в 2003 г. он был награжден Нобелевской премией по химии [1]. В дальнейшем было открыто еще 12 представителей этой группы.
В настоящее время аквапорины обнаружены во всех клетках организма. У человека они подразделяются на 13 типов (AQP0…AQP12), при этом их аминокислотные последовательности идентичны на 30–50%. Транспорт воды является основной функцией аквапоринов в ЦНС, однако конформационные изменения белка позволяют плазматической мембране также пропускать глицерин, мочевину и некоторые газы, в связи с чем по функциональному значению они классифицируются на 2 подтипа: транспортирующие воду (AQP0, 1, 2, 4, 5, 6 и 8) и транспортирующие воду и другие вещества (акваглицеропорины), такие как глицерол, мочевину и некоторые газы (AQP3, 7, 9, 10) [2, 3]. Однако в недавних исследованиях было показано, что аквапорины первого подтипа могут также транспортировать небольшие растворенные вещества (например, глицерин), а также, на основании структурных отличий некоторых аквапоринов от первых двух подтипов, выделен третий подтип аквапоринов – супераквапорины (AQP11, 12) [4].
Аквапорины стали известны в неврологии благодаря исследованиям аутоиммунной природы оптикомиелита Девика, при котором были обнаружены антитела к аквапорину 4 (AQP4-IgG) в сыворотке пациентов. Множество исследований посвящено участию аквапоринов в развитии отека мозга. Изучается роль аквапоринов в развитии опухолей мозга, эпилепсии. Предполагаемое участие данных молекул в патогенезе заболеваний делает актуальным изучение состояния данной проблемы в настоящее время [5].
СТРОЕНИЕ АКВАПОРИНОВ
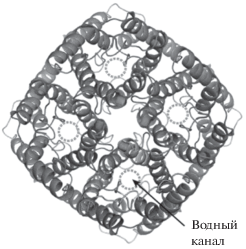
Аквапориновые мономеры имеют массу ~30 кДа и содержат 6 трансмембранных α-спиральных доменов, которые образуют “бочонок” в плоскости мембраны, и 2 коротких α-спиральных домена, расположенные в этом “бочонке” друг напротив друга и образующие водный канал. 6 указанных доменов имеют N- и С-концы, направленные в цитоплазму и отвечающие за специфическую регуляцию активности аквапорина. Цепочка мономеров, пронизывающая мембрану, имеет внеклеточные петли (А, С, Е), а также внутриклеточные петли (В, D). Петля А является более антигенной частью AQP. Петли В и Е расположены в мембране с противоположных сторон, где они сближаются, образуя водный канал. AQP образуют стабильные тетрамеры в мембранах, при этом каждый отдельный мономер образует независимый водный канал, а вдоль оси тетрамера находится катионная пара, обеспечивающая ионный транспорт (рис. 1).
Движение молекул воды осуществляется через узкий водный канал одинаково легко в обоих направлениях, а стерические и электростатические факторы отвечают за селективность аквапориновых каналов. Аквапориновые каналы имеют форму песочных часов, поскольку их концы имеют воронкообразное преддверие. Гидрофобность внутренней поверхности канала и то, насколько он узок, определяют высокую скорость движения воды [7].
ФУНКЦИИ АКВАПОРИНОВ В ЦНС
Регуляция движения и избирательного поступления воды является основной функцией аквапоринов. Некоторые исследования показывают, что AQP4 играет важную роль при определении водопроницаемости ГЭБ [7, 8]. Однако у мышей, не имеющих AQP4, было выявлено нормальное внутричерепное давление при незначительном увеличении общего содержание воды в мозге, что может свидетельствовать о том, что медленное движение воды в нормальных физиологических условиях может происходить через AQP4-независимые пути. В некоторых исследованиях сделан вывод, что экспрессия AQP4 коррелирует с выраженностью отека мозга при заболеваниях человека и грызунов [9, 10]. В моделях цитотоксического (внутриклеточного) отека, вызванного накоплением избытка воды или ишемией, у AQP4-дефицитных мышей продемонстрированы лучшие исходы, чем в моделях вазогенного (внеклеточного) отека. AQP1 играет роль в секреции ЦСЖ, а AQP4 участвует в ее обратном всасывании.
Наряду с этим показана роль аквапоринов в миграции астроцитов. Так, в исследовании было проведено добавление ртути микропипетками, что привело к нарушению подвижности нейтрофилов, предположительно, за счет уменьшения водного потока через AQP9 [11]. В дальнейшем была показана роль AQP в облегчении миграции широкого спектра иммунных, эпителиальных, опухолевых и других типов клеток [12]. На основании ряда исследований сделан вывод, что AQP4-зависимая миграция астроцитов может облегчать образование глиального рубца.
Проведены исследования, позволяющие судить о роли аквапоринов в передаче нервного сигнала и в обратном захвате глутамата после синаптической передачи. У AQP4-дефицитных мышей продемонстрировано увеличение частоты спонтанных судорог в течение первой недели после эпилептического статуса. Также выявлено ухудшение передачи слухового импульса, нарушение функции сетчатки, ослабление обоняния у AQP4-дефицитных мышей [13]. Возможные механизмы этих явлений, подтвержденные экспериментальными данными, включают задержку обратного захвата K+ астроцитами при дефиците AQP4 после возбуждения нейронов и расширение внеклеточного пространства. Связь между обратным захватом K+ астроцитами и водопроницаемостью AQP4 неизвестна. Есть предположение, что AQP4-зависимое движение воды усиливает транспорт K+. Избыток K+, высвобождаемый во внеклеточное пространство мозга из нейронов во время их возбуждения, в основном поглощается AQP4-содержащими астроцитами, вызывая осмотический приток воды и, как следствие, уменьшение внеклеточного пространства, которое поддерживает электрохимическую движущую силу для обратного захвата. Поэтому снижение водопроницаемости астроцитов при дефиците AQP4 уменьшает сокращение внеклеточного пространства и замедляет обратный захват K+ [14].
Известно, что воспалительные заболевания ЦНС сопровождаются активацией астроцитов, AQP4, а также секрецией цитокинов и хемокинов. Было показано, что IL-1 индуцирует экспрессию AQP4 [15]. Также в культурах астроцитов выявлено, что активация протеинкиназы С вызывает снижение мРНК и белков AQP4 и AQP9 [3].
Было выявлено, что нарушение экспрессии AQP4 может влиять на глифатическую систему и выведение токсичных веществ из периваскулярного пространства (будет рассмотрено ниже более подробно).
Возле петли Е находится цистеин 189, который в присутствии ртути образует с ней ковалентную связь, вследствие чего блокируется водный канал. Также известно, что угнетают функцию AQP4 Cu2+, Zn2+, тетраэтиламмония хлорид, вазопрессин, мелатонин, С-конец протеин киназы С, тромбин, дофамин, условия гипоксии, буметанид, ацетазоламид, H2S. Перечисленные вещества могут способствовать развитию отека головного мозга, судорог, образованию глиального рубца. В то же время глутамат, синтрофин, дистрофин, коннексин 43 (Cx43), K+, Na+, Pb2+, циклический АМФ, молочная кислота повышают активность AQP4 [16–18].
ЛОКАЛИЗАЦИЯ И ХАРАКТЕРИСТИКА АКВАПОРИНОВ
В ЦНС экспрессируются AQP1, 3, 4, 5, 6, 7, 8, 9, 11 и регулируют движение воды между 4 водными секторами в ЦНС (кровью, ликвором, внутриклеточной и межклеточной жидкостью) [18]. Тот факт, что AQP экспрессируется в некоторых областях ЦНС, которые не ограничены ГЭБ (преламинарный отдел диска зрительного нерва, области, окружающие желудочки мозга, зоны входа корешков в спинной мозг), заставляет предполагать, что они могут являться исходной мишенью для специфичных антител. Аквапорины являются потенциальными мишениями при различных неврологических заболеваниях, в настоящее время в их развитии выявлена роль AQP1, 4, 9, ввиду чего они будут рассмотрены ниже более подробно.
Аквапорин 1. Этот тип аквапорина был найден в клетках практически всех органов [18]. AQP1 экспрессируется в эритроцитах, эндотелии кровеносных и лимфатических сосудов, сосудов легких и дыхательных путей, кортиевом органе, эндотелиоцитах желчного пузыря, междольковых протоках и ацинозных клетках поджелудочной железы, клетках брюшины, проксимальных канальцах почек [19–22]. Важной функцией AQP1 является участие в концентрации мочи, т. к. он осуществляет осмотический водный транспорт в нисходящей части петли Генле. Открытие экспрессии аквапоринов в мозге побудило к изучению возможной связи между аквапоринами и неврологическими состояниями, связанными с нарушениями движениями воды, например, отек мозга [23]. Предполагается, что способность AQP1 к транспорту газа играет важную роль в физиологии мозга. Считается, что диффузия газов, особенно NO является основой нейрональной сигнализации и цереброваскулярного контроля. К тому же такой газ как NH3, который имеет низкую мембранную проницаемость, вовлечен в патогенез гипераммониевой энцефалопатии. Определенную роль он может играть и в миграции лейкоцитов, облегчая диффузию воды при полимеризации актиновых филаментов для формирования филоподий [24]. AQP1 в основном распределяется на апикальной мембране эпителиальных клеток сосудистого сплетения, что говорит о его роли в секреции ЦСЖ. 25% производства ЦСЖ осуществляется с помощью трансцеллюлярного движения воды через AQP1. AQP1 найден в маленьких сенсорных клетках заднего рога спинного мозга, в тройничном и узловатом ганглиях – отсюда предположение участия AQP1 в болевой чувствительности. Также AQP1 экспрессируется в астроцитах белого вещества мозга [25]. AQP1 играет важную роль в ангиогенезе, миграции и росте клеток. Предполагается, что AQP1 может быть вовлечен в опухолевый процесс, так как он был обнаружен на эндотелии сосудов различных опухолей: глиобластома, астроцитома, метастазирующая карцинома, менингиома, а также субэпендимальная астроцитома и опухоли сосудистого сплетения. Данное наблюдение связывают с уже упомянутой ролью AQP1 в ангиогенезе и в процессе инвазии опухолевых клеток [26]. Также было показано, что активность AQP1 напрямую влияет на скорость пролиферации клеток – недостаточная или сверхэкспрессия соответственно снижает или увеличивает рост клеток, тем самым регулируя процесс апоптоза [27]. Также AQP1 играет роль в развитии нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона. Данный тип аквапорина был обнаружен в астроцитах теменной доли при болезни Паркинсона [28].
Исходя из этих результатов, многие исследователи предполагают, что AQP1-ингибиторы могут быть использованы в лечении опухолей головного мозга [29]. Представляет интерес то, что AQP1 может ингибироваться мелатонином у грызунов при повреждении спинного мозга и агматином при отеке головного мозга [30], что указывает на то, что агонисты мелатонина и агматина могут быть использованы в лечебных целях. Также есть предположение, что существует взаимосвязь между AQP1 и нейропатической болью, поскольку при снижении экспрессии AQP1 наблюдалось снижение интенсивности болевого синдрома [31].
Аквапорин3, 5, 8. AQP3, 5, 8 экспрессируются в астроцитах, нейронах пириформной коры, гиппокампа и дорсальных отделах таламуса [32]. Вне ЦНС AQP3 выявлен в цитоплазматических мембранах кератиноцитов эпидермиса кожи человека, эритроцитах, кортиевом органе, эпителии конъюнктивы, всех отделов желудочно-кишечного тракта, трахеи, легких, мочеиспускательного канала, мочевого пузыря, в почечной лоханке. AQP5 также экспрессируется в хвостатом ядре и бледном шаре, а вне ЦНС встречается в роговице глаза, слюнных железах, альвеолярном эпителии, железах желудка и двенадцатиперстной кишки, поджелудочной железе. Экспрессия AQP8 в меньшей степени выявлена в олигодендроцитах, клетках эпиндимы центрального канала спинного мозга, сосудистом сплетении мозга, а также в слюнных железах, поджелудочной железе, тонкой и толстой кишке, печени, проксимальном канальце почек, семявыносящем протоке [18, 33].
AQP3 проницаем для воды, глицерина и мочи. Сравнительно недавно выяснено, что данный аквапорин имеет важное значение в гидратации кожи и эпидермальной пролиферации [34]. В настоящее время роль AQP3 в ЦНС до конца не изучена. Проводилось исследование, показавшее, что в первые 6 часов церебральной ишемии увеличивается экспрессия AQP3, что указывает на роль AQP3 в раннем образовании отека головного мозга [35].
В исследованиях показано повышение экспрессии AQP5 в головном мозге на фоне постоянной фокальной церебральной ишемии, внутрижелудочкового кровоизлияния, травматического повреждения, а также отека мозга у пациентов с менингиомой [36]. При изучении влияния гипоксии на экспрессию AQP3, 4, 5, 8, 9, выявлено, что гипоксия вызывала заметное снижение уровней экспрессии AQP4, 5 и 9, но не влияла на AQP3 и 8. Последующая реоксигенация вызывала восстановление экспрессии AQP4 и 9 до их базальных уровней, в то время как экспрессия AQP5 на этом фоне увеличилась примерно в 3 раза с последующим ее снижением в течение 20 ч после гипоксии. Полученные данные подтверждают участие AQP5 в развитии отека головного мозга на фоне церебральной ишемии [37].
AQP8 играет важную роль в развитии отека и опухолей головного мозга. Выявлена корреляция между экспрессией AQP8 и степенью тяжести астроцитомы и глиомы, на основании чего представляется перспективным создание препаратов для лечения данных заболеваний [38, 39]. В экспериментальной моделе колита, имитирующей болезнь Крона человека, с усилением выраженности воспаления подавляется экспрессия AQP8, что может указывать на то, что данный аквапорин, возможно, вовлечен в воспалительное заболевание кишечника [40].
Аквапорин6, 7, 11. AQP6 обнаружен в синаптических везикулах мозга крысы, в собирательных трубочках почки [41, 42]. Расположение AQP6 в синаптических везикулах может участвовать в их набухании и секреции, однако его роль в ЦНС до конца не ясна.
AQP7 найден в апикальной мембране эпителиальных клеток сосудистого сплетения, что предполагает его участие в продукции ЦСЖ. Также AQP7 находится в кортиевом органе, плазматической мембране адипоцитов, сперматозоидах, проксимальном канальце почек, поджелудочной железе [43]. У AQP7-нулевых мышей замечено прогрессирующее увеличение жировой массы и гипертрофии адипоцитов, накопление в них глицерина и триглицеридов. Предполагается, что причиной данных изменений является пониженная проницаемость плазматической мембраны для глицерина, что приводит к накоплению внутриклеточного глицерина и триацилглицерина. На этом основании сделан вывод, что AQP7 является важным звеном в регуляции метаболизма при сахарном диабете и ожирении, и воздействие на его экспрессию может изменять жировую массу [23]. Также AQP7 экспрессируется в β-клетках поджелудочной железы. Исследования на мышах подтвердили его участие в секреции инсулина и пролиферации данных эндокринных клеток. Показано, что активация AQP7 после бариатрической операции приводила к повышению секреции инсулина за счет увеличения внутрицитоплазматического глицерина у тучных крыс, однако результаты исследования остаются недостаточными и противоречивыми. В настоящее время обсуждается необходимость дальнейшего исследования AQP7 для определения перспектив создания новых противодиабетических препаратов [44].
AQP11 экспрессируется в клетках Пуркинье головного мозга, а также в печени, яичках и проксимальном канальце почек. У крыс и мышей выявлен в гиппокампе, эпителии сосудистого сплетения и эндотелии капилляров головного мозга. Предполагается, что AQP11 транспортирует воду так же активно, как AQP1. Хотя детальная субклеточная локализация данного аквапорина неизвестна, замечено, что он колокализуется с маркерами эндоплазматического ретикулума в трансфицированных клетках и в почках AQP11-трансгенных мышей [45, 46]. Интересно, что у мышей, нулевых по AQP11, снижается экспрессия AQP4 в два раза, что позволяет предположить их функциональное взаимодействие. AQP11, расположенный в клетках Пуркинье, обладает высокой афинностью с ионами ртути. На данном основании не исключается его роль в развитии аутизма и может иметь смысл поиск препаратов для заболеваний, связанных с нарушением когнитивных функций.
Аквапорин 4. AQP4 – наиболее распространенный водный канал в головном и спинном мозге, а также в зрительном нерве, преимущественно экспрессирующийся в астроцитарной ножке, контактирующей с микрососудами, и сосудистых сплетениях, что позволяет предполагать участие AQP4 в облегчении транспорта воды в мозг и из него. В клетках эпендимы, в гиппокампе AQP4 экспрессируется во всей плазматической мембране. AQP4 проницаем для воды и СО2 [25]. Распределение AQP4 различно в структурах головного мозга. Его наибольшая экспрессия наблюдается в гиппокампе, мозолистом теле, гипоталамусе, в стволе головного мозга. В спинном мозге и зрительном нерве AQP4 экспрессируется в периваскулярных астроцитарных ножках и в пограничной глиальной мембране.
Такая поляризованная экспрессия AQP4 может являться результатом внутриклеточных взаимодействий между этим каналом и α-синтрофином (внутриклеточным белком, способным образовывать комплекс с AQP4) или внеклеточных взаимодействий AQP4 с агрином (протеогликаном, прикрепленным к внеклеточному матриксу, способным закрепить AQP4 в мембране). Как и AQP4, α‑синтрофин и агрин демонстрируют поляризованную экспрессию в астроцитарных ножках. Для поляризации AQP4 также могут быть важны межклеточные контакты астроцитов с эндотелиальными и пиальными клетками, так как потеря этих контактов приводит к отсутствию поляризованной экспрессии [47, 48].
Также AQP4 выявлен в клетках Мюллера сетчатки глаза, цилиарном теле, кортиевом органе, эпителии верхних дыхательных путей, париетальных клетках желудка, собирательных трубочках почек.
Недавно было выяснено, что AQP4 участвует в выведении метаболитов мозговой ткани, таких как бета-амилоид. Было предположено, что цереброспинальная жидкость проникает в периваскулярные пространства пенетрирующих мозговую ткань артериол и замещает интерстициальную жидкость. Интерстициальная жидкость и растворенные вещества выводятся из тканей головного мозга через периваскулярные пространства венул и вен. Этот феномен облегчает перемещение астроглиальной жидкости через каналы AQP4 [49].
Существуют две преобладающие изоформы AQP4 (M1 и M23), взаимодействующие между с собой для образования гомо- и гетеротетрамеров. M1 и M23 различаются на цитоплазматическом N-конце, который в M1 имеет 22 дополнительных остатка. AQP4 может образовывать кристаллоподобные супрамолекулярные сборки в плазматической мембране, которые называются ортогональными массивами частиц (образованные М23 гомотетрамерами), являющихся ультраструктурным признаком астроцитарных мембран, биологическая значимость которых до конца неизвестна. Было высказано предположение, что ортогональные массивы частиц облегчают поляризацию AQP4 [50]. AQP4-IgG связывается как с M1, так и с M23 изоформами. AQP4-M1 быстро восстанавливается на плазматической мембране после исчезновения AQP4-IgG. Это может представлять собой модель, демонстрирующую обратимые изменения на фоне лечения, направленного на утилизацию AQP4-IgG [51].
В астроцитах, культивируемых в одиночку, AQP4 коэкспрессируется совместно с CD59. CD59 – регуляторный белок системы комплемента, блокирующий мембраноатакующий комплекс, тем самым защищая клетку от лизиса. Однако в астроцитарно-эндотелиальной клеточной культуре коэкспрессия с CD59 отсутствует. Эти данные говорят о том, что астроциты, культивируемые совместно с эндотелиальными клетками, более уязвимы для AQP4-IgG и комплемент-опосредованного лизиса, чем астроциты, культивируемые без эндотелиальных клеток. Можно предположить, что это является причиной избирательного поражения ЦНС при оптикомиелите, так как экспрессия AQP4 наблюдается и в других органах.
Замечено, что локализация AQP4 связана с распределением калиевых каналов. В ряде работ показано, что в гиппокампе AQP4 экспрессируется в слое CA1 и зубчатой извилине, где он может способствовать быстрому потоку воды, необходимому для поддержания гомеостаза калия для регуляции электрической активности мозга. Было выявлено, что отсутствие AQP4 приводило к задержке обратного захвата внеклеточного калия при эпилепсии [52]. Таким образом, AQP4 может являться лекарственной мишенью в терапии медиальной височной эпилепсии.
Предполагается, что AQP4 участвует в клеточной адгезии [53]. AQP4 также может участвовать в диффузии газов, таких как СО2. Кроме того, AQP4 присваивается потенциальная роль в изменении осмотического давления плазмы в ядрах гипоталамуса [54].
Аквапорин 9. AQP9 проницаем для воды, глицерина, мочевины и монокарбоксилатов. Он присутствует в эпендимальных клетках, выстилающих желудочки и таницитах гипоталамуса, астроцитах, эндотелиальных клетках сосудов мягкой мозговой оболочки, катехоламинергических нейронах, гепатоцитах.
AQP9 представлен двумя изоформами, одна из которых обнаружена на внутренней мембране митохондрий, а другая в клеточной мембране. Было показано, что AQP9 участвует в энергетическом метаболизме глюкозы в астроцитах, способствуя диффузии глицерина. Из ряда исследований можно сделать вывод, что AQP9 поддерживает энергетический баланс в нейронах, способствуя диффузии глицерина и монокарбоксилатов, служащих энергетическими субстратами в ЦНС [55]. Кроме этого, было показано, что AQP7 и AQP9 являются важными регуляторами метаболизма при диабете и ожирении. Как было сказано, AQP9 экспрессируется в синусоидальной плазматической мембране гепатоцитов, где он способствует поглощению глицерина в печени, а также поглощению NH3 и опосредует отток вновь синтезированной мочевины. Помимо участия в транспорте глицерина, AQP9 облегчает мембранный перенос H2O2 в клетках человека и мышей. В результате проведенных исследований выяснено, что дефицит AQP9 уменьшает цитотоксичность, вызванную H2O2, избыток которого может наблюдаться при действии радиации, интоксикациях [56]. Есть данные о том, что в период ишемического прекондиционирования мозга у мышей увеличивалась экспрессия AQP9 и наблюдались морфологические изменения астроцитов. Таким образом, сделан вывод, что данный аквапорин принимает участие в развитии астроглиоза [57]. AQP9 может играть роль в развитии опухолей головного мозга. Показано, что AQP9 экспрессируется в глиобластоме и инфильтрующих ее лейкоцитах [58].
РОЛЬ АКВАПОРИНОВ В РАЗВИТИИ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Отек мозга, травматическое повреждение. Как было сказано выше, аквапорины играют важную роль в развитии отека головного мозга. Имеющиеся данные показывают, что AQP4 способствует образованию цитотоксического отека, облегчая поступление воды в астроциты. Эти данные подтверждают лучшие исходы у AQP4-дефицитных мышей при водной интоксикации, ишемическом инсульте и бактериальном менингите [59]. Наоборот, при вазогенном отеке, наблюдающемся при опухолях, абсцессах головного мозга, обструктивной гидроцефалии AQP4-дефицитные мыши демонстрируют худшие исходы [10]. Аналогичную роль AQP4, по-видимому, играет в спинном мозге, уменьшая цитотоксический отек и улучшая клинический исход после компрессионного повреждения спинного мозга [23]. В моделях ишемического инсульта выявлено, что повышенная экспрессия AQP9 может играть роль в активации астроцитов в ответ на ишемическое повреждение головного мозга. Также существуют гипотеза, согласно которой значение увеличения экспрессии AQP9 после инсульта заключается в том, что данный процесс может облегчить выведение накопившегося лактата и глицерина из внеклеточного пространства [60].
При черепно-мозговой травме (ЧМТ) AQP4 играет роль в формировании астроглиоза после травмы. У взрослых AQP4-дефицитных мышей был ослаблен астроглиоз, а через месяц после травмы они были более уязвимы к развитию эпилептических приступов [61].
Воспалительные заболевания. Согласно литературным данным, к аквапоринопатиям относят оптикомиелит (ОМ), а также редкие заболевания, при которых наблюдаются мутации, связанные с нарушением функции аквапоринов (например, нефрогенный несахарный диабет). ОМ – аутоиммунное демиелинизирующее заболевание ЦНС, поражающее в основном зрительный нерв и спинной мозг. Открытие антител к AQP4 (AQP4-IgG) – специфического маркера оптикомиелита – послужило толчком к изучению роли астроцитарной патологии в развитии демиелинизирующих заболеваний. Показано, что AQP4-IgG является патогенным, что приводит к селективному разрушению и дисфункции астроцитов in vitro, ex vivo и in vivo [62]. AQP4-IgG, по-видимому, способствуют нарушению иммунорегуляторной функции и барьерной способности астроцитов. Наряду с этим часть больных является серонегативной по AQP4-IgG, ввиду чего изначально была поставлена под сомнение роль данного антитела, что подтолкнуло к более детальному исследованию патогенеза заболевания и поиску других возможных биомаркеров. Так, некоторыми исследователями проводились поиск AQP1-IgG у пациентов с ОМ и сравнение с AQP4-IgG-положительными ОМ. [63–65]. Были получены противоречивые результаты, поэтому в настоящее время диагностическое значение AQP1-IgG при ОМ до конца не ясна. Влияние AQP4-IgG на экспрессию AQP4 на мышиных моделях были разноречивы [66–68]. В одних исследованиях на мышиных моделях системное или внутримозговое введение AQP4-IgG не приводило к снижению экспрессии AQP4 или повреждению поверхности астроцита [69], в то время как по другим данным интратекальная инфузия больших количеств AQP4-IgG в течение 3 нед. приводила к локальному истощению AQP4 в спинном мозге и развитию обратимого миелита [70]. Функция EAAT2 (белка-переносчика глутамата), находящегося с AQP4 на астроцитарной мембране, подавляется у AQP4-дефицитных мышей [71]. При гистопатологическом исследовании спинного мозга при ОМ обнаружено уменьшение экспрессии EAAT2 в AQP4-дефицитных зонах [67], что свидетельствует о том, что обратный захват глутамата и вторичная эксайтотоксичность могут способствовать повреждению ЦНС. Экспрессия EAAT2 также снижается после длительной интратекальной инфузии AQP4-IgG, однако вклад эксайтотоксичности к повреждению ткани в этой модели не был исследован [70]. В то же время есть данные, что AQP4-IgG может также напрямую ингибировать функцию водного канала [72]. В настоящее время остается не до конца ясно, почему другие органы, в которых экспрессируется AQP4, в том числе почки, остаются не затронутыми при ОМ. Недавние исследования продемонстрировали, что высокоаффинные непатогенные рекомбинантные антитела (аквапорумаб) могут блокировать связывание AQP4-IgG с AQP4 и предотвращать последующее развитие повреждения.
В литературе имеются единичные публикации о развитии концентрических Бало-подобных колец в стволе головного мозга у пациента с ОМ, а также о сочетании концентрического склероза Бало (КСБ) с оптикомиелитом у пациента, серонегативного по антителам к AQP4, что заставило предполагать сходные иммунопатологические механизмы при данных заболеваниях [73, 74]. Основываясь на изученных механизмах, лежащих в основе ОМ, исследователи оценивали экспрессию AQP4 при КСБ наряду с другими маркерами астроцитарного повреждения и демиелинизации. Были сделаны выводы, что обширная потеря AQP4 в острых очагах при КСБ без периваскулярного осаждения иммуноглобулинов и компонентов системы комплемента может быть характерной для КСБ. На основании проведенных исследований предположено, что КСБ является антител-независимой астроцитопатией. Механизм потери AQP4 при КСБ до конца не ясен. Предполагается роль гипоксии в результате ишемии, дисфункции митохондрий, а также влияние активированных Т-лимфоцитов и макрофагов, способствующих подавлению AQP4. Не исключается участие в данном процессе нарушение функции коннексинов, образующих щелевые контакты между глиальными клетками и миелином [75–77].
Центральный понтинный миелинолиз. Аквапориновые каналы оказываются вовлечены в патологический процесс, поскольку отвечают за перераспределение воды и электролитов в ЦНС, при центральном понтинном миелинолизе, представляющим собой демиелинизирующее заболевание мозга, ассоциированное с осмотическими нарушениями. Потеря AQP4 и AQP1 при центральном понтинном миелинолизе может представлять собой защитный механизм, при котором астроциты ограничивают потери воды для предотвращения апоптоза [78].
Опухоли мозга. Астроцитомы являются наиболее распространенными первичными опухолями головного мозга. Гистологически классифицируются на I-IV степени в зависимости от степени злокачественности. В исследованиях выявлена повышенная экспрессии AQP4 в астроцитомах, а его наибольший показатель обнаруживается в глиобластомах. Иногда глиобластомы также экспрессируют AQP1 и AQP9. Наряду с этим аквапорины участвуют в формировании отека мозга при опухолях. Кроме того, показано, что присутствие AQP1 способствует метастазированию опухоли. Также аквапорины облегчают миграцию опухолевых клеток через внеклеточное пространство мозга, таким образом облегчая инфильтрацию таких клеток в окружающую неповрежденную ткань мозга [79]. Перспективным рассматривается применение ингибиторов AQP для уничтожения опухолевых клеток.
Эпилепсия. У мышей с дефицитом AQP4 порог судорожной готовности снижается, а продолжительность эпилептического приступа увеличивается, что свидетельствует о связи между AQP и эпилепсией. Основным механизмом может являться нарушение гомеостаза K+ в отсутствие AQP4 [52]. Гиппокампальный склероз – известная причина возникновения медиальной височной эпилепсии [80]. В образцах гиппокампа пациентов с данной патологией было выявлено повышение AQP4, локализованного на плазматической мембране астроцитов, включая астроцитарные ножки. Данный показатель положительно коррелировал с увеличением другого астроцитарного маркера – глиального фибриллярного кислого белка. Экспрессия AQP4 была связана со снижением экспрессии гена дистрофина (белка, участвующего в закреплении AQP4 в астроцитарных ножках), что может указывать на потерю полярности в распределении AQP4 в астроцитах. На основании полученных данных сделан вывод, что нарушение экспрессии AQP4 и дистрофина может быть одним из факторов, лежащих в основе нарушения ионного и водного гомеостаза при склерозе гиппокампа и может вносить вклад в развитие эпилептической аквтивности [81].
Нейродегенеративные заболевания. Болезнь Альцгеймера (БА) является наиболее распространенным нейродегенеративным заболеванием среди пожилых людей. В тканях головного мозга пациентов и моделей с БА обнаружены активированные астроциты с измененной поляризацией AQP4, что указывает на его участие в развитии данного заболевания. Также выявлено увеличение экспрессии AQP1 астроцитами в коре головного мозга при БА, а вблизи отложения ß-амилоида ее снижение [82]. Было показано, что делеция гена AQP4 у моделей мышей с БА нарушает выведение из паренхимы головного мозга ß-амилоида, вызывая ухудшение пространственного обучения, дефекты памяти, что свидетельствует о роли AQP4 в патогенезе БА.
ЗАКЛЮЧЕНИЕ
Изучение аквапоринов расширяет представление об их роли в физиологии и развитии заболеваний. AQP4 задействован в патогенезе оптикомиелита, отека и опухолей головного мозга, эпилепсии и может являться мишенью лекарственных препаратов. Ввиду того, что многие исследования проведены на трансгенных мышах, требуется уточнение полученных данных о роли данных водных белков у людей, поэтому дальнейшие исследования аквапоринов представляются перспективными.
Список литературы
Agre P. Nobel Lecture. // Biosci. Rep. 2004. V. 24. № 3. P. 127–163.
Herrera M., Garvin J.L. // Pflugers. Arch. 2011. Oct. V. 462. № 4. P. 623–630.
Takata K., Matsuzaki T., Tajika Y. // Prog. Histochem. Cytochem. 2004. V. 39. № 1. P. 1–83.
Ishibashi K., Tanaka Y., Morishita Y. // Biochim. Biophys. Acta. 2014. V. 1840. № 5. P. 1507–1512.
Hirt L., Price M., Benakis C., Badaut J. // Clinical and Translational Neuroscience. 2018. V. 2. № 1. P. 1–7.
Tani K., Fujiyoshi Y. // Biochim. Biophys. Acta. 2014. V. 184. № 5. P. 1605–1613.
Papadopoulos M.C., Verkman A.S. // J. Biol. Chem. 2005. V. 280. № 14. P. 13906–13912.
Badaut J., Ashwal S., Adami A., Tone B., Recker R., Spagnoli D., Ternon B., Obenaus A. // J. Cereb. Blood. Flow. Metab. 2011. V. 31. № 3. P. 819–831.
Zador Z., Stiver S., Wang V., Manley G.T. // Handb. Exp. Pharmacol. 2009. V. 190, 159–170.
Papadopoulos M.C., Manley G.T., Krishna S., Verkman A.S. // FASEB J. 2004. V. 18. № 11. P. 1291–1293.
Loitto V.M., Magnusson K.E. // Biochem. Biophys. Res. Commun. 2004. V. 316. № 2. P. 370–378.
Papadopoulos M.C., Saadoun S., Verkman A.S. // Pflugers. Arch. 2008. V. 456. № 4. P. 693–700.
Papadopoulos M.C., Verkman A.C. // Nat. Rev. Neurosci. 2013. V. 456. № 4. P. 265–77.
Verkman A.S. // Annu. Rev. Med. 2012. V. 63. № 1. P. 303–16.
Giles J.A., Greenhalgh A.D, Davies C.L., Denes A., Shaw T., Coutts G., Rothwell N.J., McColl B.W., Allan S.M. // Eur. J. Immunol. 2015. V. 45. № 2. P. 525–530.
Yukutake Y., Tsuji S., Hirano Y., Adachi T., Takahashi T., Fujihara K., Agre P, Yasui M., Suematsu M. // Biol. Cell. 2008. V. 100. № 6. P. 355–363.
Yukutake Y., Hirano Y., Suematsu M., Yasui M. // Biochemistry. 2009. V. 48. № 51. P. 12059–12061.
Yang B. // Aquaporins / Dordrecht: Springer Nature. 2017. P. 278.
Cho S.J., Sattar A.K., Jeong E.H., Satchi M., Cho J.A., Dash S., Mayes M.S., Stromer M.H., Jena B.P. // Proc. Natl. Acad. Sci. USA. 2002. V. 99. № 7. P. 4720–4724.
Furuya S., Naruse S., Ko S.B., Ishiguro H., Yoshikawa T., Hayakawa T. // Cell Tissue Res. 2002. V. 308. № 1. P. 75–86.
Jiang Y. // IUBMB Life. 2009. V. 61. № 10. P. 1001–1009.
Song Y., Jayaraman S., Yang B., Matthay M.A., Verkman A.S. // J. Gen. Physiol. 2001. V. 117. № 6. P. 573–582.
Verkman A.S. // J. Cell. Sci. 2011. V. 124. № 13. P. 2107–2112.
Friscourt F., Badaut J. // J. Neuroscience Research. 2018. V. 96. № 2. P. 177–179.
Satoh J., Tabunoki H., Yamamura T., Arima K., Konno H. // Neuropathology. 2007. V. 27. № 3. P. 245–256.
Saadoun S., Papadopoulos M.C., Davies D.C., Bell B.A., Krishna S. // Brain J. Cancer. 2002. V. 87. № 6. P. 621–623.
Galán-Cobo A., Ramírez-Lorca R., Toledo-Aral J.J., Echevarría M. // J. Cellular Physiology. 2016. V. 231. № 1. P. 243–256.
Hoshi A., Tsunoda A., Tada M., Nishizawa M., Ugawa Y., Kakita A. // Brain Pathol. 2016. V. 27. № 2. P. 160–168.
El Hindy N., Bankfalvi A., Herring A., Adamzik M., Lambertz N., Zhu Y., Siffert W., Sure U., Sandalcioglu I.E. // Anticancer Res. 2013. V. 33. № 2. P. 609–613.
Kim J.H., Lee Y.W., Park K.A., Lee W.T., Lee J.E. // J. Cereb. Blood. Flow. Metab. 2010. V. 30. № 5. P. 943–949.
Nesic O., Lee J., Unabia G., Johnson K., Ye Z., Vergara L., Hulsebosch C., Perez-Polo J. // J. Neurochem. 2008. V. 105. № 3. P. 628–640.
Yang M., Gao F., Liu H., Yu W., He G., Zhuo F., Qiu G., Sun S. // Anat. Histol. Embryol. 2011. V. 40. № 4. P. 299–306.
Крысова А.В., Циркин В.И., Куншин А.А. // Вятский медицинский вестник. 2012. № 2. С. 50–58.
Sougrat R., Morand M., Gondran C., Barre P., Gobin R., Bonte F., Dumas M., Verbavatz J.M. // J. Invest. Dermatol. 2002. V. 118. № 4. P. 678–685.
Yang M., Gao F., Liu H., Yu W.H., Sun S.Q. // Brain Res. 2009. V. 1290. P. 121–132.
Lambertz N., Hindy N.E., Adler C., Rump K., Adamzik M., Keyvani K., Bankfalvi A., Siffert W., Erol Sandalcioglu I., Bachmann H.S. // J. Neuro-Oncol. 2013. V. 112. № 2. P. 297–305.
Yamamoto N., Yoneda K., Asai K., Sobue K., Tada T., Fujita Y., Katsuya H., Fujita M., Aihara N., Mase M. // Mol. Brain Res. 2001. V. 90. № 1. 26–38.
Zhu S.J., Wang K.J., Gan S.W., Xu J., Xu S.Y., Sun S.Q. // Biochem. Biophys. Res. Commun. 2013. V. 440. № 1. P. 168–172.
Dong R., Tao S., Liu Z., Zheng W., Yu D. // Int. L. Clin. Exp. Pathol. 2016. V. 9. № 2. P. 1240–1248.
Zhao G., Li J., Wang J., Shen X., Sun J. // Biochem. Biophys. Res. Commun. 2014. V. 443. № 1. P. 161–166.
Jeremic A, Cho WJ, Jena BP // Exp. Biol. Med. 2005. V. 230. № 9. P. 674–680.
Yasui M., Kwon T.H., Knepper M.A., Nielsen S., Agre P. // Proc. Natl. Acad. Sci. USA. 1999. V. 96. № 10. P. 5808–5813.
Patyal P., Alvarez-Leefmans F.J. // FASEB J. 2016. V. 30. № 1. P. 621.
Méndez–Giménez L., Ezquerro S., da Silva I.V., Soveral G., Frühbeck G., Rodríguez A. // Front. Chem. 2018. V. 5. № 6. P. 99.
Nicchia G.P., Pisani F., Simone L., Cibelli A., Mola M.G., Dal Monte M., Frigeri A., Bagnoli P., Svelto M. // Exp. Eye Res. 2016. V. 146. P. 259–268.
De Castro R.M., Hirt L., Bogousslavsky J., Regli L., Badaut J. // J. Neurosci. Res. 2006. V. 83. № 7. P. 1231–1240.
Neely J.D., Amiri-Moghaddam M., Ottersen O.P., Froehner S. C., Agre P., Adams M.E. // Proc. Natl. Acad. Sci. USA. 2001. V. 98. № 24. P. 14108–14113.
Noell, S., Fallier-Becker P., Beyer C., Kroger S., Mack A.F., Wolburg H. // Eur. J. Neurosci. 2007. V. 26. № 8. P. 2109–2118.
Iliff J.J., Wang M., Liao Y., Plogg B.A., Gundersen G.A., Benveniste H., Vates G.E., Deane R., Goldman S.A., Nagelhus E.A., Nedergaard M. Sci Transl Med. // Sci. Transl. Med. 2012. V. 4. № 147. P. 147ra111.
Furman C.S., Gorelick-Feldman D.A., Davidson K.G., Yasumura T., Neely J.D., Agre P., Rash J.E. // Proc. Natl. Acad. Sci. USA. 2003. V. 100. № 23. P. 13609–13614.
Hinson S.R., Pittock S.J., Lucchinetti C.F., Roemer S.F., Fryer J.P., Kryzer T.J., Lennon V.A. // Neurology. 2007. V. 69. № 24. P. 2221–2231.
Binder D.K., Yao X., Zador Z., Sick T.J., Verkman A.S., Manley G.T. // Glia. 2006. V. 53. № 6. P. 631–636.
Hiroaki Y., Tani K., Kamegawa A., Gyobu N., Nishikawa K., Suzuki H., Walz T., Sasaki S., Mitsuoka K., Kimura K. // J. Mol. Biol. 2006. V. 355. № 4. P. 628–639.
Badaut J., Nehlig A., Verbavatz J., Stoeckel M., Freund-Mercier M.J., Lasbennes F. // J. Neuroendocrinol. 2000. V. № 10. P. 960–969.
Badaut J., Brunet J.F., Guerin C., Regli L., Pellerin L. // Brain Res. 2012. V. 1473. P. 19–24.
Watanabe S., Moniaga C.S., Nielsen S., Hara-Chikuma M. // Biochem. Biophys. Res. Commun. 2016. V. 471. P. 191–197.
Hirt L., Price M., Mastour N., Brunet J.F., Barriere J., Friscourt F., Badaudt J. // J. Neurosci. Res. 2017. V. 96. № 2. P. 194–206.
Jelen S., Parm Ulhoi B., Larsen A., Frokiaer J., Nielsen S., Rtzler M. // PLoS One. 2013. V. 8. № 9. e75764.
Manley G.T., Fujimura M., Ma T., Noshita N., Filiz F., Bollen A.W., Chan P., Verkman A.S. // Nat. Med. 2000. V. 6. № 2. P. 159–163.
Hirt L., Price M., Mastour N., Brunet J.F., Barriere J., Friscoutr F., Badaut J. // J. Neurosci. Res. 2017. V. 96. № 2. P. 194–206.
Lu D.C., Zador Z., Yao J., Fazlollahi F., Manley G.T. // J. Neurotrauma. 2011. V. 28. № 9. P. 1683–2002.
Lucchinetti C.F., Guo Y., Popescu B.F. // Brain Pathol. 2014. V. 24. № 1. P. 83–97.
Tzartos J.S., Stergiou C., Kilidireas K., Zisimopoulou P., Thomaidis T., Tzartos S.J. // PLoS ONE. 2013. V. 8. № 9. e74773.
Long Y., Zheng Y., Shan F., Chen M., Fan Y., Zhang B., Cao C., Gao Q., Yang M. // J. Neuroimmunol. 2014. V. 273. № 1–2. P. 103–110.
Sanchez Gomar I., Diaz Sanchez M., Ucles Sanchez A.J., Casado Chocán J.L., Suárez-Luna N., Ramírez-Lorca R, Villadiego J, Toledo-Aral J.J., Echevarría M. // Int. J. Mol. Sci. 2016.V. 17. № 8. P. 1195.
Ratelade J., Bennett J.L., Verkman A.S. // J. Biol. Chem. 2011. V. 286. № 52. P. 45156–45164.
Hinson S., Roemer S., Lucchinetti C., Fryer J.P., Kryzer T.J., Chamberlan J.L., Howe C.L., Pittock S.L., Lennon V.A. // J. Exp. Med. 2005. V. 205. № 11. P. 2473–2481.
Rossi A., Ratelade J., Papadopoulos M.C., Bennett J.L., Verkman A.S. // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 24. E 1511.
Bradl M., Misu T., Takahashi T., Watanabe M., Mader S., Reindl M., Adzemovic M., Bauer J., Berger T., Fujihara K., Itoyama Y., Lassmann H. // Ann. Neurol. 2009. V. 66. № 5. P. 630–643.
Geis C., Ritter C., Ruschil C., Weishaupt A., Stoll G., Holmoy T., Misu T., Fujihara K., Hemmer B., Stadelmann S., Bennet J.L., Sommer S., Toyka K.V. // Exp. Neurol. 2015. V. 265. P. 8–21.
Zeng X.N., Sun X.L., Gao L., Fan Y., Ding J.H., Hu G. // Mol. Cell. Neurosci. 2007. V. 34. № 1. P. 34–39.
Hinson S.R., Romero M.F., Popescu B.F.G., Lucchinetti C.F., Fryer J.P., Wolburg H., Fallier-Becker P., Noell S., Lennon V.A. // Proc. Natl. Acad. Sci. USA. 2011. V. 109. № 4. P. 11245–11250.
Graber J.J., Kister I., Geyer H., Khaund M., Herbert J. // Arch. Neurol. 2009. V. 66. № 2. P. 274–275.
Masuda H., Mori M., Katayama K., Kikkawa Y., Kuwabara S. // Intern. Med. 2013. V. 52. № 13. P. 1517–1521.
Misu T., Fujihara K., Kakita A., Konno H., Nakamura M., Watanabe S., Takahashi I., Nakashima I., Takahashi H., Itoyama Y. // Brain. 2007. V. 130. № 5. P. 1224–1234.
Masaki K., Suzuki S.O., Matsushita T., Yonekawa T., Matsuoka T., Isobe N., Motomura K., Wu X.M., Tabira T., Iwaki T., Kira J. // Acta. Neuropathol. 2012. V. 123. № 6. 887–900.
Воробьева А.А., Коновалов Р.Н., Кротенкова М.В., Переседова А.В., Захарова М.Н. // Анналы клинической и экспериментальной неврологии. 2015. Т. 9. № 1. С. 37–40.
Popescu B.F., Bunyan R.F., Guo Y., Parisi J.E., Lennon V.A., Lucchinetti C.F. // Acta. Neuropathol. Commun. 2013. V. 1. № 40. P. 1–12.
Verkman A.S., Hara-Chikuma M., Papadopoulos M.C. // J. Mol. Med. 2008. V. 86. № 5. P. 523–529.
Ситников А.Р., Скоробогатова В.А., Маслова Н.Н. // Анналы клинической и экспериментальной неврологии. 2019. Т. 13. № 1. С. 70–77.
Lee T.S., Eid T., Mane S., Kim J.H., Spencer D.D., Ottersen O.P., de Lanerolle N.C. // Acta. Neuropathol. 2004. V. 108. № 6. P. 493–502.
Hoshi A., Yamamoto T., Shimizu K., Ugawa U., Nishizawa N., Takahashi H., Kakita A. // J. Neuropathol. Exp. Neurol. 2012. V. 71. № 8. P. 750–759.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия