Нейрохимия, 2020, T. 37, № 1, стр. 320-38
Внутрижелудочковое введение 192IgG-сапорина вызывает изменения в состоянии микроглии в неокортексе
М. Н. Волобуева 1, Ю. В. Добрякова 1, А. О. Манолова 1, М. Ю. Степаничев 1, А. А. Квичанский 1, Н. В. Гуляева 1, В. А. Маркевич 1, А. П. Большаков 1, 2
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
Поступила в редакцию 23.05.2019
После доработки 05.07.2019
Принята к публикации 10.08.2019
Аннотация
Иммунотоксин 192IgG-сапорин является мощным инструментом для индукции селективной гибели холинергических нейронов базальных ядер. В данной работе мы исследовали влияние внутрижелудочкового введения иммунотоксина на состояние микроглии в тканях как прилежащих к желудочку (стриатум и париетальная кора), так и удаленно расположенных, но получающих иннервацию из медиальной септальной области и диагональной полоски Брока (энторинальная кора и обонятельные луковицы). Оценка состояния глиальных клеток производилась с помощью иммуногистохимического окрашивания антителами к маркерному белку микроглии IBA-1 и к маркерному белку астроцитов GFAP. Оказалось, что в париетальной коре происходит увеличение числа микроглиальных клеток, которое, однако, не сопровождалось изменениями в состоянии астроцитов, в то время как в стриатуме изменений в состоянии глиальных клеток не наблюдалось. Анализ экспрессии генов Ncf1 и Cx3Cr1 показал, что экспрессия Ncf1 увеличивается как в париетальной, так и в энторинальной коре при отсутствии изменений экспрессии Cx3Cr1. В стриатуме и обонятельных луковицах изменения в экспрессии этих генов отсутствовали. Мы также анализировали уровень мРНК генов Ptprb и Slc22a8, экспрессирующихся в кровеносных сосудах. Снижение экспрессии Slc22a8 наблюдалось лишь в стриатуме, экспрессия же гена Ptprb не менялась ни в одной из структур. Полученные данные говорят о том, что через 1.5 месяца после введения иммунотоксина наблюдается активация микроглии только в отделах неокортекса, но не в стриатуме или обонятельных луковицах.
ВВЕДЕНИЕ
Ацетилхолин (АХ) является одним из мощных модуляторов активности нейрональных сетей гиппокампа и неокортекса. Холинергическая сигнальная система вовлечена в генерацию гиппокампальных ритмов, а также играет важную роль в механизмах обучения и памяти. Снижение уровня АХ в результате дегенерации холинергических нейронов в базальных ядрах (медиальный септум, диагональная полоска Брока, базальное ядро Мейнерта) возникает при ряде патологий, таких как болезнь Альцгеймера [1], болезнь Паркинсона, ассоциированная с деменцией, а также деменция с тельцами Леви [2].
Одним из подходов, используемых в экспериментах на животных для анализа последствий холинергического дефицита, является инъекция иммунотоксина 192IgG-сапорина (IgS) [3]. Этот нейротоксин представляет собой конъюгат антитела к рецептору фактора роста нервов NGFR и рибосомного токсина сапорина. После инъекции IgS связывается с NGFR, который экспрессируется селективно на холинергических нейронах базальных ганглиев, после чего иммунотоксин подвергается эндоцитозу. Внутри нейронов IgS инактивирует рибосомы, что ведет к нарушению синтеза белков и, в конечном итоге, гибели холинергических клеток. Во множестве исследований было показано, что IgS, вводимый как в желудочки мозга, так и внутрисептально, приводит к гибели холинергических нейронов медиальной септальной области и диагональной полоски Брока [3].
Было показано, что внутрижелудочковая инъекция IgS приводит к нарушениям способности животных к обучению [3–5], к изменениям в экспрессии генов в гиппокампе [4, 5], а также микроглиозу в гиппокампе и гибели нейронов в зоне СА3 [6]. Оказалось также, что в ряде случаев иммунотоксин, введенный внутрижелудочково, приводит к развитию микроглиоза в мозолистом теле [6]. Последнее указывает на то, что при внутрижелудочковом введении IgS может влиять на функционирование структур, прилежащих к желудочкам. Поэтому в нашей работе мы проанализировали последствия внутрижелудочкового введения IgS, исследовав состояние клеток неокортекса, а также стриатума. Кроме того, мы провели молекулярно-биологический анализ структур, в которые проецируются холинергические нейроны медиальной септальной области, а именно, энторинальной коры и обонятельных луковиц.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проводили на взрослых самцах крыс Sprague–Dawley (250–350 г), полученных из питомника “Пущино” (Институт биоорганической химии им. Шемякина и Овчинникова РАН). Всего в исследовании использовано 25 крыс (контроль n = 12; Ig-сапорин n = 13). Животных содержали в стандартных условиях вивария при 21 ± 1°С с 12-часовым циклом свет/темнота; пища и вода были предоставлены ad libitum. Все эксперименты проводились в соответствии с этическими принципами, изложенными в Директиве ЕС 2010/63/EU об экспериментах на животных, и были одобрены Этическим комитетом ИВНД и НФ РАН.
Инъекция IgS. Крыс анестезировали хлоралгидратом (400 мг/кг, внутрибрюшинно). 192IgG-сапорин (Millipore Corporation, США) растворяли в концентрации 1 мкг/мкл и инъецировали билатерально в дозе 4 мкг в каждый желудочек. Это вызывало значительную потерю холинергических нейронов в области перегородки (см. предыдущие работы [4, 6]). Двусторонние инъекции выполняли стереотаксически в боковые желудочки (от брегмы назад 0.8 мм и латерально 1.5 мм) [7] с использованием шприца Гамильтона объемом 10 мкл (Hamilton, Giarmata, Румыния). Контрольные крысы получали эквивалентный объем стерильного 10 мМ фосфатно-солевого буфера (PBS). Крысам давали возможность восстановиться в течение 1.5 мес. перед морфологическим анализом. У контрольных (n = 7) и получавших IgS (n = 7) животных одно полушарие головного мозга брали для морфологического анализа, а другое полушарие – для анализа экспрессии генов; у другой части животных (контроль n = 6; Ig-сапорин n = 5) весь мозг брали для морфологического анализа.
Иммуногистохимическое окрашивание. Крыс анестезировали хлоралгидратом (400 мг/кг, внутрибрюшинно) через 1.5 мес. после инъекции и затем подвергали транскардиальной перфузии охлажденным ледяным 0.9% NaCl. Для морфологического анализа весь мозг, либо одно полушарие, вынимали и фиксировали в растворе 4% параформальдегида (Sigma-Aldrich, США) на PBS (Biolot, Россия) в течение не менее 2 дней.
Двойное иммунофлуоресцентное окрашивание маркеров микроглии IBA-1 и астроглии GFAP проводили с использованием совместной инкубации с соответствующими первичными антителами. Плавающие срезы сначала инкубировали в PBS, содержащем 0.3% тритон Х-100 (PBS-T), три раза в течение 5 мин, затем в блокирующем растворе (5% нормальная сыворотка осла (Sigma-Aldrich, США) в PBS-T) в течение 1 ч и затем в блокирующем растворе со смесью первичных антител (кроличьи поликлональные анти-IBA-1 (Wako, Япония) и мышиный моноклональный анти-GFAP-Cy3 конъюгат 1 : 400 (Sigma-Aldrich, США); оба в разведении 1 : 400) при 4°С в течение ночи. На следующий день срезы промывали и инкубировали с антителами осла к IgG кролика, конъюгированными с Alexa Fluor-488 (Life Technologies, США). Срезы заключали в Prolong Gold с DAPI (Thermo Fisher Scientific, США) и хранили при 4°C.
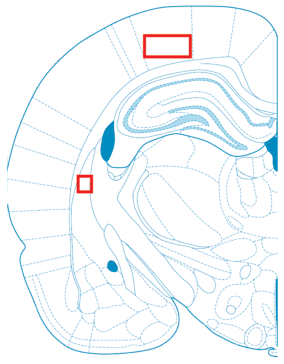
Области неокортекса (париетальная кора) и стриатума, в которых анализировали состояние глиальных клеток показаны на рис. 1.
Рис. 1.
Схематическое изображение зон мозга, которые были проанализированы в настоящем исследовании.
Подсчет клеток микроглии. Для количественного анализа получали изображения с помощью микроскопа Keyence 6000EZ (Япония). Изображения стриатума были получены с помощью конфокального микроскопа Zeiss LSM 700 (Германия).
Параметры изображения были установлены таким образом, чтобы избежать насыщения сигнала. Обработку изображений и количественный анализ изменений морфологии микроглии выполняли с использованием программного обеспечения ImageJ/Fiji (версия 1.51, NIH, США) как описано ранее [6].
Выделение РНК и синтез кДНК. После отбора образцов головного мозга собирали фрагменты серого вещества из соматосенсорной области неокортекса, обонятельных луковиц и стриатума. Тотальную РНК выделяли из образцов мозга и растворяли в ExtractRNA (Evrogen, Москва, Россия) в соответствии с протоколом производителя. Общую концентрацию РНК измеряли на спектрофотометре NanoDrop 2000 (Thermo Fisher Scientific, США). Для удаления следов геномной ДНК 1 мкг общей РНК обрабатывали ДНКазой I (Thermo Fisher Scientific, США).
кДНК первой цепи синтезировали с использованием набора для обратной транскриптазы MMLV (Evrogen, Москва, Россия) со случайными декапраймерами в соответствии с инструкцией производителя.
Количественная ПЦР в реальном времени. кПЦР проводили с использованием 7500 Real-Time PCR System (Applied Biosystems, США). Температурный профиль: (1) 95°C в течение 10 мин, (2) 40 циклов при 95°C в течение 15 с, 63°C в течение 30 с и 72°C в течение 30 с и (3) анализ кривой плавления. Для приготовления реакционных смесей использовали HS-SYBR + ROX (Evrogen, Москва, Россия).
Экспрессию генов рассчитывали как RQ = 2–ΔΔCt; экспрессия была нормализована к экспрессии гена Trappc10, который, согласно нашим предыдущим транскриптомным данным, является одним из генов с наиболее стабильной экспрессией в изученных условиях [6]. Экспрессия всех генов была нормализована на внешний калибровочный образец. Последовательности использованных в работе праймеров были взяты из предыдущих публикаций [6].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дегенерация холинергических нейронов в мозге, как известно, сопровождается нарушениями памяти. Вместе с тем, холинергическая сигнализация имеет важное значение для контроля состояния глиальных клеток в ЦНС, поскольку микроглия и астроциты могут экспрессировать никотиновые рецепторы ацетилхолина, содержащие субъединицу α7 [8]. Взаимодействие ацетилхолина с этими рецепторами снижает провоспалительный ответ микроглии. Мы предположили, что холинергический дефицит, возникающий в мозге в результате введения IgS, может способствовать активации микроглии не только в гиппокампе, но и в других структурах мозга, прилегающих к боковым желудочкам и получающих холинергическую иннервацию из базальных ядер.
В контрольных условиях клетки микроглии в стриатуме и неокортексе имели небольшие тела и тонкие разветвленные отростки (рис. 2a, 3a), то есть морфологию микроглии, которая типична для покоящихся клеток. Во всех исследованных областях астроциты также имели вид неактивированных покоящихся клеток с небольшими сомами и тонкими разветвленными отростками (рис. 2б, 3б).
Рис. 2.
Влияние внутрижелудочкового введения 192IgG-сапорина на морфологию микроглии (а, б) и астроцитов (в, г) в стриатуме. Представлены фотографии срезов стриатума контрольных (а, в) крыс и крыс, которым вводили иммунотоксин (б, г). Морфология глиальных клеток осталась практически неизменной через 1.5 мес. после введения иммунотоксина. Увеличение 200×, шкала 100 мкм.
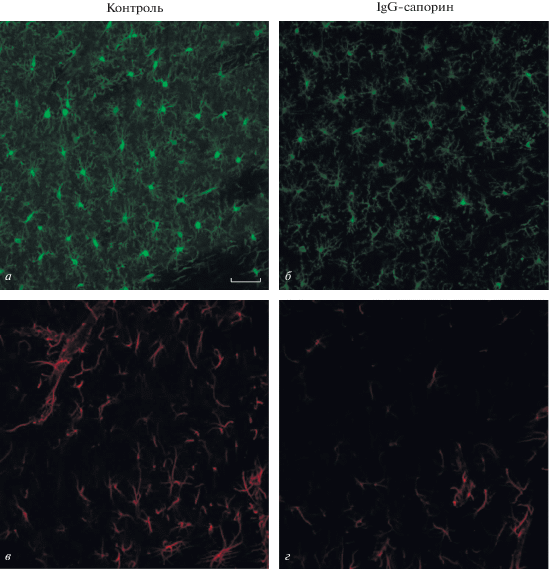
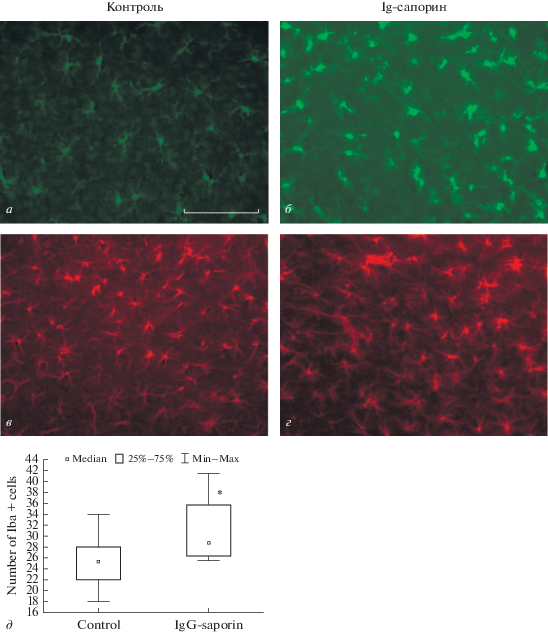
Рис. 3.
Влияние внутрижелудочкового введения 192IgG-сапорина на морфологию микроглии (а, б) и астроцитов (в, г) в париетальной коре. Представлены фотографии срезов неокортекса контрольных (а, в) крыс и крыс, которым вводили иммунотоксин (б, г). Подсчет числа микроглиальных клеток показал, что через 1.5 мес. после введения иммунотоксина наблюдается увеличение числа микроглиальных клеток (д). * – статистически значимые отличия по сравнению с контролем, р < 0.05 (тест Манна–Уитни). Увеличение 400×, шкала 100 мкм.
Через полтора месяца после введения иммунотоксина микроглиальные клетки в стриатуме сохраняли характерную морфологию с тонкими ветвящимися отростками (рис. 2б). Окрашивание на GFAP также показало, что функциональный статус астроцитов в этом отделе мозга не меняется (рис. 2г).
В отличие от стриатума, в исследованном отделе неокортекса мы обнаружили увеличение числа клеток микроглии (значимое различие между контролем (n = 13) и IgG-сапорином (n = = 12), тест Крускала–Уоллиса, p = 0.014) (рис. 3д), что также сопровождалось утолщением и укорочением микроглиальных отростков (рис. 3б). Оценка состояния астроцитов по окрашиванию на GFAP не выявила серьезных изменений в состоянии этих клеток через 1.5 мес. после введения иммунотоксина.
Ранее мы показали [6], что изменение состояния микроглии в гиппокампе может также сопровождаться изменением уровня мРНК генов, экспрессирующихся в микроглиальных клетках, а также в клетках кровеносных сосудов мозга. Поэтому в этой работе мы проанализировали как внутрижелудочковая инъекция иммунотоксина влияет на уровень молекулярных маркеров, характеризующих состояние клеток. Оказалось, что в париетальной области неокортекса происходит почти двукратное увеличение экспрессии маркера микроглии Ncf1 после воздействия иммунотоксина, тогда как другой маркер микроглии Cx3Cr1 и маркер нейровоспаления Il1β остались неизменными (рис. 3а). Анализ экспрессии Ncf1 и Cx3Cr1 в энторинальной коре также выявил достоверный рост экспрессии Ncf1 через 1.5 мес. после введения иммунотоксина, хотя это увеличение было менее значительным. Анализ экспрессии маркеров состояния сосудов не выявил никаких изменений ни в одном из исследованных отделов неокортекса.
Мы также проанализировали экспрессию упомянутых маркеров в стриатуме и клетках обонятельных луковиц, которые получают холинергическую иннервацию от клеток медиального септума и диагональной полоски Брока. Оказалось, что изменений в экспрессии микроглиальных маркеров в стриатуме и обонятельных луковицах не происходит после действия иммунотоксина (рис. 4а, б). В обонятельных луковицах также остается неизменной экспрессия маркеров клеток сосудистого русла, в то время как уровень Slc22a8 достоверно снижается в стриатуме (рис. 5а, б).
Рис. 4.
Влияние внутрижелудочкового введения 192IgG-сапорина на экспрессию микроглиальных маркеров (Ncf1, Cx3Cr1), Il1β, и сосудистых маркеров (Ptprb, Slc22a8) в париетальной (а) и энторинальной коре (б). Данные представлены в виде среднее ± ошибка среднего. * – значимые отличия по сравнению с контролем (p < 0.05, тест Манна–Уитни).
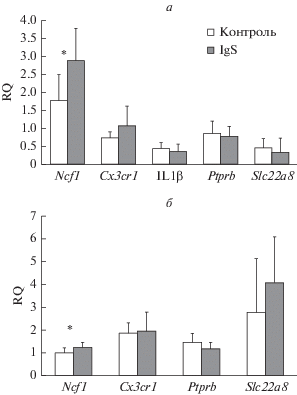
Рис. 5.
Влияние внутрижелудочкового введения 192IgG-сапорина на экспрессию микроглиальных маркеров (Ncf1, Cx3Cr1) и сосудистых маркеров (Ptprb, Slc22a8) в стриатуме (а) и обонятельных луковицах (б). Данные представлены в виде среднее ± ошибка среднего. * – значимые отличия по сравнению с контролем (p < 0.05, тест Манна–Уитни).
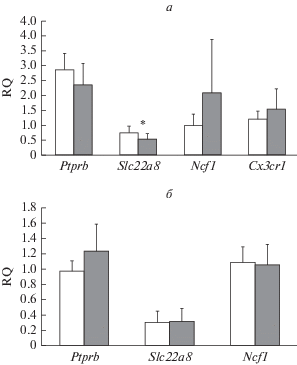
192IgG-сапорин достаточно часто используется для индукции селективной гибели холинергических нейронов в базальных ядрах. Однако недавние работы говорят о том, что этот иммунотоксин при внутрижелудочковом введении приводит не только к гибели холинергических нейронов, но также развитию микроглиоза и гибели пирамидных нейронов в зоне СА3 дорсального гиппокампа [6]. Проведенное исследование говорит о том, что при внутрижелудочковом введении иммунотоксина наблюдается также ряд изменений в париетальной коре и стриатуме. Полученные данные свидетельствуют, что через 1.5 мес. после введения иммунотоксина происходит увеличение числа микроглиальных клеток в упомянутой области неокортекса. Оценка состояния микроглии по экспрессии маркерных генов выявила значимые изменения только в экспрессии гена Ncf1. В предыдущей работе увеличение экспрессии этого гена сопровождало активацию микроглии в дорсальном гиппокампе [6]. Принимая во внимание эти данные и результаты, полученные в настоящей работе, можно предположить, что некоторая активация микроглии также происходит в энторинальной коре, где было обнаружено увеличение экспрессии Ncf1 у животных с индуцированным IgS холинергическим дефицитом. Важно отметить, что изменений в экспрессии Cx3Cr1, Ptprb, и Slc22a8 не наблюдалось в исследованных отделах коры, косвенно указывая на то, что, по видимому, не происходит существенных изменений в состоянии сосудистого русла в этих структурах.
Обонятельные луковицы иннервируются холинергическими волокнами, приходящими из диагональной полоски Брока [9]. Однако внутрижелудочковое введение иммунотоксина не приводило к каким-либо изменениям в экспрессии генов, ассоциированных с микроглией и кровеносными сосудами. Последнее, вероятно, говорит о том, что в обонятельных луковицах дефицит АХ не приводит к активации микроглии и изменению состояния сосудов и, скорее всего, не является критическим фактором, регулирующим состояние микроглии, как ранее было показано для микроглии в гиппокампе.
Важным аспектом сравнения эффектов иммунотоксина в разных отделах неокортекса является то, что энторинальная кора получает холинергический вход из медиального септального ядра и ядра вертикального лимба диагональной полоски Брока [10, 11], в то время как париетальная кора получает вход из безымянной субстанции и базального ядра Мейнерта [12]. Внутрижелудочковое введение приводит к гибели холинергических нейронов медиального септума [4, 6] и, возможно, может приводить к дегенерации холинергических аксонов в париетальной коре, т. к. последняя плотно прилегает к желудочкам. В любом случае потеря холинергической иннервации в обоих отделах неокортекса приводит к некоторой активации микроглии, лишний раз указывая на то, что АХ может являться важным регулятором состояния микроглии не только в гиппокампе, но и в неокортексе. Присутствие избыточного числа микроглиоцитов в условиях дефицита холинергической нейротрансмиссии может быть дополнительным фактором, способствующим развитию амнезии как в исследованной модели, так и при нейродегенеративных заболеваниях.
Список литературы
Hampel H., Mesulam M.-M., Cuello A.C., Farlow M.R., Giacobini E., Grossberg G.T., Khachaturian A.S., Vergallo A., Cavedo E., Snyder P.J., Khachaturian Z.S. // Brain. 2018. V. 141. № 7. P. 1917–1933.
Liu A.K.L., Lim E.J., Ahmed I., Chang R.C.-C., Pearce R.K.B., Gentleman S.M. // Neuropathol. Appl. Neurobiol. 2018. V.44. № 7. P. 647–662.
Schliebs R., Robner S., Bigl V. // Prog. Brain Res. Elsevier. 1996. V. 109. P. 253–264.
Dobryakova Y.V., Kasianov A., Zaichenko M.I., Stepanichev M.Y., Chesnokova E.A., Kolosov P.M., Markevich V.A., Bolshakov A.P. // Front. Mol. Neurosci. Frontiers Media S.A. 2017. V.10. P. 429.
Paban V., Farioli F., Romier B., Chambon C., Alescio-Lautier B. // Neurobiol. Learn. Mem. Elsevier Inc. 2010. V. 94. № 1. P. 42–56.
Dobryakova Y. V, Volobueva M.N., Manolova A.O., Medvedeva T.M., Kvichansky A.A., Gulyaeva N. V, Markevich V.A., Stepanichev M.Y., Bolshakov A.P. // Front. Neurosci. Frontiers Media S.A. 2019. V. 13. P. 146.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Elsevier, 2007.
De Simone R., Ajmone-Cat M., Carnevale D., Minghetti L. // J. Neuroinflammation. 2005. V. 2. № 1. P. 4.
Záborszky L., Carlsen J., Brashear H.R., Heimer L. // J. Comp. Neurol. 1986. V. 243. № 4. P. 488–509.
Heys J.G., Schultheiss N.W., Shay C.F., Tsuno Y., Hasselmo M.E. // Front. Behav. Neurosci. 2012. V. 6. P. 32.
Desikan S., Koser D.E., Neitz A., Monyer H. // Proc. Natl. Acad. Sci. 2018. V. 115. № 11. P. E2644–E2652.
Bucci D.J., Holland P.C., Gallagher M. // J. Neurosci. 1998. V. 18. № 19. P. 8038–8046.
Дополнительные материалы отсутствуют.


