Нейрохимия, 2021, T. 38, № 3, стр. 278-288
Неоднозначные эффекты длительного приема TC-2153 – ингибитора стриатумспецифичной протеинтирозинфосфатазы STEP – на модели спорадической формы болезни Альцгеймера
Е. А. Рудницкая 1, А. О. Бурняшева 1, Т. А. Козлова 1, Н. А. Муралева 1, Д. В. Телегина 1, Т. М. Хоменко 2, К. П. Волчо 2, Н. Ф. Салахутдинов 2, Н. Г. Колосова 1
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
2 Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН
Новосибирск, Россия
Поступила в редакцию 19.03.2021
После доработки 24.03.2021
Принята к публикации 29.03.2021
Аннотация
Болезнь Альцгеймера (БА) – неизлечимое заболевание, которое становится основной причиной сенильной деменции. Попытки создания лекарств, нацеленных на подавление накопления амилоида-β, оказались неэффективными, в связи с чем активно ведется поиск новых терапевтических подходов, направленных на другие звенья патогенеза БА. Однин из них – подавление активности стриатумспецифичной протеинтирозинфосфатазы (STEP), которая повышена в коре головного мозга пациентов с БА. Целью настоящего исследования явилась оценка влияния длительного приема ингибитора STEP TC-2153 на прогрессию признаков БА у крыс OXYS – модели спорадической формы заболевания. TC-2153 неоднозначно повлиял на поведение животных: значительно снизил и исходно пониженную моторно-исследовательскую активность и усилил тревожное поведение у крыс OXYS, но улучшил их долговременную память в водном лабиринте Морриса. При этом TC-2153 не повлиял на усиленное у крыс OXYS накопление амилоида-β, а также на уровень белка STEP61, который в коре и гиппокампе крыс OXYS был таким же, как у контрольных крыс Вистар. Такие результаты предполагают, что эффекты длительного приема TC-2153 могут быть опосредованы механизмами, не связанными со STEP. В частности, TC-2153 может действовать как потенциальный донор сероводорода и таким образом существенно влиять на окислительно-восстановительный гомеостаз.
ВВЕДЕНИЕ
Болезнь Альцгеймера (БА) – неизлечимое прогрессирующее нейродегенеративное заболевание людей старшего возраста, которое становится основной причиной сенильной деменции [1, 2]. Клинически БА проявляется дефицитом памяти, изменениями личности и депрессией, нарушением когнитивных функций, утратой способности ориентироваться в обстановке и ухаживать за собой. Патогенез БА характеризуется усиленным образованием амилоидных бляшек, гиперфосфорилированием тау-белка, митохондриальной дисфункцией, окислительным стрессом и дефицитом ацетилхолина [3]. Несмотря на то, что в доклинических исследованиях регулярно выявляются перспективные лекарственные препараты для лечения БА, клинические испытания, как правило, не подтверждают их эффективность [4]. В значительной степени это обусловлено тем, что в течение последних трех десятилетий центральное место в поисках эффективных методов лечения занимали подходы, нацеленные на пути, связанные с накоплением β-амилоида (Aβ). Однако ни один из нацеленных на Aβ препаратов при клинических испытаниях не проявил ощутимую терапевтическую эффективность. Учитывая сложность патогенеза этого комплексного многофакторного заболевания, в настоящее время ведется активный поиск альтернативных походов к лечению БА. После обнаружения в префронтальной коре головного мозга пациентов с БА и на мышиных моделях заболевания повышенной активности стриатумспецифичной протеинтирозинфосфатазы (STEP), модуляция уровней STEP или подавление ее активности рассматривается как один из перспективных подходов к разработке новых способов лечения БА [5, 6].
Семейство протеинтирозинфосфатаз STEP представлено как цитозольными (STEP46), так и ассоциированными с мембранами (STEP61) белками, которые кодируются одним геном PTPN5 и образуются путем альтернативного сплайсинга [7]. PTPN5 экспрессируется преимущественно в нейронах базальных ганглиев, гиппокампа, коры головного мозга и родственных структурах [8]. STEP61 модулирует функции синапсов и пластичность, регулируя трафик рецепторов глутамата – N-метил-D-аспартата (NMDAR) и α-амино-3-гидрокси-5-метил-4-изоксазолепропионовой кислоты (AMPAR), а также активность ERK1/2, p38, Fyn и Pyk2.
Активность STEP61 регулируют несколько путей, в том числе – сигнальные каскады глутамата, дофамина и нейротрофического фактора мозга (BDNF), изменения которых регистрируются при развитии БА. Недавние исследования показали, что Aβ влияет на STEP – его накопление приводит к повышению ее уровня и активности, что, в свою очередь, нарушает доставку глутаматных рецепторов к нейрональной мембране и от нее [6, 9]. Считается, что STEP противодействует развитию долговременной потенциации (LTP) и ограничивает долговременную память [10]. Aβ усиливает долговременную депрессию (LTD) в области зубчатой извилины гиппокампа, активируя при этом STEP [11]. Таким образом, как высокие, так и низкие уровни STEP нарушают функции синапсов и способствуют нарушениям поведения и обучения. С повышением уровня и активности STEP связывают снижение когнитивных функций при старении: такие изменения были выявлены в гиппокампе старых мышей и крыс с дефицитом памяти, у старых макак-резусов и людей с умеренными когнитивными расстройствами, вызванными амнезией [12]. Высокие уровни STEP, помимо людей с БА, выявляются в посмертных образцах пациентов с болезнью Паркинсона и шизофренией, а также в моделях на животных с синдромом ломкой Х-хромосомы [13–15]. При этом при ряде других патологических состояний, включая ишемию, хорею Хантингтона, злоупотребление алкоголем и стрессовые расстройства выявляется пониженный уровень активности STEP [6].
Показано, что генетическое снижение уровня STEP [16] или фармакологическое ингибирование ее активности [5] способны улучшить память у грызунов – моделей БА [12]. Было установлено, что специфическим ингибитором STEP является гидрохлорид 8-(трифторметил)-1,2,3,4,5-бензопентатиепин-6-амина (известный как TC-2153), который образует обратимую ковалентную связь с цистеином в каталитическом центре STEP [5]. Впервые это соединение было синтезировано в Новосибирском институте органической химии [17] и представлено Куликовым и его коллегами в качестве антидепрессанта [18]. Позднее было показано [5], что кратковременное воздействие TC-2153 восстанавливает когнитивные нарушения и дефицит памяти у трансгенных мышей – модели ранней формы БА (мыши 3xTg-AD), но при этом не влияет на уровень Aβ и тау протеина в мозге этих животных. Такие результаты подтвердили то, что STEP является потенциальной терапевтической мишенью при БА. Профилактика и лечение БА предполагают продолжительное воздействие препаратов, однако эффекты длительного подавления STEP с помощью TC-2153 ранее не изучались. Это определяет актуальность исследования долгосрочных эффектов ингибирования STEP на состояние когнитивных функций на различных биологических моделях БА, прежде всего, – на моделях наиболее распространенной (>95% случаев) спорадической формы этого заболевания.
В настоящем исследовании мы оценили эффекты длительного приема TC-2153 на крысах линии OXYS – уникальной генетической модели преждевременного старения, одним из проявлений которого становится развитие признаков БА [19–22]. При отсутствии в геноме мутаций, специфичных для ранней (семейной) формы БА, у крыс OXYS спонтанно развиваются все основные признаки и воспроизводятся стадии заболевания [19]. Поведенческие изменения, дефицит памяти и снижение способности к обучению у крыс OXYS регистрируются в возрасте 3–5 мес. одновременно с первыми признаками нейродегенерации: нарушением синапсов, гибелью нейронов, дисфункцией митохондрий и гиперфосфорилированием тау-белка в гиппокампе и коре головного мозга. С возрастом у крыс OXYS нейродегенеративные изменения усиливаются и сопровождаются избыточной продукцией белка-предшественника амилоида (APP), накоплением к 12 мес. пептида Aβ и связанными с ним ярко выраженными патологическими изменениями к возрасту 18 мес. [19, 23]. Недавно мы показали, что развитие признаков БА у крыс OXYS происходит на фоне активации сигнального пути p38 MAPK [24]. Поскольку STEP регулирует этот путь, действуя как фосфатаза p38, можно ожидать изменений ее активности в мозге крыс OXYS. Целью настоящей работы было исследование воздействия TC-2153 на развитие у крыс OXYS признаков БА в период их активной прогрессии – в возрастной период от 9 до 13 мес. Оценивали поведенческие проявления БА и накопление Aβ в коре и гиппокампе животных, а также уровни в них белка STEP61.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные и воздействие на них. Самцы преждевременно стареющих крыс OXYS в возрасте 9 мес. (~350 г) и одновозрастные крысы Вистар (контроль) были получены в ЦКП Генофонды лабораторных животных Института цитологии и генетики СО РАН (Новосибирск, Россия, [RFMEFI61914X0005 и RFMEFI61914X0010]; линия крыс OXYS была получена из линии крыс Вистар в Институте цитологии и генетики СО РАН, как было описано ранее [19, 25]. Крыс содержали в стандартных условиях вивария (4–5 самцов в одной пластиковой клетке, наполнитель – опилки) в фиксированном режиме освещенности (цикл 12 ч свет/12 ч темнота, свет включался в 8 ч утра). Животные имели свободный доступ к стандартному гранулированному корму (ПК-120-1; ООО “Лабораторснаб”, Москва, Россия) и воде. Ни одно животное не умерло в течение эксперимента. Дизайн эксперимента представлен на рис. 1.
Для оценки влияния перорального введения ТС-2153 (в возрасте от 9 до 13 мес.) на прогрессию признаков БА у крыс OXYS мы случайным образом методом простой рандомизации распределили 9-месячных самцов крыс OXYS в одну из двух групп (по 22 животных в группе). Набор экспериментальной группы осуществлялся не экспериментатором, а сотрудниками ЦКП Генофонды лабораторных животных. Размер групп (по 22 животных в экспериментальной (OXYS + TC-2153), интактной (OXYS) и контрольной (Вистар) группах) является оптимальным для проведения адекватных поведенческих исследований.
Ранее было показано, что ТС-2153 эффективен как для перорального, так и для внутрибрюшинного введения [5, 17, 18]. ТС-2153 разводили в 2% Tween 20 до получения концентрации 200 мг/мл непосредственно перед его введением. Далее соответствующее количество полученного раствора давали с сухариком для достижения дозировки 10 мг на кг массы тела. После этого каждая крыса получала по одному сухарику (1 см3) с добавлением ТС-2153 индивидуально. Крысы контрольной группы получали стандартный рацион + один сухарик без ТС-2153.
Исследование поведения животных. Влияние приема препарата TC-2153 на поведение животных оценивали с помощью тестов в следующем порядке: уровень тревожности в тесте “Приподнятый крестообразный лабиринт”, двигательная и исследовательская активность в тесте “Открытое поле”, обучение и память в тесте “Водный лабиринт Морриса”; каждое животное наблюдалось в каждом тесте только один раз. Каждый параметр в тестах оценивался наблюдателем вручную. Все тесты проводились в период времени с 10 до 14 ч во избежание флуктуаций поведения, вносимых суточными ритмами.
Тест “Приподнятый крестообразный лабиринт”. Уровень тревожности интактных крыс OXYS и Вистар, а также крыс OXYS, получавших TC-2153, оценивали в тесте “Приподнятый крестообразный лабиринт” (n = 22 в группе). Установка сделана из непрозрачного оргстекла и представляет собой 4 рукава – два противоположных “открытых рукава” без стенок (50 × 10 см) и два “закрытых рукава” того же размера, но со стенками высотой 40 см. Каждый рукав был разлинован на пять равных квадратов (10 × 10 см). Четыре рукава соединялись центральным квадратом (100 см2). Установка была приподнята на 50 см над уровнем пола. Животное помещали в центральный квадрат крестообразного лабиринта и в течение 5 мин регистрировали его поведение. Оценивали количество входов в рукава лабиринта, пройденную дистанцию и время, проведенное в них. Меньшее количество времени, проведенного в открытых рукавах, указывало на повышенный уровень тревожности.
Тест “Открытое поле”. Тест “Открытое поле” проводили через 48 часов после завершения теста “Приподнятый крестообразный лабиринт” для оценки двигательной и исследовательской активности интактных крыс OXYS и Вистар, а также крыс OXYS, получавших TC-2153 (n = 22 в группе). Установка представляла собой закрытую квадратную арену из непрозрачного оргстекла (100 × 100 см), окруженную стенками высотой 40 см. Арена была расчерчена линиями на 100 равных квадратов. Центральная область была определена как квадрат 40 × 40 см. Центральный источник света на потолке мощностью 100 Вт обеспечивал постоянное освещение в темной комнате. Каждую крысу помещали в один и тот же угол арены, обращенный в одну и ту же сторону, и позволяли свободно исследовать арену в течение 5 минут. Двигательную и исследовательскую активность оценивали путем подсчета пройденной дистанции и количества совершенных животными вертикальных стоек. Кроме того, уровень тревожности оценивали, фиксируя время до первого выхода в центральную область; животное находилось в центральной области, если все четыре лапы находились в ней.
Тест “Водный лабиринт Морриса”. Тест “Водный лабиринт Морриса” [26] был использован для оценки гиппокамп-зависимой пространственной памяти крыс (n = 8 в группе). Животным было необходимо найти платформу в бассейне с водой, используя внешние визуальные стимулы. Поведенческое тестирование проводилось в возрасте с 12.5 до 13 мес., как было описано ранее [23]. Животных тестировали в круглом бассейне, платформа была погружена на 2 см ниже поверхности воды, в воде было растворено сухое молоко для того, чтобы скрыть платформу. Температура воды составляла 22 ± 2°С. Были обозначены две главные оси лабиринта, разделяющие арену на четыре равных сектора. Платформа располагалась в середине первого сектора в течение всего 5-дневного периода обучения. Тестирование проводилось в течение пяти последовательных дней с четырьмя попытками в день, по одной попытке каждый день с каждой из четырех возможных стартовых позиций. Каждая попытка длилась либо 70 с, либо заканчивалась, когда животное находило скрытую платформу. Долговременная память количественно оценивалась на 6 день тестирования, когда платформа была убрана из бассейна. Животным предоставлялось 70 с для исследования бассейна. Фиксировалось время, проведенное животным в секторе, где раннее располагалась платформа. Каждая попытка записывалась на камеру и обрабатывалась наблюдателем вручную.
Забор и хранение образцов. После окончания поведенческих тестов животных анестезировали CO2 и декапитировали. Для иммуноферментного анализа (ИФА) и вестерн-блот анализа гиппокамп и префронтальную кору быстро выделяли, помещали в микроцентрифужные пробирки для выделения белка и замораживали в жидком азоте. Образцы хранили при температуре –70°С до проведения анализа.
Замороженные образцы гиппокампа и префронтальной коры интактных крыс OXYS и Вистар, а также крыс OXYS, получавших TC-2153, (n = 6–8 в группе) гомогенизировали в лизирующем буфере с RIPA (50 мМ Tris-HCl pH 7.4, 150 мМ NaCl, 1% Triton X-100, 1% дезоксихолат натрия, 0.1% SDS, 1 мМ EDTA) с добавлением смеси ингибиторов протеаз (№ P8340, Sigma-Aldrich, США). После инкубации в течение 20 мин на льду образцы центрифугировали при 12 000 g в течение 30 мин при 40°С, супернатанты переносили в новые пробирки. Концентрацию общего белка определяли количественно с помощью набора Bio-Rad Bradford Kit (Bio-Rad Laboratories, США).
Иммуноферментный анализ. Содержание амилоида-β1-42 (Аβ1-42) оценивали ИФА в соответствии с инструкциями производителя (Human/Rat ELISA Kit; Япония). Количественное определение проводили на основе измерения оптической плотности на спектрофотометре, концентрацию белка Аβ1-42 рассчитывали в пикограммах на миллиграмм общего белка гиппокампа или коры головного мозга.
Вестерн-блот анализ. Белки (по 30 мкг на дорожку) разделяли с помощью электрофореза на 10%-ном ПААГ SDS в Tris-глициновом буфере с pH 8.3 при комнатной температуре, затем переносили на нитроцеллюлозные мембраны. После блокирования в течение 2 ч раствором 5% БСА (№ SLBJ8588V; Sigma-Aldrich, США) в PBS, содержащем 0.1% Tween 20, каждую мембрану инкубировали ночь с поликлональными мышиными антителами к STEP (разведение 1 : 1000; № sc-2031; Santa Cruz Biotechnology, США) при температуре 4°C. Далее проводили инкубирование с соответствующими вторичными антителами (разведение 1 : 5000; № ab6808; Abcam, США) в течение 2 ч при комнатной температуре, мембрану обрабатывали SuperSignal West Femto Maximum Sensitivity Substrate (Thermo Fisher Scientific Inc., США) в соответствии с инструкциями производителя. Интенсивность свечения бендов измерялась количественно в программе ImageJ (NIH, США). Для оценки содержания референсного белка использовали антитела к β-актину (разведение 1 : 5000; № ab1801; Abcam, США).
Статистический анализ. Результаты оценивались с помощью однофакторного и двухфакторного дисперсионного анализа (программное обеспечение Statistica 8.0; StatSoft, США). Нормальность распределения проверяли по критерию Шапиро–Уилка. Тест Ньюмана–Кейлса post hoc был применен к основным значимым эффектам и взаимодействиям для оценки межлинейных различий между интактными крысами OXYS и Wistar, а также между интактными и опытными крысами OXYS. Для зависимых парных сравнений был применен t-критерий для зависимых выборок. Данные представлены в виде среднего значения ± SEM (mean ± SEM). Различия считались статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Оценка поведения животных в тесте “Приподнятый крестообразный лабиринт”. Мы не выявили значимых различий в уровне тревожности крыс OXYS и Вистар в тесте “Приподнятый крестообразный лабиринт” (рис. 2а–г): действительно, количество выходов в открытые рукава лабиринта, проведенное в них время и пройденное расстояние достоверно не различались между линиями (p > 0.05). В то же время, препарат TC-2153 уменьшил время нахождения крыс OXYS в открытых рукавах лабиринта (p < 0.02; тест Ньюмана–Кейлса), что свидетельствует об увеличении уровня тревожности. Однако этот параметр значимо не различался между крысами OXYS, получавшими TC-2153, и контрольными крысами Вистар.
Рис. 2.
Влияние приема препарата TC-2153 на уровень тревожности крыс OXYS в тесте “Приподнятый крестообразный лабиринт”. Крысы OXYS совершали меньше входов в закрытые рукава (г) по сравнению с крысами Вистар. Пероральное введение ТС-2153 уменьшало время, проведенное крысами OXYS в открытых (а) и закрытых (г) рукавах, а также количество выходов в открытые (в) и закрытые (г) рукава. Крысы OXYS продемонстрировали значительно более низкое количество вертикальных стоек (е) по сравнению с крысами Вистар. TC-2153 значительно уменьшал количество пересеченных квадратов (д) и количество вертикальных стоек (е) у крыс OXYS. Данные представлены как mean ± ± SEM; *р < 0.05 для межлинейных различий; # р < 0.05 для эффектов приема ТС-2153. n = 22 животных в группе.
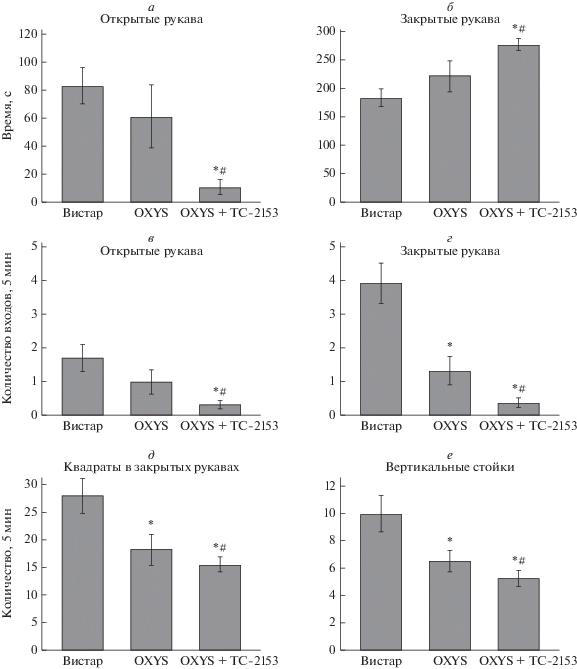
У крыс OXYS была значительно снижена двигательная активность: расстояние, пройденное в закрытых рукавах лабиринта, и количество вертикальных стоек было ниже, чем у крыс Вистар (p < 0.008 и p < 0.006 соответственно; тест Ньюмана–Кейлса). Прием препарата TC-2153 не повлиял на эти параметры у крыс OXYS. Исследовательская активность (выглядывания из закрытых рукавов, свешивания с открытых рукавов) не различалась между крысами OXYS и Вистар, и препарат TC-2153 не влиял на эти параметры.
Таким образом, мы не обнаружили достоверных различий в уровне тревожности между крысами OXYS и Вистар (рис. 1д–е), однако прием TC-2153 повышал уровень тревожности у крыс OXYS.
Поведение животных в тесте “Открытое поле”. Результаты теста “Открытое поле” представлены на рис. 3. Как и ожидалось, дисперсионный анализ показал, что крысы OXYS были значительно более пассивными, чем крысы Вистар того же возраста: количество пересеченных квадратов и количество вертикальных стоек были значительно ниже у крыс OXYS (F1,45 = 13.4, p < 0.001 и F1,45 = 10.0, p < 0.003 соответственно).
Рис. 3.
Влияние приема препарата TC-2153 на поведение крыс OXYS в тесте “Открытое поле”. Крысы OXYS демонстрировали значительно меньшее количество пересеченных квадратов (а) и вертикальных стоек (б) по сравнению с крысами Вистар. TC-2153 значительно уменьшал количество пересеченных квадратов (а) и вертикальных стоек (б) у крыс OXYS. Данные представлены как mean ± SEM; * p < 0.05 для межлинейных различий; # p < 0.05 для эффектов TC-2153. n = 22 животных в группе.
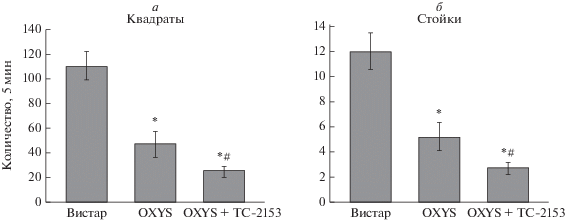
Время первого выхода в центральную область открытого поля ассоциировано с уровнем тревожности животных. Согласно результатам ANOVA-анализа, время выхода в центральную область было больше у крыс OXYS по сравнению с крысами Вистар (F1,45 = 5.7, p < 0.02), что может отражать повышенную тревожность крыс OXYS. Более низкая частота груминга может быть связана со сниженным уровнем тревожности и/или снижением активности. ANOVA-анализ показал, что частота груминга у крыс OXYS была немного ниже (F1,45 = 3.9, p = 0.05) по сравнению с крысами Вистар.
Прием TC-2153 значительно снизил двигательную и исследовательскую активность крыс OXYS в тесте “Открытое поле”: уменьшил количество пересеченных квадратов и вертикальных стоек (F1,36 = 4.1, p < 0.05 и F1,37 = 5.1, p < 0.03 соответственно) – и не влиял на задержку выхода в центральную область открытого поля и на частоту груминга.
Исследование способности к обучению и памяти крыс в тесте “Водный лабиринт Морриса”. Результаты ANOVA-анализа показали лишь незначительное влияние генотипа (F1,109 = 3.5, р = 0.064) на латентный период нахождения платформы, а post hoc анализ не выявил достоверных различий в способности к обучению между крысами OXYS и Вистар (рис. 4а): животные обеих линий научались находить скрытую под водой платформу в 1 (целевом) секторе уже на 2-й день обучения (р < < 0.05; t-тест для зависимых выборок). Крысы OXYS, получавшие ТС-2153, также научались находить скрытую платформу на 2-й день обучения (р < 0.006; t-тест для зависимых выборок). Закономерно, что латентный период нахождения платформы постепенно снижался к 5-му дню обучения у крыс обеих линий (F4,109 = 26.0, р < 0.0001).
Рис. 4.
Влияние приема препарата TC-2153 на пространственную память крыс OXYS в тесте “Водный лабиринт Морриса”. Латентный период нахождения скрытой под водой платформы (а) снижался с 1-го по 5-й день обучения. TC-2153 увеличил время, проведенное крысами OXYS в 1 (целевом) секторе по сравнению с другими секторами (б) на 6-й день обучения, когда платформа была удалена. Время нахождения платформы (а) не различалось между группами животных. Данные представлены как mean ± SEM. Условные обозначения: различия ^p < 0.05 – для различий с предыдущим днем обучения; @p < 0.05 – для различий между временем, проведенном в целевом секторе, и другими секторами. Черная линия – средний процент времени в каждом из четырех секторов. n = 8 животных в группе.
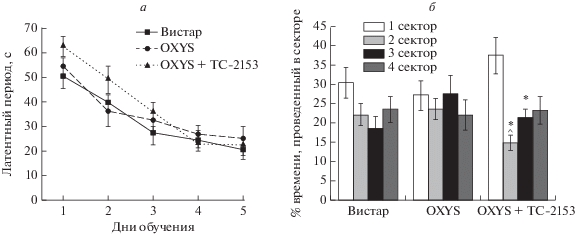
Долговременную память оценивали на 6-й день, когда платформа была удалена, с помощью t-критерия для зависимых выборок. ANOVA-анализ не выявил межлинейных различий во времени, проведенном животными в целевом секторе на 6-й день тестирования (F1, 22 = 0.1, р = 0.74); однако крысы Вистар в пределах своей линии демонстрировали предпочтение целевого сектора остальным секторам (р < 0.04), что свидетельствует о запоминании животными месторасположения платформы (рис. 4б). Крысы OXYS, напротив, проводили примерно равное количество времени во всех четырех секторах (р = 0.58). Введение TC-2153 оказало благоприятное влияние на долговременную память животных: крысы OXYS, получавшие препарат, проводили значительно больше времени в целевом секторе по сравнению с другими секторами (р < 0.02).
Важно отметить, что время нахождения платформы достоверно не отличались между крысами OXYS и Вистар во все дни обучения и прием TC-2153 на это не оказывал влияния.
Влияние TC-2153 на уровень Аβ1-42 в гиппокампе и фронтальной коре. В этом исследовании мы провели оценку влияния приема TC-2153 с 9-месячного возраста на содержание Aβ1-42 в гиппокампе и фронтальной коре крыс OXYS. Результаты ANOVA-анализа показали, что содержание Aβ1-42 в гиппокампе и фронтальной коре у крыс OXYS было значительно выше, чем у крыс Вистар (F1,18 = 146, p < 0.0001 и F1,18 = 86, p < 0.0001 соответственно), и прием TC-2153 на содержание Aβ1-42 не влиял (F1,18 = 0.38, p = 0.54 для гиппокампа и F1,18 = 0.88, p = 0.36 для фронтальной коры): уровень Aβ1-42 в коре головного мозга и гиппокампе крыс OXYS оставался почти вдвое выше, чем у крыс Вистар (рис. 5а).
Рис. 5.
Уровни белков Aβ1-42 и изоформы STEP61 в коре головного мозга и гиппокампе интактных крыс OXYS и Вистар и крыс OXYS, получавших ТС-2153. Уровни Аβ1-42 (а) были выше в коре головного мозга и гиппокампе крыс O-XYS. Уровни STEP61 (б) не различались между крысами OXYS и Вистар в коре головного мозга и гиппокампе. Прием ТC-2153 не оказал влияния на содержание обоих исследуемых белков. Данные представлены как mean ± SEM; * р < 0.05 для межлинейных различий. n = 6 животных в группе.
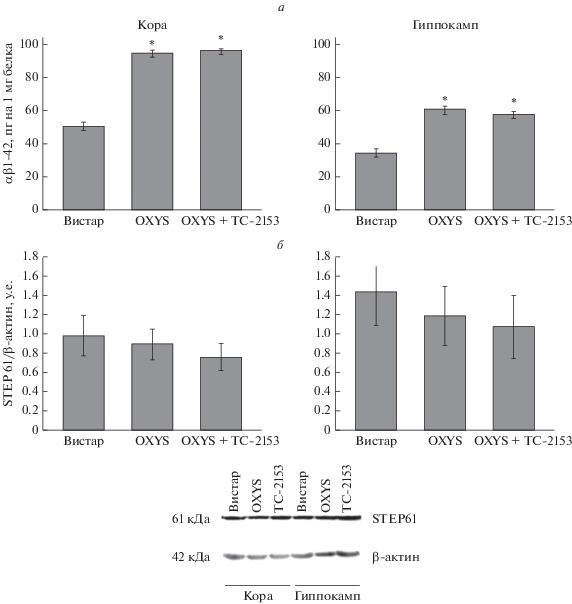
Влияние TC-2153 на уровень белка STEP61 в коре головного мозга и гиппокампе крыс OXYS. Далее мы исследовали уровни изоформы STEP61 в коре головного мозга и гиппокампе методом вестерн-блот анализа (рис. 5б). ANOVA-анализ не выявил влияние фактора “генотип” на содержание изоформы STEP61 в коре (F1,8 = 0.12, р = 0.73) и гиппокампе животных (F1,10 = 0.31, р = 0.59). Прием TC-2153 не оказывал влияния на уровень белка STEP61 ни в одной из структур мозга крыс OXYS (F1,8 = 0.39, p = 0.55 для коры и F1,10 = 0.057, p = = 0.55 для гиппокампа).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изменения в поведении у крыс OXYS начинаются в возрасте ~3 мес. и рассматриваются нами как наиболее раннее проявление ускоренного старения их мозга. С возрастом изменения нарастают на фоне постепенного накопления Aβ, и, как подтвердило настоящее исследование, в возрасте 13 мес. поведение крыс OXYS существенно отличается от такового у контрольных крыс Вистар. Длительный прием ингибитора STEP TC-2153 увеличил эти различия – вдвое снизил двигательную и исследовательскую активность крыс OXYS в тесте “открытое поле” и значительно повысил их тревожность в тесте “приподнятый крестообразный лабиринт”. Таким образом, TС-2153 отрицательно повлиял на поведенческие проявления БА-подобной патологии у крыс OXYS. В то же время мы не выявили отрицательного влияния TC-2153 на обучение крыс OXYS в водном лабиринте Морриса, и при этом он положительно повлиял на долговременную память животных: крысы OXYS, получавшие препарат, проводили значительно больше времени в целевом секторе 1. Следует отметить, что пространственное обучение крыс O-XYS в возрасте 13 мес. существенно не отличается от такового у крыс Вистар. Значительное снижение когнитивных функций в тесте “Водный лабиринт Морриса” регистрируется у крыс OXYS, начиная с возраста 14–16 мес. [27, 28]. В то же время в 8-рукавном радиальном лабиринте дефицит обучения и долговременной памяти проявляется у крыс OXYS уже в возрасте 3 мес. [29].
Как сообщалось ранее, кратковременное ингибирование STEP с помощью TS-2153 способно положительно влиять на память, зависящую от гиппокампа: снижало дефицит памяти у старых крыс Sprague-Dawley (в возрасте 20–22 мес.) при ее тестировании в Т-образном лабиринте [12], а также устраняло когнитивные нарушения у 12-месячных мышей 3xTg-AD [5]. Выполнение задач в водном лабиринте Морриса связано с долгосрочной потенциацией и функцией рецептора NMDA, и этот тест является ключевым методом исследования функций гиппокампа [30, 31]. В настоящем исследовании мы не выявили различий в способности к обучению крыс OXYS и Вистар в водном лабиринте Морриса и TC-2153 не повлиял на нее. Тем не менее, долговременная память у крыс OXYS была снижена, а прием TC-2153 позитивно повлиял на нее. Следовательно, в этом отношении наши данные совпадают с результатами исследования эффектов краткосрочного введения TC-2153 на когнитивные функции [5]. Важно, что при этом эффекты кратковременного подавления STEP у 6-месячных мышей 3xTg-AD не были связаны с изменением уровней Aβ или фосфотау [5]. Длительное введение TC-2153 в нашем исследовании также не повлияло на уровень Aβ в гиппокампе и префронтальной коре головного мозга крыс OXYS. Следует отметить, что в последней публикации группы Lombroso [32] сообщается, что способность TC-2153 улучшать когнитивные функции у мышей 3xTg-AD может быть связана с усилением синаптогенеза. Однако в процессе синаптогенеза могут образовываться не только функциональные, но и молчащие синапсы [33, 34]. Ранее мы выявили усиление синаптогенеза у 5-месячных крыс OXYS, но при этом большинство новообразованных синапсов были неактивны [20]. Не исключено, что снижение локомоторной активности и повышение тревожности у крыс OXYS на фоне приема TC-2153 связано с образованием в гиппокампе абберантных синапсов.
Мы не выявили различий в уровне белка STEP61: он был одинаковым как в коре мозга, так и в гиппокампе крыс OXYS и Вистар, и на него не повлиял длительный прием TC-2153. По данным Jian Xu и соавторов [5], TC-2153 может подавлять активность STEP, образуя ковалентную связь с Cys472 активного сайта, которая необходима для ферментативной активности, не изменяя при этом общее количество STEP и ее фосфорилированной формы. Мы не исследовали активность и фосфорилирование STEP61 в коре мозга и гиппокампе, но изучили их в сетчатке крыс OXYS при оценке эффектов длительного приема TC-2153 по той же схеме [35]. Признаки БА у крыс OXYS развивается одновременно с другими проявлениями преждевременного старения, одним из которых является ретинопатия, аналогичная возрастной макулярной дегенерации (ВМД) у людей [21]. Это заболевание имеет ряд общих клинических и гистопатологических особенностей с БА, и некоторые исследователи рассматривают ВМД как БА глаз [36]. Мы показали [35], что повышение уровня белка STEP61 и снижение, по сравнению с контрольными крысами Вистар, активности общей и STEP фосфатаз в сетчатке предшествуют проявлению клинических признаков ВМД у крыс OXYS. В то же время мы не выявили каких-либо различий в этих параметрах сетчатки у 13-месячных крыс Вистар и крыс OXYS с выраженными признаки ВМД. Более того, ингибирование STEP с помощью TC-2153 с возраста 9 до 13 мес., как и в настоящем исследовании, негативно повлияло на нейроретину, но при этом не изменило уровни мРНК гена Ptpn5, белков STEP46 и STEP61, а также их фосфатазную активность в сетчатке крыс OXYS [35]. Эти результаты, как и данные, полученные в настоящем исследовании, предполагают, что эффекты длительного приема TC-2153 могут быть опосредованы механизмами, не связанными со STEP. Ранее было показано [9], что его эффекты могут быть опосредованы влиянием как на серотонинергическую систему мозга, так и на BDNF, изменения которого при старении способствуют развитию нейродегенеративных процессов. Ранее нами было выявлено двукратное, по сравнению с крысами Вистар, снижение уровня BDNF в гиппокампе крыс OXYS в возрасте 12 мес. [29].
Известно, что STEPs являются редокс-зависимыми ферментами: с одной стороны, окислительный стресс, вызванный перекисью водорода, приводит к значительному увеличению образования димеров и олигомеров более высокого порядка STEP61, тем самым вызывая значительное снижение его ферментативной активности [37], с другой – ингибирование STEP посредством TC-2153 может быть отменено инкубацией с тиолами, такими как глутатион или дитиотреитол [5]. В то же время появились данные о том, что сам TC-2153 способен модулировать редокс-статус клеток. В недавнем обзоре [38] TC-2153, как и другие катенированные двухвалентные органические соединения серы, рассматривается как перспективное пролекарство – потенциальный донор H2S. H2S – эндогенный газотрансмиттер, способный модулировать окислительно-восстановительный гомеостаз клетки, действуя как антиоксидант и проявляя широкий спектр цитопротекторных и физиологических функций при возрастных заболеваниях [39]. Примечательно, что у пациентов с БА наблюдается значительное снижение уровня H2S, что позволяет рассматривать использование доноров H2S как многообещающую стратегию лечения нейродегенеративных заболеваний [40]. Действительно, положительные эффекты кратковременного воздействия TC-2153 уже получены на моделях фамильной формы БА, депрессивных расстройств [9] и аутизма [41]. Однако следует отметить, что не только окислительный, но и восстановительный стресс, в том числе – на фоне избытка H2S, может развиваться в клетке и приводить к побочным эффектам [42].
Таким образом, результаты нашего исследования длительного приема TC-2153 в отношении развития как БА-, так и ВМД-подобной патологии у крыс OXYS противоречивы: улучшив долговременную память, TC-2153 значительно уменьшил и без того сниженную двигательную и исследовательскую активность и увеличил тревожность животных – изменения, которые мы рассматриваем как проявления ускоренного старения их мозга. Еще более тревожным представляется негативное влияние TC-2153 на нейроны сетчатки, о котором мы сообщали ранее [35]. Можно предположить, что длительный прием TC-2153 повлиял на окислительно-восстановительный баланс. При этом избыточный восстановительный потенциал мог, вызывая изменения в образовании дисульфидных связей в белках, повлиять на клеточные сигнальные пути, изменить транскрипционную активность, подавить функцию митохондрий и снизить клеточный метаболизм [43]. Неслучайно избыточное потребление пищевых добавок с антиоксидантами, таких как витамины и/или флавоноиды, способно приводить к прооксидантным эффектам, которые могут изменять окислительно-восстановительное равновесие клеток и способствовать снижению стресса, но при этом даже сокращать продолжительность жизни.
ЗАКЛЮЧЕНИЕ
Несмотря на неоднозначность эффектов длительного приема TC-2153, мы согласны с Gü Gojon и G.A. Morales [38] в том, что TC-2153, а также его аналоги в перспективе могут стать эффективными фармакологическими терапевтическими агентами. Тем не менее, необходимы дополнительные исследования на различных моделях животных для изучения механизмов действия TC-2153, поиска оптимальных доз и продолжительности терапии.
Список литературы
Frere S., Slutsky I. // Neuron. 2018. V. 97. № 1. P. 32–58.
Alzheimer’s Disease International. // Alzheimer’s Disease International: London, UK, 2019. P. 13–16.
Querfurth H.W., LaFerla F.M. // N. Engl. J. Med. 2010. V. 362. P. 329–344.
Crous-Bou M., Minguillón C., Gramunt N., Molinuevo J.L. // Alzheimers Res. Ther. 2017. V. 9. 71.
Xu J., Chatterjee M., Baguley T.D., Brouillette J., Kurup P., Ghosh D., Kanyo J., Zhang Y., Seyb K., Ononenyi C., Foscue E., Anderson G.M., Gresack J., Cuny G.D., Glicksman M.A., Greengard P., Lam T.T., Tautz L., Nairn A.C., Ellman J.A., Lombroso P.J. // PLoS Biol. 2014. V. 12. № 8. e1001923.
Kamceva M., Benedict J., Nairn A.C., Lombroso P.J. // Neural. Plast. 2016. V. 2016. 8136925.
Bult A., Zhao F., Dirkx Jr. R., Sharma E., Lukacsi E., Solimena M., Naegele J.R., Lombroso P.J. // J. Neurosci. 1996. V. 16. № 24. P. 7821–7831.
Boulanger L.M., Lombroso P.J., Raghunathan A., During M.J., Wahle P., Naegele J.R. // J. Neurosci. 1995. V. 15. № 2. P. 1532–1544.
Kulikova E.A., Kulikov A.V. // Curr. Protein Pept. Sci. 2017. V. 18. № 11. P. 1152–1162.
Saavedra A., Ballesteros J.J., Tyebji S., Martínez-Torres S., Blázquez G., López-Hidalgo, R. Azkona G., Alberch J., Martín E.D., Pérez-Navarro E. // Mol. Neurobiol. 2019. V. 56. № 2. P. 1475–1487.
Chen X., Lin R., Chang L., Xu S., Wei X., Zhang J., Wang C., Anwyl R., Wang Q. // Neuroscience. 2013. V. 253. P. 435–443.
Castonguay D., Dufort-Gervais J., Ménard C., Chatterjee M., Quirion R., Bontempi B., Schneider J.S., Arnsten A.F.T., Nairn A.C., Norris C.M., Ferland G., Bézard E., Gaudreau P., Lombroso P.J., Brouillette J. // Curr. Biol. 2018. V. 28. № 7. P. 1079–1089.e4.
Carty N.C., Xu J., Kurup P., Brouillette J., Goebel-Goody S.M., Austin D.R., Yuan P., Chen G., Correa P.R., Haroutunian V., Pittenger C., Lombroso P.J. // Transl. Psychiatry. 2012. V. 2. № 7. e137.
Goebel-Goody S.M., Wilson-Wallis E.D., Royston S., Tagliatela S.M., Naegele J.R., Lombroso P.J. // Genes Brain Behav. 2012. V. 11. № 5. P. 586–600.
Kurup P.K., Xu J., Videira R.A., Ononenyi C., Baltazar G., Lombroso P.J., Nairnc A.C. // Proc. Natl. Acad. Sci. USA. 2015. V. 112. № 4. P. 1202–1207.
Zhang Y., Kurup P., Xu J., Carty N., Fernandez S.M., Nygaard H.B., Pittenger C., Greengard P., Strittmatter S.M., Nairn A.C., Lombroso P.J. // Proc. Natl. Acad. Sci. USA. 2010. V. 107. № 44. P. 19014–19019.
Khomenko T.M., Tolstikova T.G., Bolkunov A.V., Dolgikh M.P., Pavlova A.V., Korchagina D.V., Volcho K.P., Salakhutdinov N.F. // Lett. Drug. Des. Discov. 2009. V. 6. P. 464–467.
Kulikov A.V., Tikhonova M.A., Kulikova E.A., Volcho K.P., Khomenko T.M., Salakhutdinov N.F., Popova N.K. // Psychopharmacology (Berl). 2012. V. 221. № 3. P. 469–478.
Stefanova N.A., Kozhevnikova O.S., Vitovtov A.O., Maksimova K.Y., Logvinov S.V., Rudnitskaya E.A., Korbolina E.E., Muraleva N.A., Kolosova N.G. // Cell Cycle. 2014. V. 13. № 6. P. 898–909.
Stefanova N.A., Muraleva N.A., Korbolina E.E., Kiseleva E., Maksimova K.Y., Kolosova N.G. // Oncotarget. 2015. V. 6. № 3. P. 1396–1413.
Telegina D.V., Kozhevnikova O.S., Bayborodin S.I., Kolosova N.G. // Sci. Rep. 2017. V. 7. 41533.
Telegina D.V., Suvorov G.K., Kozhevnikova O.S., Kolosova N.G. // Int. J. Mol. Sci. 2019. V. 20. № 22. 5632.
Stefanova N.A., Muraleva N.A., Skulachev V.P., Kolosova N.G. // J. Alzheimers Dis. 2014. V. 38. № 3. P. 681–694.
Muraleva N.A., Stefanova N.A., Kolosova N.G. // Antioxidants (Basel). 2020. V. 9. № 8. 676.
Соловьева Н.А., Морозкова Т.С., Салганик Р.И. // Генетика. 1975. Т. 11. С. 63–71.
Morris R. // J. Neurosci. Methods. 1984. V. 11. № 1. P. 47–60.
Stefanova N.A., Fursova A.Z., Kolosova N.G. // J. Alzheimers Dis. 2010. V. 21. № 2. P. 479–491.
Stepanichev M.Y., Onufriev M.V., Peregud D.I., Lazareva N.A., Moiseeva Y.V., Nesterenko A.N., Novikova M.R., Stefanova N.A., Kolosova N.G., Gulyaeva N.V. // Neurochem. J. 2018. V. 12. P. 184–194.
Rudnitskaya E.A., Maksimova K.Yi., Muraleva N.A., Logvinov S.V., Yanshole L.V., Kolosova N.G., Stefanova N.A. // Biogerontology. 2015. V. 16. № 3. P. 303–316.
Vorhees C.V., Williams M.T. // Nat. Protoc. 2006. V. 1. P. 848–858.
Nunez J. // J. Vis. Exp. 2008. V. 19. 897.
Chatterjee M., Kwon J., Benedict J., Kamceva M., Kurup P., Lombroso P.J. // Exp. Brain Res. 2021.
Kullmann D.M. // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2003. V. 358. № 1432. P. 727–733.
Koya E., Dong Y. // Neuropsychopharmacology. 2018. V. 43. № 10. P. 1981–1982.
Telegina D.V., Kulikova E.A., Kozhevnikova O.S., Kulikov A.V., Khomenko T.M., Volcho K.P., Salakhutdinov N.F., Kolosova N.G. // Int. J. Mol. Sci. 2020. V. 21. № 15. 5182.
Papadopoulos Z. // Curr. Aging Sci. 2020. V. 13. № 2. P. 102–112.
Deb I., Poddar R., Paul S. // J. Neurochem. 2011. V. 116. № 6. P. 1097–1111.
Gojon G., Morales G.A. // Antioxid. Redox Signal. 2020. V. 33. № 14. P. 1010–1045.
Tabassum R., Jeong N.Y., Jung J. // Neural Regen. Res. 2020. V. 15. № 4. P. 653–662.
Sestito S., Pruccoli L., Runfola M. Citi V., Martelli A., Saccomanni G., Calderone V., Tarozzi A., Rapposelli S. // Eur. J. Med. Chem. 2019. V. 184. 111745.
Chatterjee M., Singh P., Xu J., Lombroso P.J., Kurup P.K. // Behav. Brain. Res. 2020. V. 391. 112713.
Lloret A., Fuchsberger T., Giraldo E., Vina J. // Curr. Alzheimer Res. 2016. V. 13. № 2. P. 206–211.
Pérez-Torres I., Guarner-Lans V., Rubio-Ruiz M.E. // Int. J. Mol. Sci. 2017. V. 18. № 10. 2098.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия



