Нейрохимия, 2022, T. 39, № 1, стр. 89-96
Нейрохимические изменения в островковой коре и передней поясной коре у интактных самцов и самок первого поколения крыс, подвергнутых хроническому воздействию этанола
В. Г. Коньков 1, В. С. Кудрин 1, В. Б. Наркевич 1, А. О. Ефимова 1, Т. Д. Никифорова 1, Л. Г. Колик 1
1 ФГБНУ “НИИ фармакологии им. В.В. Закусова”
Москва, Россия
Поступила в редакцию 25.05.2021
После доработки 07.07.2021
Принята к публикации 14.07.2021
- EDN: ZKFLVY
- DOI: 10.31857/S1027813322010083
Аннотация
Проблемы с психическим здоровьем, обусловленные действием алкоголя, включая повышенный риск развития тревожно-депрессивных расстройств и алкогольной зависимости, нередко передаются из поколения в поколение. В настоящее время отсутствуют работы, рассматривающие влияние длительного действия алкоголя на содержание нейромедиаторных моноаминов и нейромедиаторных аминокислот в структурах мозга, отвечающих за формирование эмоциональных и мотивационных паттернов поведения, у первого F1 поколения при отсутствии прямого воздействия алкоголя на плод. Целью работы являлось изучение тревожного поведения и нейрохимических изменений в островковой коре и передней поясной коре (ППК) у интактного потомства крыс, потреблявших раствор этанола в течение 30-ти недель до спаривания. В тесте “приподнятый крестообразный лабиринт” самки проводили больше времени в открытых рукавах по сравнению с самцами, однако значимых отличий в реакции на стресс между потомством подвергнутых и не подвергнутых воздействию этанола крыс не выявлено. В опытах ex vivo в островковой коре отмечалось снижение оборота внеклеточного дофамина у животных обоих полов (p < 0.05) и разнонаправленные сдвиги в суммарном обороте дофамина при отсутствии изменений в содержания нейромедиаторных аминокислот. В ППК наблюдалось уменьшение содержания глицина (p < 0.05) только у самок. Полученные данные свидетельствуют о влиянии этанола при длительном введении per os на зависимые от пола изменения в содержании нейротрансмиттерных моноаминов и аминокислот в структурах мозга, определяющих формирование эмоционального и мотивационного поведения у ранее не подверженного действию этанола потомства.
ВВЕДЕНИЕ
Проблемы с психическим здоровьем, обусловленные действием алкоголя, включая повышенный риск развития тревожно-депрессивных расстройств и алкогольной зависимости, нередко передаются из поколения в поколение [1–3]. В опытах in vivo доказано, что эпигенетические факторы могут быть ответственны за наследование спровоцированных алкоголем нарушений. Так, субхроническое внутрижелудочное введение алкоголя в “подростковом” возрасте приводило к изменению метилирования ДНК в гипоталамусе у ранее не подверженного действию этанола потомства крыс первого поколения [4]. Кроме того, у крысят наблюдалось снижение массы тела и маркеров пубертатного развития, что может также свидетельствовать о неблагоприятном влиянии введения этанола на эпигенетические признаки в первом поколении [5]. Подобные наблюдения имеют большое значение для терапии алкоголизма, поскольку алкоголь является наиболее распространенным легальным психоактивным веществом, и его неограниченное потребление является серьезной проблемой с долгосрочными негативными последствиями [6, 7].
Ряд областей мозга, к числу которых относятся миндалевидное тело, гиппокамп, паравентрикулярное ядро гипоталамуса, тесно связаны с формированием эмоционально-стрессовой реакции как у человека, так и у грызунов [8]. Островковая кора (insula), также относится к числу областей мозга, связанных с развитием тревожных реакций [9] и управляющих регуляцией мотивационного поведения, в том числе в отношении психоактивных веществ [10]. Работа S. Betka et al. (2019) стала первым исследованием, охарактеризовавшим нейрохимический и морфологический профиль островковой коры у потребляющих алкоголь молодых людей и показавшим связь между алкоголем и нейрохимической/структурной целостностью островковой коры [11], что позволяет предположить значимость этих нейробиологических характеристик при утрате контроля над потреблением на фоне длительного “увлечения” алкоголем.
Передняя поясная кора (ППК) посредством тесных нейроанатомических связей с передней островковой корой, миндалевидным телом, префронтальной корой и стриатумом вовлечена в регуляцию обработки информации, имеющей эмоциональную окраску. Результаты исследований, полученные с помощью магнитно-резонансной томографии, подтверждают ключевую роль ППК в интеграции интероцептивных, эмоциональных и когнитивных функций через взаимодействие с островком и стриатумом во время оценки выраженности эмоций у здоровых добровольцев и ослабление этой интеграции на фоне различных тревожных расстройств [12]. Кроме того, получены данные об активации ППК визуальными раздражителями, связанными с психоактивными веществами [13].
Несмотря на большое количество поведенческих и молекулярно-биологических экспериментальных исследований последствий пренатального воздействия алкоголя на потомство, количество публикаций, посвященных влиянию потребления алкоголя до спаривания крыс на потомство, ограничено и преимущественно описывает влияние непродолжительного воздействия алкоголя в режиме “запойного” потребления (“binge-drinking”) в подростковом возрасте [4, 14, 15]. В настоящее время отсутствуют работы, рассматривающие влияние длительного действия алкоголя на содержание нейротрансмиттерных моноаминов и аминокислот в структурах мозга, отвечающих за формирование эмоциональных и мотивационных паттернов поведения у первого F1 поколения, не подвергавшегося непосредственному воздействию алкоголя на плод.
Целью работы являлось изучение тревожного поведения и нейрохимических изменений, развивающихся в островковой коре и ППК у интактного потомства от крыс, потреблявших раствор этанола в течение 30-ти недель до спаривания.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Эксперименты выполнены на беспородных крысах (К) самцах (n = 19) и самках (n = 17) весом 210–240 г, (питомник “Столбовая” ФГБНУ “Научный центр биомедицинских технологий ФМБА России”, Московская обл.). Также в работе использовали потомство (А) крыс (самки и самцы) того же возраста, полученное при спаривании самцов (n = 9), потреблявших 10% раствор этанола в качестве единственного источника жидкости в режиме ежедневно (моделирование “хронического потребления алкоголя”), с самками (n = 14), которым 10% этанол предоставляли в качестве единственного источника жидкости в течение 3-х дней в неделю (“week-end drinking”). Среднесуточное потребление этанола рассчитывалось на 30-й неделе потребления по данным потребления за 3 дня (понедельник–среда–пятница) у “родителей” составляло 4.4 ± 0.7 г/кг (самцы) и 5.9 ± 0.3 г/кг (самки). За 48 ч до спаривания у всех животных (самцы и самки) лишали доступа к этанолу и предоставляли только воду в качестве источника жидкости, то есть во время спаривания крысы не испытывали действия этанола, также как и самки в течение всего периода беременности, таким образом потомство никогда не подвергалось непосредственному воздействию алкоголя.
За начальную точку постнатального периода мы принимали постнатальный день 0 (ПНД0). Животных из контрольной (К) группы, “родители” которых не имели доступа к алкоголю, и из опытной (А) группы, то есть потомство F1 от крыс, подверженных экспозиции с раствором этанола, начиная с возраста ПНД 26 до ПНД 62–65, содержали в клетках по 5 особей со свободным доступом к воде и гранулированному корму при регулируемом 12/12 (свет/темнота) световом режиме в соответствии с Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 81 “Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств”. Поведенческие исследования выполнены на молодых половозрелых крысах в возрасте 2-х месяцев, что соответствует возрасту человека в период полового созревания, когда биологические и социальные факторы оказывают наибольшее влияние на формирование алкогольной мотивации у подростков и молодых людей. Все эксперименты с животными проводили в соответствии с международными правилами (European Communities Council Directive of November 24,1986 (86/609/EEC)), а также в соответствии с “Правилами работы с животными”, утвержденными биоэтической комиссией ФГБНУ “НИИ фармакологии им. В.В. Закусова”.
Схема эксперимента. Животные были разделены на следующие экспериментальные группы:
1. К♂ (самцы, n = 9)
2. К♀ (самки, n = 8)
3. А♂ (самцы, потомство крыс, получавших раствор этанола, n = 10)
4. А♀ (самки, потомство крыс, получавших раствор этанола, n = 9)
Поведенческие исследования проводили в тесте “приподнятый крестообразный лабиринт” (ПКЛ), позволяющем оценить выраженность эмоциональной реакции и уровень тревожности, двигательную активность, а также скорость ориентировочных реакций у грызунов.
Установка ПКЛ, приподнятая на высоту 50 см, состоит из 2-х открытых рукавов, расположенных напротив друг друга (50 × 10 см) и двух закрытых рукавов (50 × 10 × 40 см) (НПК Открытая Наука, Россия). Животное помещали в центр лабиринта мордой по направлению к открытому рукаву. В течение 300 с визуально регистрировали время пребывания в открытых рукавах и на центральной площадке, число выходов в открытые и закрытые рукава и количество свешиваний головы (направленная исследовательская активность) [16].
Нейрохимические исследования. По завершению поведенческих исследований животных декапитировали, после чего извлекали на льду ППК и островковую кору, замораживали в жидком азоте и взвешивали. Забор биоматериала у самок крыс осуществляли в фазу диэструса. Пробы хранили в жидком азоте. Перед экспериментами по определению содержания нейротрансмиттеров пробы размельчали в гомогенизаторе поттера (тефлон-стекло) в 1 мл 0.1 н HСlO4 с добавлением 3,4-диоксибензиламина (0.5 нмоль/мл) в качестве внутреннего стандарта. Пробы центрифугировали при 10 000 g в течение 10 мин. Содержание моноаминов и их метаболитов (3-метокси-4-оксифенилгликоля (МОФЕГ), норадреналина (НА), дофамина (ДА), 3,4-диоксифенилуксусной кислоты (ДОФУК), гомованилиновой кислоты (ГВК), 3-метокситирамина (3-МТ), серотонина (5-окситриптамина, 5-ОТ) и 5-оксииндолуксусной кислоты (5-ОИУК) определяли методом высокоэффективной жидкостной хроматографии с электрохимической детекцией (ВЭЖХ/ЭД) на хроматографе LC-304T (ВАS, США) с аналитической колонкой ReproSil-Pur ODS (C18, 100 × 4 мм, 3 мкм) (Dr.Maisch, Германия), при скорости элюции подвижной фазы 1,0 мл/мин и давлении до 200 атм. Мобильная фаза состояла из: 0.1 M цитратно-фосфатного буфера, содержащего 1.1 mM октансульфоновой кислоты, 0.1 mM ЭДТА и 9% ацетонитрила (pH 3.0). Измерение проводили с помощью электрохимического детектора LC-4B (BAS США) на двойном стеклоугольном электроде (+0.85 V) против электрода сравнения Ag/AgCl. МОФЕГ, НА, ДА, ДОФУК, ГВК, 3-МТ, 5-ОТ, 5‑ОИУК в начальной концентрации 0.5 нмоль/мл в 0.1 н НClО4 использовали в качестве стандартной смеси для калибровки. Регистрация образцов проводилась с применением аппаратно-программного комплекса МУЛЬТИХРОМ 1.5 (АМПЕРСЕНД) [17]. Все использовавшиеся для анализа реактивы были высокой степени чистоты: о. с. ч. или analytical grade.
Определение содержания тормозных (ГАМК, глицин, таурин) и возбуждающих (аспартат, глутамат) нейромедиаторных аминокислот проводили методом ВЭЖХ/ФД согласно модифицированной методике [18]. Перед анализом ткань гомогенизировали в 1 мл 0.1 н HClO4 замороженные в жидком азоте и взвешенные биологические пробы в 5 мл гомогенизаторе тефлон-стекло. Затем образцы центрифугировали при 10 000 об./мин в течение 15 мин. К 0.025 мл супернатанта добавляли 0.05 мл 0.1 н NaОН, и 0.025 мл ортофталевого реагента для запуска реакцию дериватизации. Через 20 мин 20 мкл полученного деривата подвергали хроматографическому разделению. ГАМК, аспартат, глутамат, таурин, глицин в начальной концентрации 0.1 мкМ/мл в 0.1 н НClО4 использовали в качестве стандартной смеси для калибровки. Регистрацию продуктов разделения проводили на хроматографес флуоресцентным детектором Agilent 1100 (США) с аналитической колонкой HYPERSIL ODS (4.6 × 250 мм, 5 мкм) (длина волны возбуждения – 230 нм, длина волны испускания – 392 нм). Подвижная фаза для определения нейромедиаторных аминокислот состояла из 0.06 M NaH2PO4 · H2O, 0.0032 M Na2HPO4, 0.025 mМ ЭДТА, и 1.24 mM CH3OH, pH = 5.6. Скорость подвижной фазы составляла 1.5 мл/мин. Регистрация образцов проводилась с применением аппаратно-программного комплекса Agilent ChemStation v.B.04.02
После проверки на нормальность распределения по критерию Шапиро–Уилка, достоверность отличий между группами определяли методом двухфакторного дисперсионного анализа (АNOVA) с последующим post-hoc тестом Ньюмана–Кейлса, используя в качестве анализируемых факторов “пол” животных и “наследственность” (GraphPad Prizm 8.0, GraphPad Software, Inc. USA).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
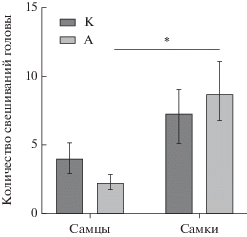
При оценке поведения крыс К и А в тесте ПКЛ не установлено влияние фактора “Наследственность” на время пребывания в открытых рукавах лабиринта (F (1, 31) = 1.281 P = 0.2664), общее число заходов в рукава (F (1, 35) = 0.2892 P = 0.5941), число выходов в открытые рукава (F (1, 35) = 0.6436 P = = 0.4278), свешивание головы (F (1, 35) = 0.005244 P = 0.9427). Фактор “Пол” статистически значимо влиял на время пребывания в открытых рукавах (F (1, 31) = 28.76 P < 0.0001), общее число заходов в рукава (F (1, 35) = 22.37 P < 0.0001), число выходов в открытые рукава (F (1, 35) = 19.74 P < 0.0001), свешивание головы (F (1, 35) = 10.15 P = 0.0030), но не влиял на время пребывания в центре ПКЛ, также не установлено взаимодействия факторов “Наследственность” и “Пол” в отношении поведения в ПКЛ. При последующем множественном сравнении зарегистрировано статистически значимое увеличение времени пребывания (в 3 и в 3.9 раз) и количества заходов в открытые рукава (в 2.4 и в 3.9 раз), а также увеличение числа заходов в рукава (в 1.5 и в 2 раза) у самок, потомков интактных крыс и крыс, хронически употреблявших алкоголь, соответственно по сравнению с самцами (рис. 1), также у самок, потомков крыс, хронически употреблявших алкоголь установлено увеличение количества свешиваний головы в 3.8 раз по сравнению с самцами (рис. 2), что согласуется с данными литературы [19, 20].
Рис. 1.
Влияние наследственности и пола животных на поведение в тесте “приподнятый крестообразный лабиринт”. M ± SEM. Примечание: * p < 0.05 по отношению к группе “Самцы, А”; # p < 0.05 по отношению к группе “Самцы, К”, согласно двухфакторному дисперсионному анализу (АNOVA) с последующим post-hoc тестом Ньюмана–Кейлса.
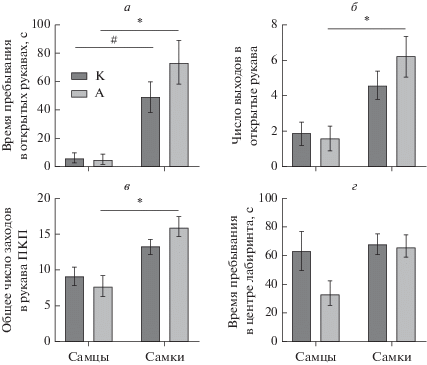
Рис. 2.
Влияние наследственности и пола животных на количество свешиваний головы в тесте “приподнятый крестообразный лабиринт”. M ± SEM. Примечание: * p < 0.05 по отношению к группе “Самцы, А”.
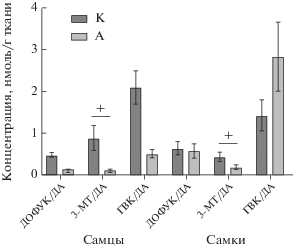
При анализе результатов нейрохимических исследований наиболее выраженные изменения в содержании моноаминов и их метаболитов были выявлены в островковой коре. Фактор “Наследственность” оказывал существенное влияние на изменение содержания ДОФУК (F (1, 33) = = 6.598 P = 0.0149), ДА (F (1, 33) = 6.463 P = 0.0159) и на внеклеточный оборот дофамина (3-МТ/ДА) (F (1, 32) = 10.31 P = 0.0030). Фактор “Пол” также влиял на содержание ДОФУК (F (1, 33) = 9.826 P = 0.0036), ДА (F (1, 33) = 7.522 P = 0.0098), 3-МТ (F (1, 35) = 6.025 P = 0.0192) и на оборот дофамина (ДОФУК/ДА) (F (1, 30) = 6.342 P = 0.0174). Установлено взаимодействие факторов “Наследственность” и “Пол” на содержание ДОФУК (F (1, 33) = 10.34 P = 0.0029) и ДА (F (1, 33) = 7.702 P = 0.0090). При последующем множественном сравнении отмечалось статистическое значимое увеличение содержания ДОФУК и ДА у самцов А по сравнению с самцами К (в 2.6 и в 9.5 раз) и самками А (в 2.7 и в 12.7). По сравнению с животными К внеклеточный оборот дофамина был снижен у обоих полов потомства крыс, потреблявших алкоголь (в 8.8 раз у самцов и в 2.5 раза у самок, соответственно). Также следует отметить разнонаправленное изменение суммарного оборота ДА (после воздействия ферментов МАО-Б и КОМТ): у самцов группы А показатель скорости метаболизма ГВК/ДА был снижен (в 4.15 раза) по сравнению с самцами К, в то время как у самок А, напротив, оборот ГВК/ДА был увеличен (в 2 раза) по сравнению с самками К (рис. 3).
Рис. 3.
Влияние наследственности животных на содержание нейромедиаторных моноаминов у самцов и самок в островковой коре. M ± SEM. Примечание: + p < 0.05 по отношению к группе “К”, согласно двухфакторному дисперсионному анализу (АNOVA) с последующим post-hoc тестом Ньюмана–Кейлса.
Статистически достоверных изменений содержания аминокислот в островковой коре не было выявлено ни у одной из групп экспериментальных животных (рис. 4).
Рис. 4.
Влияние наследственности животных на содержание тормозных (а) и возбуждающих (б) нейромедиаторных аминокислот у самцов и самок в островковой коре. M ± SEM. Примечание: двухфакторный дисперсионный анализ (АNOVA) с последующим post-hoc тестом Ньюмана–Кейлса.
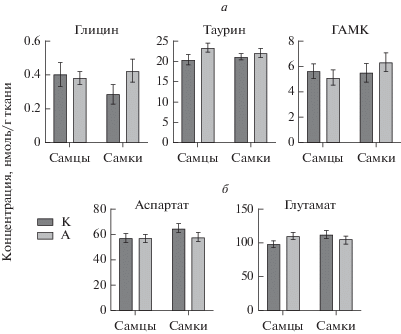
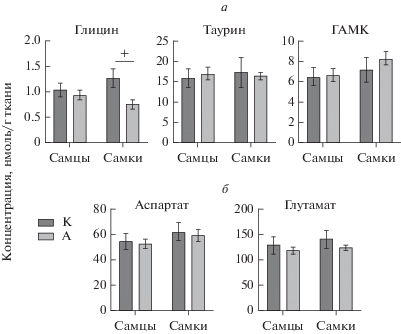
В ППК не выявлено статистических значимых изменений в содержании моноаминов, метаболитов и показателей их утилизации (рис. 5), однако, установлено, что фактор “Наследственность” существенно влиял на содержание глицина (F (1, 35) = = 6.804 P = 0.0133). Фактор “Пол” не оказывал значимого эффекта на содержание глицина (F (1, 35) = = 0.04812 P = 0.8276), также не установлено взаимодействия факторов “Наследственность” и “Пол” в данной структуре мозга (F (1, 35) = 2.988 P = = 0.0927). При последующем множественном сравнении содержание тормозной аминокислоты глицина было статистически значимо снижено (в 1.7 раз) у самок А по сравнению с самками контрольной группы К (p < 0.05) (рис. 6).
Рис. 5.
Влияние наследственности животных на содержание нейромедиаторных моноаминов у самцов и самок в передней поясной коре. M ± SEM. Примечание: двухфакторный дисперсионный анализ (АNOVA) с последующим post-hoc тестом Ньюмана–Кейлса.
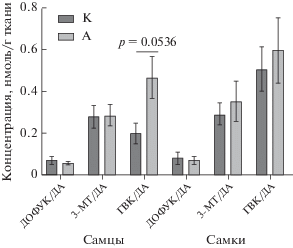
Рис. 6.
Влияние наследственности животных на содержание тормозных (а) и возбуждающих (б) нейромедиаторных аминокислот у самцов и самок в передней поясной коре. M ± SEM. Примечание: + p < 0.05 по отношению к группе “К”, согласно двухфакторному дисперсионному анализу (АNOVA) с последующим post-hoc тестом Ньюмана–Кейлса.
ОБСУЖДЕНИЕ
Несколько десятилетий изучения патогенетических последствий женского алкоголизма показало, что употребление алкоголя матерью в критические периоды развития мозга плода приводит к разрушительным долгосрочным последствиям для когнитивных функций и социального поведения. Однако, мало известно о последствиях употребления алкоголя родителями вне гестационного периода для алкоголь-зависимых эпигенетических модификаций, которые впоследствии могут проявляться в виде фенотипических изменений у потомства.
В настоящей работе использовали не подвергавшееся воздействию этанола в пренатальный и постнатальный период развития потомство от крыс, употреблявших алкоголь, начиная c 60-го дня жизни в течение 30-ти недель.
Согласно экспериментальным данным, воздействие алкоголя на крыс-самцов до спаривания вызывает у потомства зависимые от пола нарушения в поведении [21], рабочей и пространственной памяти [22], а также чувствительности к этанолу [23]. В данной работе выявлено влияние потребления этанола крысами на уровень тревожности их потомства. Самки проводили больше времени в открытых рукавах по сравнению с самцами, что свидетельствует об их меньшем уровне тревожности по сравнению с самцами и согласуется с данными литературы [19, 20], хотя выявленные половые отличия могут отражать различия в метаболизме [24].
Нейротрансмиттерные моноамины и аминокислоты в различных областях коры головного мозга играют важную роль в координации поведенческих и физиологических реакций на стресс, а также в адаптивном поддержании гомеостаза. Дофамин опосредует усиливающие эффекты психоактивных веществ, включая алкоголь, и способствует выбору действий, направленных на поиск и прием психоактивных веществ [25, 26]. В островковой коре выявлено снижение оборота дофамина (3-МТ/ДА) у крыс обеих полов, чьи родители подверглись хроническому воздействию этанола, однако только у самцов отмечалось повышенное содержание ДОФУК и ДА. Как указывалось выше, эти нейрохимические изменения сопровождаются повышенной тревожности самцов, что, по-видимому, связано с регулированием островковой корой интероцептивной реакции. Известно, что дофаминергическая система участвует в интероцепции, которая способствует осознанию негативных эмоциональных состояний [27]. Предполагается, что островковая кора интегрирует информацию о внутренней репрезентации эффектов психоактивных веществ, полученную из вентромедиальной префронтальной коры, с информацией о внешних стимулах, полученных из ППК [28].
Содержание тормозной аминокислоты глицина у самок потомков крыс, на которых было оказано воздействию этанола, было снижено по сравнению с контрольной группой, что может отчасти объяснить повышенную активность животных в тесте ПКЛ, учитывая роль глицина в формировании тревожной реакции [29]. Известно, в частности, о ключевой роли этого нейротрансмиттера, которую он играет в тормозных синапсах спинного мозга, ствола мозга и мозжечка и в возбуждающих синапсах всего мозга, являясь необходимым коагонистом глутамата в N-метил-D-аспартатных рецепторах [30].
Расширение представлений о роли островковой коры в формировании тревожности требует продолжения изучения на лабораторных животных, которые в настоящее время ограничиваются тремя работами на крысах. Согласно Li et al. (2014), воздействие на м-холинергическую систему островковой коры крыс модулирует тревожно-подобное поведение в ПКЛ [31]. Rojas et al. (2015) показали, что адренергическая активность в островковой коре изменяет вызванное возбуждением увеличение неофобии (или гипонеофагии), которая рассматривается как еще один показатель тревожного поведения у крыс [32]. Кроме того, методом микроинъекции антагониста ГАМК-рецепторов для активации и антагониста глутаматергических АМРА-рецепторов для инактивации была обнаружена функциональная гетерогенность островковой коры у крыс в условиях стрессовой ситуации, при этом было показано, что ростральные области отвечают за анксиогенную реакцию, в то время как медиальные и каудальные области связаны с реализацией анксиолитической активности [33].
ЗАКЛЮЧЕНИЕ
Таким образом, результаты проведенных нами исследований позволяют говорить о том, что поведенческие показатели реакции на стресс интактного потомства первого поколения от крыс, подвергавшихся хроническому действию раствора этанола до спаривания, не отличаются от аналогичных параметров потомства от крыс, не имевших доступа к этанолу. Зарегистрировано снижение внеклеточного оборота дофамина в островковой коре у самок и самцов от крыс, подвергавшихся хроническому воздействию этанола, а также снижение содержания глицина в ППК у самок от крыс, потреблявших алкоголь. Полученные данные указывают на определенную роль отдельных корковых структуры мозга в формировании особенностей мотивационного поведения у потомства алкоголизированных крыс обеих полов.
Список литературы
Hairston I.S., Conroy D.A., Heitzeg M.M., Akbar N.Z., Brower K.J., Zucker R.A. // J. Sleep Research. 2016. V. 25. № 3. P. 341–349.
Hill S.Y., Tessner K.D., McDermott M.D. // J. Psychiatric Research. 2011. V. 45. № 3. P. 285–294.
Sundquist J., Sundquist K., Ji J. // eLife. 2014. V. 3. E02917.
Asimes A., Torcaso A., Pinceti E., Kim C.K., Zeleznik-Le N.J., Pak T.R. // Alcohol. 2017. V. 60. P. 179–189.
Asimes A., Kim C.K., Cuarenta A., Auger A.P., Pak T.R. // J. Endocrine Society. 2018. V. 2. № 7. P. 672–686.
Crews F.T., Vetreno R.P., Broadwater M.A., Robinson D.L. // Pharmacol Rev. 2016. V. 68. № 4. P. 1074–1109.
Trantham-Davidson H., Centanni S.W., Garr S.C., New N.N., Mulholland P.J., Gass J.T., Glover E.J., Floresco S.B., Crews F.T., Krishnan H.R., Pandey S.C., Chandler L.J. // Neuropsychopharmacology. 2017. V. 42. № 5. P. 1024–1036.
Tovote P., Fadok J.P., Luthi A. // Nat. Rev. Neurosci. 2015. V. 16. P. 317–331.
Damsa C., Kosel M., Moussally J. // Curr. Opin. Psychiatry. 2009. V. 22. P. 96–110.
Droutman V., Read S.J., Bechara A. // Trends Cogn. Sci. 2015. V. 19. № 7. P. 414–420.
Betka, S., Harris L., Rae C., Palfi B., Pfeifer G., Sequeira H., Duka T., Critchley H. // Psychopharmacology. 2019. V. 236. № 9. P. 2579–2591.
Szekely A., Silton R.L., Heller W., Miller G.A., Mohanty A. // Soc. Cogn. Affect. Neurosci. 2017. V. 12. № 3. P. 476–486.
Grüsser S.M., Wrase J., Klein S., Hermann D., Smolka M.N., Ruf M., Weber-Fahr W., Flor H., Mann K., Braus D.F., Heinz A. // Psychopharmacology. 2004. V. 175. P. 296–302.
Przybycien-Szymanska M.M., Rao Y.S., Prins S.A., Pak T.R. // PLoS One. 2014. V. 9. № 2. E89320.
Rompala G.R., Finegersh A., Homanics G.E. // Alcohol. 2016. V. 53. P. 19–25.
Pellow S., Chopin P., File S., Briley M. // J. Neuroscience Methods. 1985. V. 14. P. 149–167.
Надорова А.В., Колик Л.Г., Клодт П.М., Наркевич В.Б., Наплекова П.Л., Козловская М.М., Кудрин В.С., Середенин С.Б. // Нейрохимия. 2014. Т. 31. № 2. С. 1–7.
Колик Л.Г., Надорова А.В., Коньков В.Г., Наркевич В.Б., Кудрин В.С. // Нейрохимия. 2021. Т. 38. № 2. С. 1–9.
Albrechet-Souza L., Schratz C.L., Gilpin N.W. // Biol. Sex. Differ. 2020. V. 11. № 27. P. 11.
Scholl J., Afzal A., Fox L., Watt M., Forster G. // Physiology & Behavior. 2019. V. 211. E112670.
Rompala G.R., Finegersh A., Homanics G.E. // Alcohol. 2016. V. 53. P. 19–25.
Yohn N.L., Bartolomei M.S., Blendy J.A. // Progress in Biophysics and Molecular Biology. 2015. V. 118. № 1–2. P. 21–33.
Finegersh A., Homanics G.E. // PLoS One. 2014. V. 9. № 6. E99078.
Johnston A.L., File S.E. // Physiol. Behav. 1991. V. 49. P. 245–250.
Nutt D.J., Lingford-Hughes A., Erritzoe D., Stokes P.R. // Nat. Rev. Neurosci. 2015. V. 16. № 5. P. 305–312.
Lüscher C. // Annu. Rev. Neurosci. 2016. V. 39. P. 257–276.
Koob G.F., Volkow N.D. // Lancet Psychiatry. 2016. V. 3. № 8. P. 760–773.
Parkes S.L., Bradfield L.A., Balleine B.W. // Neurosci. 2015. V. 35. № 16. P. 6464–6471.
Ketenci S., Acet N.G., Sarıdoğan G.E., Aydın B., Cabadak H., Gören M.Z. // Clin. Psychopharmacol. Neurosci. 2020. V. 18. № 2. P. 219–230.
Cummings K.A., Popescu G.K. // J. Gen. Physiol. 2015. V. 145. № 6. P. 513–527.
Li H., Chen L., Li P., Wang X., Zhai H. // Behav. Brain Res. 2014. V. 270. P. 256–260.
Rojas S., Diaz-Galarce R., Jerez-Baraona J.M., Quintana-Donoso D., MoragaAmaro R., Stehberg J. // Front. Behav. Neurosci. 2015. V. 9. P. 164.
Méndez-Ruette M., Linsambarth S., Moraga-Amaro R., Quintana-Donoso D., Méndez L., Tamburini G., Cornejo F., Torres R.F., Stehberg J. // Front. Physiol. 2019. V. 10. P. 330.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия


