Нейрохимия, 2022, T. 39, № 2, стр. 184-192
Влияние ожирения и его метаболического типа на сывороточную концентрацию нейротрофинов
И. М. Колесникова 1, С. А. Румянцев 1, 2, Н. И. Волкова 3, А. М. Гапонов 2, 4, Т. В. Григорьева 5, А. В. Лайков 5, В. В. Макаров 6, С. М. Юдин 6, О. В. Борисенко 1, А. В. Шестопалов 1, 2, 7
1 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
2 Центр цифровой и трансляционной биомедицины “Центр Молекулярного Здоровья”
Москва, Россия
3 Ростовский государственный медицинский университет
Ростов-на-Дону, Россия
4 НИИ общей реаниматологии им. В.А. Неговского ФНКЦ РР
Москва, Россия
5 Казанский (Приволжский) федеральный университет
Казань, Россия
6 Федеральное государственное бюджетное учреждение “Центр стратегического планирования и управления
медико-биологическими рисками здоровью” Федерального медико-биологического агентства России
Москва, Россия
7 Национальный медицинский исследовательский центр детской гематологии,
онкологии и иммунологии имени Дмитрия Рогачева
Москва, Россия
Поступила в редакцию 15.12.2021
После доработки 20.01.2022
Принята к публикации 09.02.2022
- EDN: PHVZCB
- DOI: 10.31857/S102781332202008X
Аннотация
Поражение нервной системы является распространенным осложнением ожирения. В связи с этим изучение содержания нейротрофинов у таких пациентов представляется актуальным. Однако риск развития осложнений определяется метаболическим типом ожирения, поэтому целью нашей работы стало изучение влияния метаболического типа ожирения на содержание нейротрофинов в сыворотке крови. Мы показали, что при ожирении не происходит изменение содержания нейротрофического фактора мозга (BDNF), однако достоверно снижается сывороточная концентрация фактора роста нервов (NGF) вне зависимости от метаболического типа ожирения. Учитывая литературные данные, что при ожирении происходит увеличения плазменной концентрации NGF, можно полагать, что ожирение ассоциировано с нарушением депонирования NGF в тромбоцитах и, как следствие, ускорением его элиминации. При этом у пациентов с метаболически нездоровым типом ожирения содержание (МНЗО) NGF было выше, чем у пациентов с метаболически здоровым типом ожирения (МЗО). Также мы показали, что при МЗО значительный вклад в формирование пула сывороточного NGF вносят мышечная и жировая ткани. Однако у пациентов МНЗО преобладало влияние жировой ткани на содержание NGF. Кроме этого, для пациентов с МНЗО было отмечено влияние секреторной активности мышечной ткани на содержание BDNF, тогда как при МЗО подобного не наблюдалось.
ВВЕДЕНИЕ
В последние десятилетия распространенность ожирения во всем мире неуклонно растет. Согласно анализу проведенному NCD-RisC, к 2025 г. до 18% мужчин и свыше 21% женщин могут иметь индекс массы тела (ИМТ) свыше 30 кг/м2, что составит практически пятую часть населения Земли [1]. В связи с этим изучение патогенеза осложнений, наблюдаемых при ожирении, становится особенно актуальным. Одними из таких осложнений являются поражения нервной системы. Для ожирения характерно как поражение периферической, так и центральной нервной системы.
Развитие нейровоспаления в гипоталамусе – один из факторов формирования метаболического синдрома на фоне избыточного питания. Воспалительные процессы в ЦНС отличаются от событий на периферии за счет наличия гематоэнцефалического барьера (ГЭБ), затрудняющего миграцию иммунных клеток и в большей степени связаны с активацией микроглии и астроцитов [2]. Thaler и соавт. (2012) обнаружили, что у пациентов с ожирением наблюдается усиление глиоза и активация микроглии в гипоталамусе [3]. Однако развивающиеся нейровоспаление затрагивает не только гипоталамус – центр регуляции пищевого поведения, но и другие структуры ЦНС [4]. Было показано, что активация глиальных клеток при ожирении может происходить под действием насыщенных и мононенасыщенных жирных кислот, которые через Толл-подобные рецепторы 4 типа запускают путь активации NF-κB и приводят к усилению синтеза провоспалительных цитокинов и реактивных форм кислорода [5, 6]. Кроме того на фоне ожирения усиливается проницаемость ГЭБ, что также вносит вклад в формирование нейровоспаления [7].
При ожирении головной мозг подвергается структурным и морфологическим изменения. Было показано, что повышение ИМТ связано с уменьшением объема мозга, атрофией серого вещества и нарушением целостности белого вещества в головном мозге [8]. Изменение архитектуры мозга приводит к функциональным нарушениям, проявляющимися в снижении когнитивных функций. Кроме того, на фоне ожирения повышается риск развития деменции [8].
Другое поражение нервной системы, ассоциированное с ожирением, – периферическая нейропатия, которая наблюдается у половины пациентов с сахарным диабетом 2 типа (СДII) и является одной из причин ивалидизации таких пациентов [9]. Также и метаболический синдром, одним из компонентов которого является ожирение, связывают с повышенным риском развития хронической сенсорной полинейропатией [10]. Callaghan B.C. и соавт. (2016) показали, что ожирение связано с развитием нейропатии даже при условии нормальной концентрации глюкозы в крови [11]. Ожирение и инсулинорезистентность как совместно, так и независимо друг от друга приводят к активации окислительного стресса, хронического воспаления, накоплению конечных продуктов гликирования, что повреждает микрососудистое русло и периферические нервные волокна [9].
В свете негативного влияния ожирения на нервную систему особый интерес представляют нейротрофины (нейротропные факторы) – белки, способствующие дифференцировке, функционированию и выживанию нейронов. К нейротрофинам относятся: фактор роста нервов (Nerve Growth Factor, NGF), нейротрофический фактор мозга (Brain-Derived Neurotrophic Factor, BDNF), а также нейротрофин 3 и нейротрофин 4 (также называемый нейротрофин 4/5 или нейротрофин 5).
NGF – первый, открытый еще в 1950 гг. Ритой Леви-Монтальчини, нейротрофин. NGF играет важную роль в выживании, регенерации и пластичности нейронов в центральной и периферической нервных системах (ЦНС и ПНС, соответственно), а также участвует в высвобождении нейромедиаторов и воспалении в ПНС [12, 13]. Интересно отметить, что действие NGF на нейроны неоднозначно и может стимулировать как их выживание, так и их апоптоз. Образование NGF происходит из более крупного белка-предшественника – proNGF, который также является сигнальной молекулой [14]. NGF и proNGF реализуют свой сигналинг связываясь с рецепторами на поверхности клеточной мембраны, к которым относятся киназа А тропомиозинового рецептора (tropomyosin receptor kinase A, TrkA), являющаяся также мишенью и для других нейротрофинов, например BDNF, и через рецептор нейротрофина p75 (p75 neurotrophin receptor, p75NTR) [15]. Стимуляция TrkA стимулирует выживание нейронов, тогда как p75NTR – их апоптоз [12]. При этом сродство NGF и proNGF не одинаково к разным типам рецепторов, зрелый NGF проявляет большую аффинность к TrkA, тогда как proNGF – к р75NTR [16]. Кроме действия на нервную систему, было показано, что NGF обладает трофическим действием на клетки иммунной системы, эпителиоциты молочной железы и эндотелиальные клетки [17]. Помимо нервной системы NGF синтезируется адипоцитами (белыми и бурыми), миоцитами, эпителиоцитами, фибробластами, иммунными клетками и даже бета-клетками поджелудочной железы [18–21]. Ряд работ продемонстрировал, что для ожирения, метаболического синдрома и СДII характерно повышение концентрации NGF в плазме крови [22, 23].
Наиболее изученным является BDNF, который синтезируется не только в центральной нервной системе и периферических нейронах, но и в скелетных мышцах, сердце, печени и жировой ткани [24]. Помимо участия в выживании и поддержании пластичности нервной системы, BDNF играет значимую роль в энергетическом гомеостазе как в мозге, так и в периферических тканях. Среди влияния BDNF на нервную систему можно отметить его роль в регуляции циркадных ритмов, анорексигенный эффект, участие в улучшении когнитивных функций в ответ на бег и кратковременное голодание, а также усиление энергетического обмена в нейронах в том числе связанное с усилением поступления глюкозы в клетки [24]. Однако, взаимосвязь ожирения и циркулирующего в крови BDNF остается неясной. Так ряд работ показал отрицательную корреляцию между BDNF плазмы крови и ожирением, другие исследования показали, напротив, что у пациентов с ожирением плазменная концентрация BDNF выше или же корреляция между ожирением и концентрацией BDNF вообще отсутствует [25–27]. Проведенный в последние годы мета-анализ, указав на важность пробоподготовки при исследовании циркулирующего BDNF, оставил открытым вопрос взаимосвязи содержания этого нейротрофина и ожирения [28].
Риск развития осложнений при ожирении зависит от метаболического типа ожирения [29]. Принято выделять метаболически здоровый тип ожирения (МЗО) с низким риском развития осложнений, который характеризуется сохранением чувствительности к инсулину, нормальным липидным профилем, низким уровнем провоспалительных медиаторов и меньшим процентом висцерального жира, по сравнению с метаболически нездоровым типом ожирения (МНЗО). МНЗО связано с высоким риском осложнений и ассоциировано с развитием инсулинорезистентности и дислипидемии, а также системным вялотекущим воспалением [29]. На сегодняшний день отсутствуют работы, демонстрирующие влияние метаболического типа ожирения на концентрацию BDNF и NGF в сыворотке крови, что и стало целью нашей работы.
ПАЦИЕНТЫ, МАТЕРИАЛЫ, МЕТОДЫ
Было проведено когортное одномоментное исследование на базе центра цифровой и трансляционной биомедицины ООО “Центр молекулярного здоровья”, кафедры внутренних болезней № 3, ФГБОУ ВО РостГМУ Минздрава России и ФГАОУ ВО “Казанский (Приволжский) федеральный университет” в период 2018–2020 гг. Было обследовано 238 человек, из которых в последствии было сформировано две исследуемых группы: Группа 1 (контрольная группа, контроль) и Группа 2 (пациенты с ожирением). В Группу 1 были включены 134 пациента без ожирения с индексом массы тела (ИМТ) от 18.5 до 24.9 кг/м2, при отсутствии метаболических нарушений (дислипидемия, гипергликемия, гиперурикемия) и без признаков артериальной гипертензии. Группа 2 была сформирована из 104 пациентов с ожирением (ИМТ ≥ 30 кг/м2) и с окружностью талии более 102 см у мужчин или 88 см у женщин. Также пациенты Группы 2 были разделены на две подгруппы: пациенты с МЗО и пациенты с МНЗО в соответствии с критериями NCEP-ATP III [30]. После разделения по типам ожирения в группу пациентов с МЗО вошло 40 человек, а в группу пациентов с МНЗО – 55 человек. Для ряда пациентов с ожирением (9 человек) не было получено убедительных данных для включения их в одну из подгрупп, поэтому результаты их исследований не были включены в сравнительный анализ влияния метаболического типа ожирения на концентрацию нейротрофинов сыворотки крови.
У всех пациентов проводился отбор венозной крови с последующим отделением сыворотки. В полученных образцах сыворотки проводилось определение концентрации нейротрофинов BDNF и NGF методом мультиплексного иммуноферментного анализа на анализаторе Magpix (BioRad, США) с использованием наборов Milliplex: Human Adipokine Magnetic Bead Panel 2 и Human Myokine Magnetic Bead Panel (Merck, Германия). Кроме этого, в полученных образцах изучали ряд показателей углеводного и липидного обмена, а также эндокринная функция жировой и мышечной тканей по концентрациям адипокинов (адипонектин, лептин, аспросин, резистин) и миокинов (ирисин, миостатин, FGF21, остеокрин), соответственно. Следует отметить, что задачей этой работы не являлась характеристика всех изучаемых показателей, полученные данные рассматривались в контексте выявления возможных связей с содержанием нейротрофинов.
Статистический анализ проводился с помощью программного обеспечения MedCalc (MedCalc Software Ltd, Бельгия). Все полученные массивы данных были проверены на нормальность распределения с использованием теста Д’Агостино-Пирсона. В зависимости от нормальности распределения данные были описаны с использованием среднего значения или медианы и их 95% доверительных интервалов. Если распределение данных носило нормальный характер, для характеристики различий использовались параметрические статистические методы: t-критерий Стьюдента (при условии равных дисперсий выборок) и t-критерий Уэлча (при неравных дисперсиях). Когда распределение данных не носило нормальный характер, использовался непараметрический критерий Манна–Уитни. Перед оценкой достоверности различий в содержании нейротрофинов между исследуемыми группами была проведена однократная проверка выбросов методом Тьюки с последующим исключением экстремальных выбросов из сравнительного анализа. Также в работе использовался корреляционный анализ по методу Пирсона для выявления взаимосвязи между изучаемыми параметрами. Коэффициенты корреляции принимались во внимания если они по модулю были более 0.3 (умеренная сила связи в соответствии со шкалой Чеддока) при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследование концентрации BDNF в сыворотке крови показало отсутствие различий в содержании этого нейротрофина между Группами 1 и 2. [28]. После разделения Группы 2 на подгруппы мы также не обнаружили различий в содержании BDNF, как между пациентами с МЗО и МНЗО, так и при сравнении их со здоровыми донорами (рис. 1а).
Рис. 1.
Содержание нейротрофинов в сыворотке у исследуемых групп. а – BDNF (пг/мл), б – NGF (пг/мл).
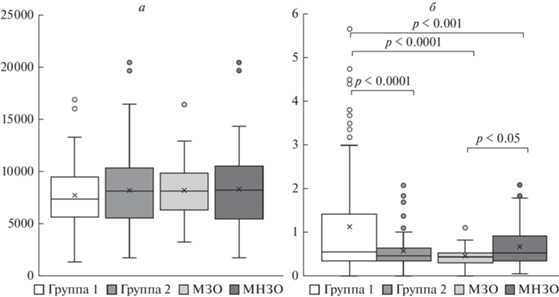
Для Группы 1, Группы 2 и пациентов с МЗО мы не обнаружили значимой корреляции (при r > 0.3) между содержанием BDNF и остальными исследуемыми параметрами. Однако для пациентов с МНЗО была выявлена умеренная связь между концентрациями BDNF и ирисина (r = 0.384, p < < 0.01).
При изучении содержания NGF в сыворотке у исследуемых групп мы обнаружили, что в сыворотке крови пациентов Группы 2 наблюдалось статистически значимое снижение концентрации этого нейротрофина по сравнению с Группой 1 (р < 0.0001) (рис. 1б). Разделение Группы 2 по метаболическому типу ожирения показало, что снижение сывороточной концентрации NGF характерно как для лиц с МЗО, так и для пациентов с МНЗО. При этом у пациентов с МНЗО уровень NGF был выше, чем у пациентов МЗО (р < 0.05).
Корреляционный анализ показал, что у пациентов Группы 1 присутствовала только близкая к умеренной связь между концентрациями NGF и VEGF (r = 0.298, p = 0.0005). У пациентов Группы 2 такой связи выявлено не было, однако присутствовала умеренная связь между концентрациями NGF и лептина (r = 0.368, p = 0.0001). У пациентов с МЗО сывороточная концентрация NGF заметно коррелировала с содержанием остеокрина (r = 0.55, p = 0.0002) и умеренно с концентрациями ирисина (r = 0.459, p < 0.01), инсулина (r = 0.373, p < 0.05), а также с индексом HOMA-IR (r = 0.406, p < 0.05). Как и в общей группе пациентов с ожирением у пациентов с МЗО наблюдалась умеренная связь между концентрациями NGF и лептина (r = 0.339, p < 0.05). Для пациентов с МНЗО была выявлена умеренная связь между содержанием NGF и адипокинов – лептина (r = 0.352, p < 0.01) и аспросина (r = 0.391, p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Отсутствие различий в содержании BDNF между Группами 1 и 2 согласуется с имеющимися литературными данными [28]. Появление взаимосвязи между содержанием BDNF и ирисина у пациентов с МНЗО не является неожиданной – и BDNF, и ирисин являются миокинами и синтезируются как жировой тканью, так и мышечной особенно при физической активности [24, 31]. Работа Huang L. и соавт. (2019) показала, что у мышей с сахарным диабетом ирисин регулирует экспрессию BDNF и улучшает метаболизм глюкозы [32]. Наши данные позволяют предполагать, что подобные взаимоотношения BDNF и ирисина возможны и в человеческом организме при метаболически нездоровом типе ожирения.
Неожиданным оказалось снижение содержания NGF у пациентов с ожирением. Все имеющиеся литературные данные свидетельствуют, что при ожирении отмечается повышение содержания NGF в плазме крови [22, 23]. На основании этого M. Hristova и L. Aloe (2006) даже сформулировали нейротрофическую гипотезу метаболического синдрома, основанную на нейро-иммунных взаимодействиях, в которой NGF отводилась значительная роль в патогенезе [23]. Согласно этой гипотезе, хронический психоэмоциональный и/или воспалительный стресс сопровождается повышением в крови провоспалительных цитокинов, что приводит к гиперпродукции NGF. Повышение концентрации этого нейротрофина опосредует развитие дисбаланса продукции нейромедиаторов, что приводит к активации вегетативной нервной системы (в частности n. vagus), стимуляции гипоталамо-гипофизарно-надпочечниковой системы, еще большей активации иммунной системы и избыточной продукции нейропептида Y. Нарушение регуляции пищевого поведения, гиперинсулинемия, гиперкортизолемия и увеличение уровня провоспалительных цитокинов приводят к гиперфагии, ожирению и, в конечном итоге, формированию инсулинорезистентности. Таким образом, согласно гипотезе M. Hristova и L. Aloe, дисбаланс нейромедиаторов вследствие повышенного содержания NGF является одним из ключевых аспектов в формировании инсулинорезистентности и развитии метаболического синдрома [23].
Противоречия с полученными нами данными могут быть объяснены тем, что в вышеупомянутых работах исследование концентрации NGF проводилось в плазме крови, тогда как в нашем исследовании определялась его концентрацию в сыворотке. Нейротрофины NGF и BDNF присутствуют в крови не только в плазме, но и захватываются тромбоцитами и хранятся в их гранулах [33]. В 1994 Ordoñez G. и соавт. на мышах показали, что при диабете происходит снижение NGF в сыворотке, что согласуется с полученными нами данными [34]. Еще раньше, в 1990 г. V. Faradji и J. Sotelo выявили, что при диабетической нейропатии снижается концентрация сывороточного NGF [35].
Таким образом, для ожирения характерно, с одной стороны, увеличение концентрации NGF в плазме и снижение его содержания в сыворотке. Причиной таких разнонаправленных изменений может быть нарушение захвата NGF тромбоцитами. На сегодняшний день нет убедительных данных о механизмах захвата NGF тромбоцитами, но можно предположить следующие варианты: поступление NGF через открытую канальцевую систему (ОКС) тромбоцитов или его связывание с TrkA и последующим эндоцитозом. Интернализация TrkA с NGF и образование “сигнальных эндосом” были описаны для нейронов, в которых эндосомы могут транспортироваться по отросткам нейрона к телу клетки [36]. TrkA экспрессируется на мегакариоцитах, и было показано, что действие NGF через TrkA подавляет мегакариопоэз и стимулирует тромбопоэз [37]. Однако не известно, присутствует ли TrkA на зрелых тромбоцитах. Поступление NGF в тромбоциты через ОКС представляется более вероятным. В своей работе K. Kniewallner и соавт. (2015) показали, что ультразвук способствует более эффективной “загрузке” гранул тромбоцитов NGF [38]. Несмотря на более чем 50-летнюю историю изучения открытой канальцевой системы тромбоцитов мы до сих пор не знаем, как осуществляется и регулируется захват биологически активных веществ через ОКС тромбоцитами [39]. Известно, что при ожирении наблюдается изменение функциональной активности тромбоцитов. Недавние работы Barrachina M. и соавт. показали, что при ожирении наблюдается гиперактивация сигнального пути GPVI [40, 41]. Скорее всего, дисфункция сигнальных путей – не единственное изменение тромбоцитов при ожирении. Возможно, ожирение сказывается и на ОКС тромбоцитов, что приводит к нарушению захвата NGF. Стоит отметить, что гемодинамика и гемореология значительно влияют на функционирование тромбоцитов. Изменение гемореологических характеристик и функциональной активности тромбоцитов наблюдается у пациентов с СДII и метаболическим синдромом и вносит свой негативный вклад в формирование клинической картины при ишемическом инсульте [42]. Ожирение также ассоциировано с изменением гемодинамики, а потеря веса – с улучшением гемодинамических показателей [43, 44]. Таким образом, изменение гемодинамических и гемореологических показателей при ожирении также может вносить свой вклад в снижение поступления NGF в тромбоциты.
Если принять гипотезу о снижении запасания NGF в тромбоцитах при ожирении, тогда становится понятно, почему сывороточная концентрация NGF гораздо выше у лиц с нормальной массой тела. Ростовые факторы обладают коротким периодом полужизни и быстро подвергаются протеолизу. Запасание NGF в тромбоцитах, по-видимому, защищает нейротрофин от действия пептидаз, тем самым увеличивая его период полужизни и, как следствие, сывороточную концентрацию, что характерно для пациентов с нормальной массой тела.
Так как снижение содержания NGF по сравнению с Группой 1 наблюдалось и у пациентов с МЗО и у пациентов с МНЗО, можно предполагать, что вне зависимости от метаболического типа у пациентов с ожирением нарушается “загрузка” тромбоцитов NGF. При этом у пациентов с МНЗО уровень NGF был выше, чем у пациентов МЗО. Подобные отличия могут быть опосредованы влиянием провоспалительных цитокинов на жировую ткань. Peeraully M.R. и соавт. (2004) показали, что фактор некроза опухоли альфа (tumor necrosis factor alpha, TNFα) повышает секрецию NGF белыми адипоцитами [19]. Учитывая, что “уровень” воспаления при МНЗО выше, чем при МЗО, более активная продукция NGF жировой тканью у пациентов с МНЗО представляется логичным следствием [29].
Выявленная для пациентов Группы 1 корреляция между концентрациями NGF и VEGF не является неожиданной – было показано, что стимуляция нейронов и глиальных клеток (клеток Мюллера) NGF приводит к усилению продукции VEGF, что, видимо, отражается и на сывороточных концентрациях этих ростовых факторов [45, 46]. У пациентов Группы 2 такой связи выявлено не было, однако присутствовала умеренная связь между концентрациями NGF и лептина. Наличие такой связи подразумевает бо́льший вклад жировой ткани в формирование пула сывороточного NGF, так как основным источником лептина являются адипоциты. Atanassova P. и соавт. (2014) продемонстрировали, что на фоне метаболического синдрома усиливается продукция лептина и NGF жировой тканью [47]. Наши данные показывают, что подобное “совместное” усиление секреции NGF и лептина происходит до формирования инсулинорезистентности и метаболического синдрома. Также объяснением подобной взаимосвязи уровней NGF и лептина является возможное влияние NGF на дифференцировку адипоцитов. Было показано, что рецепторы TrkA и р75NTR экспрессируются в белой жировой ткани у мышей, что позволяет рассматривать жировую ткань не только как источник NGF, но и как одну из тканей-мишеней этого нейротрофина [19]. На линии клеток РС12 (модель нейрональной дифференцировки) было показано, что TrkA-сигнальный путь NGF приводит к активации рецептора, активируемым пероксисомным пролифератором γ (peroxisome proliferator-activated receptor γ, PPARγ) и стимулирует выживание и дифференцировку нейронов [48]. В свою очередь в жировой ткани активация PPARγ играет ключевую роль в терминальной дифференцировке преадипоцитов [49]. Если предположить, что NGF является одним из факторов, стимулирующих терминальную дифференцировку адипоцитов, становится понятной взаимосвязь концентрации NGF и лептина – синтез последнего активируется по мере продвижения адипоцитов к терминальной дифференцировке [50].
У пациентов с МЗО сывороточная концентрация NGF коррелировала не только с содержанием лептина, но и с концентрациями остеокрина, ирисина, инсулина, а также с индексом HOMA-IR. Следует отметить, что NGF синтезируется не только нервной и жировой тканями, но и скелетной мускулатурой [51]. Поэтому появление связи между содержанием NGF и миокинов (ирисин, остеокрин) у пациентов с МЗО свидетельствует о значительном вкладе скелетных мышц в формирование пула сывороточного NGF. Интересно, что при МЗО концентрация NGF коррелировала с содержанием инсулина и индексом HOMA-IR. Бета-клетки сами способны синтезировать NGF, хотя он и не высвобождается в достаточном объеме для его количественной оценки [21]. Таким образом, бета-клетки мало влияют на формирование пула сывороточного NGF, однако они экспрессируют на своей поверхности рецепторы к этому нейротрофину – TrkA и р75NTR. Было показано, что NGF улучшает выживаемость и подавляет апоптоз бета-клеток поджелудочной железы [52, 53]. Кроме того, Attilio Pingitore и соавт. (2016) выявили, что ингибирование передачи сигнала NGF через TrkA и р75NTR в бета-клетках, с одной стороны, приводит к увеличению базальной секреции инсулина, с другой стороны, нарушало секрецию гормона, индуцированную глюкозой [21]. Стоит отметить, что Pingitore A. и соавт. изучали аутокринный эффект NGF и неясно влияет ли циркулирующий в крови NGF на бета-клетки. Однако появление связи между NGF и инсулином, а также индексом HOMA-IR, демонстрирует возможность влияния сывороточного NGF на бета-клетки. Можно предполагать, что при метаболически здоровом типе ожирения NGF регулирует чувствительность бета-клеток к глюкозе и, возможно, способствует поддержанию нормогликемии у таких пациентов.
Для пациентов с МНЗО была выявлена корреляция между содержанием NGF и адипокинов – лептина и аспросина. Жировая ткань является основным источником аспросина в крови, при этом, ожирение ассоциировано с повышением концентрации этого адипокина [54]. Появление связи между содержанием NGF и адипокинов при МНЗО может указывать на общий источник этих сигнальных молекул – жировую ткань.
Интересно, что у пациентов с МНЗО, в отличие от лиц с МЗО, не было выявлено корреляции между содержанием NGF и миокинов (остеокрин, ирисин). Можно предполагать, что при метаболически нездоровом типе ожирения более значимым источником NGF является жировая ткань. Напротив, у лиц с метаболически здоровым ожирением NGF, по-видимому, активно синтезируется и скелетной мускулатурой, и жировой тканью. Также для пациентов с МНЗО не было выявлено связи между содержанием NGF и инсулина и/или с величиной индекса HOMA-IR. Является ли отсутствие подобной связи свидетельством дисрегуляции секреции инсулина при участии NGF неизвестно, однако такие различия в результатах корреляционного анализа интересны и требуют дальнейшего изучения.
ВЫВОДЫ
У пациентов с ожирением не наблюдается изменений в сывороточной концентрации BDNF, вне зависимости от метаболического типа ожирения. При этом у пациентов с МНЗО значительный вклад в формирование пула сывороточного BDNF вносит мышечная ткань, тогда как при МЗО подобной динамики не наблюдается. Однако концентрация NGF в сыворотке у пациентов с ожирением значительно ниже по сравнению со здоровыми донорами, что, по-видимому, объясняется нарушением депонирования данного нейротрофина в тромбоцитах. При этом для пациентов с МНЗО выявлено более высокое содержание NGF в плазме по сравнению с пациентами с МЗО, что может являться следствием хронического воспаления, характерного для метаболически нездорового ожирения. Также при МЗО значительный вклад в продукцию NGF вносит как мышечная, так и жировая ткани, тогда как в случае МНЗО эта роль в большей степени принадлежит жировой ткани.
Список литературы
NCD Risk Factor Collaboration (NCD-RisC) // Lancet. 2016. V. 387. № 10026. P. 1377–1396.
Graeber M.B., Li W., Rodriguez M.L. // FEBS Lett. England. 2011. V. 585. № 23. P. 3798–3805.
Thaler J.P., Yi C.X., Schur E.A., Guyenet S.J., Hwang B.H., Dietrich M.O., Zhao X., Sarruf D.A., Izgur V., Maravilla K.R., Nguyen H.T., Fischer J.D., Matsen M.E., Wisse B.E., Morton G.J., Horvath T.L., Baskin D.G., Tschöp M.H., Schwartz M.W. // J. Clin. Invest. 2012. V. 122. № 1. P. 153–162.
Guillemot-Legris O., Muccioli G.G. // Trends Neurosci. 2017. V. 40. № 4. P. 237–253.
Button E.B., Mitchell A.S., Domingos M.M., Chung J.H., Bradley R.M., Hashemi A., Marvyn P.M., Patterson A.C., Stark K.D., Quadrilatero J., Duncan R.E. // Lipids. United States. 2014. V. 49. № 4. P. 305–316.
Wang Z., Liu D., Wang F., Liu S., Zhao S., Ling E.A., Hao A. // Br. J. Nutr. England. 2012. V. 107. № 2. P. 229–241.
Van Dyken P., Lacoste B. // Front. Neurosci. 2018. V. 12. № December. P. 1–19.
Dye L., Boyle N.B., Champ C., Lawton C. // Proc. Nutr. Soc. 2017. V. 76. № 4. P. 443–454.
Kazamel M., Stino A.M., Smith A.G. // Muscle and Nerve. 2021. V. 63. № 3. P. 285–293.
Smith A.G., Singleton J.R. // J. Diabetes Complications. 2013. V. 27. № 5. P. 436–442.
Callaghan B.C., Xia R., Reynolds E., Banerjee M., Rothberg A.E., Burant C.F., Villegas-Umana E., Pop-Busui R., Feldman E.L. // JAMA Neurol. 2016. V. 73. № 12. P. 1468–1476.
Rocco M.L., Soligo M., Manni L., Aloe L. // Curr. Neuropharmacol. 2018. V. 16. № 10. P. 1455–1465.
Ding X.W., Li R., Geetha T., Tao Y.X., Babu J.R. // Biochim. Biophys. Acta – Mol. Basis Dis. Elsevier B.V. 2020. V. 1866. № 10. P. 165858.
Aloe L., Rocco M.L., Bianchi P., Manni L. // J. Transl. Med. 2012. V. 10. № 1. P. 1–15.
Huang E.J., Reichardt L.F. // Annu. Rev. Neurosci. 2001. V. 24. P. 677–736.
Bruno M.A., Cuello A.C. // Proc. Natl. Acad. Sci. USA. 2006. V. 103. № 17. P. 6735–6740.
Chaldakov G.N. // Arch. Ital. Biol. 2011. V. 149. № 2. P. 257–263.
Nisoli E., Tonello C., Benarese M., Liberini P., Carruba M.O. // Endocrinology. United States. 1996. V. 137. № 2. P. 495–503.
Peeraully M.R., Jenkins J.R., Trayhurn P. // Am. J. Physiol. Endocrinol. Metab. United States. 2004. V. 287. № 2. P. E331-9.
Minnone G., De Benedetti F., Bracci-Laudiero L. // Int. J. Mol. Sci. 2017. V. 18. № 5.
Pingitore A., Caroleo M.C., Cione E., Castañera Gonzalez R., Huang G.C., Persaud S.J. // Mol. Cell. Endocrinol. Elsevier Ltd. 2016. V. 15. № 436. P. 23–32.
Bulló M., Peeraully M.R., Trayhurn P., Folch J., Salas-Salvadó J. // Eur. J. Endocrinol. 2007. V. 157. № 3. P. 303–310.
Hristova M., Aloe L. // Med. Hypotheses. 2006. V. 66. № 3. P. 545–549.
Marosi K., Mattson M.P. // Trends Endocrinol. Metab. Elsevier Ltd. 2014. V. 25. № 2. P. 89–98.
Lee I.T., Wang J.S., Fu C.P., Lin S.Y., Sheu W.H. // Med. (United States). 2016. V. 95. № 43.
Motamedi S., Karimi I., Jafari F. // Metab. Brain Dis. Metabolic Brain Disease. 2017. V. 32. № 3. P. 651–665.
Slusher A.L., Whitehurst M., Zoeller R.F., Mock J.T., Maharaj A., Huang C.J. // J. Neuroendocrinol. 2015. V. 27. № 5. P. 370–376.
Sandrini L., Di Minno A., Amadio P., Ieraci A., Tremoli E., Barbieri S.S. // Int. J. Mol. Sci. 2018. V. 19. № 8.
Iacobini C., Pugliese G., Blasetti Fantauzzi C., Federici M., Menini S. // Metabolism. Elsevier Inc. 2019. V. 92. P. 51–60.
Phillips C.M. // Rev. Endocr. Metab. Disord. 2013. V. 14. № 3. P. 219–227.
Arhire L.I., Mihalache L., Covasa M. // Front. Endocrinol. (Lausanne). 2019. V. 10. № August. P. 1–12.
Huang L., Yan S., Luo L., Yang L. // Mol. Med. Rep. 2019. V. 19. № 2. P. 1074–1082.
Hochstrasser T., Ehrlich D., Humpel C. // Platelets. 2015. V. 46. № 1. P. 29–34.
Ordoñez G., Fernandez A., Perez R., Sotelo J. // J. Neurol. Sci. Netherlands. 1994. V. 121. № 2. P. 163–166.
Faradji V., Sotelo J. // Acta Neurol. Scand. Denmark. 1990. V. 81. № 5. P. 402–406.
Sofroniew M., Howe C., Mobley W. // Annu. Rev. Neurosci. 2001. V. 24. № 1217–1281. P. 926–932.
Kizilyer A., Singh M.V., Singh V.B., Suwunnakorn S., Palis J., Maggirwar S.B. // Sci. Rep. Springer US. 2019. V. 9. № 1. P. 2781.
Kniewallner K.M., Grimm N., Humpel C. // Neurosci. Lett. 2015. V. 574. P. 64–69.
Selvadurai M.V., Hamilton J.R. // Platelets. Taylor & Francis. 2018. V. 29. № 4. P. 319–325.
Barrachina M.N., Sueiro A.M., Izquierdo I., Hermida-Nogueira L., Guitián E., Casanueva F.F., Farndale R.W., Moroi M., Jung S.M., Pardo M., García Á. // Atherosclerosis. Elsevier. 2019. V. 281. № December 2018. P. 62–70.
Barrachina M.N., Izquierdo I., Hermida-Nogueira L., Sueiro A.M., Guitián E., Casanueva F.F., Farndale R.W., Moroi M., Jung S.M., Pardo M., García Á. // Data Brief. 2019. V. 23. P. 103784.
Танашян, М.М., Щепанкевич, Л.А. Орлов, С.В., Теленкова, Н.Г., Шабалина, А.А., Костырева, М.В. // Анналы клинической и экспериментальной неврологии. 2014. V. 8. № 3. P. 14–20.
Alpert M.A., Omran J., Bostick B.P. // Curr. Obes. Rep. United States. 2016. V. 5. № 4. P. 424–434.
Reddy Y.N.V., Anantha-Narayanan M., Obokata M., Koepp K.E., Erwin P., Carter R.E., Borlaug B.A. // JACC. Heart Fail. 2019. V. 7. № 8. P. 678–687.
Wang J., He C., Zhou T., Huang Z., Zhou L., Liu X. // Mol. Vis. 2016. V. 22. P. 254–263.
Nakamura K., Tan F., Li Z., Thiele C.J. // Mol. Cell. Neurosci. 2011. V. 46. № 2. P. 498–506.
Atanassova P., Hrischev P., Orbetzova M., Nikolov P., Nikolova J., Georgieva E. // Folia Biol. (Praha). Poland. 2014. V. 62. № 4. P. 301–306.
Fuenzalida K.M., Aguilera M.C., Piderit D.G., Ramos P.C., Contador D., Quiñones V., Rigotti A., Bronfman F.C., Bronfman M. // J. Biol. Chem. 2005. V. 280. № 10. P. 9604–9609.
Шатова О.П., Заболотнева А.А., Шестопалов А.В. // Успехи современной биологии. 2021. V. 141. № 5. P. 428–442.
Martínez-Sánchez N. // Int. J. Mol. Sci. 2020. V. 21 № 17. P. 1–26.
Zhao C., Veltri K., Li S., Bain J.R., Fahnestock M. // J. Neurotrauma. United States. 2004. V. 21. № 10. P. 1468–1478.
Pierucci D., Cicconi S., Bonini P., Ferrelli F., Pastore D., Matteucci C., Marselli L., Marchetti P., Ris F., Halban P., Oberholzer J., Federici M., Cozzolino F., Lauro R., Borboni P., Marlier L.N. // Diabetologia. Germany. 2001. V. 44 № 10. P. 1281–1295.
Hata T., Sakata N., Yoshimatsu G., Tsuchiya H., Fukase M., Ishida M., Aoki T., Katayose Y., Egawa S., Unno M. // Transplantation. United States. 2015. V. 99. № 6. P. 1132–1143.
Yuan M., Li W., Zhu Y., Yu B., Wu J. // Front. Endocrinol. 2020. V. 11. № 64. P. 1–7.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия


