Нейрохимия, 2022, T. 39, № 2, стр. 144-152
Фактор роста нервов может корректировать нарушения синаптической пластичности в гиппокампе, возникающие при холинергическом дефиците
Ю. Е. Волобуева 1, Ю. В. Добрякова 1, А. П. Большаков 1, В. А. Маркевич 1
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
Поступила в редакцию 14.02.2022
После доработки 16.02.2022
Принята к публикации 23.02.2022
- EDN: EVNLQL
- DOI: 10.31857/S1027813322020157
Аннотация
В данной работе проводилось исследование влияния фактора роста нервов NGF на пластичность гиппокампальных синапсов в условиях дегенерации септальных холинергических нейронов, вызванной иммунотоксином 192IgG-сапорином (192-Sap). На переживающих срезах гиппокампов полученных от контрольных животных тетанизация коллатералей Шаффера приводила к индукции долговременной потенциации. Прединкубация этих срезов со зрелым рекомбинантным NGF не влияла на базовые характеристики фокальных вызванных постсинаптических потенциалов (фВПСП), а также на характеристики индукции и сохранения долговременной потенциации. В другой группе подопытных животных, вызванная иммунотоксином гибель холинергических нейронов медиальной септальной области способствовала значимому снижению амплитуды фВПСП в ответ на тетанизирующую стимуляцию коллатералей Шаффера. Аппликация NGF в дозе 200 нг/мл на переживающие срезы гиппокампов, полученные от животных с холинергическим дефицитом, приводила к восстановлению характеристик долговременной потенциации до контрольного уровня. Обработка гиппокампальных срезов NGF, предварительно деградированным с помощью трипсина, также оказывала положительное влияние на долговременную потенциацию в условиях холинергического дефицита. Можно заключить, что применение NGF может компенсировать нарушения синаптической пластичности в гиппокампе, возникающие при холинергическом дефиците.
ВВЕДЕНИЕ
Ацетилхолин (АЦХ) является одним из основных нейромедиаторов, регулирующих в центральной нервной системе процессы формирования памяти и обучения [1]. Холинергические нейроны, расположенные в медиальной септальной области, базальном ядре, вертикальной и горизонтальной полосках Брока, иннервируют гиппокамп, неокортекс и миндалину [2, 3]. Хорошо известно, что холинергическая дегенерация является одним из структурно-функциональных нарушений, возникающих при болезни Альцгеймера (БА), и может быть одной из основных причин нарушения обучения и памяти [3]. Гибель холинергических нейронов в базальном переднем мозге при БА ведет к потере холинергической иннервации гиппокампа, миндалины и неокортекса, что может способствовать отложению β-амилоида и гиперфосфорилированного тау-белка, которые являются маркерами этого нейродегенеративного заболевания [4].
Важным компонентом взаимосвязи нейронов медиальной септальной области и гиппокампа является тот факт, что некоторые интернейроны гиппокампа экспрессируют фактор роста нервов (nerve growth factor, NGF), который поглощается аксонами базальных холинергических нейронов переднего мозга и транспортируется в их тела [4]. Одна из функций NGF в зрелом мозге – обеспечение выживания и нормального функционирования холинергических нейронов медиальной септальной области [5]. Кроме того, в гиппокампе NGF может выступать в роли регулятора выброса ацетилхолина из синаптических терминалей [6]. Однако именно трофическая роль NGF подтолкнула различные группы исследователей к использованию NGF для замедления развития разных нейродегенеративных патологий. Было показано, что инъекция вируса, несущего кассету с NGF, в медиальную септальную область способствует выживанию нейронов этой области в условиях, когда эти клетки лишены притока нейротрофина из гиппокампа вследствие разрушения свода (fimbria-fornix) [7]. Этот результат заложил основу для создания вирусной терапии БА, однако, первые результаты клинических испытаний не выявили достаточной эффективности вирусной терапии с помощью NGF, видимо, вследствие ошибки, допущенной при инъекции вирусов в структуры базального мозга и очень ограниченной диффузии вирусов в ткани мозга [8]. Однако исследования синаптической пластичности и поведения, проведенные нами, а также другими исследователями, показали, что положительный эффект NGF может развиваться в отсутствие холинергической иннервации [9, 10] и не зависит от восстановления холинергической иннервации гиппокампа [11]. Кроме того, оверэкспрессия NGF в гиппокампе может оказывать защитное влияние не только на уровне синаптической пластичности и поведения, но также может предотвращать подавление долговременной потенциации, вызванное бета-амилоидом [12]. Таким образом, существующие данные говорят о том, что эффект NGF может зависеть от условий, в которых нейротрофин оказывает свое действие, причем позитивные эффекты этого нейротрофина, по всей видимости, могут развиваться именно в условиях некоторых нарушений.
В нашей работе мы использовали хорошо известную модель холинергического дефицита в гиппокампе, возникающего после дегенерации нейронов медиальной септальной области, вызываемой иммунотоксином 192IgG-сапорином (192-Sap) [13, 14], чтобы определить, может ли аппликация NGF на срезы гиппокампа компенсировать последствия холинергического дефицита.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводились на половозрелых самцах крыс линии Wistar (200-250 г), полученных из питомника “Пущино” Филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН. Общее число использованных животных – 42 особи. От каждого животного в электрофизиологических экспериментах использовали от 2 до 4 срезов гиппокампа (n = 14–29 на группу). Животные содержались в стандартных условиях вивария при температуре 21 ± 1°С с 12-часовым циклом свет/темнота, пища и вода предоставлялись ad libitum. Перед инъекцией иммунотоксина животные были случайным образом разделены на группы. Эксперименты выполнялись в соответствии с этическими нормами. Содержание животных соответствовало правилам лабораторной практики, утвержденной приказом № 199н от 01.04.2016 г. Минздрава РФ. При проведении экспериментов были приняты меры, исключающие излишние физические страдания или повреждения животных.
Работа включала в себя три последовательных эксперимента:
1. Исследование влияния NGF на базовую линию и индукцию и сохранение ДП. В эксперименте было задействовано две группы животных: (1) контрольная группа (n = 15) с инкубацией в ACSF и (2) группа, срезы которой были проинкубированы с NGF (ACSF + NGF) (n = 16). Обе группы получали предварительные инъекции PBS в медиальную септальную область.
2. Исследование влияния NGF на срезы от животных с холинергическим дефицитом. В эксперименте было задействовано три группы животных: (1) контрольная группа (n = 15), с предварительной инъекцией PBS и инкубацией срезов в ACSF; (2) опытная, с предварительной инъекцией животным 192-Sap и инкубацией срезов в ACSF (n = 19), (3) группа с предварительной инъекцией животным 192-Sap и инкубацией срезов в NGF (ACSF + + NGF) (n = 14).
3. Исследование влияния химически деградированного NGF на срезы от животных с холинергической дисфункцией. В эксперименте было задействовано 3 группы: (1) группа с предварительной инъекцией животным 192-Sap и инкубацией в ACSF (n = 29), (2) группа с введением животным 192-Sap и инкубацией с NGF (ACSF+NGF) (n = 23) и (3) группа c введением животным 192-Sap и инкубацией с химически деградированным dNGF (ACSF + dNGF) (n = 17).
Введение иммунотоксина. Электрофизиологическим экспериментам предшествовала хирургическая операция. Животным стереотаксически под ингаляционной анестезией изофлюраном вводили иммунотоксин 192-Sap (Merck, США) в медиальную септальную область (1.5 мкл/животное). Контрольные животные получали эквивалентные объемы растворителя – фосфатно-солевого буфера (PBS). Введение иммунотоксина в медиальную септальную область производили с помощью микроинфузионного насоса (Stoelting Co., США) со скоростью 0,5 мкл/мин по следующим координатам: AP + 0.4 мм, L – 1.5 мм, 14–15°.
Электрофизиология. Через 21 день после инъекции подопытных животных декапитировали и извлекали мозг. Переднюю часть мозга, содержащую медиальную септальную область, помещали в 4% раствор формальдегида на 2 дня для фиксации, из оставшийся части мозга готовили горизонтальные срезы гиппокампа толщиной 400 мкм с помощью вибратома (Leica Biosystems, Германия) в ледяной искусственной спинномозговой жидкости (ACSF), содержащей (в мМ): 126 NaCl, 2.5 KCl, 24 NaHCO3, 1.23 NaH2PO4, 1 MgCl, 13 глюкозы, и 2 CaCl2 (насыщение 95% O2 и 5% CO2). Подготовка срезов, инкубация, регистрация фокальных потенциалов (фВПСП) проводилась по стандартным методикам [12]. В течение 1 ч после порезки срезы инкубировали при температуре 32°C в насыщенном кислородом ACSF. Для регистрации фВПСП срезы переносили в специальные камеры объемом 25 мл с постоянным протоком (3–5 мл/мин) ACSF и температурным режимом 31–32°C. ACSF комнатной температуры, которую подавали в камеру, непрерывно перфузировали смесью 95% O2 и 5% CO2 со скоростью 5 мл/мин. фВПСП регистрировали в поле СА1 с помощью стеклянного микроэлектрода, заполненного ACSF, со средним сопротивлением 1–5 МОм. Стимуляцию срезов производили с помощью биполярного электрода (нихромовая проволока, 80 мкм) подведенного к коллатералям Шаффера. фВПСП регистрировали в ответ на парные импульсы с межстимульным интервалом 50 мс и частотой тестирования 0.033 Гц. Для записи фВПСП использовали интенсивность стимула, вызывавшую фВПСП амплитудой 50–60% от максимума.
Регистрацию электрофизиологических показателей проводили в 3 этапа: (1) Запись базовой линии: 20 мин. (2) Инкубация с NGF или dNGF в дозе 200 нг/мл для групп SAP в ACSF + NGF и SAP в ACSF + dNGF. Затем запись фВПСП в течение 20 минут (3) тетанизацию коллатералей Шаффера, вызывавшую длительную потенциацию (ДП) проводили высокочастотной стимуляцией (HFS) (3 последовательности по 1 с 100 Гц каждая, применяемые с интервалом 20 с), с использованием той же интенсивности стимула, что и для записи базовой линии. После индукции ДП фВПСП регистрировались еще в течение 60 мин.
Стоковые растворы рекомбинантного человеческого белка NGF (активный) (abcam, Великобритания) добавляли в омывающий срезы раствор с конечной концентрацией 200 нг/мл. Стоковые растворы NGF в дистиллированной воде c концентрацией 200 мкг/мл хранили при температуре –70°C. Для получения химически разрушенного NGF (dNGF) был произведен химический гидролиз NGF ферментом трипсином 1–250 (MP Biomedical). В ранее приготовленные стоки NGF добавляли по 1 мкл трипсина в концентрации 1 мкг/мл. Трипсин разводили в растворе карбонатного буфера. После добавления трипсина смесь инкубировали 12 ч при температуре 37°C. Далее добавляли 1 мкл ингибитора трипсина, в аналогичной трипсину концентрации. Инкубацию с ингибитором проводили при комнатной температуре 20–30 мин, стоковые растворы с dNGF хранили при температуре ‒70°C до использования.
Иммуногистохимия. Для проверки работы иммунотоксина 192-Sap и оценки степени гибели холинергических нейронов проводили окрашивание на холинацетилтрансферазу (ХАТ). Фиксированную переднюю часть мозга резали на вибротоме, делая фронтальные срезы толщиной 50 мкм. От каждого животного брали по 2 среза из медиальной септальной области. Сначала свободно плавающие срезы отмывали в растворе PBS, содержащем 0.3% Triton X100 (Serva, ФРГ), затем инкубировали 1 час в блокирующем растворе (5% неиммунная сыворотка козы в PBS-T). После чего срезы помещали в блокирующий раствор с первичными антителами (поликлональные антитела кролика к ХАТ) (Santa Cruz Biotechnology, США) в разведении 1 : 500 на ночь при температуре 4°C. На следующий день срезы отмывали в PBS-T и инкубировали с антителами козы к иммуноглобулину кролика, конъюгированными с биотином (Sigma-Aldrich, США) в разведении 1 : 800. Антитела разводили в блокирующем растворе, состоявшем из 5% неиммунной сыворотки козы в PBS-T. Инкубация продолжалась в течение 2 ч при комнатной температуре. После дополнительной промывки в PBS срезы инкубировали с комплексом авидин-биотин-HRP (ABC Elite kit, Vector Labs, США) в течение 1 ч. В качестве хромогена применяли 3,3'-диаминобензидин (SIGMA-Fast Kit, Sigma-Aldrich, США). Все изображения были получены с помощью микроскопа Leica DM6000B (Leica Biosystems, Германия). Подсчет клеток проводили на срезах, содержавших медиальное септальное ядро.
Иммуногистохимический анализ срезов мозга, проведенный после завершения всех электрофизиологических экспериментов, показал, что инъекции 192-Sap вызывали гибель большинства ХАТ-позитивных нейронов в медиальной септальной области. Гибель ХАТ-позитивных клеток в этой области достигала от 50 до 90%, в среднем на срез после инъекции PBS приходилось 94 ± 12.7% клеток, после инъекции SAP – 31 ± 4.8% клеток (F(1, 19) = 19,5, p < 0.05; ANOVA-метод, однофакторный).
Статистическая обработка данных. В качестве основного параметра, описывающего динамику индукции и сохранения ДП, была выбрана амплитуда фВПСП, измеренная полуавтоматически с помощью программного обеспечения Clampfit 10.2. Полученные данные были усреднены и нормализованы к ответам за последние 10 мин до подачи высокочастотной стимуляции. Статистическая обработка данных производилась с помощью программы Statistica 10 (StatSoft, США). Для оценки достоверности результатов использовался двухфакторный ANOVA-метод с одним межгрупповым (фактор группы) и одним внутригрупповым (повторные изменения) факторами.
РЕЗУЛЬТАТЫ
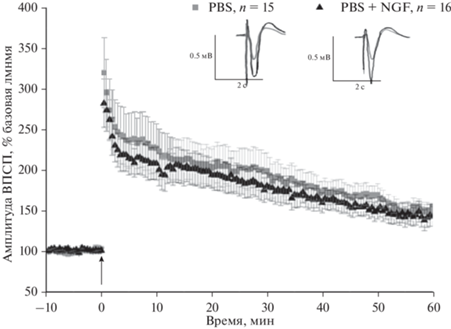
В ходе анализа влияния NGF на характеристики вызванных ответов поля CA1 гиппокампа было выявлено, что аппликация NGF в дозе 200 нг/мл на срезы, полученные от контрольных животных, не оказывает влияния на амплитуды фВПСП (рис. 1). ANOVA не выявила значимых межгрупповых различий (F(1, 21) = 0.28, p = 0.6), но был выявлен значимый эффект времени F(139, 2919) = 24.7, p < < 0.0001). Помимо амплитуды фВПСП оценивался такой показатель как парная фасилитация (PPF) в ответ на парную стимуляцию с интервалом 50 мс. Статистических различий между группами выявлено не было (F(1, 21) = 0.08, p = 0.8. Значимый эффект был выявлен только для временной зависимости (F(139, 2919) = 4.3, p < 0.0001). Во всех группах наблюдалось снижение значений парной фасилитации после развития ДП в ответ на тетанизацию коллатералей Шаффера.
Рис. 1.
Изменение амплитуды фВПСП поля CA1 гиппокампа в ответ на стимуляцию коллатералей Шаффера до и в течение 60 минут после индукции ДП у контрольных животных (PBS, n = 15) и группы животных, с аппликацией NGF (200 нг/мл) на срезы (PBS + NGF). Амплитуда ответа представлена в процентах от базового уровня (10 мин перед индукцией ДП). Каждая точка представляет собой среднее значение ± ошибка среднего.
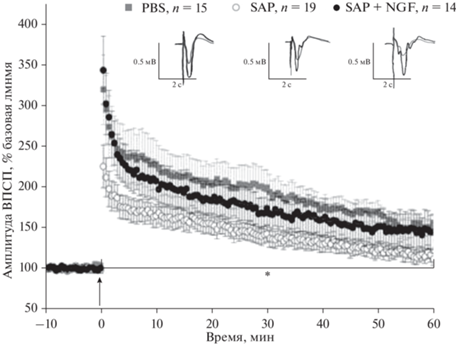
Анализ изменений фокальных потенциалов в группах с дегенерацией нейронов в медиальной септальной области выявил значимые межгрупповые различия по амплитуде фВПСП поля CA1 гиппокампа после тетанизации коллатералей Шаффера. Показано, что амплитуда ДП у животных, получавших инъекции 192-Sap стабильно снижена по сравнению с контролем, в то время как инкубация срезов от животных с холинергическим дефицитом в NGF приводила к частичному восстановлению уровня амплитуд фВПСП (F(2, 41) = 3.6, p < 0.05; ANOVA; повторные измерения 0-60 мин) (рис. 2). Кроме того, выявлен значимый эффект времени F(139, 5699) = 43.9, p < 0.0001) и значимое взаимодействие между факторами F(278, 5699) = 1.8, p < < 0.0001). Post hoc анализ показал, что во всех группах наблюдался значимый прирост амплитуды после тетанизации коллатералей Шаффера, однако в группе животных, которым инъецировали 192-Sap достоверные изменения наблюдались лишь в первые 15 мин после тетанизации, затем амплитуда фВПСП спадала, приближаясь к значениям близким к базовым. В контрольной группе и в группе с холинергическим дефицитом, обработанной NGF, достоверные изменения ДП сохранялись вплоть до 40 мин. При анализе PPF статистических различий между группами выявлено не было (F(2, 41) = 2.1, p = 0.1). Однако выявлен значимый эффект времени (F(139, 5699) = 8.2, p < 0.0001). Полученные результаты говорят о том, что применение NGF способно восстанавливать пластические свойства гиппокампальных синапсов, несмотря на отсутствие своей основной мишени – холинергических аксонов, приходящих из медиальной септальной области. Это результат говорит о том, что гиппокампальные клетки сами способны осуществлять рецепцию NGF, однако, возникает вопрос о том, необходим ли полноразмерный белок для индукции наблюдаемого протекторного эффекта.
Рис. 2.
Изменение амплитуды фВПСП поля CA1 гиппокампа в ответ на стимуляцию коллатералей Шаффера до и в течение 60 мин после индукции ДП у крыс контрольной группы (PBS, n = 15), группы животных с инъекцией SAP (SAP, n = 19) и группы с аппликацией NGF (200 нг/мл) на срезы (SAP + NGF, n = 14). Амплитуда ответа представлена в процентах от базового уровня (10 мин перед индукцией ДП). Каждая точка представляет собой среднее значение ± ошибка среднего. Значимые межгрупповые отличия отмечены *, достоверные различия по сравнению с контрольной группой (SAP), р < 0.05.
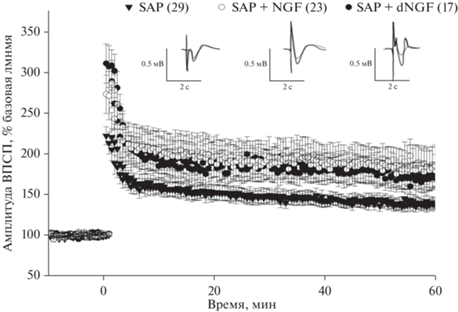
Для ответа на последний вопрос мы сравнили влияние активного и химически деградированного нейротрофина (dNGF) на фВПСП поля CA1 гиппокампа на фоне холинергической дисфункции и обнаружили, что как NGF, так и dNGF, разрушенный трипсином, вызывали прирост амплитуд после тетанизации близкий к достоверному (рис. 3). Как и в предыдущих экспериментах амплитуда ДП у животных, получавших инъекции 192-Sap (1.5 мкл/животное) без инкубации срезов в NGF или в dNGF, стабильно снижена по сравнению с группами, в которых применялся нейротрофин, на протяжении 60 мин после тетанизации (F(2, 66) = 2.5, p = 0.09). Кроме того, выявлен значимый эффект времени (F(139, 9174) = 46.04, p < < 0.0001) и значимое изменение взаимодействия между факторами F(278, 9174) = 1.75, p < 0.0001). Последующий Post Hoc анализ выявил, что во всех группах наблюдался прирост амплитуды после тетанизации коллатералей Шаффера, однако, в группе животных без инкубации срезов в NGF или в dNGF достоверные изменения наблюдаются лишь первые 20 мин. В свою очередь, при инкубации срезов от животных с дегенерацией нейронов медиальной септальной области с NGF или с dNGF достоверные изменения уровня амплитуд фВПСП наблюдаются на протяжении всей записи (60 мин). Анализ PPF не выявил статистически значимых различий между группами (F(2, 66) = 0.6, p = 0.6). Однако мы обнаружили значимый эффект времени (F(278, 9174) = 1.3, p < 0.05) и значимое взаимодействие между факторами F(278, 9174) = 1.75, p < 0.05). Post hoc анализ показал, что во всех группах наблюдалось снижение значений парной фасилитации после тетанизации коллатералей Шаффера, схожее со снижением, наблюдавшимся у контрольных животных в первой серии экспериментов.
Рис. 3.
Изменение амплитуды фВПСП поля CA1 гиппокампа в ответ на стимуляцию коллатералей Шаффера до и в течение 60 минут после индукции ДП у крыс с инъекцией SAP (SAP, n = 17), группы с аппликацией NGF (200 нг/мл) на срезы (SAP + NGF, n = 10) и с аппликацией dNGF (200 нг/мл) на срезы (SAP + NGF, n = 8). Амплитуда ответа представлена в процентах от базового уровня (10 мин перед индукцией ДП). Каждая точка представляет собой среднее значение ± ошибка среднего.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Восстановление нормального функционирования ЦНС при болезни Альцгеймера является одним из актуальнейших направлений нейробиологических исследований. В качестве одного из подходов к компенсации холинергического дефицита, возникающего при БА было предложено использовать нейротрофин NGF [15]. Однако исследования последних лет указывали на то, что защитный эффект может быть обусловлен не только трофической поддержкой холинергических нейронов переднего мозга, но и некоторыми другими механизмами, связанными с локальным действием нейротрофина в гиппокампе [9–11]. В настоящем исследовании мы показали, что аппликация NGF на гиппокампальные срезы от контрольных животных значимо не повлияла на индукцию и поддержание ДП на всем протяжении экспериментальной записи, что согласуется с данными предыдущих исследований [12, 16]. Модулирующее влияние NGF на пластические перестройки в гиппокампе контрольных животных наблюдалось либо при инъекции NGF в медиальную септальную область [17], либо когда NGF оверэкспрессировали в гиппокампе, но эффект оценивали не по влиянию на характеристики фВПСП, а по влиянию на амплитуду популяционного спайка [18]. Последнее важно, т.к. было показано, что ацетилхолин, выделяемый из септальных волокон, может не влиять на характеристики фВПСП, но изменять амплитуду популяционного спайка в гиппокампе [19, 20]. Усиление именно популяционного ответа при оверэкспрессии NGF в работе [18] может говорить о том, что оверэкспрессия NGF в условиях нормы в гиппокампе могла приводить к формированию дополнительных холинергических коллатералей в гиппокампе и как следствие усилению холинергического влияния, что могло привести к описанному усилению популяционной активности.
В нашей работе мы также подтвердили данные предыдущих исследований о том, что дегенерация нейронов медиального септума приводит к ослаблению ДП в гиппокампальных синапсах [17, 21, 22], возможно, за счет ослабления холинергического влияния на тормозные нейроны гиппокампа [10].
Предварительная инкубация с NGF срезов гиппокампа, полученных от животных с холинергическим дефицитом, не влияла сама по себе на амплитуду фВПСП, но восстанавливала амплитуду ДП до контрольных значений. Полученные данные свидетельствуют о том, что NGF способен оказывать положительный эффект на синаптическую пластичность в условиях гибели холинергических нейронов в медиальной септальной области. Сходные данные были получены нами ранее in vivo, у животных с оверэкспрессией NGF в гиппокампе на фоне холинергической дисфункции наблюдались значимо более высокие значения амплитуд ДП по сравнению с животными, которым вводили только иммунотоксин 192-Sap [10]. Однако существенная разница между предыдущими результатами и данными, полученными в настоящей работе, заключается в том, что в случае оверэкспрессии NGF в гиппокампе нейротрофин оказывает свое действие на клетки гиппокампа продолжительное время и, возможно, может запускать какие-то дополнительные механизмы, связанные с транскрипцией и/или трансляцией некоторых дополнительных генов, которые и опосредуют конечный положительный эффект NGF. Кроме того, при оверэкспрессии повышается уровень как пронейротрофина, так и его зрелой формы и остается неясным какая из форм оказывает свой защитный эффект. В настоящей же работе время действия NGF перед индукцией ДП составляло порядка 20 мин, что практически исключает возможность развития эффектов NGF за счет активации сложных многостадийных процессов и, скорее, говорит об активации “быстрых” биохимических каскадов после активации некоторых рецепторов. Кроме того, оказалось, что позитивный эффект может оказывать зрелая форма NGF.
Важным аспектом полученных данных является также то, что нарушение индукции ДП после индукции холинергического дефицита происходит не только, как нами ранее было показано [10, 21], в дорсальной, но и в вентральной части гиппокампа. Кроме того, мы обнаружили, что положительный эффект NGF также имеет место в срезах вентрального гиппокампа. В целом, наши данные говорят о том, что NGF, по всей видимости, оказывает схожее влияние на клетки дорсального и вентрального гиппокампа.
Существует несколько возможных механизмов действия нейротрофина. Основной механизм – это влияние NGF непосредственно на терминали холинергических нейронов, экспрессирующих TrkA/NTRK1 и p75/NGFR рецепторы нейротрофина [5]. Действительно, анализ срезов медиальной септальной области показал, что септальные инъекции 192-Sap вызывают не тотальную гибель клеток, в нашей работе гибель составила от 50 до 90% (см. рис. 4) холинергических нейронов по отношению к контрольному уровню. Можно предположить, что аппликация NGF в исследуемой дозе, которая сильно превышает базовый уровень экспрессии нейротрофина, повышала уровень ацетилхолина в гиппокампе, за счет усиления влияния нейротрофина на сохранившиеся терминали холин-ергических нейронов. Однако сходное усиление ДП должно было наблюдаться и в контрольных экспериментах, где все холинергические волокна оставались интактными. Мы выше отмечали, это эффект NGF отсутствовал в контрольных экспериментах, что говорит о том, что защитный эффект NGF в гиппокампе вряд ли опосредован классическими рецепторами NGF, расположенными на терминалях холинергических нейронов. Мы ранее показали, что дегенерация холинергических волокон после внутрисептальной инъекции 192-Sap не приводит к изменениям в экспрессии TrkA/NTRK1 и p75/NGFR рецепторов на клетках гиппокампа и выдвинули предположение о том, что защитный эффект NGF в гиппокампе не связан с активацией его классических рецепторов [10]. Полученные нами данные подтверждают это предположение и представляют дополнительные доказательства того, что защитный эффект NGF не связан с активацией классических рецепторов. Мы показали, что трипсинизированный зрелый NGF оказывает эффект, схожий с нерасщепленным зрелым NGF, а при трипсинизации происходит разрушение сайтов связывания фрагментов NGF с рецептором p75 и остаются лишь пептиды, содержащие последовательности для связывания с TrkA (см. рис. 5). Из этих данных следует, что если эффект NGF и опосредован классическими рецепторами, то только TrkA. Необходимо подчеркнуть, что TrkA не экспрессируются клетками гиппокампа, что говорит о том, что с высокой вероятностью эффект NGF опосредован другими рецепторами, например, пептидными рецепторами SORCS2 [23] и SORCS3 [24], которые способны связывать NGF и экспрессируются на нейронах гиппокампа [25, 26].
Рис. 4.
Влияние внутрисептального введения иммунотоксина 192-Sap на число клеток в медиальной септальной области. Каждая точка представляет собой среднее значение ± ошибка среднего. * Достоверные различия по сравнению с контрольной группой (PBS), р < 0.05.
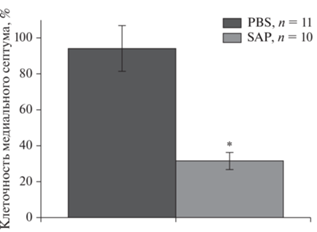
Рис. 5.
Аминокислотная последовательность зрелого NGF. Серым показаны аминокислоты, после которых происходит расщепление трипсином. Зелеными прямоугольниками показаны места связывания с TrkA/NTRK1, а красными – места связывания с p75/NGFR (по данным [27]). Последовательность NGF. Серым цветом показаны точки трипсинизации.

Остается нерешенным вопрос, почему положительный эффект NGF наблюдается лишь в условиях дегенерации холинергических волокон. Наши данные говорят лишь о том, что мишенью с наибольшей вероятностью являются именно клетки гиппокампа, которые приобретают (или усиливают) свою способность осуществлять рецепцию NGF. Механизмы возникновения положительного эффекта NGF, а также пептидов, возникающих при его обработке трипсином, требуют дальнейших исследований.
ВЫВОДЫ
Мы показали, что: (1) зрелая форма фактора роста нервов не влияет на пластические свойства гиппокампальных синапсов в нормальных условиях; (2) индукция холинергического дефицита приводит в вентральном гиппокампе к нарушению индукции долговременной потенциации; (3) зрелая форма фактора роста нервов, а также ее фрагменты, образующиеся в результате ее расщепления трипсином, могут компенсировать нарушения, возникающие при холинергическом дефиците.
Список литературы
Woolf N.J., Butcher L.L. // Behav. Brain Res. 2011. V. 221. №. 2. P. 488–498.
Mesulam M.M., Mufson E.J., Wainer B.H., Levey A.I. // Neuroscience 1983. V. 10. № 4. P. 1185–1201.
Hasselmo M.E. // Behav. Brain Res. 1995. V. 67. № 1. P. 1–27.
Ramos-Rodriguez J.J., Pacheco-Herrero M., Thyssen D., Murillo-Carretero M.I., Berrocoso E., Spires-Jones T.L., Bacskai B.J., Garcia-Alloza M. // J. Neuropathol. Exp. Neurol. 2013. V. 72. № 4. P. 272–285.
Carmo S.Do, Kannel B., Cuello A.C. // Cells 2021. V. 11. № 1.
Knipper M., da Penha Berzaghi M., Blöchl A., Breer H., Thoenen H., Lindholm D. // Eur. J. Neurosci. 1994. V. 6. № 4. P. 668–671.
Blesch A., Conner J., Pfeifer A., Gasmi M., Ramirez A., Britton W., Alfa R., Verma I., Tuszynski M.H. // Mol. Ther. 2005. V. 11. № 6. P. 916–925.
Castle M.J., Baltanás F.C., Kovacs I., Nagahara A.H., Barba D., Tuszynski M.H. // Hum. Gene Ther. 2020. V. 31. № 7–8. P. 415–422.
Dobryakova Y.V., Zaichenko M.I., Spivak Y.S., Stepanichev M.Y., Markevich V.A., Bolshakov A.P. // Neurochem. J. 2021. V. 15. № 3. P. 273–281.
Dobryakova Y.V., Spivak Y.S., Zaichenko M.I., Koryagina A.A., Markevich V.A., Stepanichev M.Y., Bolshakov A.P. // Front. Neurosci. 2021. V. 15.
Eu W.Z., Chen Y.J., Chen W.T., Wu K.Y., Tsai C.Y., Cheng S.J., Carter R.N., Huang G.J. // Transl. Psychiatry 2021. V. 11. № 1.
Ivanov A.D., Tukhbatova G.R., Salozhin S.V., Markevich V.A. // Neuroscience 2015. V. 289. P. 114–122.
Bolshakov A.P., Stepanichev M.Y., Dobryakova Y.V., Spivak Y.S., Markevich V.A. // Toxins (Basel). 2020. V. 12. № 9.
Schliebs R., Roßner S., Bigl V. // Prog. Brain Res. 1996. V. 109. P. 253–264.
Rafii M.S., Tuszynski M.H., Thomas R.G., Barba D., Brewer J.B., Rissman R.A., Siffert J., Aisen P.S., AAV2-NGF Study Team // JAMA Neurol. 2018. V. 75. № 7. P. 834–841.
Kang H., Schuman E.M. // Science 1995. V. 267. № 5204. P. 1658–1662.
Conner J., Franks K., Titterness A., Russell K., Merrill D., Christie B., Sejnowski T., Tuszynski M. // J. Neurosci. 2009. V. 29. № 35. P. 10883–10889.
Uzakov S.S., Ivanov A.D., Salozhin S.V., Markevich V.A., Gulyaeva N.V. // Brain Res. 2015. V. 1624. P. 398–404.
Bilkey D.K., Goddard G.V. // Brain Res. 1985. V. 361. № 1–2. P. 99–106.
Fantie B.D., Goddard G.V. // Brain Res. 1982. V. 252. № 2. P. 227–237.
Dobryakova Y.V., Stepanichev M.Y., Markevich V.A., Bolshakov A.P. // Int. J. Neurosci. 2020.
Motooka Y., Kondoh T., Nomura T., Tamaki N., Tozaki H., Kanno T., Nishizaki T. // Brain Res. Dev. Brain Res. 2001. V. 129. № 1. P. 119–123.
Leloup N., Chataigner L.M.P., Janssen B.J.C. // Nat. Commun. 2018. V. 9. № 1.
Westergaard U.B., Kirkegaard K., Sørensen E.S., Jacobsen C., Nielsen M.S., Petersen C.M., Madsen P. // FEBS Lett. 2005. V. 579. № 5. P. 1172–1176.
Hermey G., Plath N., Hübner C.A., Kuhl D., Schaller H.C., Hermans-Borgmeyer I. // J. Neurochem. 2004. V. 88. № 6. P. 1470–1476.
Tasic B., Yao Z., Graybuck L.T., Smith K.A., Nguyen T.N., Bertagnolli D., Goldy J., Garren E., Economo M.N., Viswanathan S., Penn O., Bakken T., Menon V., Miller J., Fong O., Hirokawa K.E., Lathia K., Rimorin C., Tieu M., Larsen R., Casper T., Barkan E., Kroll M., Parry S., Shapovalova N.V., Hirschstein D., Pendergraft J., Sullivan H.A., Kim T.K., Szafer A., Dee N., Groblewski P., Wickersham I., Cetin A., Harris J.A., Levi B.P., Sunkin S.M., Madisen L., Daigle T.L., Looger L., Bernard A., Phillips J., Lein E., Hawrylycz M., Svoboda K., Jones A.R., Koch C., Zeng H. // Nature. 2018. V. 563. № 7729. P. 72–78.
Wlesmann C., Ultsch M.H., Bass S.H., De Vos A.M. // Nature. 1999. V. 401. № 6749. P. 184–188.
Дополнительные материалы отсутствуют.


