Нейрохимия, 2022, T. 39, № 3, стр. 288-298
Анальгетическая активность пальмитоилэтаноламида при развитии нейропатической боли у крыс
Д. Н. Ивашкевич 1, И. В. Манжуло 1, А. И. Пономаренко 1, А. А. Тыртышная 1, И. В. Дюйзен 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
Владивосток, Россия
Поступила в редакцию 22.03.2022
После доработки 23.03.2022
Принята к публикации 30.05.2022
- EDN: NQZHMG
- DOI: 10.31857/S1027813322030049
Аннотация
Анальгетическая активность пальмитоилэтаноламида (ПЭА, C18H37NO2) изучалась с использованием модели повреждения седалищного нерва у крыс. В исследовании был использован комплекс физиологических, биохимических и иммуногистохимических методов выявления активности микро- и астроглии, а также нейрональной формы NO-синтазы. В работе установлено, что введение ПЭА (100 мг/кг) снижает интенсивность и продолжительность нейрогенного болевого синдрома и приводит к более ранней стабилизации распределения веса. Пероральное введение ПЭА стабилизирует уровень активности микро-, астроглии и nNOS-позитивных нейронов в задних рогах спинного мозга и спинномозговых ганглиях. Кроме того, в культуре клеток микроглии (SIM-A9) ПЭА ингибирует выработку ЛПС-индуцированных провоспалительных цитокинов (TNFα), маркера главного комплекса гистосовместимости (MHC II) и маркер клеточной поверхности провоспалительной микроглии (CD86), а также усиливает продукцию противовоспалительного интерлейкина-10 (IL10) и маркера клеточной поверхности противовоспалительной микроглии (CD206). Результаты данного исследования свидетельствуют о комплексном воздействии ПЭА на процесс нейровоспаления, что вероятно обеспечивает его анальгетический потенциал.
ВВЕДЕНИЕ
Лечение хронической боли является одной из наиболее актуальных проблем фундаментальной и практической нейробиологии. Трудности, связанные с лечением нейропатического болевого синдрома обусловлены разнообразием причин, способствующих его развитию, сложностью и недостаточным пониманием физиологических и психологических процессов, формирующих ощущение боли [1]. Хроническая боль, может способствовать развитию и прогрессированию большинства соматических заболеваний [2–4]. Современные методы лечения нейропатических болевых синдромов весьма ограничены [5, 6]. Разработка новых и эффективных методов лечения хронической боли требует более четкого представления о ее физиологических, биохимических и психофизиологических механизмах и способах ее эндогенного подавления.
Ранее было показано, что повреждение седалищного нерва вызывает повышение активности ноцицептивных нейронов в задних рогах спинного мозга и спинномозговых ганглиях. Система синтеза оксида азота (NO) претерпевает количественные и качественные изменения при хронических болевых состояниях и лежит в основе болевого поведения, такого как термическая аллодиния [7]. Изменения нейротрансмиттерной активности нейронов спинного мозга и спинномозговых ганглиев сопровождаются активацией астроглии и микроглии [8]. После активации глиальные клетки продуцируют ряд провоспалительных цитокинов, которые активируют сенсорные нейроны в спинном мозге, тем самым усиливая ноцицептивную активность. Клетки микроглии подразделяют на две функциональные категории: активированный провоспалительный фенотип М1, характеризующийся провоспалительной активностью (TNFα, IL1β, IL6) и альтернативно активированный фенотип М2, характеризующиеся противовоспалительным медиаторным профилем (IL4, IL10) участвующим в процессах репарации и ремоделирования ткани [9]. Регуляция глиальной активности, представляет собой перспективную терапевтическую стратегию, поскольку можно модулировать иммунный ответ, не исключая его нейропротекторные функции.
Традиционный подход к лечению периферической нейропатической боли включает прегабалин (аналог гамма-аминомасляной кислоты (ГАМК)), габапентин (ингибитор ГАМК), дулоксетин (ингибитор обратного захвата серотонина и норадреналина) и различные трициклические антидепрессанты в качестве вариантов лечения первой линии. Препараты второй линии для лечения нейропатической боли включают капсаицин [10], пластыри с лидокаином и трамадол (опиоидный агонист и ингибитор обратного захвата серотонина-норадреналина), тогда как сильные опиоиды могут использоваться в качестве лечения третьей линии. Однако, использование большинства из представленных на сегодняшний день препаратов сопровождается высоким риском развития побочных эффектов и привыкания. Поэтому, для терапии нейропатического болевого синдрома значительный интерес представляют вещества липидной природы, полученные из морских гидробионтов, демонстрирующие полную безопасность, и при этом противовоспалительную и нейропротекторную активность. Пальмитоилэтаноламид (ПЭА) является одним из представителей группы неэндоканнабиноидных амидов жирных кислот, он участвует в широком спектре защитных процессов при повреждении центральной и периферической нервной системы и/или при развитии нейровоспаления. На сегодняшний день уже представлено несколько лицензированных пищевых добавок, потенциально полезных в широком диапазоне терапевтических эффектов. Для ПЭА основным изученным действием является его противовоспалительная активность [11, 12], а также нейропротекторное действие и защита от эксайтотоксичности, осуществляемые за счет модуляции тучных клеток [13, 14]. Кроме того, ПЭА обладает анальгетическим действием, однако механизмы, реализующие данный эффект на сегодняшний день, остаются мало изученными. Известно, что ПЭА имеет опосредованное влияние на эндоканнабиноидные рецепторы CB1 и CB2. Обладая слабым сродством к каннабиноидным рецепторам, ПЭА может косвенно их активировать, выступая в качестве ложного субстрата для гидролазы амидов жирных кислот (FAAH), фермента, участвующего в деградации эндоканнабиноидного анандамида [13, 15]. Что приводит к повышению уровня анандамида и, в свою очередь, к повышенной активации передачи сигналов, опосредованных каннабиноидными рецепторами.
В настоящем исследовании мы проверяем гипотезу о том, что анальгетическое действие ПЭА реализуется путем направленной модуляции микро- и астроглиальной активности и продукции цитокинов.
МАТЕРИАЛ И МЕТОДИКА
Способ получения пальмитоилэтаноламида (ПЭА)
Для получения этилового эфира пальмитиновой кислоты (ЭЭПК), к пальмитиновой кислоте добавляли безводный этанол в соотношении 1 : 2, с добавлением серной кислоты в качестве катализатора (1% от массы реакционной смеси), выдерживали при 75°С и перемешивали в течение 2 ч. Полученный ЭЭПК промывали 1% раствором NaCl до нейтрального значения pH. Далее к ЭЭПК прибавляли моноэтаноламин в соотношении 1 : 2, с добавлением 3% раствора этилата натрия в этаноле в качестве катализатора (10% от массы реакционной смеси) и выдерживали при 75°С и перемешивали в течение 4 ч. Полученный этаноламид пальмитиновой кислоты промывали от остатков моноэтаноламина 1% раствором NaCl до нейтрального значения pH. Полученный пальмитоилэтаноламид представлял собой белый рассыпчатый порошок без запаха, чистотой 99.6%.
Характеристика экспериментального материала
Исследование выполнено на самцах крыс (2–3 месяца, 240–260 г), содержащихся в условиях вивария со свободным доступом к пище и воде. Животных содержали при постоянной температуре (23 ± 2°С) и влажности (55 ± 15%) с 12-часовым циклом день/ночь. Животные получали стандартную диету (корм Дельта Фидс, БиоПро). Все экспериментальные манипуляции с животными одобрены комиссией по биомедицинской этике Национального научного центра морской биологии им. А.В. Жирмунского ДВО РАН.
Перед проведением операции животных анестезировали 4.5% изофлураном в 100% кислороде (система анестезии (Harvard Apparatus, США)). Животные были разделены на три группы (n = 15), по 5 крыс в группе: №1 – группа “ЛО” (животным проводили рассечение кожи и мышц бедра, но не накладывались лигатуры на седалищный нерв), №2 – группа “Боль” (животным накладывали три тугие лигатуры на седалищный нерв правой задней лапы) и №3 – группа “Боль + ПЭА” (животным накладывали три тугие лигатуры на седалищный нерв и вводили ПЭА). Препарат ПЭА вводили перорально (с помощью пищеводного зонда) в дозировке 100 мг/кг (в виде суспензии с питьевой водой) ежедневно в течение 14 дней. Животные групп “ЛО” и “Боль” получали перорально питьевую воду в том же режиме. Пальмитоилэтаноламид предоставлен для исследования, сотрудниками лаборатории фармакологии ННЦМБ ДВО РАН.
Физиологическое тестирование
Все поведенческие тесты выполнены с использованием специализированного оборудования. Функциональные тесты проводились раз в 3 дня после операции, каждое животное тестировалось три раза с интервалом 10 мин между измерениями. Поведение животных тщательно контролировалось на всех этапах эксперимента.
Инвалидность. Распределение нагрузки на задние конечности исследовали с помощью тестера инвалидности (Incapacitance tester, Columbus Instruments, США). Крыс помещали в камеру, предназначенную для размещения правой и левой задней конечностей на отдельных сенсорных панелях. Сила, которую животное оказывало на правую и левую сенсорную панели при спокойном положении животного с упором на задние конечности, измерялась в граммах в течение 3 с. Для каждой крысы было получено три значения, затем данные были усреднены для определения распределения массы тела на каждой лапе. Распределение веса на правой и левой конечностях (в граммах) выражали в процентах.
Холодовая и тепловая аллодиния. Исследование холодовой и тепловой аллодинии проводили с помощью холодной/горячей пластины (Columbus Instruments, США). Испытание температурной аллодинии проводили в камере с 30 см акриловыми стенками на металлической пластине 30 × 30 см, охлажденной до 0°C (холодовая аллодиния) или разогретой до 54°С (тепловая аллодиния). Для количественной оценки данного параметра время отсутствия контакта конечности с холодной пластиной регистрировали в течение 60 с, а с горячей пластиной в течение 30 с, чтобы исключить повреждение тканей стопы.
Иммуногистохимическое и гистологическое исследование
Поясничный сегмент спинного мозга и спинномозговые ганглии для последующего иммуногистохимического исследования извлекали через 14 дней после операции. Для этого животных анестезировали 4.5% изофлураном в 100% кислороде (система анестезии (Harvard Apparatus, США)), затем перфузировали 10% раствором забуференного формалина и извлекали материал. Поясничный сегмент спинного мозга и дорсальные ганглии фиксировали в течение 24 ч при 4°С в 10% забуференном формалине. После 3–4-кратной промывки 0.1 М фосфатным буфером (рН 7.2) образцы биоматериала заливали в парафин по стандартному протоколу.
Для выявления микроглии был использован иммунопероксидазный метод с применением первичных антител к iba-1, 1 : 1000, Abcam (ab178846), Великобритания), для выявления астроцитов использовали антитела к глиальному фибриллярному кислому белку (GFAP, 1 : 2000, Sigma Aldrich (AMab91033)), для выявления нейрональной формы NO-синтазы использовали антитела к nNOS (Sigma Aldrich (07-571-I)). Вторичные антитела, меченные пероксидазой хрена (Vector Laboratories, PI-1000 (против кролика), PI-2000 (против мыши) 1 : 200), использовали в соответствии с инструкциями фирмы-производителя.
Парафиновые срезы спинномозговых ганглиев и поясничного сегмента спинного мозга (7 мкм) после депарафинирования инкубировали в 3% перекиси водорода для блокирования эндогенной пероксидазы. После трех промывок в 0.1 М фосфатном буфере (рН 7.2) срезы обрабатывали в течение 60 мин в 2% растворе бычьего сывороточного альбумина (Санта-Крус, SC-2323, США) и 0.25% Тритона Х-100 (Gerbu, США). Инкубация с первичными антителами проводилась во влажной камере при 4°С в течение 24 ч. После 3 промывок срезы инкубировали во вторичных антителах в течение 60 мин, затем проводили трехкратную промывку фосфатным буфером (рН 7.2). Для проведения иммунопероксидазной реакции использовали хромоген (Nova Red, Vector Laboratories, США) в течение 5–10 мин. Затем срезы промывали 0.1 М фосфатным буфером (рН 7.2), обезвоживали и заключали в бальзам.
Для гистологического окрашивания депарафинированные срезы спинномозговых ганглиев помещали на 2 мин в раствор толуидинового синего (Biо Vitrum), обезвоживали, просветляли и заключали в бальзам.
Количественная обработка данных
Оценку площади иммуногистохимического окрашивания микроглии и астроглии, а также количества nNOS-позитивных нейронов в задних рогах спинного мозга (ипсилатеральная сторона) и спинномозговых ганглиях проводили в каждом десятом серийном срезе с использованием пакета программ ImageJ 1.41 (NIH, США). Количество nNOS-позитивных нейронов/мм3 рассчитывали по формуле: d = (109 × n)/(S × 7), где d - плотность клеток; 109 – коэффициент пересчета мкм2 в мм3; n – количество иммунопозитивных клеток; S – площадь области интереса (мкм2); 7 – толщина среза (мкм). Отношение площади исследуемой области интереса к площади иммунопозитивного окрашивания выражали в процентах.
Культура микроглии
Во всех экспериментах in vitro использовали линию мышиных микроглиальных клеток SIM-A9 (CRL-3265), полученную из Американской коллекции типовых культур. Клетки культивировали в стандартной среде DMEM, содержащей 10% FBS, 5% DHS и 0.5% пенициллин/стрептомицин, при 37°C в увлажненной атмосфере с 5% CO2. Каждый эксперимент in vitro проводился независимо не менее трех раз.
Вестерн-блоттинг
Клетки микроглии высевали в 6 луночные планшеты в количестве 1 × 109 клеток и обрабатывали ПЭА (0.1, 1, 10 мкМ) в течение 24 ч, снимали, а затем подвергали ультразвуковой гомогенизации в фосфатном буфере (7.2 pH) с добавлением 0.150 мМ ингибитора cериновых протеаз. После чего проводили измерение концентрации белка с последующим выравниванием до значений 2 мг/мл. Затем пробы разбавляли в соотношении 1 : 1 со стоковым загрузочным буфером (1× Sample buffer – Biorad), содержащим 5% 2-меркаптноэтанола, после чего помещали на водяную баню при температуре 94.5°С на 5 мин. Электрофорез проводили с помощью системы Biorad, с использованием готовых гелевых картриджей (Protean mini gel Any kDa (Biorad)) и молекулярной лестницы (Spectra Multicolor Broad Range Protein Ladder (Thermo Fisher)), нагрузка на одну лунку составляла 60 мкг белка, сила тока на один гель – 15 мА. После электрофореза осуществляли перенос белков на PVDF мембрану с помощью системы переноса Turbo transblot (Biorad). Все материалы для проведения переноса использовали из набора Transblot Turbo RTA Transfer kit (Biorad). По завершении переноса мембраны помещали в блокирующий буфер (фосфатный буфер с содержанием 2% БСА, 0.1% Tween 20, 0.05% Triton X100) на ночь. На следующий день промывали от блокирующего буфера, после чего инкубировали 1 ч с первичными антителами к ASAHL (1 : 1000, Santa Cruz (sc-100470)); β-actin (1 : 5000, Thermo Fisher (MA5-15739)); IL10 (1 : 1000, Thermo Fisher (ARC0102)) и CD206 (1 : 1000, Abcam (ab64693)). После инкубации мембраны снова промывали фосфатным буфером, далее час инкубировали со вторичными кроличьими (Vector laboratories, PI-1000) и мышиными антителами (Vector laboratories, PI-2000), а затем промывали. Для проведения реакции хемилюминесценции использовался Western Blot ECL Substrate (Biorad) – в количестве 1 мл субстрата на одну мембрану, инкубация проводилась в течение 5 мин. Визуализация осуществлялась с использованием системы гель-документации ChemiDoc (Biorad). Полученные изображения анализировались с использованием пакета программ ImageLab.
Иммуноферментный анализ (ИФА).
Для количественной оценки TNFα, MHC II и CD86 был проведен иммуноферментный анализ с использованием клеток микроглии мыши SIM-A9. Клетки были разделены на 3 группы: интактные клетки, клетки обработанные ЛПС в концентрации 1 мкг/мл, и клетки обработанные ЛПС + ПЭА в концентрации 10 мкМ. Обработанную культуру клеток гомогенизировали на льду в буфере для экстракции (100 мМ Трис, pH 7,4, 150 мМ NaCl, 1 мМ EGTA, 1 мМ EDTA, 1% Triton X-100 и 0.5% дезоксихолата натрия) с 1 мг/мл смеси ингибиторов протеаз (Сomplete; Sigma-Aldrich, США) и 0.01 мг/мл смеси ингибиторов фосфатазы (P5726; Sigma-Aldrich). Использовались готовые ИФА наборы для определения TNFα (Abcam, ab208348), MHC II (Abcam, ab233629) и CD86 (LSBio, LS-F15288). Набор для анализа белка BCA (Pierce, Rockford, IL, USA) использовали для определения общей концентрации белка. Поглощение при 450 нм измеряли с помощью считывающего устройства для микропланшетов iMark (Bio-Rad, США).
Статистическая обработка данных
Оценку достоверности различий данных, проводили с использованием Two-way Anova (Bonferroni post test). Все данные были проверены на нормальность распределений с использованием теста Колмогорова-Смирнова. Данные выражали как среднее ± SEM, p < 0.05 было принято как статистически значимое. Все статистические тесты выполнялись с использованием программного обеспечения GraphPad Prism 4.00 (GraphPad Software, Сан-Диего, Калифорния, США).
РЕЗУЛЬТАТЫ
Анальгетическое действие пальмитоилэтаноламида обусловлено снижением процессов периферической сенситизации
Тестирование на холодовую аллодинию показало сокращение латентного периода подъема поврежденной конечности в группе “Боль” (31.8 ± 1.5 с) на следующий день после операции в сравнении с группой “ЛО” (60 с). Этот параметр в дальнейшем имел неравномерную динамику и до конца наблюдения не сопровождался восстановлением интактного уровня чувствительности к холодовому воздействию (18.6 ± 1.5 с и 27 ± 0.4 с для второго и третьего измерения, соответственно). У животных, получавших после операции препарат ПЭА, латентный период подъема лапы незначительно снижался (52 ± 1.2 с) по сравнению с ложнооперированными животными, начиная с 1-х суток наблюдения, и сохранял высокие значения на всем протяжении эксперимента (рис. 1а).
Рис. 1.
Динамика болевого поведения у животных с моделью нейропатической боли и при введении ПЭА. а – тест “холодная пластина”; б – тест “горячая пластина”; в – тест инвалидности. Данные представлены как среднее значение ± SEM, * достоверные различия с группой “Боль” (при р < 0.05).
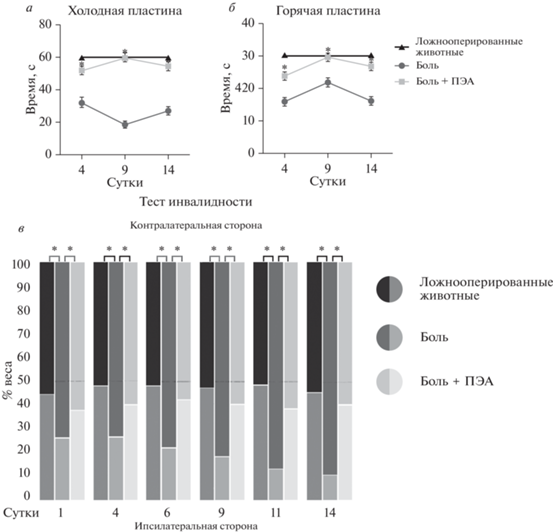
Увеличение латентного периода подъёма лапы в тесте “горячая пластина” было не так отчетливо и носило волнообразный характер. Тем не менее, у животных группы “Боль + ПЭА” также наблюдалось достоверное увеличение по сравнению с группой “Боль” в первые трое суток после операции (15.8 ± 3 с для группы “Боль” и 23.8 ± 3 с для группы “Боль + ПЭА”), при этом в группе “ЛО” все животные выдерживали максимальный период измерения (30 с), данные различия наблюдались в течение всего периода наблюдения (рис. 1б).
Ложнооперированные животные симметрично распределяли свой вес на задние конечности, симметрия распределения веса сохранялась на всем протяжении эксперимента (47.56 ± 1 : 52.44 ± 1%). У животных группы «Боль» показатели асимметрии в использовании задних конечностей в разные послеоперационные сроки имел нарастающую динамику в течение всего периода наблюдения и имел достоверные отличия от животных группы “ЛО”. На следующий день после операции животные в группе “Боль” распределяли большую часть своего веса на неповрежденной лапе (74.26 ± ± 0.5% : 25.74 ±1%). К концу периода наблюдения распределение веса в группе “Боль” составило 80.75 ± 1 : 19.25 ± 1%, т.е. сохранилась тенденция к перераспределению веса на неповрежденную конечность. При использовании ПЭА установлено, что выраженность асимметрии при нагрузке на задние конечности достоверно отличается от животных группы “Боль” на всех этапах наблюдения. Животные в группе “Боль + ПЭА” в течение всего срока наблюдения демонстрировали более симметричные показатели в пределах – 60.36 ± 1 : 39.64 ± 1% (рис. 1в).
Пальмитоилэтаноламид снижает общую глиальную активность в спинальных центрах регуляции болевого синдрома
Спинномозговые ганглии. При перевязке седалищного нерва у животных группы “Боль” количество сателлитных клеток окрашенных толуидиновым синим в ипсилатеральных ганглиях увеличивается, они начинают располагаться в 2–3 слоя вокруг нейронов всех калибров. В группе “Боль” количество клеток-сателлитов нейронов больших, средних и малых размеров возрастает соответственно в 1.64; 1.79 и 2.5 раза по сравнению с ложнооперированными животными. В спинальных ганглиях животных группы “Боль + ПЭА” клетки-сателлиты располагаются в 1–2 слоя, характер взаимодействия их с нейронами после перевязки седалищного нерва практически не отличается от соответствующих показателей в группе “ЛО”. Количество клеток-сателлитов у животных, получающих ПЭА достоверно не отличается от ложнооперировнных животных (рис. 2д, е).
Рис. 2.
Морфо-химические изменения в спинномозговых ганглиях при развитии болевой реакции и действии ПЭА. а – иммунопероксидазная реакция в ганглиях на маркер сателлитной глии (GFAP), микроглии/макрофагов (Iba-1) и нейрональную форму NO-синтазы (nNOS). Площадь иммунопозитивного окрашивания GFAP (б), Iba-1 (в), и количества nNOS-позитивных нейронов (г). Характеристика нейро-глиального индекса для нейронов разного калибра (д, е). Данные представлены как среднее значение ± SEM, * p < 0.05, *** p < 0.001.

Кроме того, травма периферического нерва сопровождается изменением площади распределения клеток сателлитов спинальных ганглиев. Наиболее значительные изменения регистрируются в группе “Боль”, плотность распределения GFAP-позитивных клеток в спинномозговых ганглиях увеличивается в 3.4 раза, по сравнению с группой ложнооперированных животных. В группе “Боль + ПЭА” процент площади GFAP-позитивных клеток достоверно не отличается от группы “ЛО” (рис. 2 а, б).
Изменение активности селективного маркера микроглии/макрофагов (Iba-1), вызванное повреждением периферического нерва, было выявлено в спинальных ганглиях животных всех исследуемых групп. У ложнооперированных животных микроглиальные/макрофагальные клетки встречаются редко – единичные элементы веретеновидной формы с 2–3 первичными отростками располагаются вблизи от перикарионов псевдоуниполяров (рис. 2а). Повреждение периферического нерва сопровождается увеличением популяции микроглии/макрофагов, наиболее выраженное у животных группы “Боль” в ганглиях испилатеральной стороны. Количественная оценка иммуногистохимической активности микроглиального/макрофагального маркера в спинальных ганглиях животных группы “Боль” демонстрирует значительное увеличение площади окрашивания (в 4.6 раз по сравнению с группой “ЛО”). В группе “Боль + + ПЭА” активация микроглии/макрофагов также наблюдается, хотя и имеет не столь выраженный характер. В данной группе площадь окрашивания Iba-1-позитивной микроглии/макрофагов спинальных ганглиев увеличивается в 1,92 раза по сравнению с ложнооперированными животными (рис. 2в).
Поверхностные пластины задних рогов спинного мозга. Активность GFAP-позитивных астроцитов существенно возрастает в поверхностных пластинах задних рогов спинного мозга и имеет наибольшую плотность в группе “Боль”, применение препарата ПЭА способствует снижению плотности распределения астроцитов более чем в 2 раза (“ЛО” – 4.2%, “Боль” – 19.1%, “Боль + ПЭА” – 8.75%) (рис. 3а, б).
Рис. 3.
Морфо-химические изменения в задних рогах спинного мозга при развитии болевой реакции и действии ПЭА. а – иммунопероксидазная реакция в поверхностных пластинах спинного мозга на маркер астроглии (GFAP), микроглии (Iba-1) и нейрональную форму NO-синтазы (nNOS). Площадь иммунопозитивного окрашивания GFAP (б), Iba-1 (в), и количества nNOS-позитивных нейронов (г). Данные представлены как среднее значение ± SEM, *** p < 0.001.

В поверхностных пластинах задних рогов спинного мозга после перевязки седалищного нерва наблюдается увеличение площади окрашивания Iba1-позитивной микроглии. Это состояние регистрируется вплоть до 14-х суток после операции и в целом соответствует уровню болевой реакции по тестируемым параметрам. В случае ложнооперированных животных, иммунопозитивные клетки встречались относительно редко как в передних, так и в задних рогах спинного и представляли собой единичные веретенообразные элементы с 2–3 первичными отростками, расположенными вблизи нейрональной сомы. Активация микроглии характеризуется специфическим изменением морфологии – ретракция отростков и гипертрофия клеточных тел, а также приобретением амебовидной формы, допускающей миграцию клеток к очагу воспаления (рис. 3а). Количественная оценка маркера микроглии в задних рогах спинного мозга животных в группе “Боль” показала значительное увеличение площади окрашивания (в более чем 4 раза по сравнению с группой “ЛО”). Увеличение площади окрашивания iba-1-позитивной микроглии также наблюдалось в задних рогах спинного мозга крыс в группе “Боль + + ПЭА”, но была значительно менее выражена (в 2 раза по сравнению с группой “ЛО”) (рис. 3в).
Пальмитоилэтаноламид способствует снижению экспрессии nNOS на уровне первых двух звеньев ноцицептивных проводящих путей
На препаратах спинальных ганглиев ложнооперированных животных количество nNOS-позитивных нейронов составляет лишь малую долю от общей популяции клеток. При развитии нейропатической боли наблюдается увеличение количества иммунореактивных нейронов всех размеров. Количество nNOS-позитивных нейронов в группе “Боль” увеличивается в 3.4 раза по сравнению с группой ложнооперированных животных. В группе “Боль + ПЭА” отсутствуют достоверные отличия количества nNOS-позитивных нейронов от группы “ЛО” (рис. 2 а, г).
Кроме того, результаты иммуногистохимического исследования показывают более высокую продукцию оксида азота в задних рогах спинного мозга травмированных крыс (“Боль” – 5086.6 клеток/мм3) по сравнению с ложнооперированной группой животных (“ЛО” – 4060.1 клеток/мм3), а также достоверное снижение экспрессии nNOS-позитивных нейронов в группе “Боль + ПЭА” (4234.6 клеток/мм3) до уровня группы “ЛО” (рис. 3а, г).
Противовоспалительная активность пальмитоилэтаноламида в культуре клеток микроглии
Для оценки влияния ПЭА на уровень фермента его деградации (ASAHL/NAAA) были использованы средние значения каждой группы, предварительно нормализованные по β-актину. Методом вестерн-блоттинга было выявлено, что добавление ПЭА в концентрации 10 мкМ в клеточную среду к микроглии сопровождается двукратным увеличением синтеза фермента ASAHL (рис. 4а).
Рис. 4.
(а) Вестерн–блоттинг культуры клеток микроглии на фермент ASAHL при добавлении ПЭА (10 мкМ). (б) Вестерн-блоттинг культуры клеток микроглии на противовоспалительные маркеры (CD206, IL10) при добавлении ПЭА в возрастающей концентрации (0.1, 1, 10 мкМ). Иммуноферментный анализ культуры клеток микроглии на TNFα (в), СD86 (г), MHC II (д), при ЛПС-индуцированном и добавлении ПЭА (10 мкМ). Данные представлены как среднее значение ± SEM, * p < 0.05, ** p < 0.001, *** p < 0.001.

Результаты вестерн-блоттинга культуры клеток микроглии также демонстрируют прямую зависимость между экспрессией IL10 и увеличением концентрации ПЭА в среде. Максимальная количество белка в данном случае соответствует максимальной концентрации ПЭА – 10 мкМ. Аналогичная динамика прослеживается также для маркера маннозных рецепторов (СD206), которые экспрессируются преимущественно на противовоспалительных макрофагах (рис. 4б).
Результаты иммуноферментного анализа культуры клеток микроглии демонстрируют повышение уровней провоспалительных маркеров: TNFα, CD86 и MHC II при действии ЛПС (1 мкг/мл) на 15–20% по сравнению с контролем, и их снижение до контрольных значений при применении ПЭА (рис. 4в–д).
ОБСУЖДЕНИЕ
Перевязка седалищного нерва ведет к развитию нейропатического болевого синдрома, активность которого может быть количественно охарактеризована с помощью инструментальных тестов. При развитии нейропатической боли порог температурной болевой чувствительности снижается уже в первые сутки и сохраняется на данном уровне вплоть до конца эксперимента. Несимметричное использование задних конечностей̆ в удержании веса также было выражено с первых суток, и вплоть до конца наблюдения не возвращалось к уровню интактного контроля. Использованные в исследовании тесты болевого поведения считаются характеристикой̆, собственно, ноцицептивных систем (тест холодной и горячей пластины), а также отражают глубину моторной дисфункции (тест инвалидности), поскольку повреждeнный̆ седалищный̆ нерв содержит не только сенсорные, но и двигательные волокна [16]. Результаты тестирования животных, получающих препарат ПЭА свидетельствуют о наличии анальгетического действия, проявляющегося как снижением интенсивности ноцицептивных реакций в ответ на температурный стимул, так и меньшей степенью моторной дисфункции, поэтому последующую оценку клеточной активности методом иммуногистохимии проводили на уровне первых двух звеньев ноцицептивных проводящих путей (задние рога спинного мозга и спинномозговые ганглии).
Развитие нейропатического болевого синдрома приводит к динамическому и согласованному с выраженностью болевого поведения изменению количества nNOS-позитивных нейронов первичных переключательных станций (спинномозговых ганглиев и задних рогов спинного мозга). Это явление неоднократно описано в литературе на различных экспериментальных моделях [17], и наши данные в целом соответствуют существующим экспериментальным и клиническим наблюдениям. Динамика NO-ергической активности в спинальных центрах боли протекает параллельно с активацией̆ глии в данных структурах мозга. Локальная глиальная активность обеспечивает развитие процесса нейровоспаления, поддерживающего трансмиссию болевого сигнала [18]. В настоящем исследовании, увеличение площади окрашивания микро- и астроглии при развитии нейропатической боли характеризуется специфическим изменением морфологии (ретракция отростков и гипертрофия клеточных тел), также клетки приобретают амебовидную форму, которая позволяет им мигрировать к очагу воспаления. Кроме того, в спинномозговых ганглиях у животных группы “Боль” изменение нейро-глиального индекса присутствует у нейронов всех размерных групп и происходит как за счет увеличения количества клеток-сателлитов, так и увеличения их слоев вокруг крупных и средних нейронов. Предполагается, что прирост популяции клеток-сателлитов возникает не только вследствие их пролиферации, но и за счет клеток-сателлитов соседних погибших нейронов [19]. В этой связи нельзя исключать прямых взаимомодулирующих влияний спинальной глии и NO-ергических ноцицептивных нейронов; вероятно, что выраженность активации микро- и астроглии определяется эффективностью NO-ергической нейротрасмиссии. Так, при использовании различных анальгетических препаратов, направленных на снижение термической и механической аллодинии, вызванной нейропатической болью, показано, что наряду с уменьшением выраженности поведенческих проявлений болевого синдрома наблюдается синхронное уменьшение уровня экспрессии нейрональной и индуцибельной NO-синтазы и снижение активации глии в спинальных ганглиях и задних рогах спинного мозга [20–23]. Кроме того, Meller с коллегами [24] доказали взаимосвязь между усилением продукции оксида азота и увеличением концентрации провоспалительных молекул в месте повреждения. Введение либо интерлейкина IL1β и TNFα, либо эндотоксина (ЛПС) индуцировало экспрессию NO-синтазы в резидентных клетках ЦНС in vitro. А использование избирательных ингибиторов NO-синтазы in vivo, приводит к снижению гипералгезии. Также инъекция провоспалительных цитокинов индуцировала воспалительный ответ в спинном мозге, что способствовало усилению регуляции NO-синтазы в экзогенных воспалительных клетках [25].
В настоящем исследовании выраженность нейровоспалительного процесса и NO-ергической нейротрансмиссии, как показывают результаты морфометрического анализа, достоверно снижается в спинном мозге и спинальных ганглиях животных, получающих ПЭА. Пальмитоилэтаноламид является агонистом рецептора, активируемого пролифератором пероксисом-альфа (PPAR-α), который являются фактором транскрипции в суперсемействе ядерных рецепторов. Активация PPAR-α приводит к изменению транскрипции большого количества генов, начиная от тех, которые кодируют белки, участвующие в транспорте и метаболизме жирных кислот, и заканчивая теми, которые кодируют провоспалительные молекулы и окислительный стресс [26]. Противовоспалительные эффекты агонистов PPAR-α включают трансрепрессию провоспалительных факторов транскрипции, таких как NFκB, что приводит к ингибированию высвобождения провоспалительных цитокинов (TNFα, IL1β и IL6) [27]. Более того, полученные нами данные в экспериментах in vivo подтверждаются результатами как вестерн-блоттинга, так и иммуноферментного анализа культуры клеток микроглии. Добавление ПЭА приводит к ингибированию ЛПС-индуцированной выработки провоспалительных молекул: TNFα, MHC II и маркера клеточной поверхности провоспалительной микроглии CD86, а также индуцирует усиление экспрессии противоспалительных молекул: IL10 и маркера противовоспалительной микроглии CD206, что на физиологическом уровне влечет за собой снижение интенсивности воспаления и, следовательно, интенсивности болевого синдрома. Фермент NAAA/ASAHL, идентифицированный относительно недавно и способный гидролизовать ПЭА более эффективно, чем анандамид и другие N-ацетилэтаноламиды [28] экспрессируется главным образом макрофагами и, как предполагается, в этих же клетках происходит его разрушение [29]. Тот факт, что обработка микроглиальных клеток препаратом ПЭА сопровождается увеличением активности ASAHL, подтверждает его метаболизм данным типом клеток в используемой форме, и косвенно подтверждает гипотезу, что экзогенный ПЭА способен метаболизироваться глиальными клетками, находящимися как на уровне ганглиев, так и на уровне спинного мозга.
Таким образом, результаты физиологического тестирования, последующее иммуногистохимические исследования и параллельный анализ культуры микроглиальных клеток не противоречат друг другу и указывают на возможность ПЭА к реализации анальгетического действия за счет глиального, и нейронального компонента как на уровне периферической (спинномозговые ганглии), так и на уровне центральной (спинной мозг) нервной системы.
Список литературы
Berker A.B., Beyer C., Zuloff-Shani A., Brener E., Bloch M.H. // Pain Physician. 2017. V. 20. P. 353–362.
Amor S., Woodroofe N. // Immunology. 2014. V. 141. P. 287–291.
Muthuraju S., Karuppan Z.R., Al-Rahbi B. // BioMed Research Int. 2020. V. 2020. 9231452.
Subhramanyam C.S., Wang C., Hu Q., Dheen S.T. // Semin Cell Dev Biol. 2019. V. 94. P. 112–120.
Watson J.C., Sandroni P. // Mayo Clinic proceedings. 2016. V. 91. P. 372–385.
Matta S.M., Hill-Yardin E.L., Crack P.J. // Brain Behav. Immun. 2019. V. 79 P. 75–90.
Leonard P.A., O’Donnell J., Wilson K. // Emerg Med J. 2001. V. 18. P. 316.
Obata K., Sato J., Funakubo M., Mizumura K. // International Journal of Biometeorology. 2010. V. 55. P. 319–326
Schetters S.T.T., Vallejo D.J.J., Van Kooyk Y. // Front. Immunol. 2018. V. 8. P. 1905.
Chung M.K., Campbell J.N. // Pharmaceuticals (Basel). 2016. V. 9. P. 66.
Bronzuoli M.R., Facchinetti R., Steardo L., Romano A., Stecca C., Passarella S., Steardo L., Cassano T., Scuderi C. // Oxid Med Cell Longev 2018. V. 2018. 4720532.
Beggiato S., Tomasini M.C., Ferraro L. // Front Pharmacol. 2019. V. 10. P. 821.
Mattace R.G., Russo R., Calignano A., Meli R. // Pharmacol Res. 2014. V. 86. P. 32–41.
Petrosino S., Di Marzo V. // Br J Pharmacol. 2017. V. 174. P. 1349–1365.
Petrosino S., Puigdemont A., Della Valle M.F., Fusco M., Verde R., Allarà M., Aveta T., Orlando P., Di Marzo V. // Vet J. 2016. V. 207. P. 85–91
Jasmin L., Kohan L., Franssen M., Janni G., Goff J.R. // Pain. 1998. V. 75. P. 367–82.
Costigan M., Scholz J., Woolf C.J. // Annu Rev Neurosci. 2009. V. 32. P. 1–32.
Mika J., Osikowicz M., Rojewska E. // Eur. J. Pharm. 2009. V. 623. P. 65–72.
Ройтбак А.И. // Санкт-Петербург: Наука. 1993. –352 с.
Kuboyama K., Tsuda M., Tsutsui M., Toyohara Y., Tozaki-Saitoh H., Shimokawa H., Yanagihara N., Inoue K. // Mol Pain. 2011. V. 7. P. 50.
Arakawa Y., Qin J., Chou H., Bhatt S., Wang L., Stuehr D., Ghosh A., Fung J.J., Lu L., Qian S. // Transplantation. 2014. V. 97. P. 740–747.
Liu C.P., Dai Z.K., Huang C.H., Yeh J.L., Wu B.N., Wu J.R., Chen I.J. // Kaohsiung J Med Sci. 2014. V. 6. P. 267–78.
Liu X., Wang D., Zhao R., Dong X., Hu Y., Liu P. // Front Pharmacol. 2016. V. 7. P. 337.
Meller S.T., Cummings C.P., Traub R.J., Gebhart G.F. // Neuroscience. 1994 V. 60. P. 367–374.
Rothwell N.J., Hopkins S.J. // Trends Neurosci. 1995. V. 3. P. 130–136
Bougarne N., Weyers B., Desmet S.J., Deckers J., Ray D.W., Staels B., De Bosscher K. // Endocr Rev. 2018. V. 39. P. 760–802.
Wójtowicz S., Strosznajder A.K., Jeżyna M., Strosznajder J.B. // Neurochem Res. 2020. V. 45. P. 972–988.
Tsuboi K., Sun Y.X., Okamoto Y., Araki N., Tonai T., Ueda N. // J Biol Chem. 2005 V. 280. P. 11082–11092.
Sun Y.X., Tsuboi K., Zhao L.Y., Okamoto Y., Lambert D.M., Ueda N. // Biochim Biophys Acta. 2005. V. 1736. P. 211–220.
Дополнительные материалы отсутствуют.


