Нейрохимия, 2022, T. 39, № 3, стр. 279-287
Ранний провоспалительный стресс влияет на социальное поведение взрослых крыс: эффекты пола и базового уровня интерлейкина 1-бета в крови
Н. Д. Брошевицкая 1, И. В. Павлова 1, М. И. Зайченко 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
Поступила в редакцию 24.02.2022
После доработки 25.02.2022
Принята к публикации 03.03.2022
- EDN: IKMJCV
- DOI: 10.31857/S1027813322030025
Аннотация
Исследовали влияние активации иммунной системы в раннем онтогенезе (введение липополисахарида, ЛПС, на 3 и 5 день после рождения в дозе 50 мкг/кг) на различные аспекты социального поведения взрослых крыс самцов и самок: социальное взаимодействие и доминирование. Поведение крыс сопоставляли с уровнем кортикостерона и интерлейкина 1-β в сыворотке крови, взятой до начала тестирования. У самцов ЛПС группы по сравнению с контролем увеличивалось время взаимодействия в тесте на социальное взаимодействие, а также возрастала доля побед в тесте на социальное доминирование в трубе. Для победителей в тесте в трубе был характерен более высокий базовый уровень интерлейкина 1-β в сыворотке крови. У самок не наблюдалось изменений в социальном поведении после введения ЛПС в раннем онтогенезе. Полученные результаты свидетельствуют о влиянии раннего провоспалительного стресса на социальное поведение взрослых крыс самцов (но не самок) и ассоциации изменений поведения с базовым уровнем интерлейкина 1-β.
ВВЕДЕНИЕ
Известно, что стресс в раннем онтогенезе может оказать влияние на поведение взрослых особей и привести к серьезным нарушениям нормального развития гипоталамо-гипофизарно-надпочечниковой, иммунной и других систем организма [1–5]. В результате субъекты, перенесшие такой стресс, приобретают предрасположенность к развитию целого ряда психоневрологических заболеваний: депрессии, тревожным расстройствам, шизофрении, синдрому гиперактивности и дефициту внимания, симптомы которых могут проявляться уже во взрослой жизни, после повторного столкновения с негативными воздействиями. В экспериментах на животных в качестве модели раннего стресса часто используется нейровоспаление, вызываемое инъекцией бактериального липополисахарида (ЛПС), являющегося составным компонентом внешней части мембраны грамотрицательных бактерий и введение которого приводит к высвобождению большого числа эндогенных провоспалительных медиаторов (цитокины, хемокины и др.) [6]. В настоящее время изучено влияние введения ЛПС в раннем онтогенезе на уровень тревожности, депрессивное поведение, а также на выработку и угашение различных видов оборонительных условных рефлексов [4, 7, 8]. Данные о влиянии раннего провоспалительного стресса на социальное поведение немногочисленны. Постнатальное системное введение ЛПС (на 3-й и 5-й постнатальные дни) либо не влияло на социальное взаимодействие [1], либо приводило к уменьшению времени социальных контактов у взрослых животных [9]. Однако в последующих работах более детальный анализ показал, что снижение социального взаимодействия происходило за счет контактов, направленных к животному с введением ЛПС [10]. В опытах с разрушением обонятельного эпителия было показано, что аверсию вызывал запах, исходящий от крыс ЛПС группы. В работах с ранним постнатальным введением ЛПС непосредственно в гиппокамп [11], было показано, что у взрослых крыс наблюдали дефициты в социальном поведении, ухудшение распознавания нового объекта, нарушение предимпульсного торможения и рост числа активной микроглии.
Таким образом, следует признать, что вопрос о влиянии раннего постнатального провоспалительного стресса на социальное поведение изучен недостаточно, в частности нет данных о влиянии на социальную мотивацию и социальное доминирование. Вместе с тем, актуальность данной проблемы велика, поскольку известно, что хроническое введение ЛПС матери на разных сроках беременности (пренатальное введение) может приводить к существенным нарушениям социального поведения, а именно к расстройствам аутистического спектра [12–16] и появлению симптомов шизофреноподобных отклонений [17]. Вместе с тем, в литературе имеются данные о влиянии иммунной системы на социальное поведение, в частности на агрессию [18, 19]. На линиях высоко- и низкоагрессивных животных было показано, что высокие уровни провоспалительных цитокинов коррелировали с высоким уровнем агрессии [20, 21]. Похожие данные были получены и при исследовании пациентов с депрессией, которые демонстрировали повышенную агрессивность и высокий уровень провоспалительных цитокинов [22]. На основании этих данных можно было предположить, что ранний провоспалительный стресс будет приводить к изменениям социального поведения.
Целью нашей работы стало исследование влияния раннего постнатального провоспалительного стресса на такие аспекты социального поведения взрослых крыс линии Вистар, как социальное доминирование и социальное взаимодействие. В задачи нашей работы входило: 1) подготовить экспериментальные групп животных, что включало в себя введение бактериального липополисахарида (группа ЛПС, 50 мкг/кг), либо физиологического раствора (группа ФИЗ, контроль) крысятам на 3-й и 5-й день от рождения; 2) у взрослых крыс в группах ЛПС и ФИЗ сопоставить социальное взаимодействие в двухкамерном тесте, социальное доминирование в тесте в трубе; 3) сопоставить влияние провоспалительного стресса на социальное поведение самцов и самок; 4) провести биохимический анализ сыворотки крови на кортикостерон и интерлейкин-1β и сопоставить результаты с поведением крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. В опытах участвовало 102 крысы линии Вистар в возрасте от 2.5 до 5.5 месяцев (58 самцов и 44 самки). Крысята (20 пометов) были выведены в виварии ИВНД и НФ от родителей, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА, Россия. На 3-й и 5-й день от рождения у половины крысят из помета вызывали провоспалительный стресс путем введения бактериального липополисахарида (ЛПС, от Echerichia coli, серотип О26:В6, Sigma) в дозе 50 мкг/кг в объеме 10 мкл/г (группа ЛПС, всего 61 крысенок). Во время этой процедуры крысята отлучались от матери на 15–20 мин. Они взвешивались на электронных весах с точностью до 0.01 г и получали подкожную инъекцию ЛПС в холку с помощью инсулинового шприца. Крысята группы ЛПС дополнительно метились с помощью подкожного введения у основания хвоста 10 мкл черной краски (фирма Dynamic Color, цвет Triple Black), используемой для татуировок у людей. Другой половине крысят из помета в этом же возрасте подкожно вводили физиологический раствор в объеме 10 мкл/г (группа ФИЗ, контроль, всего 41 крысенок). При разделении пометов старались уравнять число самцов и самок в группах ЛПС и ФИЗ. Разделение пометов делалось с целью ослабить влияние генетического фактора на результаты экспериментов. В возрасте 25 дней крысят отлучали от матери, и формировали клетки таким образом, что в одной клетке содержались 4–5 крысы одного пола из 2–3 пометов из одной группы (либо ЛПС, либо ФИЗ). В дальнейшем животных содержали в виварии при обычном 12-часовом световом режиме в свободном доступе к воде и стандартному корму. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU) и положения ИВНД и НФ РАН о работе с экспериментальными животными.
Иммуноферментный анализ крови. Забор крови проводили у крыс в возрасте 80 дней до начала проведения поведенческих тестов. Для этого крыс наркотизировали с помощью изофлуранового ингаляционного наркоза (Аэрран), на кончике хвоста делали косые надрезы скальпелем и собирали периферическую кровь в объеме 0.7–1 мл в микропробирки с ранее добавленным гепарином (10 µл). Затем кровь центрифугировали 15 мин при 1500 g для получения сыворотки и отбирали аликвоты объемом 50 и 150 µл. Аликвоты сыворотки хранили при –80°С до проведения иммуноферментного анализа.
Для определения уровня кортикостерона в сыворотке крови использовали наборы для иммуноферментного анализа (DRG, Германия), с помощью которых детектировали как свободный, так и связанный с транспортными белками кортикостерон методом конкурентного иммуноферментного анализа. Содержание провоспалительного интерлейкина-1β (ИЛ-1β) в сыворотке крови определяли с помощью наборов производства R&D Systems (США) согласно инструкции производителя. При дальнейшей статистической обработке из выборки исключали экстремумы.
Тестирование социального взаимодействия проводили в возрасте 100 дней в квадратном открытом поле (100 × 100 × 30 см), где около одной из стенок, посередине располагался пластиковый отсек (21 × 21 × 14 см) с перфорированными стенками. Тест проводился в течение двух дней: в первый день внутренний отсек был пустой, во второй день в отсек заранее помещали интактную незнакомую крысу-гостя одного пола и возраста с исследуемой крысой. Поведение крысы регистрировали в течение 5-ти минут. Перед помещением в камеру животного другого пола кроме обычной влажной и сухой уборки лабиринт протирали 20% раствором этилового спирта. Самцы и самки тестировались в разные дни, и для переноски самцов и самок из вивария в экспериментальную комнату использовали разные клетки. Для регистрации поведения крыс использовали программы Etho Vision и Mediocruser. Анализировали время нахождения крысы в зоне взаимодействия (коридор шириной 13 см около внутреннего отсека), число и длительность взаимодействий (нос крысы вблизи стенки внутреннего отсека), пройденную дистанцию в зоне взаимодействия. Рассчитывали коэффициент времени взаимодействия КВ = = Тв2/Тв1 × 100%, где Тв2 – время взаимодействия во второй, Тв1 – в первый опыт. Такой же коэффициент рассчитывали по времени пребывания в зоне взаимодействия КЗВ = ТЗВ2/ТЗВ1 × 100%, где ТЗВ2 – время пребывания в зоне взаимодействия во второй опыт, Тзв1 – в первый опыт.
Социальное доминирование оценивали в возрасте 110 дней при помощи тестирования в трубе из прозрачного оргстекла длиной 150 см и внутреннего диаметра 6 см. Эксперимент проводили в течение двух дней: в первый день животные исследовали новую обстановку и проходили по трубе в обоих направлениях, во второй проводили само тестирование. За день до начала эксперимента крыс взвешивали и формировали однополые пары так, чтобы одна крыса была из ФИЗ группы, другая из ЛПС группы, а вес у животных в паре не отличался более чем на 10 г. Во время тестирования крыс одновременно запускали с разных концов трубы, чтобы животные двигались друг-другу на встречу. “Победителем” считали то животное, которое смогло оттеснить оппонента назад и выйти с противоположного конца трубы. У каждой пары было две попытки, при этом каждую крысу запускали с разных концов трубы. Если в течение 2 мин не выявлялся “победитель”, считали, что ничья. Поведение регистрировали на цифровую видеокамеру Logitech C270 HD Webcam. Анализировали число и латентность побед у крыс в группе ФИЗ и ЛПС.
Статистическая обработка результатов. Для вторичной обработки результатов использовали стандартную программу STATISTICA 8.0. Распределение исследованных параметров было проверено на нормальность по критерию Колмогорова-Смирнова (Basic Statistics, раздел Descriptive Statistics). Если анализируемый параметр удовлетворял данному критерию, то при сравнении групп крыс использовали дисперсионный анализ ANOVA, раздел factorial ANOVA и Repeated measures ANOVA. При post-hoc анализе применяли критерий Newman–Keuls test. Различия считали статистически значимыми при р < 0.05, отмечали наличие тенденции при 0.05 ≤ р < 0.1. Во всех экспериментах анализировали влияние факторов ПОЛ, ГРУППА, в ряде случаев еще № теста. Для определения корреляционных связей между различными поведенческими показателями или между показателем поведения и уровнем кортикостерона/ИЛ-1β строили корреляционные матрицы и рассчитывали коэффициенты корреляции (Basic Statistics). При отсутствии нормальности распределения поведенческих параметров использовали непараметрические методы анализа. При сравнении двух групп применяли Mann–Whitney U Test. При сравнении двух выборочных долей вариант использовали 2 × 2 Table (Nonparametric Statistics), применяли критерий χ2. Данные на рисунках представлены в виде средних значений ± ошибки средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Тест социального взаимодействия. Сопоставление поведения крыс в Тесте 1 (без крысы-гостя) и Теста 2 (с гостем во внутреннем отсеке) с помощью Repeated measures ANOVA выявило существенное влияние фактора № теста на время взаимодействия, время нахождения в зоне взаимодействия и пройденную дистанцию в зоне взаимодействия (табл. 1). Значения всех указанных показателей увеличивались в Тесте 2 по сравнению с Тестом 1 во всех группах, как у самцов, так и самок, что свидетельствовало о наличии социальной мотивации (рис. 1а, в, д). Фактор ПОЛ оказывал влияние на время взаимодействия и дистанцию в зоне взаимодействия (табл. 1), также наблюдалось взаимодействие факторов ПОЛ и № теста, у самок дистанция в зоне взаимодействия и время взаимодействия в тесте 2 были больше (рис. 1д), чем у самцов. Было обнаружено взаимодействие факторов № теста, ГРУППА и ПОЛ во влиянии на время взаимодействия (табл. 1). Post hoc анализ показал (рис. 1а), что в Тесте 2 у самцов группы ЛПС время взаимодействия было больше, чем в группе ФИЗ. Время нахождения в зоне взаимодействия в Тесте 1 было меньше у самцов из ЛПС группы (рис. 1в). Сопоставление коэффициентов времени взаимодействия (рис. 1б), а также коэффициентов времени пребывания в зоне взаимодействия (рис. 2г), показало, что у самцов ЛПС группы коэффициенты были больше (Mann–Whitney U Test, U = 178, р = 0.002; Mann–Whitney U Test, U = 226, р = 0.017 соответственно), чем у группы ФИЗ. У самок различий в коэффициентах взаимодействия не было обнаружено в группах ФИЗ и ЛПС. Полученные данные свидетельствуют о том, что ранний провоспалительный стресс оказал влияние на социальное взаимодействие только у самцов и привел к увеличению мотивации к взаимодействию.
Таблица 1.
Значения F и р при анализе с помощью Repeated measures ANOVA показателей поведения в тесте на социальное взаимодействие
| Показатель | Факторы | |||||
|---|---|---|---|---|---|---|
| ПОЛ | № теста | ГРУППА | № теста × × ПОЛ | № теста × × ГРУППА | № теста × × ГРУППА × × ПОЛ | |
| Время взаимодействия | F1,88 = 7.19, p = 0.009 | F1,88 = 219.26, p = 0.000 | – | F1,88 = 4.62, p = 0.034 | F1,88 = 5.56, p=0.021 | F1,88 = 4.75, p = 0.032 |
| Время в зоне взаимодействия | – | F1,88 = 130.78, p = 0.000 | – | F1,88 = 7.13, p = 0.009 | F1,88 = 8.86, p = 0.004 | – |
| Дистанция в зоне взаимодействия | F1,88 = 23.43, p = 0.000 | F1,88 = 130.97, p = 0.0000 | – | F1,88 = 23.54, p = 0.000 | – | – |
Рис. 1.
Влияние раннего постнатального введения ЛПС на поведение взрослых крыс в тесте на социальное взаимодействие. ФИЗ – животные с введением физиологического раствора, ЛПС – крысы с введением ЛПС. Тест 1 – без крысы-гостя во внутреннем отсеке камеры. Тест 2 – с крысой-гостем. n – число крыс в группе (Самцы/Самки). ↑ – увеличение (р < 0.05) значений показателя поведения в Тесте 2 по сравнению с Тестом 1, * статистичеcки значимые различия (р < 0.05) между группой ЛПС и ФИЗ (на а, в, д – Repeated measures ANOVA, post hoc анализ, на б и г – критерий Mann-Whitney U Test). n – число крыс самцы/самки.

Рис. 2.
Влияние раннего постнатального введения ЛПС на поведение взрослых крыс в тесте на социальное доминирование в трубе. n – число попыток. * Статистичеcки значимые различия (р < 0.05) между группой ЛПС и ФИЗ (критерий χ2, 2 × 2 Table, Nonparametric Statistics). Остальные обозначения как на рис. 1.

Тест социального доминирования в трубе. Доля попыток, увенчавшихся победой, у самцов ЛПС группы была больше (0.65, χ2 = 13.79, р = 0.0002, 2 × 2 Table, критерий χ2), чем у самцов группы ФИЗ группы (0.35). У самок не было различий в числе победителей из ЛПС и ФИЗ групп (рис. 2а). Не было обнаружено различий в латентности “побед” у крыс группы ФИЗ и ЛПС (рис. 2б). Таким образом, ранний провоспалительный стресс увеличивал социальное доминирование только у самцов, не влияя на самок.
При сопоставлении результатов тестов социального взаимодействия и социального доминирования у самцов была обнаружена слабая, но статистически значимая положительная корреляция между числом побед в трубе и длительностью социального взаимодействия в Тесте 2 (r = 0.291, p = 0.033), что может говорить о высокой социальной мотивации у доминантных самцов. У самок не было обнаружено статистически значимой корреляции между данными показателями (r = –0.182, p = 0.275).
Сопоставление показателей социального поведения и биохимии крови. На рис. 3а и б представлены результаты сопоставления поведения в тесте на социальное доминирование и уровня кортикотерона и ИЛ-1β в сыворотке крови. На уровень интерлейкина оказывал влияние фактор ПОЛ (F1,51 = 13.78, p = 0.001, Repeated measures ANOVA), у самцов уровень интерлейкина был выше, также наблюдалось взаимодействие фактора ПОЛ и ПОБЕДА (F1,51 = 7.82, p = 0.007). Post hoc анализ показал, что уровень интерлейкина-1β был выше у самцов-победителей по сравнению с самцами-проигравшими (рис. 3а). У самок не наблюдалось различий в уровне интерлейкина-1β у проигравших и победителей (рис. 3а). На уровень кортикостерона оказывал влияние фактор ПОЛ (F1,85 = 133.37, p = 0.000). Уровень кортикостерона у самок был выше по сравнению с самцами. Post hoc анализ показал, что у победителей и побежденных не наблюдалось различий по уровню кортикостерона, как у самцов, так и самок (рис. 3б). Таким образом, для доминантных самцов характерен высокий уровень интерлейкина-1β.
Рис. 3.
Сопоставление уровня кортикостерона или ИЛ-1β в сыворотке крови у победителей и побежденных в тесте в трубе. * Cтатистически значимые различия между победителями и проигравшими (Factorial ANOVA, post hoc анализ).

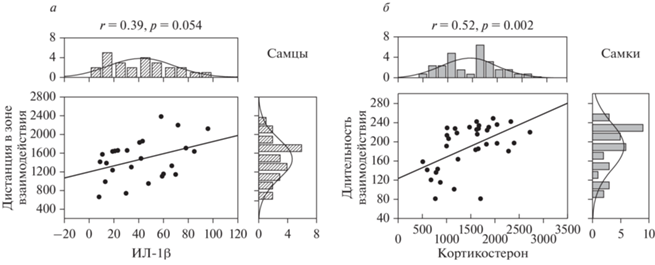
На рис. 4а и б представлены результаты корреляционного анализа между показателями поведения в Тесте 2 на социальное взаимодействие и уровнем кортикостерона и ИЛ-1β в сыворотке крови. У самок была обнаружена статистически значимая положительная корреляция между длительностью взаимодействия в Тесте 2 и уровнем кортикостерона (r = 0.52, p = 0.002). У самцов была обнаружена тенденция к положительной корреляции между уровнем ИЛ-1β и дистанцией в зоне взаимодействия в тесте 2 на социальное взаимодействие (r = 0.39, p = 0.054). Таким образом, высокая социальная мотивация коррелировала у самок с высоким уровнем кортикостерона, а у самцов – с высоким уровнем ИЛ-1β.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашей работе впервые было показано, что введение ЛПС на ранних сроках постнатального развития приводит к увеличению социального доминирования у взрослых крыс самцов в тесте в трубе. Ранее увеличение социального доминирования наряду с увеличением агрессивного поведения наблюдали в модели депрессии, создаваемой с помощью хронического непредсказуемого стресса средней силы во взрослом возрасте [23], или в биохимической модели депрессии, вызываемой с помощью диеты с низким уровнем триптофана [24]. Травмы мозга в подростковом возрасте [25] также могли приводить к увеличению социального доминирования. Вместе с тем, содержание в обогащенной среде [26], частое использование бегового колеса [27], хроническая боль [28], хронический стресс обездвижения [29], наоборот, были способны делать крыс более подчиненными в тесте в трубе. Необходимо отметить, что тест на социальное доминирование в трубе в настоящее время используется достаточно широко у грызунов, как в работах на крысах, так и мышах, при этом часто проводится сопоставление результатов с другими тестами на социальную доминантность (конкурентный поиск пищи, предпочтение при спаривании, тест теплого места, маркировка территории мочой и др.) [26, 30]. Считается, что тест на доминирование в трубе определяет территориальное доминирование, но не учитывает агрессию и может использоваться у животных, живущих группами [31]. Анализ нейронных механизмов социальной иерархии приводит к выводу о роли префронтальной коры в качестве центрального регулятора [32]. Анализ транскриптома в медиальной префронтальной коре обнаружил различия в экспрессии определенных генов у доминантов и подчиненных [31], в частности различалась экспрессия вомероназальных и обонятельных рецепторов в коре мозга. Авторы приходят к выводу, что различные гены в медиальной префронтальной коре могут быть использованы как биомаркеры социального доминирования. Кроме того, обнаружена корреляция между социальным доминированием и фосфорилированием АМРА рецепторов в медиальной префронтальной коре, которое может также служить биомаркером социального доминирования [29].
Кроме увеличения социального доминирования самцы ЛПС группы в нашей работе показали увеличение социального взаимодействия в двухкамерном тесте по сравнению с контрольной группой. Корреляционный анализ показал наличие корреляционной связи между числом побед в трубе и длительностью социального взаимодействия. Эти данные свидетельствуют о высокой социальной мотивации у доминантных самцов. В некоторых работах также была продемонстрирована связь между доминантностью и высокой социальной мотивацией [33], мыши высокого ранга больше времени взаимодействовали с незнакомой мышью, чем мыши низкого ранга. С исследовательской мотивацией авторы не увидели связи. В литературе имеются противоречивые данные относительно влияния раннего провоспалительного стресса на социальное взаимодействие крыс. В одной из первых работ [34] после введения ЛПС на 3 и 5 день после рождения у взрослых крыс наблюдалось уменьшение времени социального взаимодействия при нахождении опытной крысы в одной клетке с незнакомой крысой. В дальнейшем, было установлено, что социальное взаимодействие уменьшается за счет контактов, направленных на крысу из ЛПС группы [9]. Для проверки гипотезы о роли обонятельных сигналов, исходящих от крысы ЛПС группы, в социальной аверсии вызывали дегенерацию обонятельного эпителия с помощью интраназальной перфузии ZnSO4 у партнера крысы ЛПС группы [9]. После такой процедуры увеличивалось число социальных контактов, направленных на крыс из ЛПС группы. Предполагалось наличие нарушений в содержании микробиоты кишечника крыс после неонатального воспаления, однако секвенирование РНК из фекальных болюсов не выявило отличий в бактериях самцов ЛПС группы [10]. Несмотря на это, лечение антибиотиками, вызывающими изменения в микробиоте, устраняло социальную аверсию. Как известно, крысы избегают общение с больными особями. Так, острое введение большой дозы ЛПС, вызывающей болезненное состояние у крысы, приводило к подавлению социального взаимодействия в отношении больного партнера [35] и могло вызывать упреждающий иммунный ответ у здоровой крысы в виде увеличения содержания TNF-α в обонятельных луковицах.
Необходимо отметить, что в отличие от наших данных с ранним постнатальным введением ЛПС, активация иммунной системы матери (введение ЛПС беременным самкам) приводила к нарушениям социального поведения у потомства аутистического спектра. Самцы из такого потомства проводили меньше времени за активным социальным взаимодействием с незнакомой крысой, показали больше повторяющегося поведения, нарушения ультразвуковой коммуникации и имели отличия в бактериях в фекалиях, что характерно для аутистических заболеваний у людей [12, 14–16]. Кроме того, активация иммунной системы матери во время беременности могла приводить к шизофреноподобным изменениям в поведении потомства, о чем судили по дефициту предимпульсного торможения [17].
В нашей работе в ряде случаев была обнаружена связь между показателями социального поведения и уровнем кортикостерона и ИЛ-1β в сыворотке крови. Впервые было показано, что у самцов крыс победителей в тесте на социальное доминирование в трубе наблюдался более высокий уровень ИЛ-1β, чем у побежденных крыс. Уровень кортикостерона не отличался у победителей и побежденных, что согласуется с ранее полученными данными [26]. У крыс с высокой социальной мотивацией также наблюдался более высокий уровень ИЛ у самцов и более высокий уровень кортикостерона у самок. Необходимо напомнить, что биохимические показатели крови определялись задолго до начала социального тестирования и, возможно, способствовали проявлению особенностей социального поведения. Косвенным подтверждением наших результатов являются данные о том, что экспрессия маркера активации микроглии (IBA-1) и активации генов связанных с пролиферацией микроглии (CSF1 и IL-34) снижается в гипоталамусе при уменьшении доминирования у крыс после содержания в обогащенной среде [26], введение ингибитора микроглии уменьшало процент победителей в тесте в трубе. Ранее наблюдали увеличение уровня кортикостерона и ИЛ-6 в плазме после агрессивных схваток между мышами, причем уровень кортикостерона зависел от того, доминировали ли мыши в схватке или были в подчинении [36], у подчиненных мышей наблюдалось наибольшее повышение. В литературе имеются работы, в которых показана связь между доминантностью и агрессивностью, агрессию внутри группы обычно проявляет доминирующая особь [18, 37]. Имеются данные о связи агрессивности с повышенным уровнем провоспалительных цитокинов. На линиях высоко- и низкоагрессивных животных было показано, что высокие уровни провоспалительных цитокинов коррелировали с высоким уровнем агрессии [20, 21]. Сходные данные были получены и при исследовании пациентов с депрессией, которые демонстрировали повышенную агрессивность и высокий уровень провоспалительных цитокинов [22]. Исходя из этих данных, не кажется удивительным увеличение уровня ИЛ-1β у крыс склонных к социальному доминированию.
В заключении необходимо отметить, что ранний провоспалительный стресс оказывал влияние только на самцов в тестах на социальное доминирование и взаимодействие. Ранее мы также наблюдали более выраженные изменения в тревожно-депрессивном поведении и оборонительном поведении самцов под влиянием введения ЛПС в раннем онтогенезе [7, 8]. Бóльшая уязвимость самцов к влиянию ЛПС объясняется тем, что нейровоспалительный процесс протекает по-разному у самцов и самок [5]. У самцов и самок может различаться набор выделяемых цитокинов, их локализация и клеточный источник при нейровоспалении. У самцов микроглия является источником цитокинов при нейровоспалении, их экспрессия увеличивается после стресса, у самок не происходит увеличения выделения цитокинов из микроглии [38]. Кроме того эстрогены самок способны оказывать противовоспалительное влияние. Известно, что эстрогены ускоряют протекание воспалительного процесса в сторону его деактивации, большая роль при этом отводится противовоспалительному IL-4 [39], и эстрогены способны затормозить выработку провоспалительных цитокинов [40].
ВЫВОДЫ
1. Введение ЛПС (50 мкг/кг) на 3 и 5 постнатальные дни приводило к увеличению социального доминирования у взрослых самцов в тесте в трубе по сравнению с контрольными крысами, которым вводили физиологический раствор.
2. Для самцов победителей в тесте в трубе был характерен более высокий базовый уровень интерлейкина 1-β в сыворотке крови по сравнению с побежденными крысами.
3. У самцов ЛПС группы по сравнению с контролем увеличивалось время взаимодействия в двухкамерном тесте на социальное взаимодействие, что свидетельствовало об увеличении социальной мотивации.
4. У самок не наблюдалось изменений в социальном доминировании и взаимодействии после введения ЛПС в раннем онтогенезе.
Список литературы
Custódio C.S., Mello B.S.F., Filho A.J.M.C., de Carvalho Lima C.N., Cordeiro R.C., Miyajima F., Réus G.Z., Vasconcelos S.M.M., Barichello T., Quevedo J., de Oliveira A.C., de Lucena D.F., MacedoD.S. // Mol. Neurobiol. 2018. V. 55. № 5. P. 3775-3788.
Hohmann C.F., Odebode G., Naidu L., Koban M. // Ann. Psychiatry Ment. Health. 2017. V. 5. № 2. P.1095.
van Bodegom M., Homberg J.R., Henckens M.J.A.G. // Front. Cell Neurosci. 2017. V. 11. P. 87.
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. // Behav. Brain Res. 2016. V. 304. P. 1–10.
Григорьян Г.А. // Успехи физиол. наук. 2020. Т. 51. № 1. С. 18–32.
Alexander C., Rietschel E.T. // J. Endotoxin Res. 2001. V. 7. P. 167–202.
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Груздева В.А., Григорьян Г.А. // Рос. физиол. журн. им. И.М. Сеченова. 2020. Т. 106. № 6 С. 1–20.
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Онуфриев М.В., Моисеева Ю.В., Григорьян Г.А. // Журн. высш. нервн. деят. 2020. Т. 70. № 2. С. 261–278.
MacRae M., Kenkel W.M., Kentner A.C. // Brain Behav Immun. 2015. V. 49. P. 43–48.
Kentner A.C., Khan U., MacRae M., Dowd S.E., Yan S. // Physiol. Behav. 2018. V. 194. P. 311–318.
Zhu F., Zhang L., Ding Y.Q., Zhao J., Zheng Y. // Brain Behav. Immun. 2014. V. 38. P. 166–74.
Baharnoori M., Bhardwaj S.K., Srivastava L.K. // Schizophr. Bull. 2012. V. 38. № 3. P. 444–456.
Foley K.A., MacFabe D.F., Vaz A., Ossenkopp K.P., Kavaliers M. // Int. J. Dev. Neurosci. 2014. V. 39. P. 68–78.
Lee G.A., Lin Y.K., Lai J.H., Lo Y.C., Yang Y.S.H., Ye S.Y., Lee C.J., Wang C.C., Chiang Y.H., Tseng S.H. // Brain Sci. 2021. V. 11. № 8. P. 1085.
Xu X., Wu D., Hou S., Zhu J., Li J., Tang J. // Iran. J. Basic Med. Sci. 2017. V. 20. № 9. P. 1016–1020.
Kirsten T.B., Taricano M., Maiorka P.C., Palermo-Neto J., Bernardi M.M. // Neuroimmunomodulation. 2010. V. 17. P. 240–251.
Chamera K., Szuster-Głuszczak M., Trojan E., Basta-Kaim A. // Cells. 2020. V. 9. № 7. P. 1676.
Кудрявцева Н.Н. // Нейробиология агрессии: мыши и люди. Новосибирск, Наука-Центр, 2013. 272 с.
Das S., Deuri S.K., Sarmah A., Pathak K., Baruah A., Sengupta S., Mehta S., Avinash P.R., Kalita K.N., Hazarika J. // J. Neuroimmunol. 2016. V. 292. P. 45–51.
Alperina E., Idova G., Zhukova E., Zhanaeva S., Kozhemyakina R. // Neurosci. Lett. 2019. V. 92. P. 193–198.
Idova G.V., Markova E.V., Gevorgyan M.M., Alperina E.L., Zhukova E.N. // Bull. Exp. Biol. Med. 2016. V. 160. № 5. P. 679–682.
Takahashi A., Flanigan M.E., McEwen B.S., Russo S.J. // Front. Behav. Neurosci. 2018 V. 12. P.56.
Yang C.R., Bai Y.Y., Ruan C.S., Zhou H.F., Liu D., Wang X.F., Shen L.J., Zheng H.Y., Zhou X.F. // Neurotox. Res. 2015. V. 27. № 2. P. 129–142.
Uchida S., Kitamoto A., Umeeda H., Nakagawa N., Masushige S., Kida S. // J. Nutr. Sci. Vitaminol. (Tokyo). 2005. V. 51. № 3. P. 175–181.
Semple B.D., Canchola S.A., Noble-Haeusslein L.J. // J. Neurotrauma. 2012. V. 29. № 17. P. 2672–2683.
Cao W-Y, Hu Z.L., Xu Y., Zhang W.J., Huang F.L., Qiao X.Q., Cui Y.H., Wan W., Wang X.Q., Liu D., Dai R.P., Li F., Li C.Q. // Psychopharmacology (Berl). 2017. V. 234. № 22. P. 3321–3334.
Klomberg K.F., Garland T.Jr, Swallow J.G., Carter P.A. // Physiol. Behav. 2002. V. 77. № 1. P. 27–38.
Tansley S.N., Tuttle A.H., Wu N., Tohyama S., Dossett K., Gerstein L., Ham B., Austin J.S., Sotocinal S.G., Mogil J.S. // Genes. Brain Behav. 2019. V. 18. № 1. P. e12514.
Park M.J., Seo B.A., Lee B., Shin H.S., Kang M.G. // Sci. Rep. 2018. V. 8. № 1. P. 15008.
Fan Z., Zhu H., Zhou T., Wang S., Wu Y., Hu H. // Nat. Protoc. 2019. V. 14. № 3. P. 819–831.
Pallé A., Zorzo C., Luskey V.E., McGreevy K.R., Fernández S., Trejo J.L. // FASEB J. 2019. V. 33. № 6. P. 6995–7008.
Wang F., Kessels H.W., Hu H. // Trends Neurosci. 2014. V. 37. № 11. P. 674–682.
Kunkel T., Wang H. // Behav. Brain Res. 2018. V. 15. № 336. P. 173–176.
Breivik T., Stephan M., Brabant G.E., Straub R.H., Pabst R., von Horsten B. // Brain Behav. Immun. 2002. V. 16. № 4. P. 421–438.
Hamasato E.K., Lovelock D., Palermo-Neto J., Deak T. // Physiol. Behav. 2017. V. 182. P. 128–136.
Audet M.-C., Mangano E.N., Anisman H. // Front. Behav. Neurosci. 2010. V. 4. P. 1–12.
Barabas A.J., Lucas J.R., Erasmus M.A., Cheng H.W., Gaskill B.N. // Front. Vet. Sci. 2021. V. 8. P. 695948.
Fonken L.K., Frank M.G., Gaudet A.D., D’Angelo H.M., Daut R.A., Hampson E.C., Ayala M.T., Watkins L.R., Maier S.F. // Brain Behav. Immun. 2018. V. 70. P. 257–267.
Villa A., Rizzi N., Vegeto E., Ciana P., Maggi A. // Sci. Rep. 2015. V. 5. P. 15224.
Najjar F., Ahmad M., Lagace D., Leenen F.H.H. // Am. J. Physiol. Heart Circ. Physiol. 2018. V. 315. № 5. P. H1159–H1173.
Дополнительные материалы отсутствуют.