Нейрохимия, 2022, T. 39, № 3, стр. 265-278
Роль полиаминов в механизмах когнитивных нарушений
М. Г. Маклецова 1, Г. Т. Рихирева 2, Е. Ю. Кириченко 1, И. Ю. Тринитатский 3, М. Ю. Вакуленко 1, А. М. Ермаков 1
1 Донской государственный технический университет
Ростов-на-Дону, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
Москва, Россия
3 ГБО РО “Ростовская областная клиническая больница”
Ростов-на-Дону, Россия
Поступила в редакцию 09.12.2021
После доработки 25.04.2022
Принята к публикации 28.04.2022
- EDN: IGICJR
- DOI: 10.31857/S1027813322030050
Аннотация
По мере старения населения возрастные когнитивные нарушения становятся все более актуальной проблемой. В настоящее время активно обсуждается роль полиаминов (путресцина, спермидина и спермина) в патогенезе когнитивных нарушений различного генеза. При этом показано, что с возрастом содержание полиаминов в мозге снижается. Экзогенное введение полиаминов позволяет избежать когнитивные нарушения и/или повлиять на патогенетические процессы, связанные с прогрессированием различных патологий. Известны три способа поступления полиаминов в организм человека: из продуктов питания, синтеза бактериями кишечника и собственного биосинтеза в организме. В настоящее время одним из наиболее перспективных подходов к профилактике когнитивных нарушений является использование продуктов питания с высоким содержанием полиаминов, а также употребление различных пробиотиков, влияющих на бактерии кишечника, которые синтезируют полиамины. С 2018 года в ряде европейских стран были запущены проекты, направленные на оценку влияния диеты с высоким содержанием полиаминов на когнитивные процессы. В обзоре на основе анализа современной научной литературы и собственных данных авторов представлен материал о влиянии полиаминов на когнитивные процессы, роли полиаминов в регуляции нейромедиаторных процессов, а также обсуждается роль полиаминов в когнитивных нарушениях при неврологических и психических заболеваниях.
Цель этого мини-обзора – обобщить информацию о некоторых аспектах обмена полиаминов при неврологических и психических заболеваниях и оценить возможности применения полиаминов для коррекции нарушений когнитивных функций.
ОБЩАЯ ХАРАКТЕРИСТИКА ПОЛИАМИНОВ
Полиамины представляют собой большую группу органических поликатионов.
Поскольку первичные и вторичные аминогруппы полиаминов связаны с Н+, при физиологических значениях рН полиамины взаимодействуют электростатически с отрицательно заряженными молекулами, такими как ДНК, РНК, белки и фосфолипиды [1]. В живых организмах полиамины представлены как в свободных (протонированных), так и в связанных формах. Взаимодействие полиаминов с нуклеиновыми кислотами и кислыми макромолекулами более стабильно, чем с неорганическими катионами (Mg2+ и Са2+), что определяется наличием в молекулах полиаминов двух или нескольких положительно заряженных групп [2].
Полиамины принимают участие в различных важных биохимических процессах, таких как синтез, функционирование и поддержание стабильности нуклеиновых кислот (ДНК и РНК) и белков [2], играют ключевую роль в клеточной передаче сигналов, связывании ДНК, транскрипции, сплайсинге РНК, функционировании цитоскелетов, в трансляции эукариот с помощью фактора инициации трансляции 5A (eIF5A) [3–7].
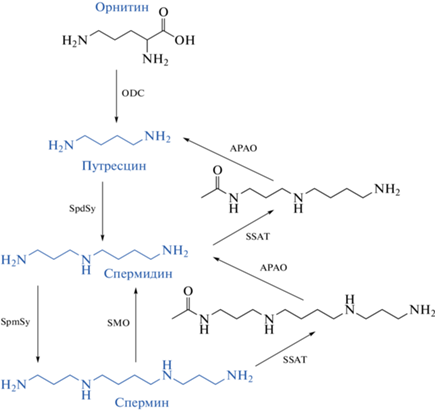
Такие эндогенные полиамины как путресцин, спермин и спермидин, представляют собой органические поликатионы, которые синтезируются из L-орнитина при декарбоксилировании (рис. 1).
К большой группе полиаминов относят ацетильные производные спермидина и спермина, а также кадаверин и агматин, образование которых связано с декарбоксилированием лизина и аргинина. В данной статье обсуждается обмен и роль полиаминов спермидина и спермина, образование которых происходит с участием фермента орнитиндекарбоксилазы (ОDС) (рис. 2), и для которых показана их способность увеличивать продолжительность жизни [8–14].
Рис. 2.
Схема синтеза и распада полиаминов. (цитируется по [14]). Список сокращений: ODC – орнитиндекарбоксилаза; SpdSy – спермидинсинтаза; SpmSy – сперминсинтаза; SSAT – спермидин/сперминN1-ацетилтрансфераза; APAO – ацетилполиаминоксидаза; SMO –сперминоксидаза.
СПЕРМИДИН И СПЕРМИН УВЕЛИЧИВАЮТ ПРОДОЛЖИТЕЛЬНОСТЬ ЖИЗНЕДЕЯТЕЛЬНОСТИ ЖИВОТНЫХ
Для полиаминов, особенно спермидина, увеличение продолжительности жизнеспособности организмов показано на целом ряде организмов и клеточных систем, включая дрожжи (S. cerevisiae), дрозофилы, нематоды, иммунные клетки человека и мышей [9–14]. Установлено, что механизм увеличения продолжительности жизни спермидином связан с прямым ингибированием активности гистонацетилтрансферазы (HAT) и индукцией аутофагии [11]. Эффекты спермидина на активность HAT приводят к глобальному для гистонов сценарию, в результате которого подавляется транскрипция гипоацетилирования многих генов [13]. Активация аутофагии спермидином включает ингибирование экспрессии Atg генов, регуляцию транскрипции elF5A и TFEB, а также ингибирование EP300, который непосредственно способствует ацетилированию генов Atg и косвенно стимулирует деацетилирование тубулина [13]. Очевидно, что изучение метаболизма полиаминов является актуальной проблемой в связи с выше описанными эффектами.
ОБМЕН ПОЛИАМИНОВ В ОРГАНИЗМЕ МЛЕКОПИТАЮЩИХ В НОРМЕ
Синтез. Путресцин синтезируется из орнитина (рис. 2) [14]. Лимитирующим скорость биосинтеза полиаминов является фермент ОDC [15]. Спермидинсинтаза (SpdSy) осуществляет перенос NH2 (CH2)3-фрагмента от S-аденозилметионина к аминогруппе путресцина, что приводит к образованию спермидина. Спермин формируется путем переноса данного фрагмента к спермидину с участием фермента сперминсинтазы (SPMSy). Спермин и спермидин преобразуются обратно в путресцин в результате катаболизма с участием ферментов: полиаминоксидазы, сперминоксидазы (SMO), ацетилполиаминоксидазы (APAO) и в свою очередь SMO осуществляет окислительный переход спермина в спермидин [16, 17].
Распад. Распад полиаминов может быть связан с преобразованием их в более низкомолекулярные полиамины в ходе двух последовательных ферментативных реакций. Первая: спермин или спермидин ацетилируются ферментом спермидин/сперминN1-ацетилтрансферазой 1 (SSAT), который является ключевым регуляторным ферментом, определяющим распад полиаминов [18]. Вторая состоит в окислительном расщеплении между С3 и N4 в ацетилированных спермине и спермидине с образованием более низкомолекулярных полиаминов и 3-аминопропаналя. Важно отметить, что как синтез полиаминов, так их распад осуществляются с переносом трехатомного (СН2)3-фрагмента.
К распаду полиаминов также приводит их окисление.
Продуктами окисления полиаминов являются более низкомолекулярные полиамины, Н2О2, 3‑аминопропаналь (3-АП) и 3-ацетиламинопропаналь [2, 18]. Эти альдегиды неустойчивы и самопроизвольно переходят в акролеин после дезаминирования. Акролеин, ненасыщенный альдегид, легко вступает в реакцию с остатками лизина белков с образованием белок-конъюгированного акролеина (protein-conjugated acrolein, PCAcrolein) [17]. Акролеин, высокотоксичный ненасыщенный альдегид, при взаимодействии с белками, липидами, нуклеиновыми кислотами оказывает системное повреждающее действие, что приводит к гибели клеток. Показано, что при экспериментальном фото-индуцированном инсульте содержание акролеина в зоне некроза увеличивается в 28 раз, что связано с активацией распада полиаминов. Акролеин является значительно более токсичным соединением, чем Н2О2 [17].
Регуляция обмена полиаминов. Активности ферментов биосинтеза и распада полиаминов ODC и SSAT регулируются за счет изменений концентраций полиаминов, а также различными соединениями: факторами роста, гормонами и т.д. [1, 2, 15–17]. При высоких концентрациях спермидина и спермина в клетках активности ферментов синтеза полиаминов (ODC и SAMDC) подавляются, в то время как активность ферментов распада (SSAT) увеличивается. И, наоборот, когда клеточное содержание полиаминов снижается, ODC и SAMDC позитивно регулируются и SSAT подавляется. Регуляция синтеза и распада полиаминов происходит на уровне транскрипции и трансляции биосинтеза данных ферментов [16]. При увеличении содержания полиаминов внутри клетки активность ODC подавляется путем индукции белка – антизима (antizyme, AZI), образующего комплекс с ODC-мономером, приводящей к инактивации его ферментативной активности (рис. 3) [19].
Рис. 3.
Схема регуляции биосинтеза полиаминов (цитируется по [19]). Сокращения: ODC – орнитиндекарбоксилаза; AZI – antizyme, AZIN – antizyme inhibitor.
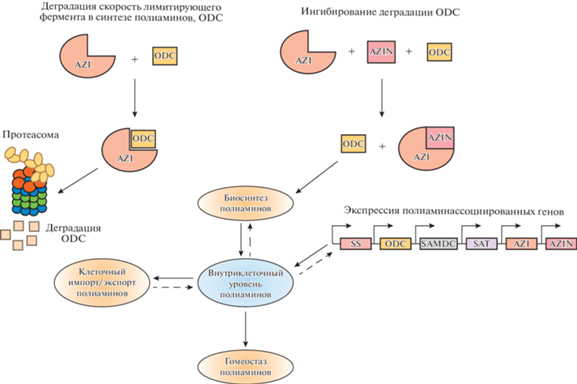
Деградация этого комплекса происходит в 26S протеасомах. Кроме того, белки – антизимы способны ингибировать поглощение полиаминов или стимулировать их секрецию. Показано существование 3-х форм антизимов AZI: AZI 1, AZI 2 и AZI 3 [21]. Более сложная регуляция активности ODC представлена белками – ингибиторами антизимов (antizyme inhibitor, AZIN), которые способны взаимодействовать с AZI с более высоким сродством, чем к ОДС. В настоящее время идентифицировано две их формы: AZIN 1 и AZIN 2 [21].
Транспорт полиаминов в клетку осуществляется транспортерами ОСТ (organic cation transporter) [21].
Таким образом, в норме гомеостаз полиаминов в организме поддерживается сложными механизмами обратной связи на уровне их биосинтеза, распада, поглощения и выведения их из клетки. Вместе с тем, не менее важным вопросом в регуляции обмена полиаминов является оценка поступление их из кишечника. Известны три способа поступления полиаминов в организм человека: из продуктов питания, синтеза бактериями кишечника и собственного биосинтеза в организме. Изучению содержания полиаминов в продуктах питания и оценке влияния пробиотиков на содержание полиаминов в организме человека посвящено много работ [22–24].
НАРУШЕНИЯ ГОМЕОСТАЗА ПОЛИАМИНОВ
Нарушения в метаболизме полиаминов могут приводит к тяжелым неврологическим заболеваниям, например, мутации в сперминсинтазе и последующие изменения уровня спермина и спермидина являются причиной синдрома Снайдера-Робинсона [25]. Аналогичным образом мутация в гене ODC1 приводит к тяжелым последствиям, таким как макросомия, макроцефалия, задержка развития, алопеция, спастичность, гипотония, кожные сосудистые мальформации, нарушение зрительного восприятия и нейросенсорная тугоухость [26]. Исследования Jain et al. 2018, показали, что подавление распада полиаминов связано с спермин-опосредованным повреждением эпителия дыхательных путей и провоцирует развитие астмы [27]. В модельных опытах на мышах с инактивацией SMOX и с комбинированной инактивации SMOX и SSAT1 обнаружено повышение уровня спермина и снижение уровня спермидина в головном мозге и в мозжечке Smox-KO и Smox/Sat1-dKO по сравнению с интактными животными [28]. В опытах на мышах Smox/Sat1-dKO показано, что длительный дефицит катаболизма полиаминов вызывает активацию TGM2 90 и усиленную экспрессию α-синуклеина, полиаминирование и агрегацию белков с последующей активацией цепи событий, которые приводят к повреждению мозжечка и атаксии у мышей Smox/Sat1-dKO [28].
ОСОБЕННОСТИ ОБМЕНА ПОЛИАМИНОВ В НЕРВНОЙ ТКАНИ
Путресцин, спермин и спермидин представлены во всех структурах мозга [29, 30]. Ферментативная система ОDС локализована в ядрах нейронов, в дендритах, аксонах и нервных терминалях. В нейронах обнаружена высокая активность спермин- и спермидинсинтаз [31–33].
В головном мозге присутствуют все ферменты распада полиаминов – SSAT, диаминооксидаза и полиаминоксидаза. В процессе распада полиаминов также участвует МАО [30]. Важно отметить, что модификация молекулярной структуры МАО, вызванная окислительным стрессом, приводит к изменению субстратной специфичности и активации МАО по отношению к полиаминам [30]. Существует еще несколько метаболических путей превращения полиаминов в ЦНС. Показано вовлечение путресцина в биосинтез ГАМК и дальнейшее превращение в гистидинсодержащий дипептид – гомокарнозин [34]. Содержание полиаминов в глии значительно выше, чем в нейронах [31, 33]. Тот факт, что полиамины синтезируются в нейронах, а аккумулируются в глии, позволил Скачкову с соав. [31] разработать гипотезу о роли полиаминов как глиотрансмиттеров, регулирующих функцию нейронов. В транспорте полиаминов в клетки мозга участвуют эндотелий и капилляры [31].
Процесс поглощения/высвобождения полиаминов происходит с участием транспортера органических катионов 1 (organic action transporter, OCT 1), через глиальные щелевые соединения и гемиканалы коннексина-43 (Cx43 HCs) и через полиамин-проницаемые рецепторы и каналы [33].
Полиамины и щелевые контакты головного мозга. В ЦНС помимо участия в осуществлении базовых регуляторных функций, таких как регуляция биосинтеза белков, РНК и ДНК и др., полиамины выполняют ряд специфических функций: модулируют разные стороны обмена, синтеза и распада различных нейромедиаторов, а также их взаимодействие с рецепторами [30, 35]. Благодаря способности полиаминов взаимодействовать с мембранами они могут модулировать активности мембранносвязанных ферментов, в частности Na,K-AТФазы [36].
Стоит отметить связь полиаминов и межклеточных щелевых контактов головного мозга в норме и при развитии нейропатологий. Щелевые контакты (ЩК) – это система плотно упакованных каналов, пронизывающих билипидные слои мембран двух контактирующих клеток. Каждый такой канал состоит из двух состыкованных полуканалов, называемых коннексонами, при этом субъединицей каждого коннексона является белок коннексин. Во взрослом нормальном мозге ЩК способствуют образованию глиальных синцитиев – трехмерных глиальных каркасов, выполняющих ряд важнейших функций, таких как контроль концентраций внеклеточных ионов и нейротрансмиттеров, а также осуществление метаболических процессов [37]. Для поддержания этих функций в синцитии необходимым условием является открытие ЩК, что связано с наличием полиаминов [38]. При этом во взрослом мозге накопление полиаминов (спермина, спермидина, путресцина, агматина) является отличительной особенностью именно астроцитов, но не нейронов [39–41, 31 ]. Уникальная способность коннексина 43 (Сх43) поддерживать в открытом состоянии ЩК в синцитии была показана при сравнении Сх43 и Сх40 и демонстрации явления блокады полиаминами аминокислотной последовательности (сайта связывания) в N-конце Сх40 [17–21]. Такие специфические сайты связывания для полиамина спермина не были обнаружены в Сх43 [42]. Более того, в дальнейших исследованиях было отмечено, что Сх43 чувствителен к полиаминам, которые открывают каналы ЩК, а также, что наиболее важно для физиологии клеток, полиамины устраняют блокаду этих каналов катионами водорода [44] и кальция [45]. Устранение катионного блока полиаминами является критически важным фактором для функционирования ЩК в глии, поскольку именно подкисление цитоплазмы и последующее высвобождение кальция (так называемые кальциевые волны в астроцитах) является отличительным свойством астроцитарного синцития, но не нейронных ансамблей. Обеспечивая распространение калиевых и кальциевых волн в глиальном синцитии, ЩК и полуканалы напрямую способны контролировать активность как отдельных нейронов, так и нейронных сетей. В то же время деполяризация такого синцития при повышении концентрации ионов калия при эпилепсии, нейротравме или ишемии [46] ведет к потере астроцитами способности устранять избыток калия из межклеточного пространства, что приводит к инактивации нейрональной активности и нейропатологиям.
РОЛЬ ПОЛИАМИНОВ В ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ МОЗГА
Регуляция стробирования. Полиамины классически рассматриваются как регуляторы стробирования ионных каналов. Спермин регулирует ионный транспорт, участвуя в процессе ректификации калиевых каналов. Впервые А. Лопатиным и соавт. был раскрыт механизм так называемого аномального выпрямления – свойства спермина осуществлять ректификацию калиевых ионных каналов семейства KirX.X. и носит потенциал-зависимый характер [47–49].
В настоящее время установлено, что полиамины обеспечивают ректификацию калиевых каналов, каналов АМРА- и nACh-рецепторов [35, 50]. Механизм ректификации каналов полиаминами прост: деполяризация мембраны вызывает спонтанное втягивание цитозольных полиаминов во внутрь поры канала, тем самым полиамины блокируют поток положительно заряженных ионов во внутрь клетки через поры рецепторов [50]. Таким образом, внутриклеточные полиамины обеспечивают контроль перевозбуждения данных рецепторов. Указанное свойство цитоплазматических полиаминов осуществляется благодаря тому, что у них низкая молекулярная масса и при физиологических значениях рН они имеют положительный заряд.
Регуляция полиаминами синтеза nACh-рецепторов. Для спермина показана способность не только стробировать nACh-рецепторы, но и модулировать активность фермента обмена ACh – ацетилхолиностеразы. Другой уровень регуляции полиаминами обмена ацетилхолина был недавно обнаружен Дхара и др. [51]. Продемонстрировано, что полиамины контролируют сборку нейрональных никотиновых α4β2 и α7 ацетилхолиновых рецепторов [41]. Эта способность уникальна, поскольку полиамины не модулируют сборку каких-либо других ионных каналов. Примечательно, что снижение уровня полиамина повышает уровни α4β2 и α7Ach [51] в мозге. Авторы показали четкую корреляцию между вызванными ацетилхолином потенциалами действия и активностью SSAT. α4β2- и α7Ach-рецепторы являются наиболее распространенными рецепторами ацетилхолина.
Регуляция полиаминами NMDA-рецепторов. В многочисленных исследованиях показаны множественные эффекты внеклеточных полиаминов на чувствительные к глутамату рецепторы: NMDA, AMPA и каинат [35, 50, 52, 53]. Полиамины оказывают двухфазный эффект на глутаматные рецепторы: они либо блокируют каналы AMPA- и NMDA-рецепторов в высоких дозах, либо активируют каинат- и NMDA-рецепторы при низких концентрациях [22].
В цикле работ Вильямса и соавт. (1984–1989) показано, что комплекс рецепторов NMDA обладает сайтом распознавания полиаминов, также, как и у коннексинов [54–58, 37]. Рецепторы NMDA являются преобладающим молекулярным устройством для контроля синаптической пластичности и функции памяти на клеточном уровне, полиамины, по-видимому, эффективно модулируют их. Эффекты полиаминов на NMDA-рецепторы впервые были обнаружены при анализе их связывания с спермином и спермидином, но не диамина путресцина. Показана способность спермина и спермидина специфически взаимодействовать с полиамин-связывающим аллостерическим сайтом глутаматных рецепторов [35].
Выявлено четыре типа эффектов спермина на NMDA-рецепторы в мозге, которые различались в зависимости от мембранного потенциала, рН и концентрации агониста и ко-агониста. Первый тип – стимуляция потока ионов Са в присутствии “замещающих” концентраций глицина, так называемая глицин-зависимая стимуляция [56, 59]. Соответственно, спермин увеличивает сродство NMDA-рецепторов к глицину, независимо от того, содержат ли эти рецепторы субъединицы GluN2A или GluN2B. Более того, этот эффект спермина не был чувствителен к изменениям внеклеточного рН. Вторым типом реагирования NMDA-рецепторов на спермин является стимуляция потока катионов, которую наблюдают в присутствии насыщенных концентраций глутамата и глицина, так называемая независимая от глицина стимуляция [55, 60]. Мони и др. идентифицировали сайт связывания, ответственный за индуцированную спермином независимую от глицина стимуляцию GluN2B-содержащейся субъединицы в NMDA-рецепторах [61]. Показано, что полиамины активируют NMDA-рецепторы, экранируя отрицательные заряды в аминокислотной последовательности в белках субъединиц GluN1 и GluN2B [61]. Третий тип реагирования – спермин – может снижать чувствительность к глутамату глутаматных рецепторов, что связано со снижением сродства к рецептору. Этот эффект наблюдается только на рецепторах, содержащих субъединицы GluN1 и GluN2B, и, вероятно, включает сайт связывания спермина, ответственный за независимую от глицина стимуляцию [61]. Наконец, 4 тип реагирования – спермин может также связываться с порами ионного канала и индуцировать зависящую от напряжения блокировку канала в месте, связанном с внеклеточным сайтом связывания для Mg2+ [62]. Причем эффективность спермина на два порядка выше Mg2+ [31]. Синтезированы селективные ингибиторы связывания полиаминов с субъединицами NR2B NMDA-рецепторов – аркаин, ифенпродил и траксопродил, введение которых экспериментальным животным вызывает нарушение процесса запоминания и воспроизведения условного рефлекса [64]. При введении спермина или спермидина в область гиппокампа наблюдается значительное увеличение способности к обучению. Таким образом, была установлена прямая связь между полиаминным сайтом связывания с субъединицами NR2B NMDA-рецепторов с нарушениями процессов памяти [35, 50, 65].
На модели фокальной ишемии мозга у крыс было обнаружено, что при нарушениях памяти и обучаемости, вызванных ишемией, глицин облегчал формирование, но не влиял на сохранность приобретенного навыка. В то время как спермин способствовал выработке условного рефлекса, который воспроизводился в течение всего периода наблюдения [30].
Очевидно, полиамины являются позитивными модуляторами NMDA-рецепторов и способны компенсировать дисфункцию глутамат- и холинергической передачи, тем самым устраняя нарушения памяти и обучаемости.
Нейротоксичность полиаминов. Ранее было показано, что избыточные уровни полиамина нейротоксичны [50] и что прямая внутримозговая инфузия спермина может спровоцировать нарушение врожденного иммунного ответа. Добавление полиаминов может оказывать токсическое воздействие на культуру нейронов. При инкубации чистой нейрональной культуры с 50 мкМ спермина наблюдается гибель клеток, в то время как в целостной структуре срезов мозга, состоящей из нейронов и глии (астроцитов), данная концентрация спермина не вызывала их гибели [31].
Нейротоксичность полиаминов может быть связана с развитием окислительного стресса, который вызывается индукцией, во-первых, Н2О2 и, во-вторых, ненасыщенных альдегидов, таких как 3-АП и акролеин [16, 17, 30]. Добавление спермина и спермидина в культуру клеток, содержащую сыворотку крови, вызывает ингибирование пролиферации любых типов клеток за счет образования продуктов окисления полиаминов – Н2О2 и акролеина [16]. В нейрональной клеточной культуре полное ингибирование роста клеток достигается при инкубации с 10 мкМ акролеина, 100 мкМ H2O2 и 20 мкМ OH [16]. При этом акролеин является более токсичным агентом для ткани мозга, чем АФК. Введение в нейрональную культуру, содержащую токсические дозы спермина, альдегиддегидрогеназы – фермента, устраняющего акролеин, предотвращало гибель клеток [23]. На модели ишемии, вызванной глюкозокислородной депривацией, на культуре нейробластомы M. Nakamura с соотв. установили, что именно Са2+ является фактором, индуцирующим токсичность полиаминов, при этом в нейроне происходит снижение содержания полиаминов и увеличение образования продуктов их распада (PCAcrolein) [21]. Одним из основных путей для входа Ca2+ в нейроны являются каналы АМРА и NMDA рецепторов. В опытах на животных показано, что введение N1,N4,N8-трибензилспермидина – блокатора канала NMDA- рецепторов приводит к снижению содержания Ca 2+ и PCAcrolein в нейронах, что ассоциируется с уменьшением размера очага инфаркта мозга [21]. Установлено, что полиамины глии способны защищать нейроны от гибели, регулируя данные рецепторные каналы нейронов [31].
Полиамины-нейропротекторы. Нейропротекторный эффект полиаминов показан в опытах на животных при моделировании нейродегенеративных заболеваний. К таким заболеваниям относят болезнь Гентингтона, обусловленную мутациями – увеличением количества тринуклеотидных повторов СAG, которые кодируют аминокислоту глутамин. Экспансия СAG-повторов приводит к увеличению длины полиглутаминового участка в белке гентингтине (Htt). Клиническая картина болезни Гентингтона характеризуется двигательными, психическими и когнитивными расстройствами, связанными с глутаматными рецепторами [68]. Дозозависимый нейропротекторный эффект спермидина был обнаружен при моделировании болезни Гентингтона при интрастриатальном введении хинолиновой кислоты [69]. Авторы обнаружили, что низкая доза спермидина увеличивает активность NMDA-рецепторов в стриатуме, а высокая доза снижает рецепторную активность NMDA-рецепторов в этой модели [68].
Болезнь Паркинсона – возраст-зависимое нейродегенеративное заболевание, патологическими признаками которого являются двигательные и когнитивные нарушения, связанные с потерей дофаминергических нейронов в черной субстанции мозга, аномальным накоплением железа в этой структуре и наличием внутриклеточных агрегатов неправильно свернутых белков, состоящих в основном из альфа-синуклеиновых фибрилл и ряда других белков [70]. Показан нейропротекторный эффект спермидина при моделировании болезни Паркинсона введением ротенона, который связан с антиоксидантными свойствами полиаминов [70].
Для нейродегенеративных заболеваний, несмотря на различие триггерных инициирущих событий, характерны общие механизмы, приводящие к гибели клеток мозга. В качестве таких механизмов рассматривают избыточное образование АФК, дефицит эндогенной антиоксидантной системы и эксайтотоксичность. Полиамины. являясь “ловушками” для свободных радикалов, способны существенно снизить уровень АФК [71, 72] и эксайтотоксичность [35, 50].
НАРУШЕНИЕ ОБМЕНА ПОЛИАМИНОВ ПРИ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ
Существует целый ряд экспериментальных доказательств участия полиаминов в патогенезе многих из известных неврологических заболеваний, при которых наблюдаются нарушения памяти и поведения. Когнитивные нарушения, возникновение которых связывают с нарушением обмена полиаминов, являются характерными для пациентов с болезнью Альцгеймера, болезнью Паркинсона, болезнью Гентингтона, при остром воспалительном процессе в нервной системе, при острых и хронических нарушениях мозгового кровообращения и черепно-мозговой травме [31, 32, 35, 50, 66 ]. Особенно важно изучение роли полиаминов в молекулярных механизмах патогенеза болезни Альцгеймера. Показано, что для болезни Альцгеймера характерно накопление тау-белка, образующего нейрофибриллярные клубки, и нейротоксического амилоидного бета-пептида, ответственного за образование сенильных бляшек [34]. Одновременно у пациентов с болезнью Альцгеймера наблюдается высокая активность ODC, увеличение ее генной экспрессии и увеличение содержания спермидина и спермина в головном мозге, что авторы связывают с ролью полиаминов в когнитивном дефиците и в синаптической потере [50]. Моделирование болезни Альцгеймера (введение амилойдного бета-пептида) в опытах на животных показало, что введение ингибитора синтеза полиаминов DFMO (дифторметилорнитин) или блокирование сайта связывания спермина с NМDA-рецепторами аркаином восстанавливает нарушенную память у мышей.
Болезнь Паркинсона является еще одним нейродегенеративным заболеванием, при котором обнаружены нарушения в обмене полиаминов, связанные с генетическими мутациями [73, 74]. Дефицит АТР13А2 (PARK9) приводит к выраженным изменениям в экспорте полиаминов [74]. При болезни Паркинсона изменяется экспрессия фермента SSАТ, что приводит к увеличению содержания ацетильных производных полиаминов и нарушению их обмена [73]. Механизмы участия полиаминов в снижении когнитивных функций у пациентов с болезнью Паркинсона связаны с модуляцией NMDA-рецепторов, а также с агрегацией α‑синуклеина [75]. Нами было изучено содержание спермидина в эритроцитарной массе крови пациентов, страдающих болезнью Паркинсона, которое коррелировало с показателями MMCE. Так, в крови больных 1–2-ой стадиями заболевания (ММСЕ = 25–27 баллов) содержание спермидина значительно увеличивалось по сравнению с донорской кровью, а в крови больных на поздних стадиях (3–4-я) (ММСЕ = 12) с выраженными когнитивными нарушениями наблюдалось снижение содержания спермидина по сравнению с контролем [75].
ПОЛИАМИНЫ И ПСИХИЧЕСКИЕ ЗАБОЛЕВАНИЯ
В настоящее время получены доказательства участия полиаминов в патогенезе многих из известных психических заболеваний [76]. Показано изменение в экспрессии и активности ферментов распада полиаминов, в содержании индивидуальных полиаминов (путресцина, спермидина и спермина) при шизофрении, депрессии, тревожных синдромов и др. [77–79]. Особое место в нейрохимии психических заболеваний занимают работы, посвященные изучению роли полиаминов в патогенезе депрессивных состояний с последующим суицидальным исходом [79]. Так в образцах аутопсии 22 областей мозга лиц, погибших в результате суицида, обнаружены значительные различия по сравнению с контролем в экспрессии генов, ответственных за метаболизм полиаминов: ODC, AZI 1 и AZI 2, сперминоксидазы, сперминсинтетазы и семейства альдегиддегидрогеназ (ферментов, удаляющих продукты распада полиаминов – токсические альдегиды) [79]. Причем, как обнаружено в нескольких независимых исследованиях, особенно выражено снижение экспрессии фермента SSAT в аутопсии образцов коры головного мозга у людей, умерших при суициде [80]. Снижение экспрессии SSAT в мозге больных, погибших при суициде, приводит к значительному увеличению содержания спермидина и путресцина в структурах мозга по сравнению с их содержанием в мозге психически здоровых лиц.
Таким образом, по-видимому, генетически детерминированное нарушение в обмене полиаминов является одним из патогенетических механизмов психических растройств.
ПОЛИАМИНЫ И ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ
С возрастом содержание полиаминов в мозге снижается [81], что по мнению ряда авторов играет ведущую роль в возрастных изменениях когнитивных функций [81, 82]. Установлено, что введение спермина и/или спермидина оказывает существенное положительное влияние на когнитивные и поведенческие реакции у старых животных [83]. Важно отметить, что введение спермидина или спермина оказывает регулирующее влияние на белки аутофагии [84]. Спермидин и спермин поддерживают энергетический обмен нейронов [84–86]. Кроме того, результаты анализа таких показателей как Bcl-2, Bax, Каспаза-3, NLRP3, IL-18 и IL-1β показали, что спермидин и спермин предотвращают апоптоз и воспаление [86]. В 2013 году V.K. Gupta et al. в опытах на стареющих мухах обнаружили, что пищевые добавки со спермидином ослабляют возрастные нарушения памяти с помощью механизмов аутофагии [86]. В 2016 году в работах T. Eisenberg et al. сообщалось, что пероральное введение спермидина мышам снижало гипертрофию миокарда и системное кровяное давление, усиливало сердечную аутофагию и улучшало механоэластические свойства кардиомиоцитов [86].
Учитывая злободневность проблемы следует остановиться на данных о возможности использования спермидина в качестве антивозрастного соединения в противостоянии инфекции COVID-19 [85]. В доступной литературе отражена растущая озабоченность о влиянии коронавирусной инфекции не только на физическое но и на психическое здоровье человека. Наиболее важными признаками психических расстройств, наблюдаемых при COVID-19, являются симптомы депрессии и тревожности, а также когнитивные нарушения. Обращает на себя внимание пересечение (crosstalk) признаков старения и систем, которые поражаются при коронавирусной инфекции, а также более высокий уровень смертности у пожилых пациентов. Один из признаков возрастных изменений это постоянное укорочение теломер, которые являются защитными структурами на концах хромосом. Истощение теломер способствует снижению тканей к регенерации, потере тканевого гомеостаза, к заболеваниям. При определении длины теломер в лимфоцитах периферической крови пациентов с COVID-19 было обнаружено, что более короткие теломеры связаны с большей тяжестью заболевания [85]. Обнаруженное свойство спермидина поддерживать теломеры, удлинять их при добавке полиамина в рацион, может, по-видимому, определить как антивозрастные эффекты спермидина, так и его вклад в противовирусное действие [12]. Некоторые авторы считают, что нарушение аутофагии, как характерной черты старения, может привести к тяжести COVID-19 [85]. Спермидин является индуктором аутофагии. Тем не менее, механизмы взаимодействия аутофагии и COVID-19 пока остаются не выясненными.
В целом изучение противовирусных эффектов антивозрастных соединений, в частности полиаминов, имеет большое значение для решения вопросов терапевтической стратегии.
ВЛИЯНИЕ НА КОГНИТИВНЫЕ ПРОЦЕССЫ ВВЕДЕНИЯ ПОЛИАМИНОВ В ДИЕТУ ПОЖИЛЫМ ПАЦИЕНТАМ. КЛИНИЧЕСКИЕ ИСПЫТАНИЯ
Обоснованием для клинических испытаний явился обнаруженный эффект спермидина на аутофагию. Спермидин обладает способностью запускать важный процесс растворения бета-амилоидных бляшек путем аутофагии [50, 86]. Установлена четкая корреляционная зависимость между уровнем спермидина в крови и когнитивными показателями у пациентов с болезнью Альцгеймера с деменцией [87]. Диетическое потребление спермидина коррелирует с когнитивными показателями у людей [88]. Были проведены исследования на мышах, которые подтвердили безопасность и хорошую переносимость полиаминов, полученных из зародышей пшеницы [86]. Эти данные позволили использовать спермидин в клинических испытаниях. Показано, что количество полиаминов – 13,5 мкг/кг массы тела в сутки для спермидина или 3.1 мкг/кг массы тела в сутки для спермина является дозой “отсутствия побочного эффекта”.
В 2018 году M. Wirth et al. опубликовали результаты одного из первых пилотных клинических испытаний, посвященных оценке способности полиаминов улучшать когнитивные функции у пожилых пациентов, в котором было показано, что прием с пищей 1200 мг спермидина в день в течение 3 месяцев улучшает когнитивных функций по сравнению с контрольной группой [88]. T. Pekar et al. в 2020 году сообщили, что диета, обогащенная спермидином, может предотвратить потерю памяти при старении. Была установлена четкая корреляция между концентрацией спермидина и улучшением когнитивных показателей у пациентов с легкой и умеренной деменцией. Одновременное введение в диету 200 мкг путресцина, 900 мкг спермидина и 500 мкг спермина (всего 1600 мкг) в день в течение 12 месяцев пожилым людям оказало наиболее эффективное позитивное влияние на когнитивные процессы [89, 90].
В настоящее время в ряде работ обсуждаются результаты обследования пациентов с болезнью Альцгеймера, получавших диету с полиаминами [91, 92].
ВЛИЯНИЕ СТРЕССА НА ОБМЕН ПОЛИАМИНОВ В МОЗГЕ
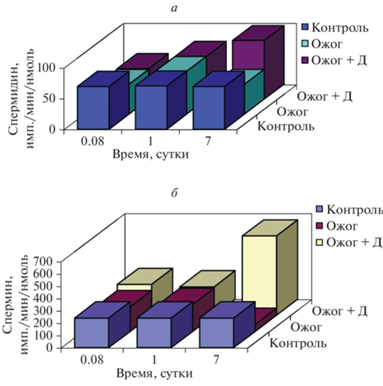
Полиамины активно вовлечены в молекулярные механизмы реализации неспецифической стресс-реакции – так называемый полиаминный стресс-ответ (ПСО) [93, 94]. При стрессорном воздействии на организм в целом (ожог, травма и пр.) в мозге активируется ОDС с последующим значительным увеличением содержания полиаминов в первые сутки, что запускает активацию генов “раннего” ответа – c-fos, c-jus, c-myc [95, 96]. Нами было обнаружено, что в мозге животных, перенесших ожоговый стресс, содержание спермина и спермидина снижалось на 5-7 сутки после ожогового стресса по сравнению с контролем. Введение адаптогена (ДСИП) после стресса оказывало модулирующее воздействие на метаболизм полиаминов в мозге на 5–7 сутки после ожога: содержание спермидина увеличивалось на 5 сутки, интенсивность включения радиоактивной метки из [С14]-орнитина в полиамины увеличивалась для спермина в 3 раза (р ≤ 0.01) на 7 сутки после стресса по сравнению с контролем (рис. 4).
Рис. 4.
Влияние введения ДСИП на интенсивность включения радиоактивной метки из [С14]-орнитина в спермидин (а) и спермин (б) в мозге крыс после ожога.
При данном стрессорном воздействии наблюдались нарушения памяти и обучаемости. Введение адаптогена (ДСИП) вызванное им последующее увеличение биосинтеза полиаминов облегчало формирование новых навыков, а также положительно влияло на сохранность приобретенного навыка до стресса [95].
ПОЛИАМИННЫЙ СТРЕСС ОТВЕТ И ТАУ-ПАТОЛОГИИ
В нервной ткани обнаружены метаболические особенности ПСО, которые зависят от характера стрессорного воздействия [79]. При психоэмоциональном стрессе, а также ишемии/гипоксии мозга происходит более интенсивная активация ферментов распада полиаминов, которая превышает скорость их синтеза. При этом наблюдается резкое увеличение активности ODC и содержания путресцина при одновременном снижении содержания спермидина и спермина. В модельных опытах на животных было обнаружено, что ответная реакция со стороны системы полиаминов на стрессорные воздействия различается в зависимости от длительности стрессорного воздействия и определяет характер метаболизма полиаминов в мозге. Данные, полученные Sandusky-Beltran et al. в 2019 году, свидетельствуют о том, что повышение уровня полиаминов, вызванное кратковременным стрессорным воздействием, “полезно” для нервной системы [97]. При этом спермидин и спермин способны уменьшать содержание тау-белка, ассоциированного с микротрубочками, за счет активации аутофагии. Однако, длительное хроническое стрессорное воздействие приводит к дезадаптивной дисрегуляции обмена полиаминов и оказывает негативное воздействие.
Sandusky-Beltran et al. в 2021 году сообщили об уникальной связи между метаболизмом полиаминов, поведенческими нарушениями и судьбой тау-белка [98]. Как известно, для тау-патологий характерно наличие тех или иных когнитивных и аффективных поведенческих нарушений [99]. Обнаружено, что при болезни Альцгеймера происходит дисрегуляция транскриптов генов, связанных с метаболизмом полиаминов в мозге, при этом в значительной степени повышается уровень антизимного ингибитора ODC AZIN 2, что значительно увеличивает содержание ацетильных производных полиаминов, усиливает накопление тау-белка и способствует когнитивным и аффективным нарушениям поведения [98].
Поддержание гомеостаза в обмене полиаминов является потенциальным способом лечения болезни Альцгеймера и тау-патологий [100].
Таким образом, ПСО может вызывать как положительные, так и отрицательные последствия в ЦНС в зависимости от длительности и характера стрессирующего воздействия. Введение адаптогенов оказывало модулирующее воздействие на содержание полиаминов, которое позволяло положительно сказываться на процессах запоминания и обучения. Важно отметить, что в настоящее время ПСО рассматривается как провокационный фактор в механизмах запуска неврологических и психических заболеваний.
ЗАКЛЮЧЕНИЕ
В настоящее время нарушения в метаболизме полиаминов и в их внутриклеточном распределении рассматриваются как патогенетические механизмы развития многих заболеваний, которые сопровождаются когнитивными расстройствами. Спермидин и спермин способны значительно улучшать процесс обучения, запоминания и повысить работоспособность благодаря модулированию нейромедиаторных процессов (nAch, полиаминным сайтом NMDA-рецепторов) и активации аутофагии в ЦНС. Тот факт, что функциональная активность данных рецепторов связана с контролем синаптической передачи сигналов и механизмами пластичности, а также с формированием памяти и механизмами запоминания, позволяет рассматривать полиамины в качестве положительных модуляторов когнитивных процессов. В связи с этим полиамины представляют перспективное направление для разработки терапии когнитивных нарушений. Успешное практическое применение полиаминотерапии напрямую связано с развитием наших представлений о функциональной значимости полиаминов в патогенезе когнитивных нарушений, а также тщательным анализом возможных противопоказаний к ее применению.
Список литературы
Pegg A.E. // J. Biol. Chem. 2016. V. 291. P. 14904–14912.https://doi.org/10.1074/jbc.R116.731661
Park M.H., Igarashi K. // Biomol. Ther. (Seoul). 2013. V. 21. № 1. P. 1–9.
Ramani D., De Bandt J.P., Cynober L. // Clin. Nutr. 2014. V. 3. № 1. P. 14–22.
Landau G., Ran A., Bercovich Z., Feldmesser E., Horn-Saban S., Korkotian E., Jacob-Hirsh J., Rechavi G., Ron D., Kahana C. // J. Biol. Chem. 2012. V. 287. P. 35825–35837. https://doi.org/10.1074/jbc.M112
Handa A.K., Fatima T., Mattoo A. // Front. Chem. 2018. V. 6. P. 10. https://doi.org/10.3389/fchem.2018.00010
Zwighaft Z., Aviram R., Shalev M., Rousso-Noori L., Kraut-Cohen J., Golik M., Brandis A., Reinke H., Aharoni A., Kahana C., Asher G. // Cell Metab. 2015. V. 22. № 5. P. 874–885. https://doi.org/10.1016/j.cmet.2015.09.011
Thomas E. Dever T.E., Ivanov I.P. // J. Biol. Chem. 2018. V. 293. № 48. P. 18719–18729.
Minois N., Carmona-Gutierrez D., Madeo F. // Aging (Albany NY). 2011. V. 3. P. 716–732.
Eisenberg T., Abdellatif M., Schroeder S., Primessnig U., Stekovic S., Pendl T., Harger A., Schipke J., Zimmermann A., Schmidt A., Tong M., Ruckenstuhl C., Dammbrueck C., Gross A.S., Herbst V., Magnes C., Trausinger G., Narath S., Meinitzer A., Hu Z., Kirsch A., Eller K., Carmona-Gutierrez D., Büttner S., Pietrocola F., Knittelfelder O., Schrepfer E., Rockenfeller P., Simonini C., Rahn A., Horsch M., Moreth K., Beckers J., Fuchs H., Gailus-Durner V., Neff F., Janik D., Rathkolb B., Rozman J., de Angelis M.H., Moustafa T., Haemmerle G., Mayr M., Willeit P., von Frieling-Salewsky M., Pieske B., Scorrano L., Pieber T., Pechlaner R., Willeit J., Sigrist S.J., Linke W.A., Mühlfeld C., Sadoshima J., Dengjel J., Kiechl S., Kroemer G., Sedej S., Madeo F. // Nat. Med. 2016. V. 22. № 12. P. 1428–1438. https://doi.org/10.1038/nm.4222
Eisenberg T., Knaue H., Schauer A., Büttner S., Ruckenstuhl C., Carmona-Gutierrez D., Ring J., Schroeder S., Magnes C., Antonacci L., Fussi H., Deszcz L., Hartl R., Schraml E., Criollo A., Megalou E., Weiskof D., Laun P., Heeren G., Breitenbach M., Grubeck-Loebenstein B., Herker E., Fahrenkrog B., Fröhlich K-U., Sinner F., Tavernarakis N., Minois N., Kroemer G., Madeo F. // Nat. Cell. Biol. 2009. V. 11. P. 1305–1314. https://doi.org/10.1038/ncb1975
Ghosh I., Sankhe R., Mudgal J., Arora D., Nampoothiri M. // Neuropeptides, 2020. V. 83. P. 102083. https://doi.org/10.1016/j
Wirth A., Wolf B., Huang C.K. Glage S., Hofer S.J., Bankstahl M., Bär C., Thum T., Kahl K.G., Sigrist S.J., Madeo F., Bankstahl J.P., Ponimaskin E. // GeroScience. 2021. V. 43. P. 673–690. https://doi.org/10.1007/s11357-020-00310-0
Nakanishi S., Cleveland J.L. // Med. Sci. 2021. V. 9. № 2. P. 28. https://doi.org/10.3390/medsci9020028
Березов Т.Т., Коровкин В.Ф. // Биохимия. 1997. М.: Медицина, с. 325.
Pegg A.E. // J. Biol. Chem. 2006. V. 281. № 21. P. 14529–14532.
Pegg A.E. // Chem. Res. Toxicol. 2013. V. 26. № 12. P. 1782–1800.
Igarashi K., Kashiwagi K. // Mol. Nutr. Food Res. 2011. V. 55. № 9. P. 1332–1341.
Seller N. // Neurochemical Research. 2000. V. 25. № 4. P. 471–490.
Силачев Д.Н. и др. // Цитология. 2018. Т. 60. № 3. С. 164–172.
Kahana C. // J. Biol. Chem. 2018. V. 293(48). P. 18730–18735. https://doi.org/10.1074/jbc.TM118.003339
Soda K. // Cells. 2022. V. 11. P. 164. https://doi.org/10.3390/ cells11010164
lLarqué E., Sabater-Molina M., Zamora S. // Nutrition. 2007. V. 23. № 1. P. 87–95.
Ramos-Molina B., Queipo-Ortur, M.I., Lambertos A., Tinahones F.J., Peñafiel R. // Front. Nutr. 2019. V. 6. № 24. P. 1–15. https://doi.org/10.3389/fnut.2019.00024
Rika Hirano R., Shirasawa H., Kurihara S. // Med. Sci. 2021. V. 9. № 1. 8; https://doi.org/10.3390/medsci9010008
Murray-Stewart T., Dunworth M., Foley J.R., Schwartz C.E., Casero R.A. // Med. Sci. 2018.V. 6. № 4. 12. https://doi.org/10.3390/medsci6040112
Bupp C.P., Schultz C.R., Uhl K.L., Rajasekaran S., Bachmann A.S. // AJMG. 2018. V. 176. № 12. P. 2548–2553.
Jain V. // Med. Sci. 2018. V. 6. P. 4.
Marcoli, M., Cervetto, C. Amato S., Fiorucci C., Maura G., Mariottini P., Cervelli M. // Biomolecules. 2022. V. 12. P. 204.https://doi.org/10.3390/biom12020204
Березов Т.Т., Маклецова М.Г., Федорова Т.Н. // Анн. клин. эксперимент. неврол. 2012. Т. 6. С. 38–43.
Березов Т.Т., Маклецова М.Г., Сяткин С.П., Рихирева Г.Т., Куликова О.И., Коновалова Е.В., Федорова Т.Н. // Журнал неврологии и психиатрии им. С.С. Корсакова. 2013. Т. 113. № 7. С. 65–70.
Скачков С.Н., Антонов С.М., Итон М.Дж. // Биологические мембраны. 2016. Т. 33. № 1. С. 3–31. https://doi.org/10.7868/S0233475516010114
Nakanishi S., Cleveland J.L. // Medical Sciences. 2021. V. 9. № 2. P. 28. https://doi.org/10.3390/medsci9020028
Kovács Z., Skatchkov S.N., Veh R.W., Szabó Z., Németh K., Szabó P.T., Kardos J., Héja L. // Front. Cell. Neurosci. 2022. V. 15. P. 787319. https://doi.org/10.3389/fncel.2021.787319
Makletsova M.G., Uskova N.I., Bondarenko T.I. // Biokhimiia. 1992. V. 57. № 9. P. 1348–1351.
Guerra G.P., Rubin M.A., Mello C.F. // Pharmacol. Res. 2016. V. 112. P. 99–118. https://doi.org/10.1016/j.phrs.2016.03.023
Moinard C., Cynober L., Bandt J.-P. // Clinical Nutrition. 2005. V. 24. № 2. P. 184–197.
Kirichenko E.Y., Churyumova G.A., Logvinov A.K. // Biochem. Mosc. Suppl. Ser. Membr. Cell Biol. 2016. V. 10. № 3. P. 207–217.
Benedikt J., Inyushin M., Kucheryavykh Y.V., Rivera Y., Kucheryavykh L.Y., Nichols C.G., Eaton M.J., Skatchkov S.N. // Neuroreport. 2012. V. 23. № 17. P. 1021–1025.
Laube G., Bernstein H.-G. // Biochem J. 2017.V. 474. P. 2619–2640.
Laube G., Veh R.W. // Glia. 1997. V. 19. P. 171–179.
Hamon L., Savarin P., Pastré D.// Bioessays. 2016. V. 38. № 6. P. 498–507.
Musa H., Fenn E., Crye M., Gemel J., Beyer E.C., Veenstra R.D. // J. Physiol. 2004. V. 557. P. 863–878.
Gemel J., Lin X., Veenstra R.D., Beyer E.C. // J. Cell Sci. 2006. V. 119. P. 2258–2268.
Skatchkov S.N., Bukauskas F.F., Benedikt J., Inyushin M., Kucheryavykh Y.V. // Neuroreport. 2015. V. 26. P. 528–532.
Kucheryavykh L.Y., Benedikt J., Cubano L.A., Skatchkov S.N., Bukauskas F.F., Kucheryavykh Y.V. // Neuroreport. 2017. V. 28. № 4. P. 208–213.
Wang Q., Wang W., Aten S., Kiyoshi C.M., Du Y., Zhou M. // Brain Sci. 2020. V. 10. № 4. P. 208.
Lopatin A.N., Makhina E.N., Nichols C.G. // Nature. 1994. V. 372. P. 366–369.
Lopatin A.N., Nichols C.G. // Inward rectifiers in the heart: an update on I(K1). J Mol Cell Cardiol. 2001. V. 33. № 4. P. 625–638.
Nichols C.G., Lee S.J. // J. Biol. Chem. 2018. V. 293. P. 18779–18788.https://doi.org/10.1074/jbc.TM118.00334430333230
Polis B., Karasik D ., Samson A.O. // Aging (Albany NY). 2021. V. 13. № 7. P. 10770–10795. https://doi.org/10.18632/aging.202928
Dhara M., Matta J.A., Lei M., Knowland D., Yu H., Gu S., et al. // Nat. Commun. 2020. V. 11. P. 2799. https://doi.org/10.1038/s41467020-16629-3
Girardi B.A., Fabbrin S., Wendel A.L, Mello C.F., Rubin M.A. // Psychopharmacology (Berl.). 2020. V. 237. № 3. P. 681–693. https://doi.org/10.1007/s00213-019-05403
Geoffroy C., Paoletti P., Mony L. // J. Physiology. 2022. V. 600. № 2. P. 233–259.
Williams K., Romano C., Molinoff P.B. // Mol. Pharmacol. 1989. V. 36. № 317. P. 575–581.
Williams K., Dawson V.L., Romano C., Dichter M.A., Molinoff P.B. // Neuron. 1990. V. 5. № 318. P. 199– 208.
Williams K., Zappia A.M., Pritchett D.B., Shen Y.M., Molinoff P.B. // Mol. Pharmacol. 1994. V. 45. P. 803–809.
Williams K. // Neurosci. Lett. 1995. V. 184. № 314. P. 181–184.
Williams K. // Biochem. J. 1997. V. 325. P. 289–297.https://doi.org/10.1042/bj32502899230104
Bowie D., Mayer M.L. // Neuron. 1995. V. 15. P. 453–462. https://doi.org/10.1016/0896-6273(95)90049-77646897
Benveniste M., Mayer M.L. // J. Physiol.-Lond. 1994. V. 464. P. 131–163.
Mony L., Zhu S., Car. valho S., Paoletti P. // EMBO J. 2011. V. 30. № 15. P. 3134–3146.
Rock D.M., Macdonald R.L. // Mol. Pharmacol. 1992. V. 41. P. 83–88.
Yadav M., Parle M., Jindal D.K, Sharma N. // Biomed. Pharmacother. 2018. V. 98. P. 207–213. https://doi.org/10.1016/j.biopha.2017.12.016
Sharma S., Kumar P., Deshmukh R. // Neurochem. Int. 2018. V. 116. P. 104–11.
Ferchmin P.A., Pérez D., Biello M. // Brain Res. 2000. V. 859. P. 273–79.
Маклецова М.Г., Федорова Т.Н. // Живые и биокосные системы. 2016. Вып. 17. http://www.jbks.ru/archive/issue-17/article-2.
Nakamura M., T. Uemura, R. Saiki et al., Atherosclerosis. 2016. V. 244. P. 131–137.
Клюшников С.А. // Неврологический журнал им. Л.О. Бадаляна. 2020. Т. 1. № 3. С. 139–158.
Velloso N.A., Dalmolin G.D., Gomes G.M., Rubin M.A., Canas P.M., Cunha R.A., Mello C.F. // Neurobiology of leaening and memory. 2009. V. 92. № 4. P. 574–580.
Buttner S., Broeskamp F., Sommer C., Markaki M., Habernig L. Alavian-Ghavanini A., Carmona-Gutierrez D., Eisenberg T., Michael E., Kroemer G., Tavernarakis N., Sigrist S.J., Madeo F. // Cell Cycle. 2014. V. 13. № 24. P. 3903–3908.
Limon A., Mamdani F., Hjelm B.E., Vawter M.P., Sequeira A. // Neurosci. Biobehav. Rev. 2016. V. 66. P. 80. https://doi.org/10.1016/j.nlm.2013.04.00823632063
XianjianW., Cao W., Jia G., Zhao H, Chen X., Wu C., Tang J., Wang J., Liu G. // Animal Nutrition. 2017. V. 3. № 1. P. 85–90.
Saiki S., Sasazawa Y., Fujimaki M., Kamagata K., Kaga N., Taka H., Li Y., Souma S., Hatano T., Imamichi Y., Furuya N., Mori A., Oji Y., Ueno S.I., Nojiri S., Miura Y., Ueno T., Funayama M., Aoki S., Hattori N. // Ann. Neurol. 2019. V. 86. № 2. P. 251–263. https://doi.org/10.1002/ana.25516
Vrijsen S., Besora-Casals L., van Veen S., Zielich J., Van den Haute C., Hamouda N.N., Fischer C., Ghesquière B., Tournev I., Agostinis P., Baekelandt V., Eggermont J., Lambie E., Martin S., Vangheluwe P. // Proc. Natl. Acad. Sci. USA. 2020. V. 117. № 49. P. 31198–31207. https://doi.org/10.1073/pnas.1922342117
Makletsova M.G., Syatkin S.P., Poleshchuk V.V., Urazgildeeva G.R., Chigaleychik L.A., Sungrapova C.Y., Illarioshkin S.N. // J. Neurology Research. 2019. V. 9. № 1–2. P. 1–7. https://doi.org/10.14740/jnr509
Сяткин С.П., Свинарев В.И. // Вестник РУДН. 2010. Т. 1. С. 36–41.
Baroli G., Sanchez J.R., Agostinelli E., Mariottini P., Cervelli M. // IJMM. 2019. P. 3–9. doi.org/.https://doi.org/10.3892/ijmm.2019.4401
Chen G., Fiori L., Moquin L., Gratton A., Mamer O., Mechawar N., Turecki G. // Neuropsychopharmacology. 2010. V. 35. № 7. P. 1477–1484. https://doi.org/10.1038/npp.2010.17
Fiori L.M., Turecki G. // J. Psychiatr. Res. 2011. V. 45. № 9. P. 1229–1235. https://doi.org/10.1016/j.jpsychires.2011.03.015
Bernstein HG, Keilhoff G, Laube G, Dobrowolny H, Steiner J. // World J. Psychiatr. 2021. V. 11. №. 12. P. 1177–1190.
Liu P., Jing Y., Zhang H. // Neuroscience. 2008. V. 155. P. 789–796.
Nishimura K., Shiina R., Kashiwagi K., Igarashi K. // J. Biochem. 2006. V. 139. P. 81–90.
Schroeder S., Hofer S.J., Zimmermann A., Pechlaner R., Dammbrueck C., Pendl T., Marcello G.M., Pogatschnigg V., Bergmann M., Müller M., Gschiel V., Ristic S., Tadic J., Iwata K., Richter G., Farzi A., Üçal M., Schäfer U., Poglitsch M., Royer P., Mekis R., Agreiter M., Tölle R.C., Sótonyi P., Willeit J., Mairhofer B., Niederkofler H., Pallhuber I., Rungger G., Tilg H., Defrancesco M., Marksteiner J., Sinner F., Magnes C., Pieber T.R., Holzer P., Kroemer G., Carmona-Gutierrez D., Scorrano L., Dengjel J., Madl T., Sedej S., Sigrist S.J., Rácz B., Kiechl S., Eisenberg T., Madeo F. // Cell Repots. 2021. V. 35. № 2. P. 108985. https://doi.org/10.1016/j.celrep.2021.108985
Liang Y.T., Piao C., Beuschel C.B., Toppe D., Kollipara L., Bogdanow B., Maglione M., Lützkendorf J., See J.C.K., Huang S., Conrad T.O.F., Kintscher U., Madeo F., Liu F., Sickmann A., Sigrist S.J. // Cell Reports. 2021. V. 35. № 2. P. 108941.
Sharma P., Sharma R. // Saudi J. Bio Sci. 2021. V. 28. № 12. P. 7046–7053.
Eisenberg T., Abdellatif M., Schroeder S., Primessnig U., Stekovic S. Pendl T., Harger A., Schipke J., Zimmermann A., Schmidt A., Tong M., Ruckenstuhl C., Dammbrueck C., Gross A.S., Herbst V., Magnes C., Trausinger G., Narath S., Meinitzer A., Hu Z., Kirsch A., Eller K., Carmona-Gutierrez D., Büttner S., Pietrocola F., Knittelfelder O., Schrepfer E., Rockenfeller P., Simonini C., Rahn A., Horsch M., Moreth K., Beckers J., Fuchs H., Gailus-Durner V., Neff F., Janik D., Rathkolb B., Rozman J., de Angelis M.H., Moustafa T., Haemmerle G., Mayr M., Willeit P., von Frieling-Salewsky M., Pieske B., Scorrano L., Pieber T., Pechlaner R., Willeit J., Sigrist S.J., Linke W.A., Mühlfeld C., Sadoshima J., Dengjel J., Kiechl S., Kroemer G., Sedej S., Madeo F. // Nat. Med. 2016. V. 22. № 12. P. 1428–1438. https://doi.org/10.1038/nm.4222
Wirth M., Benson G., Schwarz C., Köbe T., Grittner U., Schmitz D., Sigrist S.J., Bohlken J., Stekovic S., Madeo F., Flöel A. // Cortex. 2018. V 109. P. 181–188.
Wirth M., Schwarz C., Benson G., Horn N., Buchert R., Lange C., Köbe T., Hetzer S., Maglione M., Michael E., Märschenz S., Mai K., Kopp U., Schmitz D., Grittner U., Sigrist S.J., Stekovic S., Madeo F., Flöel A. // Alzheimers Res. Ther. 2019. V. 11. № 1. P. 36. https://doi.org/10.1186/s13195-019-0484-1
Pekar T., Wendzel A., Flak W., Kremer A., Pauschenwein-Frantsich S., Gschaider A., Wantke F., Jarisch R. // Wien Klin. Wochenschr. 2020. V. 132. № 1–2. P. 42–46. https://doi.org/10.1007/s00508-019-01588-7
Pekar T., Bruckner K., Pauschenwein-Frantsich S., Gschaider A., Oppliger M., Willesberger J, Ungersbäck P., Wendzel A., Kremer A., Flak W., Wantke F., Jarisch R. // Wien Klin Wochenschr. 2021. V. 133. № 9–10. P. 484–491.
Hirano R., Shirasawa H., Kurihara S. // Med. Sci. 2021. V. 9. P. 8. https://doi.org/10.3390/ medsci9010008
Soda K., Uemura T., Sanayama H., Igarashi K., Fukui T. // Med. Sci. 2021. V. 9. № 2. P. 22. https://doi.org/10.3390/medsci9020022
Gilad G.M., Gilad V. // Cell Mol. Neurobiol. 2003. V. 23. P. 637–649.
Gilad G.M., Gilad V.H. // Brain Res. 2002. V. 5. P. 23–29.
Маклецова М.Г., Прокофьев В.Н., Рихирева Г.Т., Михалева И.И., Маркво Л.И., Кураев Е.Г. // Новые лекарственные препараты. 2007. Т. 3. С. 33–43.
Randi A.S., Hernandez S., Sanchez M., Schwarcz M., Kleiman D., Pisarev D.L. // Toxicol. Sci. 2003. V. 76. P. 291–298.
Sandusky-Beltran L.A., Kovalenko A., Ma C., Calahatian JI.T., Placides D.S., Watler M.D., Hunt J.B., Darling A.L., Baker J.D., Blair L.J., Martin M.D., Fontaine S.N., Dickey C.A., Lussier A.L., Weeber E.J., Selenica M.B., Nash K.R., Gordon M.N., Morgan D., Lee D.C. // Alzheimers Res. Ther. 2019. V. 11. № 1. P. 58. https://doi.org/10.1186/s13195-019-0507-y
Sandusky-Beltran L.A., Kovalenko A., Placides D.S., Ratnasamy K., Ma C., Hunt J.B., Jr., Liang H., Calahatian J.I.T., Michalski C., Fahnestock M., Blair L.J., Darling A.L., Baker J.D., Fontaine S.N., Dickey C.A., Gamsby J.J., Nash K.R., Abner E., Selenica M.B., Lee D.C. // J. Clin. Invest. 2021. V. 131. № 4. e126299. https://doi.org/10.1172/JCI126299
Prokop J.W., Bupp C.P., Frisch A., Bilinovich S.M., Campbell D.B., Vogt D., Schultz C.R., Uhl K.L., VanSickle E., Rajasekara S., Bachmann A.S. // Genes. 2021. V. 12. P. 470. https://doi.org/10.3390/genes12040470
Signor C., Mello C.F., Porto G.P., Ribeiro D.A., Rubin M.A. // Eur. J. Pharmacol. 2014. V. 730. P. 72–76. https://doi.org/10.1016/j.ejphar.2014.02.03524630833
Дополнительные материалы отсутствуют.