Нейрохимия, 2022, T. 39, № 3, стр. 217-227
Действие гипергомоцистеинемии на содержание нейротрофинов в структурах мозга беременных крыс
Ю. П. Милютина 1, 2, А. В. Арутюнян 1, А. Д. Щербицкая 1, 3, И. В. Залозняя 1
1 Федеральное государственное бюджетное учреждение “НИИ акушерства,
гинекологии и репродуктологии им. Д.О. Отта
Санкт-Петербург, Россия
2 ФГБОУ ВО “Санкт-Петербургский государственный педиатрический медицинский университет”
Минздрава
Санкт-Петербург, Россия
3 Федеральное государственное бюджетное учреждение науки институт эволюционной физиологии
и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
Поступила в редакцию 08.04.2022
После доработки 11.05.2022
Принята к публикации 13.05.2022
- EDN: AZALYU
- DOI: 10.31857/S1027813322030062
Аннотация
Гипергомоцистеинемия (ГГЦ) матери во время беременности может приводить к нарушению развития нервной системы плода и вызывать отдаленные последствия, в том числе когнитивную дисфункцию, у потомства в постнатальном периоде. Нарушение процессов метилирования и развитие окислительного стресса (ОС) относятся к одним из основных механизмов нейротоксического действия гомоцистеина и его метаболитов. Изменение уровня нейротрофинов в гиппокампе самцов крыс является одним из установленных последствий воздействия ГГЦ на взрослый организм, однако такие исследования на самках отсутствуют. В данном исследовании проводился анализ влияния ГГЦ (пероральное введение метионина с 4-го по 20-й дни беременности) на содержание нейротрофинов в растворимой фракции различных структур мозга (гиппокамп, гипоталамус, кора больших полушарий, мозжечок) крыс на 20-й день беременности. Анализ суточной динамики содержания гомоцистеина в данных структурах при введении метионина проводили на 4-й день беременности. Полученные данные свидетельствуют, что на фоне отсутствия изменения уровней проформ фактора роста нервов (NGF) и нейротрофического фактора мозга (BDNF) в растворимой фракции коры и гипоталамуса беременных крыс при ГГЦ имеет место снижение содержания зрелой формы BDNF и повышение уровня ДНК-метилтрансферазы 1 (DNMT1) на 20-й день беременности. При этом в коре отмечено повышение уровня продуктов окислительной модификации белков. Значимых изменений исследованных показателей в гиппокампе обнаружено не было, что указывает на устойчивость данной структуры мозга к токсическому влиянию ГГЦ у беременных крыс. Таким образом, патологическое действие ГГЦ при беременности проявляется в коре и гипоталамусе, что может повлечь за собой развитие тревожно-депрессивных состояний, способных негативно сказаться на состоянии здоровья как будущей матери, так и, соответственно, развивающегося плода.
ВВЕДЕНИЕ
В настоящее время активно исследуются негативные последствия влияния различных видов стресса, в том числе и гипергомоцистеинемии (ГГЦ), во время беременности, на нервную систему потомства, как в раннем, так и позднем постнатальном периоде [1–4]. Однако, значительно меньше исследований посвящено изучению влияния стресса на самих матерей [5, 6]. В частности, практически игнорируется вклад нарушений, происходящих в отдельных структурах мозга в развитие патологии беременности и послеродового периода. Влияние ГГЦ на изменение содержания нейротрофинов, в частности, нейротрофического фактора мозга (BDNF) и фактора роста нервов (NGF), в различных структурах мозга оценивается преимущественно в контексте когнитивных нарушений и психических расстройств у самцов или небеременных самок [7–11]. В связи с этим основными объектами исследования, как правило, являются гиппокамп и кора мозга. Известно также, что в развитии депрессии, принимают участие, наряду с нейротрансмиттерами и их рецепторами системы передачи внутриклеточных сигналов, процессы транскрипции генов, трансляции белков и их посттрансляционные изменения, связанные с нейротрофическими нарушениями и снижением нейропластичности в различных отделах мозга [12–15]. При этом установлено, что повышенное содержание гомоцистеина (ГЦ) относится к числу неоспоримых факторов патогенеза таких осложнений беременности, как преэклампсия, отслойка плаценты, задержка внутриутробного развития плода и незаращение нервной трубки [16–18]. Предполагают, что негативное воздействие ГЦ на организм, в том числе, организм матери, является следствием развития под влиянием этого соединения и его активных метаболитов как окислительного стресса (ОС) [19, 20], так и связанных с ним процессов апоптоза и воспаления [21–23]. Кроме того, ГЦ обладает эксайтотоксическим эффектом ввиду его структурного сходства с глутаматом [24, 25]. Накопленные данные свидетельствуют о том, что взаимодействие между факторами окружающей среды и эпигенетическими процессами, такими как метилирование ДНК и модификации хроматина, может играть роль в реализации неблагоприятных эффектов ГЦ, включая его влияние на регуляцию гипоталамо-гипофизарно-надпочечниковой системы [1]. Применение модели экспериментальной ГГЦ во время беременности является важным инструментом для понимания механизмов возможного влияния ГЦ на экспрессию нейротрофических факторов в мозге матери, которое может быть связано как с усилением ОС и активацией зависимых от уровня АФК путей апоптоза [26], так и с изменением степени метилирования ДНК и структурной реорганизации генов, ответственных за синтез этих ростовых факторов [27, 28].
Таким образом, цель данной работы состояла в оценке влияния ГГЦ во время беременности, вызванной метиониновой нагрузкой, на содержание нейротрофических факторов (BDNF и NGF), DNMT1 и продуктов окислительной модификации белков в различных структурах мозга самок крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Крысы линии Wistar были получены из Питомника лабораторных животных “Рапполово”, Ленинградская обл., Россия. Животных содержали в виварии с искусственной вентиляцией при постоянной комнатной температуре с контролируемым 12-часовым циклом света и темноты, и они получали стандартный коммерческий корм с содержанием белка 20% (ЗАО “Волосово”, “Волосовский комбикормовый завод”, Ленинградская обл., Россия) и воду.
Однократное введение метионина для анализа суточной динамики изменения уровня ГЦ в различных структурах мозга самок крыс. В данном эксперименте использовали однократное пероральное введение 0.15%-го водного раствора L-метионина (0.6 г/кг массы животного) на 4-й день беременности. Исследование выполнено на 30 самках крыс. Уровень ГЦ оценивали в гипоталамусе, гиппокампе, коре и мозжечке на иммунохемилюминесцентном анализаторе “Architect i1000” (Abbott, США) до введения метионина, через 1, 3, 6 и 24 ч после его введения. Образцы тканей структур мозга были гомогенизированы на льду в соотношении 1 : 1 (w/v) в PBS, pH 7.4 (Sigma-Aldrich, США). Полученные гомогенаты центрифугировали при 16000 g в течение 20 мин для удаления клеточного дебриса. Концентрирование супернатантов проводили с использованием вакуумного концентратора Labconco (США). Концентрацию общего белка в пробах оценивали по методу Бредфорда на спектрофотометре NanoDrop One (Thermo Scientific, USA) [29].
Хроническое введение метионина для анализа содержания нейротрофинов, DNMT1 и окислительной модификации белков в различных структурах мозга беременных самок крыс. В эксперименте использовали хроническое ежедневное пероральное введение раствора L-метионина. Животные были разделены на две группы. Первая группа (контрольная, n = 6) состояла из самок крыс, находившихся на стандартном рационе с дополнительным ежедневным пероральным введением питьевой воды с 4 по 20 день беременности. Вторую группу (n = 6) составили самки, которым также в этот период беременности на фоне стандартного корма и воды ежедневно, один раз в сутки, перорально вводили 0.15%-й водный раствор L‑метионина (0.6 г/кг массы животного). На 20‑й день беременности самок обеих групп декапитировали, образцы ткани мозга хранили при ‒80°С до времени анализа.
Иммуноблотинг. Образцы тканей структур мозга гомогенизировали на льду в соотношении 1 : 2 (w/v) в PBS, pH 7.4 (Sigma-Aldrich, США). Полученные гомогенаты центрифугировали при 16 000 g и +4°C в течение 20 мин для удаления нерастворенных белков и клеточного дебриса. Концентрацию общего белка в супернатантах оценивали по методу Бредфорда. Образцы с равным содержанием белка (50 мкг) смешивали с 2x буфером для образцов (62.5 mM Tris-HCl, pH 6.8, 2% SDS, 25% глицерин, 0.01% бромфеноловый синий, 5% β-меркаптоэтанол) (Laemmli Sample Buffer, Bio-Rad, США), инкубировали 5 мин при 98°С. Электрофорез проводили в денатурирующих условиях по методу Laemmli в 10%-м SDS-полиакриламидном геле (TGS Stain-Free FastCast Acrylamide Kit, Bio-Rad, США), в трис-глициновом буфере (10× Tris/Glycine/SDS Buffer, Bio-Rad, США). Белки визуализировали с использованием технологии stain-free в системе гель-документации ChemiDocTM Touch Imaging system (Bio-Rad, США) и переносили на PVDF-мембрану в трансфер-буфере (Bio-Rad, США), содержащем 20% этанола. Относительное содержание BDNF, NGF и DNMT1 выявляли с помощью специфичных первичных антител Anti-BDNF [EPR1292] (rabbit Ab 1 : 1000, Abcam, США), anti-NGF [EP1320Y] (rabbit Ab 1 : 1000, Abcam, США), которые распознают иммунореактивные формы NGF ~ 30 кДа и DNMT1 (D63A6) (rabbit Ab, 1 : 1000, Cell Signaling Technology, США). После инкубации с HRP-конъюгированными козьими антителами против кролика или мыши (1 : 1000, Bio-Rad, США), сигналы регистрировали с помощью усиленной хемилюминесценции (Clarity Western ECL Substrate, Bio-Rad, США). Интенсивность полос, полученных в результате иммуноблотинга, определяли с помощью программного обеспечения ImageLab. Полученные данные, были нормализованы по глицеральдегид-3-фосфат дегидрогеназе (GAPDH (14C10) Rabbit Ab, 1 : 1000, Cell Signaling Technology). Содержание показателей в каждой структуре мозга в группе животных с ГГЦ оценивали относительно его содержания в соответствующих структурах в группе контроля.
Определение окислительной модификации белков. Анализ осуществляли с использованием набора OxyBlot™ Protein Oxidation Detection Kit (Merck Millipore, США) согласно протоколу производителя, в основе которого лежит метод дериватизации окисленных карбонильных групп белков при помощи 2.4-динитрофенилгидразина в течение 15 мин при комнатной температуре с образованием 2.4-динитрофенилгидразонов белков [30]. Для этого к 5 мкл супернатанта, полученного способом, описанным выше, содержащего 15 мкг общего белка добавляли 5 мкл 12% SDS и 10 мкл раствора 2.4-динитрофенилгидразина и инкубировали при комнатной температуре в течение 15 мин. Реакцию останавливали добавлением 7.5 мкл нейтрализующего буфера. После добавления 1.5 мкл β‑меркаптоэтанола, 25 мкл образца, содержащего 13 мкг общего белка, загружали в лунки 10%-го SDS-полиакриламидного геля (TGS Stain-Free FastCast Acrylamide Kit, Bio-Rad, США). Электрофорез проводили в трис-глициновом буфере (10× Tris/Glycine/SDS Buffer, Bio-Rad, США). Белки визуализировали с использованием технологии stain-free в системе гель-документации ChemiDocTM Touch Imaging system (Bio-Rad, США) для последующей нормализации результатов, и переносили на PVDF-мембрану в трансфер-буфере (Bio-Rad, США), содержащем 20% этанола. Мембрану блокировали в 1%-м растворе бычьего сывороточного альбумина на TBS-буфере (pH 7.5), содержащем 0.1% Tween-20, в течение 1.5 ч и инкубировали с первичными антителами, специфичными к модифицированным карбонильным группам белков (Anti-DNP Rabbit Ab, 1 : 150, Merck Millipore, США). Далее, после инкубации с соответствующими HRP-конъюгированными козьими моноклональными антителами (Goat Anti-Rabbit Ig (H + L)-HRP, 1 : 1000, BioRad, США) сигналы визуализировали с помощью усиленной хемилюминесценции (Clarity Western ECL Substrate BioRad, США). Денситометрическую интенсивность зоны разделения белков каждого образца, полученных в результате иммуноблотинга, анализировали с помощью программного обеспечения ImageLab (Bio-Rad, США). На основании существующих рекомендаций по нормализации содержания белка [31] полученные данные, которые оценивались как суммарная денситометрия всей зоны разделения белков каждого образца, были нормализованы по содержанию общего белка в геле, определяемого с помощью технологии stain-free (BioRad, США) согласно инструкции производителя с использованием программы ImageLab (Bio-Rad, США).
Статистическая обработка результатов. Нормальность распределения данных проверяли с помощью критерия Шапиро-Уилка. Для проверки равенства дисперсий использовали критерий Левена. Статистический анализ был выполнен с помощью программы STATISTICA 10.0. Статистическая обработка полученных данных проведена с использованием параметрического t-критерия Стьюдента для независимых выборок. При проведении множественного сравнения использован непараметрический H-критерий Крускала-Уоллиса. Непрерывные переменные с нормальным распределением представлены как среднее арифметическое ± стандартная ошибка среднего (M ± SEM). Медианы [25-ая–75-ая перцентили] использовались, когда нормальное распределение отсутствовало. Различия при p < 0.05 считались статистически значимыми.
РЕЗУЛЬТАТЫ
Повышение уровня гомоцистеина в отделах мозга самок крыс при метиониновой нагрузке. В различных отделах головного мозга при однократной метиониновой нагрузке происходит повышение уровня ГЦ (рис. 1). Показано, что в норме у молодых половозрелых самок крыс, до введения метионина, содержание ГЦ в мозжечке и гиппокампе выше его уровня в коре и гипоталамусе. При этом значимое повышение уровня ГЦ отмечено в трех исследованных отделах. Так в гиппокампе максимальный подъем ГЦ показан через 6 ч. после введения метионина, тогда как в коре и гипоталамусе – через 3 ч. При этом через 24 ч содержание ГЦ в них не отличается от значения данного показателя до введения метионина. Таким образом показано, что выбранная схема введения метионина уже с первого дня приводит к повышению содержания ГЦ в данных структурах мозга, что предполагает также подобное его повышение во все последующие дни беременности, при ежедневном введении метионина каждые 24 ч. В мозжечке, наблюдаются значительные индивидуальные различия в характере изменения содержании ГЦ при введении метионина, на что указывает высокий уровень межквартильных интервалов данного показателя в исследуемые временные периоды, в связи с чем, время максимального подъема уровня ГЦ в мозжечке после метиониновой нагрузки не было установлено.
Рис. 1.
Суточная динамика изменения ГЦ в различных отделах мозга самок крыс после однократного введения метионина на 4-й день беременности (n = 4–8 в каждой исследованной группе). Данные представлены как Медианы, 25-, 75-ая перцентиль, минимальное и максимальное значение. * р < 0.05.

Изменение содержания нейротрофинов в структурах мозга при ГГЦ. При анализе содержания BDNF во фракции растворимых белков тканей мозга методом иммуноблотинга у взрослых животных были выявлены 3 изоформы BDNF (39, 29 и 14 кДа) (рис. 2а). Анализ содержания нейротрофинов в различных отделах мозга самок крыс на 20-ый день беременности показал, что в коре и гипоталамусе на фоне экспериментальной ГГЦ снижается содержание изоформы BDNF с молекулярной массой 14 кДа, что соответствует его зрелой форме (рис. 2б, г). В коре также отмечено снижение содержание его про-формы 29 кДа. При этом в гиппокампе и мозжечке содержание различных изоформ BDNF у беременных самок крыс при ГГЦ не отличалось от их уровня у контрольных беременных животных (рис. 2в, д). Под влиянием ГГЦ уровень NGF не изменялся ни в одной из исследованных областей мозга беременных самок крыс (рис. 3).
Рис. 2.
Содержание различных изоформ BDNF в мозге беременных самок крыс на 20-й день беременности в норме и при ГГЦ. а – репрезентативный иммуноблотинг содержания трех изоформ BDNF в различных отделах мозга самок крыс на 20-й день беременности; данные денситометрии содержания BDNF в гипоталамусе (б), гиппокампе (в), коре (г) и мозжечке (д) беременных самок крыс. Значения содержания изоформ в каждой структуре мозга в группе животных с ГГЦ, соответственно, нормализованы к их содержанию в контрольной группе самок с нормальной беременностью. Данные представлены как M ± SEM, (n = 6 в каждой группе). * р < 0.05 достоверные различия значения показателя в группе беременных самок с ГГЦ и группе контроля.

Рис. 3.
Содержание NGF в мозге беременных самок крыс на 20-й день беременности в норме и при ГГЦ. а – репрезентативный иммуноблотинг содержания NGF в различных отделах мозга самок крыс на 20-й день беременности; б – данные денситометрии о влиянии ГГЦ на содержание NGF в гипоталамусе, гиппокампе, коре и мозжечке беременных самок крыс. Значения содержания NGF в каждой структуре мозга в группе животных с ГГЦ соответственно нормализованы к его содержанию в контрольной группе самок с нормальной беременностью. Данные представлены как M ± SEM, (n = 6 в каждой группе).

Изменение содержания DNMT1 в отдельных отделах мозга при ГГЦ. У животных при ГГЦ было обнаружено повышение содержания DNMT1 в растворимой фракции коры, гипоталамуса и мозжечка по сравнению с контрольными животными. При этом в гиппокампе оно значимо не отличалось в группе контрольных животных с нормальной физиологической беременностью без ГГЦ, и в группе беременных самок с ГГЦ (рис. 4).
Рис. 4.
Содержание DNMT1 в мозге беременных самок крыс на 20-й день беременности в норме и при ГГЦ. а – репрезентативный иммуноблот содержания DNMT1 в различных отделах мозга самок крыс на 20-й день беременности; б – влияние ГГЦ на содержание DNMT1 в гипоталамусе, гиппокампе, коре и мозжечке беременных самок крыс. Значения DNMT1 в каждой структуре мозга в группе животных с ГГЦ соответственно нормализованы по его содержанию в контрольной группе самок с нормальной беременностью без ГГЦ. Данные представлены как M ± SEM, (n = 6 в каждой группе). * р < 0.05; ** p < 0.01 – достоверные различия между группой беременных самок с ГГЦ и контролем.

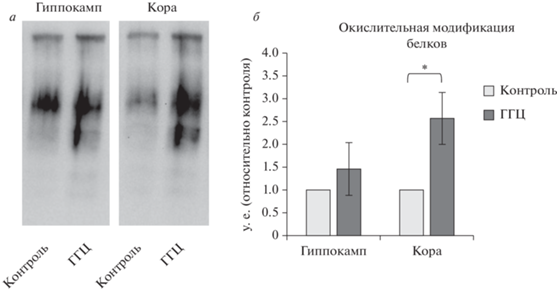
Окислительная модификация белков в коре и гиппокампе мозга беременных самок крыс при ГГЦ. Анализ белков с применением метода OxyBlot™ Protein Oxidation Detection показал увеличение степени окислительной модификации белков в растворимой фракции коры мозга самок крыс с ГГЦ на 20-й день беременности по сравнению с контрольными беременными самками (p < 0.05). При этом содержание продуктов окислительной модификации белков в гиппокампе у животных, находящихся на хронической метиониновой нагрузке, значимо не отличалось от его уровня в гиппокампе контрольных животных, и повышение данного показателя носило лишь характер тенденции (рис. 5).
Рис. 5.
Относительный уровень окислительной модификации белков (OxyBlot™) в растворимой фракции гиппокампа и коры на 20-ый день беременности в норме и при ГГЦ. а – репрезентативный oxyblot содержания продуктов окислительной модификации белков в гиппокампе и коре мозга самок крыс на 20-ый день беременности; б – количественный анализ влияния ГГЦ на содержание продуктов окислительной модификации белков в гиппокампе и коре беременных самок крыс. Значения в каждой структуре мозга в группе животных с ГГЦ соответственно нормализованы по его содержанию в контрольной группе самок с нормальной беременностью. Данные представлены как M ± SEM, (n = 4 в каждой группе). * р < 0.05; – достоверные различия показателей в группе беременных самок с ГГЦ и группе контроля.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нейротрофины являются регуляторами функции нейронов в развивающемся и взрослом мозге и, таким образом, играют важную роль в развитии и поддержании его нормального функционирования. Наиболее изученным нейтрофином является BDNF. Полученные нами данные свидетельствуют, что в норме содержание BDNF во фракции легко растворимых белков гиппокампа крыс выше, чем в коре, что согласуется с данными, полученными на мышах [11]. В связи с тем, что одним из основных, наблюдаемых эффектов воздействия ГГЦ, является когнитивная дисфункция, кора и гиппокамп преимущественно являются основными объектами изучения нейротрофинов [32]. Имеются данные о том, что введение ГЦ в течение 7 дней вызывало снижение экспрессии BDNF в гиппокампе крыс и увеличивало количество TUNEL-позитивных нейронов в области СА1. При этом увеличение эндогенной продукции H2S и экспрессии BDNF значительно понижало индуцированный ГЦ апоптоз нейронов и стресс-реакцию эндоплазматического ретикулума (ER) в гиппокампе [33]. Внутримозговая инъекция ГЦ вызывала повышенную экспрессию рецепторов NMDA и их мРНК, а также снижала экспрессию белка BDNF и мРНК BDNF в гиппокампе мышей, при этом было показано, что ГЦ приводит к ремоделированию синапсов в гиппокампе [8]. В ряде исследований также показано, что у крыс с ГГЦ снижены уровни BDNF в спинномозговой жидкости и гиппокампе [7, 34], в том числе именно в модели с метиониновой нагрузкой [34]. Также было показано, что однократное (“острое”) введение ГЦ приводит к снижению зрелой формы BDNF (mBDNF) в гиппокампе уже через 1 ч после введения, при этом, данный эффект нивелировался через 24 ч, однако изменений уровня BDNF в коре не было обнаружено ни через 1 ч, ни через 24 ч [7]. Однако некоторые расхождения в результатах, продемонстрированных в данной работе и в нашем исследовании, могут явиться следствием различий в способе выделения анализируемых белков. Ряд исследователей также отмечает, что ГГЦ, вызванная хронической метиониновой нагрузкой в течение 2–6 мес., не приводит к статистически значимому снижению BDNF в коре [9]. Однако в проведенном нами исследовании показано, что у беременных крыс происходит снижение содержания изоформы BDNF с молекулярной массой 14 кДа, соответствующей mBDNF в коре и гипоталамусе, при этом, в отличие от других исследователей, мы не обнаружили значимого изменения содержания ни одной из изоформ BDNF в гиппокампе и мозжечке. Необходимо отметить, что представленные ранее экспериментальные работы были выполнены преимущественно на самцах, либо небеременных самках. В связи с этим, нельзя исключить, что отсутствие изменений уровня BDNF в гиппокампе беременных самок крыс при ГГЦ, полученное в нашем исследовании, по сравнению с его снижением, отмеченном во множестве других работ, выполненных на небеременных самках, может быть обусловлено тем что, что организм при беременности способен адаптивно обеспечить защиту от неблагоприятного воздействия ГГЦ. Подобное заключение было также сделано другими исследователями при сравнении эффектов иммобилизационного стресса на индукцию апоптоза нейронов гиппокампа у небеременных и беременных самок крыс [35], что в совокупности с полученными нами результатами может косвенно свидетельствовать об усилении нейропластичности при беременности.
В проведенном нами исследовании метиониновая нагрузка беременных самок крыс в течение 16 дней не приводила к изменению уровня NGF ни в одной из исследованных структур. В данном случае, NGF, определяемый как изоформа 30 кДа, соответствует его про-форме. Другими исследователями также показано, что только длительное введение ГЦ, в течение 15 мес., приводит к повышению уровня NGF в коре мозга крыс, при этом даже 5-месячное введение ГЦ не сопровождается изменением данного показателя [36]. Интерес представляет тот факт, что, как показано нами в предыдущих исследованиях, у самок крыс на 20-ый день беременности под влиянием экспериментальной ГГЦ в плаценте повышаются уровни proBDNF и proNGF, что, как мы предполагали связано с повышением экспрессии их генов и с возможным нарушением процессинга до зрелых форм [37]. Установлено, что proBDNF и mBDNF оказывают различное влияние на выживание и функционирование нейронов. В отличие от mBDNF, proBDNF специфически связывается с рецептором р75 нейротрофинов (p75NTR), активация которого приводит к снижению пролиферации нейронов и усилению процессов апоптоза [38]. Кроме того, proBDNF оказывает негативное влияние на нейрональные механизмы, участвующие в процессах обучения и памяти, что также указывает на противоположную роль, которую он играет по сравнению с mBDNF в развитии синаптической пластичности [39].
Важность исследования изменений в гипоталамусе при ГГЦ беременных обусловлена тем, что гормоны гипоталамо-гипофизарно-надпочечниковой системы, являющиеся критическим компонентом системы стресса, оказывают метаболическое/гомеостатическое действие практически на все системы организма, способствуют восстановлению после стресса и важны для реализации нормальных когнитивных и психологических функций [40, 41]. При этом было показано, что повышенный уровень ГЦ в период беременности может приводить к снижению у матерей экспрессии генов ферментов одноуглеродного метаболизма в гиппокампе потомства крыс, но не в гипоталамусе [1].
Наиболее распространенное представление о том, что в условиях ГГЦ и накопления S-аденозил-гомоцистеина (SAH), а, следовательно, ингибирования большинства метилтрансфераз, наблюдается снижение как общего метилирования, так и метилирования промоторов отдельных генов, что ведет к увеличению экспрессии S-аденозилметионина (SAM), в настоящее время рассматривается уже не так однозначно. Действительно, большое количество исследований подтверждают тот факт, что ГГЦ может приводить к глобальному гипометилированию ДНК [28, 42]. ГЦ-индуцированное гипометилирование ДНК промоторных областей гена приводит к селективной активации генов, что способствует усиленному повреждению клеток [43]. Эти результаты отчасти подтверждаются в исследованиях на культурах клеток. Так в отдельных исследованиях было показано, что изменение концентрации SAH и соотношения SAH/SAM при воздействии ГЦ может приводить к снижению активности и экспрессии белков ДНК-метилтрансфераз (DNMT) в нейрональных стволовых клетках [44], при этом в других работах получены противоположные данные, свидетельствующие об увеличении содержания DNMT1 [45], активирующей метилирование полуметилированных сайтов CpG. Необходимо отметить, что в растворимой фракции белков гиппокампа, в отсутствие изменений содержания нейротрофинов, не происходит также и изменения содержания DNMT1. Несмотря на то, что данные других исследований указывают на то, что гиппокамп наиболее восприимчив к окислительному стрессу (ОС), тогда как кора является более устойчивой структурой [15, 46], в нашей работе при ГГЦ в гиппокампе не обнаружены признаки развития ОС, в отличие от коры, в которой на фоне ГГЦ уровень окислительной модификации белков повышается более чем в 2 раза, по сравнению с контролем. Однако, повышение уровня ГЦ после введения метионина отмечено в обеих этих структурах. Изменение содержания и активности метилтрансфераз в цитоплазматической (растворимой) фракции различных отделов мозга, вероятно, зависит от накопления в них самого ГЦ и его метаболитов. Имеются сведения о распределении SAM в различных отделах головного мозга, в том числе, рассматриваемых в нашем исследовании. Так показано, что в норме, содержание SAM в них имеет значительные различия. При этом наибольшее его количество обнаружено в коре и гиппокампе и существенно ниже в мозжечке и гипоталамусе [47]. При этом авторы отмечают, что при гипофизэктомии в различных структурах мозга уровень SAM претерпевает разнонаправленные изменения, а в некоторых, не изменяется вообще. Эти результаты свидетельствуют о том, что в различных отделах мозга представлено разнообразие факторов, регулирующих уровни SAM in vivo. На основании наших данных подобное заключение справедливо и в отношении уровня и скорости метаболизма ГЦ. Мы также выявили значительные отличия в уровне ГЦ в различных отделах мозга. Кроме того, при введении метионина, динамика его изменения в гипоталамусе и коре отличалась от гиппокампа, тогда как наличие существенных индивидуальных особенностей метаболизма метионина у отдельных животных не позволило вообще достоверно определить единое время максимального подъема ГЦ в мозжечке. Ранее, мы уже отмечали, что как у молодых половозрелых, так и у беременных самок крыс, метиониновая нагрузка уже через час приводит к повышению уровня ГЦ в сыворотке крови [37, 48]. Максимальная концентрация ГЦ у большинства животных достигается через 3, либо 6 ч после введения. При этом через 24 ч его уровень значительно снижается, но сохраняется повышенным относительно уровня до введения метионина только у небеременных самок, что указывает на более активный метаболизм ГЦ при беременности [37, 48]. Известно, что метионин способен проникать через гематоэнцефалический барьер [49–51]. В мозге его оптимальный уровень отмечается уже через 15–30 мин после инъекции [52]. Транспорт ГЦ, образующегося при метаболизме метионина, опосредован различными транспортными системами клеток [53, 54]. Он имеет общие транспортеры с другими нейтральными аминокислотами [53, 55], что предполагает возможность его транспорта через гематоэнцефалический барьер. В связи с этим, благодаря интенсивному транспорту метионина и ГЦ в исследуемые структуры мозга, непосредственно в них может быть реализован нейротоксический эффект как самого ГЦ, так и его метаболитов. Для выяснения вопроса о том, является ли повышение содержания ГЦ в ткани мозга при ГГЦ результатом повышения его транспорта или он синтезируется из поступающего в мозг метионина, потребуются дополнительные исследования.
Эффективный гидролиз SAH S-аденозилгомоцистеингидролазой (SAHH) необходим для поддержания реакций метилирования. Показано, что SAHH взаимодействует с DNMT1 и усиливает ее функциональный статус в клетках млекопитающих [56]. Кроме того, SAHH контролирует циркадную экспрессию генов, взаимодействуя с основным активатором транскрипции CLOCK и BMAL1. У мышей ингибирование SAHH в гипоталамусе изменяет циркадную двигательную активность и ритмическую транскрипцию в супрахиазматическом ядре [57]. При этом циркадианные ритмы, в частности катехоламинов, в структурах гипоталамуса половозрелых самок крыс, связанных с регуляцией репродуктивной функции, могут нарушаться при ГГЦ [58]. В связи с этим, данные о повышении ГЦ в гипоталамусе, а также снижении mBDNF и увеличении содержания DNMT1 в его цитозольной фракции необходимо учитывать при анализе эффектов влияния ГГЦ на функции, находящиеся под контролем гипоталамической регуляции.
В настоящее время большое внимание уделяется изучению процессов метилирования нейротрофических факторов, в частности, BDNF при действии неблагоприятных факторов на организм в период беременности. Это позволяет на основании экспериментальных данных рассматривать изменение уровня ДНК-метилирования BDNF в различных отделах мозга в качестве биомаркера нарушений в раннем онтогенезе потомства [59, 60]. Важным результатом проведенного нами исследования является также тот факт, что несмотря на то, что в гиппокампе при метиониновой нагрузке беременных крыс, а также в коре и в гипоталамусе наблюдается повышение уровня ГЦ, значимых эффектов хронической ГГЦ в период беременности в данной структуре на уровне исследованных показателей не обнаружено. При этом в коре на фоне ГГЦ происходит снижение уровня mBDNF и про-формы BDNF 29 кДа, повышение содержания DNMT1 и увеличение продуктов окислительной модификации во фракции растворимых белков, указывающих на развитие ОС.
ЗАКЛЮЧЕНИЕ
Таким образом, при ГГЦ во время беременности динамика изменения ГЦ при метиониновой нагрузке, а также содержание неротрофинов и DNMN1 во фракции растворимых белков претерпевают различные изменения в разных структурах мозга. При этом в гиппокампе изменений в содержании нейротрофинов и DNMN1 не обнаружено. Эти результаты свидетельствуют о том, что в различных отделах мозга действуют разные системы, регулирующие уровень ГЦ и его метаболитов in vivo, которые могут существенно изменяться с наступлением беременности. Подавляющее большинство исследований, посвящено изучению нейротоксического воздействия неблагоприятных факторов, в том числе ГГЦ, на плод и новорожденного. Однако, накапливается множество экспериментальных и клинических фактов, доказывающих, что эпигенетические модификации при беременности вызывают метаболические изменения в структурах мозга, сопровождающиеся нейропатологическими процессами [61], которые могут способствовать развитию депрессивных состояний и сказываться на здоровье матери [62]. Это делает исследования влияния ГГЦ на мозг во время беременности особенно актуальными и своевременными.
Список литературы
Ngai Y.F., Sulistyoningrum D.C., O’Neill R., Innis S.M., Weinberg J., Devlin A.M. // Am J Physiol Regul Integr Comp Physiol. 2015. V. 309. № 5. P. R613–622.
Shcherbitskaia A.D., Vasilev D.S., Milyutina Y.P., Tumanova N.L., Mikhel A.V., Zalozniaia I.V., Arutjunyan A.V. // Cells. 2021. V. 10. № 6. P.
Yakovleva O., Bogatova K., Mukhtarova R., Yakovlev A., Shakhmatova V., Gerasimova E., Ziyatdinova G., Hermann A., Sitdikova G. // Biomolecules. 2020. V. 10. № 7. P.
Shcherbitskaia A.D., Vasilev D.S., Milyutina Y.P., Tumanova N.L., Zalozniaia I.V., Kerkeshko G.O., Arutjunyan A.V. // Neurotox Res. 2020. V. 38. № 2. P. 408–420.
Wang J., Ge J., Yang L., Zhang H., Li X., Xue D. // Neural Regen Res. 2012. V. 7. № 28. P. 2199–2205.
Maghsoudi N., Ghasemi R., Ghaempanah Z., Ardekani A.M., Nooshinfar E., Tahzibi A. // Basic Clin. Neurosci. 2014. V. 5. № 2. P. 131–137.
Matte C., Pereira L.O., Dos Santos T.M., Mackedanz V., Cunha A.A., Netto C.A., Wyse A.T. // Neuroscience. 2009. V. 163. № 4. P. 1039–1045.
Kamat P.K., Kyles P., Kalani A., Tyagi N. // Mol. Neurobiol. 2016. V. 53. № 4. P. 2451–2467.
de Rezende M.M., D’Almeida V. // PLoS One. 2014. V. 9. № 8. P. e105704.
Baloula V., Fructuoso M., Kassis N., Gueddouri D., Paul J.L., Janel N. // Redox Biol. 2018. V. 19. № P. 200–209.
Souchet B., Latour A., Gu Y., Daubigney F., Paul J.L., Delabar J.M., Janel N. // J. Mol. Neurosci. 2015. V. 55. № 2. P. 318–323.
Luo J., Tang C., Chen X., Ren Z., Qu H., Chen R., Tong Z. // Int. J. Environ. Res. Public Health. 2020. V. 17. № 6.
Nestler E.J., Barrot M., DiLeone R.J., Eisch A.J., Gold S.J., Monteggia L.M. // Neuron. 2002. V. 34. № 1. P. 13–25.
Kang J., Wang D., Duan Y., Zhai L., Shi L., Guo F. // Brain Sci. 2020. V. 11. № 1.
Dionisie V., Ciobanu A.M., Toma V.A., Manea M.C., Baldea I., Olteanu D., Sevastre-Berghian A., Clichici S., Manea M., Riga S., Filip G.A. // Int. J. Mol. Sci. 2021. V. 22. № 14.
Hague W.M. // Best Pract. Res. Clin. Obstet Gynaecol. 2003. V. 17. № 3. P. 459–469.
Cotter A.M., Molloy A.M., Scott J.M., Daly S.F. // Am. J. Obstet Gynecol. 2003. V. 189. № 2. P. 391–394; discussion 394–396.
Murphy M.M. // Biomark Med. 2007. V. 1. № 1. P. 145–157.
Jakubowski H. // Cell Mol. Life Sci. 2004. V. 61. № 4. P. 470–487.
Powers R.W., Gandley R.E., Lykins D.L., Roberts J.M. // Hypertension. 2004. V. 44. № 3. P. 327–333.
Xi H., Zhang Y., Xu Y., Yang W.Y., Jiang X., Sha X., Cheng X., Wang J., Qin X., Yu J., Ji Y., Yang X., Wang H. // Circ. Res. 2016. V. 118. № 10. P. 1525–1539.
Zanin R.F., Bergamin L.S., Morrone F.B., Coutinho-Silva R., de Souza Wyse A.T., Battastini A.M. // Purinergic Signal. 2015. V. 11. № 4. P. 463–470.
Kasture V.V., Sundrani D.P., Joshi S.R. // Life Sciences. 2018. V. 206. P. 61–69.
Poddar R., Chen A., Winter L., Rajagopal S., Paul S. // J Neurochem. 2017. V. 142. № 4. P. 560–573.
Boldyrev A.A. // Biochemistry (Mosc). 2009. V. 74. № 6. P. 589–598.
Cai B., Li X., Wang Y., Liu Y., Yang F., Chen H., Yin K., Tan X., Zhu J., Pan Z., Wang B., Lu Y. // PLoS One. 2013. V. 8. № 5. P. e63561.
Dhobale M.V., Pisal H.R., Mehendale S.S., Joshi S.R. // Int J Dev Neurosci. 2013. V. 31. № 8. P. 719–723.
Jiang Y., Sun T., Xiong J., Cao J., Li G., Wang S. // Acta Biochim Biophys Sin (Shanghai). 2007. V. 39. № 9. P. 657–667.
Bradford M.M. // Anal Biochem. 1976. V. 72. № P. 248–254.
Levine R.L., Garland D., Oliver C.N., Amici A., Climent I., Lenz A.G., Ahn B.W., Shaltiel S., Stadtman E.R. // Methods Enzymol. 1990. V. 186. № P. 464–478.
Bass J.J., Wilkinson D.J., Rankin D., Phillips B.E., Szewczyk N.J., Smith K., Atherton P.J. // Scand J Med Sci Sports. 2017. V. 27. № 1. P. 4–25.
Fang M., Wang J., Yan H., Zhao Y.X., Liu X.Y. // Mol Med Rep. 2014. V. 10. № 5. P. 2511–2516.
Wei H.J., Xu J.H., Li M.H., Tang J.P., Zou W., Zhang P., Wang L., Wang C.Y., Tang X.Q. // Acta Pharmacol Sin. 2014. V. 35. № 6. P. 707–715.
Gao L., Zeng X.N., Guo H.M., Wu X.M., Chen H.J., Di R.K., Wu Y. // Neurol Sci. 2012. V. 33. № 1. P. 39–43.
Moosavi M., Ghasemi R., Maghsoudi N., Rastegar K., Zarifkar A. // European Journal of Obstetrics & Gynecology and Reproductive Biology. 2011. V. 158. № 2. P. 199–203.
Pirchl M., Ullrich C., Humpel C. // Eur J Neurosci. 2010. V. 32. № 9. P. 1516–1527.
Arutjunyan A.V., Milyutina Y.P., Shcherbitskaia A.D., Kerkeshko G.O., Zalozniaia I.V., Mikhel A.V. // Biochemistry (Mosc). 2020. V. 85. № 2. P. 213–223.
Sasi M., Vignoli B., Canossa M., Blum R. // Pflugers Arch. 2017. V. 469. № 5–6. P. 611.
Dincheva I., Lynch N.B., Lee F.S. // Depress Anxiety. 2016. V. 33. № 10. P. 907–916.
de Kloet E.R., Joels M., Holsboer F. // Nat Rev Neurosci. 2005. V. 6. № 6. P. 463–475.
Lupien S., Lecours A.R., Lussier I., Schwartz G., Nair N.P., Meaney M.J. // J Neurosci. 1994. V. 14. № 5 Pt 1. P. 2893–2903.
Yi P., Melnyk S., Pogribna M., Pogribny I.P., Hine R.J., James S.J. // J Biol Chem. 2000. V. 275. № 38. P. 29318–29323.
Kim C.S., Kim Y.R., Naqvi A., Kumar S., Hoffman T.A., Jung S.B., Kumar A., Jeon B.H., McNamara D.M., Irani K. // Cardiovasc Res. 2011. V. 92. № 3. P. 466–475.
Lin N., Qin S., Luo S., Cui S., Huang G., Zhang X. // FEBS J. 2014. V. 281. № 8. P. 2088–2096.
Jia S.J., Lai Y.Q., Zhao M., Gong T., Zhang B.K. // Pharmazie. 2013. V. 68. № 4. P. 282–286.
Salim S. // J. Pharmacol. Exp. Ther. 2017. V. 360. № 1. P. 201–205.
Wong D.L., Zager E.L., Ciaranello R.D. // J. Neurosci. 1982. V. 2. № 6. P. 758–764.
Arutyunyan A.V., Milyutina Y.P., Zaloznyaya I.V., Pustygina A.V., Kozina L.S., Korenevskii A.V. // Neurochemical Journal. 2012. V. 6. № 1. P. 71–76.
Young S.N., Shalchi M. // J. Psychiatry Neurosci. 2005. V. 30. № 1. P. 44–48.
He W., Wu G. // Adv. Exp. Med. Biol. 2020. V. 1265. № P. 167–185.
Wu G. // Amino Acids: Biochemistry and Nutrition, 2021. 816 p.
Streck E.L., Vieira P.S., Wannmacher C.M., Dutra-Filho C.S., Wajner M., Wyse A.T. // Metab. Brain Dis. 2003. V. 18. № 2. P. 147–154.
Jiang X., Yang F., Brailoiu E., Jakubowski H., Dun N.J., Schafer A.I., Yang X., Durante W., Wang H. // Arterioscler. Thromb. Vasc. Biol. 2007. V. 27. № 9. P. 1976–1983.
Tsitsiou E., Sibley C.P., D’Souza S.W., Catanescu O., Jacobsen D.W., Glazier J.D. // J. Inherit. Metab. Dis. 2011. V. 34. № 1. P. 57–65.
Budy B., O’Neill R., DiBello P.M., Sengupta S., Jacobsen D.W. // Arch. Biochem. Biophys. 2006. V. 446. № 2. P. 119–130.
Ponnaluri V.K.C., Esteve P.O., Ruse C.I., Pradhan S. // J. Mol. Biol. 2018. V. 430. № 14. P. 2051–2065.
Greco C.M., Cervantes M., Fustin J.M., Ito K., Ceglia N., Samad M., Shi J., Koronowski K.B., Forne I., Ranjit S., Gaucher J., Kinouchi K., Kojima R., Gratton E., Li W., Baldi P., Imhof A., Okamura H., Sassone-Corsi P. // Sci. Adv. 2020. V. 6. № 51. P. eabc5629
Korenevskii A.V., Arutyunyan A.V., Milyutina Y.P., Zaloznyaya I.V., Kozina L.S. // Neurochemical Journal. 2014. V. 8. № 3. P. 205–207.
Kundakovic M., Gudsnuk K., Herbstman J.B., Tang D., Perera F.P., Champagne F.A. // Proc. Natl. Acad. Sci. U S A. 2015. V. 112. № 22. P. 6807–6813.
Kertes D.A., Bhatt S.S., Kamin H.S., Hughes D.A., Rodney N.C., Mulligan C.J. // Clin. Epigenetics. 2017. V. 9. P. 68.
Mandaviya P.R., Stolk L., Heil S.G. // Mol. Genet. Metab. 2014. V. 113. № 4. P. 243–252.
Cattane N., Raikkonen K., Anniverno R., Mencacci C., Riva M.A., Pariante C.M., Cattaneo A. // Mol. Psychiatry. 2021. V. 26. № 2. P. 482.
Дополнительные материалы отсутствуют.


