Нейрохимия, 2023, T. 40, № 4, стр. 353-366
Структурные детерминанты малых внеклеточных везикул (экзосом) и их роль в осуществлении биологических функций
А. М. Турчинец 1, А. А. Яковлев 1, 2
1 Научно-практический психоневрологический центр им. З.П. Соловьева ДЗМ
Москва, Россия
2 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
Поступила в редакцию 29.05.2023
После доработки 30.05.2023
Принята к публикации 31.05.2023
- EDN: OUFCLZ
- DOI: 10.31857/S1027813323040222
Аннотация
Внеклеточные везикулы (ВВ) – новая и активно развивающаяся область современной экспериментальной и теоретической биологии, которая привлекает исследователей прежде всего возможностью использования ВВ в качестве диагностических биомаркеров и терапевтических агентов. В настоящее время наибольший объем данных накоплен о малых внеклеточных везикулах (мВВ) – экзосомах, везикулах эндосомального происхождения, и эктосомах (ранее известных как микровезикулы), представляющих собой продукт непосредственного отпочковывания от плазматической мембраны. В настоящем обзоре мы рассматриваем основные этапы биогенеза экзосом и эктосом, основные процессы внутриклеточного трафика мембран, а также сигналинг с участием мВВ. Также обсуждается роль мВВ в физиологии и патофизиологии нервной системы, а также многие перспективные аспекты изучения биологии мВВ.
Список сокращений
CHMP – charged multivesicular body proteins
ESCRT – endosomal sorting complex required for transport
HRS – hepatocyte growth factor-regulated tyrosine kinase substrate
ISG-15 – interferon-stimulated gene 15
MHC – major histocompatibility complex
SNARE – soluble NSF attachment receptor
STAM – signal transducing adaptor molecule
TCR – T-cell receptor
TSG101 – tumor susceptibility gene 101 protein
V-АТФаза – вакуолярная АТФаза
Vps-4 – vacuolar protein sorting-associated protein 4
ВВ – внеклеточные везикулы
ВПП – внутрипросветные пузырьки
мВВ – малые внеклеточные везикулы
МВТ – мультвезикулярные тельца
ОАМЭ – обусловленный активностью массовый эндоцитоз
ВВЕДЕНИЕ
Внеклеточные везикулы (ВВ) – окруженные двойным слоем фосфолипидной мембраны пузырьки, секретируемые всеми типами клеток во внеклеточное пространство. Существует несколько субпопуляций внеклеточных везикул, самыми исследованными из которых являются апоптотические тельца (размером 50–1000 нм), эктосомы (также известные как микровезикулы, размером 100–1000 нм) и экзосомы (размером 30–200 нм). Существующие в настоящее время методы выделения не всегда позволяют специфически выделить определенную популяцию ВВ, поэтому принято использовать термин малые ВВ (мВВ) для обозначения везикул размером менее 200 нм [1]. При этом мВВ различаются по своему происхождению (биогенезу), способу секреции, размеру, составу и функции. Состав мВВ (в иностранной литературе широко используется термин cargo – англ. груз) отличается широким разнообразием и зависит от многих факторов, в первую очередь от биогенеза и типа родительской клетки. Современные методы анализа позволяют выявить в составе мВВ белки (в т.ч. ферменты, рецепторы, структурные белки), липиды, нуклеиновые кислоты (ДНК, мРНК, микроРНК и др.), а также низкомолекулярные метаболиты.
Вплоть до 1980-х гг. прошлого столетия принято было считать, что секреция мВВ является способом поддержания клеточного гомеостаза и позволяет клетке избавиться от переработанных веществ [2]. В 1983 году с помощью подробных ультраструктурных исследований было выяснено, что в эритроцитах везикулы секретируются при слиянии мультивезикулярных телец (МВТ) с плазматической мембраной в процессе созревания этих клеток [3], а в 1996 г. было установлено, что везикулы, выделяемые лимфоцитами, зараженными вирусом Эпштейна–Барр, обладают антигенпрезентирующими свойствами и способны индуцировать Т-клеточный ответ [4]. Новый виток интереса к изучению мВВ произошел в 2006–2007 гг., когда было обнаружено, что в составе мВВ обнаруживаются РНК (мРНК и микроРНК) – и с тех пор мВВ стали рассматриваться как новый способ передачи эпигенетической информации между клетками [5]. Областью, в которой за последнее десятилетие были проведены самые масштабные исследования мВВ, является онкология [6], в первую очередь благодаря способности раковых клеток секретировать мВВ, которые готовят прометастатические ниши в организме [7]. Вместе с тем проведенные на данный момент исследования показали, что секреция мВВ является фундаментальным свойством всех клеток и представляет собой механизм локального и дистантного межклеточного взаимодействия, наблюдаемый не только у эукариот, но также и у бактерий и архей [8].
мВВ У БАКТЕРИЙ И АРХЕЙ
У прокариот ВВ – это единственная секреторная система, осуществляющая обмен между клетками липидов, гидрофобных или денатурированных белков, а также гидрофобных сигнальных молекул [9]. В связи с этим предложено называть этот тип секреции системой секреции нулевого типа (по аналогии с 7 изученными типами секреции) [9]. У прокариот ВВ участвуют в осуществлении многих процессов: межклеточное взаимодействие и чувство кворума, формирование биопленок, защита от токсических субстанций (в т. ч. антибиотиков), взаимодействие с эукариотическими клетками и распространение факторов вирулентности и токсинов [10–12]. Также у архей и бактерий предполагается роль ВВ в осуществлении горизонтального переноса генов, в дополнение к хорошо известным механизмам трансформации, трансдукции и конъюгации [13]. Несмотря на способность клеток всех трех доменов жизни секретировать ВВ, на настоящий момент накоплено недостаточно информации о механизмах биогенеза ВВ, чтобы судить о единстве эволюционного происхождения этого феномена или его независимом формировании в различных доменах [8]. Однако в геноме многих архей закодированы и участвуют в ремоделировании мембран и репродукции вирусов гомологи ESCRT-III и Vps4 – ключевых белков, определяющих секрецию экзосом у эукариот [14], а у бактерий аналогичные функции выполняют белки PspA и Vipp1, которые также являются гомологами комплекса ESCRT-III [15]. Подробнее компоненты этой системы будут рассмотрены ниже.
Также у бактерий существуют закономерности сортировки грузов в состав ВВ. Особенно большая роль в этом процессе отведена внутриклеточному расположению белков. В частности, факторы вирулентности чаще ассоциированы с заряженными липополисахаридами, и имеют большую вероятность оказаться в составе ВВ, чем белки, ассоциированные с нейтральными липополисахаридами [16].
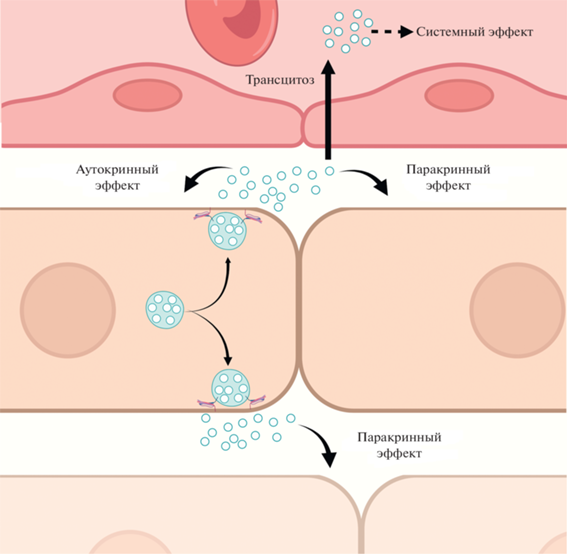
В классической клеточной биологии принято считать, что клетки эукариотических организмов взаимодействуют друг с другом напрямую и/или при помощи секреции во внеклеточную среду растворимых вещества – гормонов, факторов роста, цитокинов. Подобные вещества могут действовать как на секретирующую их клетку (аутокринный сигналинг), так и на соседние (паракринный сигналинг) или отдаленные клетки (эндокринный сигналинг). Получается, что ВВ представляют собой принципиально новый способ межклеточного взаимодействия, общий для эукариот и прокариот (рис. 1).
Рис. 1.
На рисунке представлены способы межклеточного взаимодействия с участием экзосом. Будучи секретированы клеткой во внеклеточную среду, экзосомы могут воздействовать на материнскую клетку (аутокринный эффект) и соседние клетки в пределах ткани (паракринный эффект), а также проникать в кровоток и переноситься с кровью, оказывая системное воздействие.
ЭКЗОСОМЫ
Экзосомы, до момента высвобождения из клетки называемые внутрипросветными пузырьками (ВПП, англ. intraluminal vesicles (ILVs)), являются наиболее хорошо изученной субпопуляцией мВВ. Они секретируются всеми типами клеток и были найдены во всех биологических жидкостях – плазме крови, амниотической, синовиальной и цереброспинальной жидкостях, грудном молоке, лимфе, желчи, слезах, желудочном соке [17–19]. По своему происхождению они являются компонентами эндосомальной системы и формируются за счет впячивания мембраны ранних эндосом внутрь с образованием ВПП, ранние эндосомы в течение этого процесса созревают в МВТ. Эти органеллы играют важную роль в осуществлении эндоцитоза и внутриклеточном трафике мембранных компонентов и сортировке, переработке и транспорте белков. После созревания МВТ либо сливаются с лизосомой, что приводит к расщеплению их содержимого, либо сливаются с плазматической мембраной клетки, высвобождая во внеклеточное пространство ВПП в виде экзосом [20].
До сих пор достоверно не установлены факторы, определяющие судьбу МВТ, однако проведено несколько исследований, показывающих, что МВТ с высоким содержанием холестерола с большей вероятностью сливаются с плазматической мембраной, в то время как обедненные холестеролом МВТ чаще деградируют путем слияния с лизосомами [21, 22]. В регуляции формирования МВТ и экзосом ключевую роль играют белки сортировочного комплекса эндосом, необходимого для транспорта – ESCRT (endosomal sorting complex required for transport) [23–25]. Также на этот процесс большое влияние оказывают ростовые факторы, которые, уменьшая активность PI3K III класса и синтез фосфатидилинозитола-3-фосфата, предотвращают замену Rab5 на Rab7 на мембране везикулы и слияние эндосом с лизосомами, тем самым стимулируют секрецию экзосом [26].
мВВ В МЕЖКЛЕТОЧНОМ ВЗАИМОДЕЙСТВИИ
Множество функций, сопряженных с мВВ, прежде всего, экзосомами, ставит сигналинг с их участием в один ряд с фундаментальными физиологическими процессами. В сравнении с живой клеткой, разнообразие молекул в составе ВВ (белков, липидов, нуклеиновых кислот) невелико, однако они оказывают значительное функциональное воздействие на клетки-акцепторы. Предполагается, что это возможно благодаря селективному и эффективному взаимодействию и особыми механизмами передачи сигнала [27].
Ключевую роль во взаимодействии экзосом с клеткой-акцептором, а также в поглощении и осуществлению биологических функций, играет химический и молекулярный состав внешней поверхности липидной мембраны экзосом – или ее “биокороны”. Состав этой короны уникален и представляют собой структуры родительской клетки, полученные в процессе биогенеза, а также приобретенные в процессе электростатического взаимодействия с внеклеточной средой (в т.ч. плазмой крови) молекулы [28, 29]. Предполагается, что именно уникальный состав биокороны определяет специфичность взаимодействия экзосомы с клетками-акцепторами, биораспределение и характеристики мобильности экзосом. Кроме того, поверхностные детерминанты представляют интерес в качестве мишеней для идентификации, классификации экзосом и их аффинной хроматографии [28, 29].
В патологических условиях секреция экзосом из поврежденных клеток нередко увеличивается, и экзосомы приобретают некоторые характеристики, свойственные протекающему патологическому процессу. Немалый объем данных накоплен о роли экзосом в патогенезе неврологических и психиатрических заболеваний, в частности, при болезни Альцгеймера, болезни Паркинсона, боковом амиотрофическом склерозе, депрессии, шизофрении и многих других [30–35]. Особый интерес в данном контексте представляет способность экзосом проникать через гематоэнцефалический барьер в двух направлениях, что делает экзосомы перспективным объектом исследования в качестве неинвазивного биомаркера заболеваний (“liquid biopsy”) и возможного механизма адресной доставки терапевтических средств [36].
Таким образом, молекулярный состав экзосом зависит от биогенеза, типа клетки-донора и ее состояния. Поскольку в процессе формирования экзосомы образуются путем инвагинации из цитозоля, в отличие от других процессов, обеспечивающих трафик мембраны между компартаментами клетки, ориентация их мембраны аналогична плазматической мембране – снаружи оказываются внеклеточные домены трансмембранных белков, и компоненты цитозоля – внутри [37].
БИОГЕНЕЗ мВВ
Кратко рассмотрим основные этапы биогенеза, транспортировки и доставки экзосом, для того чтобы лучше понять функциональную значимость структур поверхности экзосом.
ESCRT. Эндосомальный комплекс сортировки, необходимый для транспорта (ESCRT) – семейство белков, которые последовательно собираются в комплексы (ESCRT-0, I, II и III) на мембране МВТ и регулируют поступление груза в состав ВПП и их формирование [38]. Интересно отметить, что недавние работы показали, что белки-предшественники комплекса ESCRT-III – преимущественно семейства CHMP (charged multivesicular body proteins, заряженные белки мультивезикулярных телец) – находятся в комплексе с мембранами эндосом и полимеризуются под воздействием комплекса ESCRT-II, приобретая функциональную активность [39]. Белок Alix может напрямую катализировать полимеризацию CHMP, без участия ESCRT-I, II, фактически являясь их функциональной заменой [40].
Присутствие белка гена чувствительности к опухолям 101 (TSG101) и других белков комплекса ESCRT или сопутствующих молекул, например, Alix и связанного с вакуолярным белком сортировки белка 4 (vacuolar protein sorting-associated protein 4 – Vps4), в мВВ часто оценивают как доказательство их эндосомального происхождения. Тем не менее, комплекс ESCRT задействован и в других внутриклеточных процессах трафика мембраны, кроме компонентов ESCRT-0, участие которых не описано в моделях выпячивания и отшнуровки мембран. Поэтому именно зависимость секреции мВВ от ESCRT-0 является более надежным свидетельством их эндосомального происхождения. Это подтверждается в исследовании Colombo и соавт. в 2013 на клетках линии HeLa, показавших, что выключение компонентов ESCRT-0 (HRS и STAM1) приводит к уменьшению секреции мВВ, несущих CD63 и CD81, соответствующих экзосомам [41].
HRS связывается с убиквитинированными белками, чтобы направить их во ВПП [38]. Одного лишь присутствия убиквитинированных белков в составе мВВ недостаточно, чтобы делать утверждение об их эндосомальной природе [42], поскольку не доказано отсутствие подобных белков в везикулах, образующихся путем отшнуровки от плазматической мембраны напрямую, т.е. в эктосомах. Наоборот, воздействие на клетки интерферонов 1 типа приводит к связыванию клеточных белков с подобной убиквитину молекулой ISG-15, которая в свою очередь способствует слиянию МВТ с лизосомой, и тем самым приводит к уменьшению секреции экзосом [43]. Однако, необходимо помнить, что одной из ключевых мишеней ISG15 является TSG101, который участвует и в формировании эктосом плазматической мембраны [44], и поэтому связанное с ISG-15 уменьшение секреции везикул может быть специфично не только для экзосом.
Результаты последних исследований свидетельствуют о том, что не существует единой молекулы, которая бы определяла сортировку груза по ESCRT-зависимому пути, так как присоединение к любому компоненту каждого из четырех комплексов ESCRT вне зависимости от убиквитина может привести к сортировке в состав ВПП, и это прежде всего определяется силой взаимодействия груз-мембрана-ESCRT [45]. Кроме того, показано, что ни один из убиквитин-связывающих доменов в составе комплексов ESCRT не является необходимым для сортировки грузов [46].
Достоверно известно, что некоторые белки включаются в состав МВТ по ESCRT-независимому пути. В клетках дрожжей интегральный мембранный белок Cvt17/Aut5p и белок Sna3p поступают в МВТ независимо от убиквитинирования [47], а бета цепь рецептора к интерлейкину 2 (IL2-Rb) сортируется в состав экзосом, присоединяясь к HRS вне мотива, взаимодействующего с убиквитином [48]. Белки с KFERQ-мотивом (например, фактор, индуцируемый гипоксией 1-альфа (HIF1A), и α-синуклеин) включаются в состав экзосомального груза при участии LAMP2A и шаперона HSC70. Другими словами, некоторые механизмы сортировки груза во ВПП очень похожи на механизмы шаперон-опосредованной аутофагии и эндосомальной микроаутофагии, и по похожему механизму происхлдит сортировка во ВПП с участием белков Alix, CD63, синтенина, Rab31, а также церамида [49, 50].
Липиды. Почкование пузырьков из цитозоля происходит при участии липидов, таких как церамид, который образуется под действием сфингомиелиназы из сфингомиелина. Ингибирование нейтральной сфингомиелиназы (nSMase-2) приводит к нарушению формирования ВПП в МВТ и сокращению секреции экзосом по ESCRT-независимому пути [51]. Несмотря на то, что не до конца ясна роль сфингомиелиназы в формировании других типов мВВ, использование агентов, ингибирующих нейтральную сфингомиелиназу (GW4869), и прицельная РНК-интерференция nSMAse-2 часто используется для доказательства экзосомальной природы мВВ или указывает на связь с экзосомами того или иного биологического эффекта. Однако обязательно стоит упомянуть, что нарушение образования церамида ведет к изменению многих клеточных функций [52]. Так, при воздействии GW4869 отмечается компенсаторное увеличение секреции микровезикул большего размера [53]. Также nSMAse влияет на весь мембранный трафик после комплекса Гольджи, таким образом, предположительно и на любую секрецию вообще [54]. Церамид также регулирует процессы аутофагии [55], и воздействие на него может косвенно приводить к нарушению гомеостаза МВТ. В целом, для интерпретации влияния тех или иных агентов или модуляции активности генов на секрецию мВВ, необходимо также учитывать их влияние на другие клеточные процессы, в первую очередь процессы клеточной гибели и аутофагии.
У Caenorhabditis elegans экстернализация фосфатидилэтаноламина, который в норме удерживается на цитозольном листке мембраны ферментом флиппазой, ведет к почкованию и отшнуровке мВВ [56]. В клетках млекопитающих потеря мембранной асимметрии фосфатидилсерина и фосфатидилэтаноламина также ведет к почкованию пузырьков, в этом процессе задействованы два семейства транслоказ со скрамблазной активностью [57], но влияние этих процессов на секрецию экзосом не установлено.
Синдекан и синтенин. Специфическое направление трансмембранных белков в состав ВПП может происходить в результате белок-белковых взаимодействий [58]. Синтенин-1 и синдекан-1 обнаруживаются в экзосомальных фракциях. Взаимодействие синтенина-1 с цитозольным доменом синдекана-1 привлекает Alix, который вместе с белками комплексов ESCRT-I и -III способствует почкованию ВПП. Этот процесс основан на Src-зависимом эндоцитозе синдекана-1 [59], и требует активности фосфолипазы D2 и ГТФазы фактора АДФ-рибозилирования 6 (ARF6) [60]. Однако сомнительна специфичность этого процесса для экзосом всех клеток. Так, в дендритных клетках и адипоцитах, синтенин в большинстве своем присутствует в мВВ, соответствующих по характеристикам экзосомам, но обнаруживается и в более крупных везикулах [61]. Более того, ARF6 задействован в секреции опухолевыми клетками крупных внеклеточных везикул [62]. Таким образом, ARF6 может принимать участие в секреции разных типов мВВ (рис. 2).
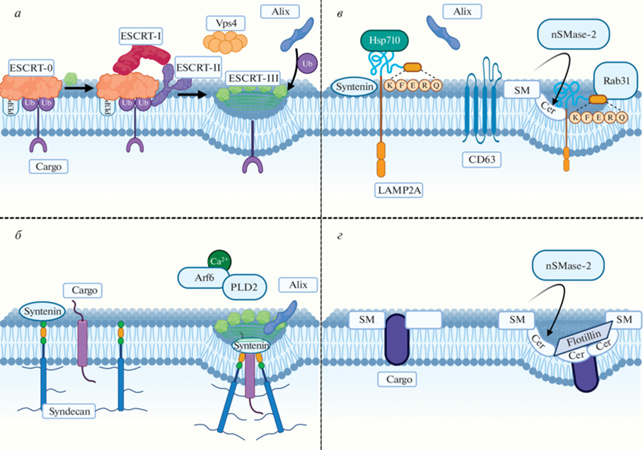
Рис. 2.
На рисунке представлены ESCRT-зависимые (а, б) и ESCRT-независимые (в, г) способы биогенеза ВПП и их загрузки (cargo loading). (а) При классическом ESCRT-зависимом сортинге к убиквитинированному белку последовательно присоединяются комплексы ESCRT-0, ESCRT-I и ESCRT-II, формируется начальная кривизна мембраны. Под воздействием ESCRT-I,II белки комплекса ESCRT-III, находящиеся на поверхности эндосом, начинают полимеризоваться сначала в плоскую спиральную структуру, а затем в объемную коническую спираль, формирующую инвагинацию мембраны. Связывающийся с убиквитином белок Alix может индуцировать полимеризацию комплекса ESCRT-III независимо от ESCRT-I,II. АТФаза Vps4 обеспечивает привлечение новых субъединиц ESCRT-III и окончательную отшнуровку пузырька, а также деполимеризацию ESCRT-III после формирования ВПП. (б) При взаимодействии синдекана с синтенином происходит независимая от ESCRT кластеризация груза (без участия убиквитина и ESCRT-0) и инвагинация мембраны при участии фосфолипазы D2 и ARF6, а также привлекается Alix, который участвует в полимеризации ESCRT-III и отшнуровке ВПП. (в) Белки, содержащие KFERQ-мотив, направляются в состав ВПП при участии белка мембраны LAMP2A и шаперона HSC70. В формировании ВПП в данном случае участвуют CD63 (который способен формировать тетраспаниновые домены, обеспечивающие инвагинацию мембраны), Rab31 и церамид. (г) Основной ESCRT-независимый механизм формирования ВПП реализуется за счет церамида, образующегося на мембранах путем гидролиза сфингомиелина нейтральной сфингомиелиназой-2. Церамид способен формировать липидные рафты, которые за счет физических свойств обеспечивают спонтанное выпячивание мембраны и формирование ВПП.
Закисление МВТ. По мере созревания МВТ закисление их внутренней среды необходимо для слияния МВТ с лизосомами, последующего расщепления и переработки поглощенных компонентов [63]. Ключевую роль в закислении МВТ играет H+-АТФаза вакуолярного типа (V-АТФаза): мультисубъединичный комплекс, образованный трнасмембранным протон-транспортирующим каналом (V0) и цитоплазматическим внемембранным АТФ-гидролизующим комплексом (V1) [64]. В настоящее время накоплен немалый объем знаний о многоуровневой регуляции функции V-АТФазы и ее влиянии на секреторные процессы, в частности на секрецию синаптических везикул [65, 66].
Регуляция функции V-АТФазы имеет большое значение в определении развития МВТ по деградационному или секреторному пути. Guo и соавт. (2017) обнаружили, что белки аутофагии Atg5 и Atg16L147 приводят к диссоциации Е1-субъединицы V1-АТФазы, уменьшению закисления МВТ и увеличению секреции экзосом в клетках человека. Показано, что эти белки действуют независимо от Atg7 и классического каскада макроаутофагии. Это происходит благодаря следующей последовательности событий: Atg5, в большом количестве находящийся на мембранах МВТ, участвует в упаковке LC3 в состав ВПП, а LC3 в свою очередь связывает Е1 субъединицу V1-АТФазы и также увлекает ее в состав экзосом, нарушая функцию переносчика протонов V1-АТФазы и приводя к повышению pH МВТ [67].
В 2019 г. Latifkar и соавт. сообщили о роли сиртуина 1 (SIRT1) в регуляции функции V-АТФазы: сиртуин 1 увеличивает стабильность мРНК A‑субъединицы V1-АТФазы, тем самым увеличивая закисление поздних эндосом и лизосом. Соответственно, снижение экспресии сиртуина 1 ведет к увеличению секреции экзосом, причем в таких экзосомах обнаруживается большое количество убиквитинированных белков [68]. Сиртуины – ферменты, чье участие в процессах выживания клеток известно достаточно давно, известно, что их экспрессия снижается с возрастом. Возможно, снижением экспрессии сиртуинов можно объяснить увеличение количества экзосом в образцах крови людей старшего возраста.
В своей недавней работе Choezom и соавт. (2022) показали, что на функцию V-АТФазы также влияет и nSMase-2. V-АТФаза на эндосомальных мембранах располагается в рафт-подобных доменах, обогащенных сфингомиелином и холестеролом, и ультраструктурные исследования с применением криоэлектронной микроскопии показали, что организованные в определенном порядке липиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, холестерол) являются интегральной частью V0 комплекса и играют важнейшую роль в сборке и регуляции функционирования V-АТФазы [69]. nSMase-2 гидролизует сфингомиелин с образованием церамида, который, совместно с холестеролом, провоцирует инвагинацию мембраны для формирования ВПП, и увлекает субъединицы V-АТФазы с собой, тем самым препятствуя дальнейшему закислению просвета МВТ и способствуя секреции экзосом [70].
Таким образом, предполагается важная роль pH в определении развития судьбы МВТ по секреторному или деградационному пути. В некоторых случаях, pH является определяющим фактором в осуществлении экзосомами физиологических функций: экзосомы, несущие неактивный pH-чувствительный TGF β-1, активируются в кислой эндосомальной среде и приобретают возможность индуцировать фенотипические изменения в клетках-акцепторах [71].
Кроме того, существует множество доказательств того, что V-АТФаза, помимо функции переносчика протонов, непосредственно участвует и в процессах экзоцитоза и секреции [66]. Это продемонстрировано в работе Poëa-Guyon и соавт. (2013) на секреторных гранулах клеточной линии PC12. При достижении определенной концентрации протонов в просвете гранулы комплексы V1 и V0 диссоциируют, благодаря чему V0 оказывается доступной к взаимодействию с другими белками – ARNO-ARF6 и SNARE, определяя секрецию. При фармакологической блокаде закисления нигерицином или хлоридом аммония прочность ассоциации V1 и V0 увеличивается, и секреция сокращается. Однако при диссоциации субъединиц с использованием бафиломицина закисление просвета прекращается, но секреция не останавливается. Таким образом, авторами был сделан вывод, что V0 субъединица служит одновременно сенсором кислотности в просвете везикулы и адаптером для последующих ступеней секреторного пути, однако точные механизмы, стоящие за этими функциями, пока неясны [72].
ВНУТРИКЛЕТОЧНЫЙ ТРАФИК И СЕКРЕЦИЯ ЭКЗОСОМ И мВВ
Молекулы внутриклеточного трафика, которые осуществляют адресное перемещение МВТ и их слияние с плазматической мембраной, также могут использоваться для дифференциации экзосом от эктосом, происходящих из цитоплазматической мембраны.
Малые ГТФазы Rab. Члены семейства малых ГТФаз Rab играют доказанную роль в перемещении пузырьков между клеточными компартментами [73] и также могут быть вовлечены в перемещение МВТ к плазматической мембране и секрецию экзосом. Центральную роль в этом процессе играет механизм Rab5/Rab7 конверсии, который определяет превращение ранних эндосом в поздние и их слияние с лизосомами [74]. Предотвращение конверсии Rab5/Rab7 ведет к увеличению секреции экзосом. В частности, Wei и соавт. было показано, что Rab31, будучи активированным рецептором эпидермального фактора роста, привлекает эффекторные белки, которые инактивируют Rab7 [75]. В недавней работе Verweij и соавт. показали, что в секреции CD63-позитивных экзосом играет роль еще один каскад конверсии Rab: Rab7a-Arl8b-Rab27a – который происходит в области мембранных контактов эндоплазматического ретикулума и поздних эндосом/мультивезикулярных телец [76].
Известно, что повреждение Rab27a или Rab27b приводит к изменению морфологии МВТ и нарушает их состыковку с плазматической мембраной [77]. Также была показана роль Rab35 в секреции экзосом олигоденроцитами [78]. Rab11 также участвует в биогенезе МВТ и их стыковке с плазматической мембраной, при этом его функция находится в тесной взаимосвязи с внутриклеточным уровнем кальция и, по-видимому, является специфичной для клеток определенных типов [79, 80].
Интересно, что Rab35 и компоненты комплекса ESCRT (прежде всего Alix) также ответственны за обусловленный активностью массовый эндоцитоз (ОАМЭ, activity dependent bulk endocytosis – ADBE), который является необходимым для образования синаптических пузырьков, и рециркуляции пресинаптических белков [81, 82]. Это подтверждается повышением иммунореактивности Alix в пресинаптических компартментах синапсов, находящихся в состоянии высокочастотной активации при эпилептических приступах [83].
Помимо своей роли в переработке белков (в частности рецептора к трансферрину), Rab11 в настоящее время рассматривается как один из важнейших участников эндосомального трафика в нервных клетках. Rab11 осуществляет плейотропные функции, в том числе модулирует эффективность синаптической передачи (предположительно за счет взаимодействия с эпсилон-субъединицей V-АТФазы [84]), участвует в транспорте многих важных для развития и регенерации нервных клеток молекул (AMPA-рецепторы, интегрины, Trk, протрудин [85, 86]), благодаря чему играет важную нейропротективную роль при многих нейродегенеративных заболеваниях [87].
SNARE. ГТФазы Rab могут действовать на слишком ранних или неспецифических этапах внутриклеточного транспорта, чтобы их можно было использовать для модулирования секреции экзосом. Поэтому главной задачей в изучении биогенеза экзосом является установление специфических комплексов SNARE, ответственных за слияние мембраны МВТ с плазматической мембраной. На настоящий момент показано, что YKT6 SNARE необходим для секреции Wnt-позитивных экзосом [88], а Syx-5, гомолог синтаксина-5 C. elegans, направляет МВТ к плазматической мембране при участии малой ГТФазы Ral-1 [89]. Однако оба этих белка участвуют в трафике мембран от ЭПР к комплексу Гольджи, поэтому их ингибирование также связано с нарушением обычных секреторных путей. Также было показано, что специфичный для нейронов белок SNARE синтаксин-1А, участвующий в секреции синаптических пузырьков, влияет на секрецию экзосом у дрозофил [90]. На клетках линии HeLa, ассоциированный с плазматической мембраной SNARE SNAP-23, опосредует слияние МВТ с плазматической мембраной спонтанно и после воздействия гистамина [91]. Эти белки участвуют в процессах слияния в непосредственной близости от плазматической мембраны, и потому могут быть не задействованы в обычном внутриклеточном трафике мембранных компонентов, тем не менее, они могут быть вовлечены в процессы секреции из секреторных гранул.
Цитоскелет. Для почкования и отшнуровки ВВ необходима полимеризация актина под плазматической мембраной и сокращение актомиозинового комплекса [92], регулируемое малыми ГТФ-азами RhoA. Однако состояние актинового пула вокруг МВТ и его влияние на формирование ВПП не исследовалось. Нельзя исключать, что для слияния МВТ с плазматической мембраной и выброса экзосом необходима локальная деполимеризация кортикального актина. Таким образом, можно предположить, что воздействие на актин косвенно увеличивает секрецию экзосом. Предполагается, что для транспорта МВТ к плазматической мембране требуется участие системы микротрубочек [93]. Ее повреждение ведет к уменьшению секреции экзосом, но также воздействует на другие мембранные компартменты [94]. Поэтому мембранные компоненты могут использоваться для различения экзосом и эктосом, но воздействие на них также могут привести к множеству неспецифических эффектов (рис. 3).
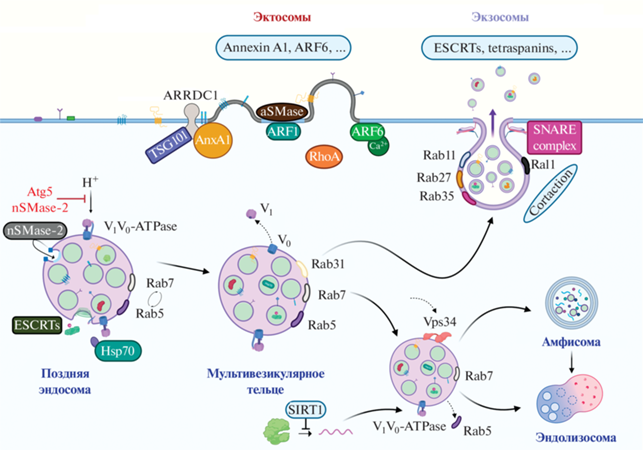
Рис. 3.
На рисунке представлены основные участники биогенеза, внутриклеточного трафика и секреции экзосом и эктосом. Центральную роль в определении судьбы мультивезкулярных телец играет механизм Rab5/Rab7 конверсии: Rab7-позитивные МВТ с большей вероятностью оказываются направлены на деградацию, тогда как предотвращение смены Rab5 на Rab7 (в частности, при участии Rab31) определяет секрецию. Не менее важное значение играет pH МВТ, который в первую очередь обеспечивает V-АТФаза. Atg5 и нейтральная сфингомиелиназа-2 приводят к снижению активности V-АТФазы, что уменьшает закисление МВТ и способствует секреции экзосом. Сиртуин 1, напротив, увеличивает стабильность мРНК V-АТФазы и способствует закислению МВТ и их направлению на деградацию. В стыковке МВТ с пламатической мембраной важную роль играют малые ГТФазы Rab11, 27, 35, а также комплекс SNARE. Эктосомы формируются путем прямого отшнуровывания от плазматической мембраны при участии TSG-101 (компонент ESCRT-комплекса), Аннексина А1, ГТФаз ARF1 и ARF6, кислой сфингомиелиназы и других молекул.
БИОЛОГИЯ ПОГЛОЩЕНИЯ ВВ И ОСУЩЕСТВЛЕНИЕ ИМИ ФУНКЦИЙ
Высокий интерес исследователей к ВВ обусловлен их способностью вызывать фенотипические изменения в клетках-акцепторах. Различия в размере и структуре ВВ могут оказывать влияние на их распознавание и поглощение клетками-мишенями. Например, микропиноцитоз совместим с захватом отдельных мВВ, но не с крупными ВВ или агрегатами мВВ [95].
Предложено несколько схем взаимодействия ВВ с клетками-акцепторами. Это слияние с целевой клеткой и высвобождение содержимого ВВ в цитоплазме, воздействие лигандов на поверхности ВВ на рецепторы клетки-акцептора (kiss-and-run) и разрушение ВВ в непосредственной близости к мембране клетки-акцептора с последующим воздействием содержимого ВВ на рецепторы клетки. Например, при осуществлении иммунного ответа, ВВ, несущие на себе молекулы MHC, могут активировать TCR на поверхности Т-лимфоцитов [96]. ВВ могут быть поглощены клеткой и направлены на деградацию в лизосомы или переработаны и вновь секретированы во внеклеточное пространство. Такой тип показан на клетках рака молочной железы: поглощенные CD81-позитивные экзосомы фибробластов внутри клеток связываются с Wnt11 и повторно секретируются, тем самым стимулируя подвижность находящихся рядом раковых клеток по Wnt-зависимому пути [97].
Однако главное свойство ВВ – способность заключать молекулы в состав пузырька с липидным бислоем и переносить их на расстоянии. Несколько исследований показывают роль ВВ в прогрессировании онкологических заболеваний, например, путем обмена РНК между клетками глиобластомы и эндотелием [98], онкогенными ДНК и ретротранспозонами, между клетками медуллобластомы и эндотелием [98], а также путем обмена белками, как например рецептором эпителиального фактора роста вариант III (EGFRvIII) между клетками глиомы [99].
Роль ВВ в обмене белками показана в нервной системе, где опосредованный ВВ перенос белка синаптотагмина 4 из пресинаптических клеток к постсинаптическим обеспечивает ретроградный контроль пресинаптической активности [100], а постсинаптические нейроны секретируют экзосомы, содержащие GluR2,3 субъединицы AMPA-рецептора (но никогда – субъединицы NMDA-рецептора) и синаптобревин, необходимый для высвобождения нейромедиатора из синаптического пузрька – предполагается, что благодаря этому возможно быстрое возобновление в пресинаптических нейронах пула белков, необходимых для секреции [101, 102]. В дополнение, при опосредовании ВВ может происходить обмен между моноцитами и эндотелиальными клетками хемокиновым рецептором CCR5, который необходим для передачи и распространении ВИЧ-1, что приводит к проникновению вируса в клетки, изначально лишенные машинерии для его воспроизведения [103].
Механизмы поглощения ВВ и доставки их грузов в цитозоль клеток-акцепторов по-прежнему описаны не полностью. Первый шаг в этом процессе состоит в “наведении” ВВ на клетку-акцептор. До сих пор вопрос о том, обусловлена ли специфичность воздействия типом клеток или субпопуляцией ВВ, или этот процесс является неспецифическим и стохастическим, остается нерешенным, и в литературе можно найти подтверждения обеим этим гипотезам.
Например, олигодендроцитарные мВВ поглощаются преимущественно микроглией, а не нейронами. мВВ первичных нейронов захватываются только другими нейронами [104], а мВВ нейробластомы в равной степени связываются с астроцитами [102]. В то же время показано, что при повышенном уровне глутаматергической трансмиссии в соседних к активным нейронам олигодендроцитах повышается уровень Ca2+ и увеличивается секреция экзосом, которые селективно связываются с нейронами и оказывают нейропротекторный эффект, внося вклад в аксональный гомеостаз и регуляцию нейропластичности [105].
Напротив, клетки линии HeLa способны связывать большой набор ВВ, продуцируемых различными клетками [106], что справедливо и для многих других клеток, что было показано в исследованиях с липофильными красителями и флуоресцентным CD63 [107]. Более того, возможен и межвидовой обмен ВВ – между мышиными клетками и человеческими [5]. Тем не менее, нельзя исключить возможность существования специфического механизма захвата, обусловленного типом клетки и субпопуляцией ВВ. CD47, ассоциированный с интегринами белок, который защищает клетки от фагоцитоза, часто можно обнаружить на поверхности ВВ, что увеличивает время их циркуляции в крови и защищает от фагоцитоза моноцитами и макрофагами [108]. Таким образом, возможно наведение ВВ может быть достигнуто по механизму отрицательной селекции. Идентификация других подобных компонентов на разных типах ВВ может дать возможность разработки новых моделей и способов применения ВВ.
Второй шаг – точка входа в клетку-акцептор. Большинство исследований свидетельствуют об интернализации ВВ, однако происходит ли это неспецифическим путем (макро или микропиноцитоз) или посредством специфического рецептор-зависимого взаимодействия, неясно. Предполагается роль различных молекул на поверхности ВВ и клеток-акцепторов – интегринов, лектинов/протеогликанов, Т-клеточных иммуноглобулинов и муцин домен-содержащего белка 4 (Tim4) – в процессе поглощения, а, значит, они могут влиять и на специфичность наведения [7, 109, 110]. Однако ни один из этих компонентов не является достаточным и необходимым условием для поглощения ВВ. Различные субпопуляции ВВ несут на своей поверхности одинаковые поверхностные белки и, вероятно, один из них играет роль лиганда для рецептора, обеспечивающего интернализацию, аналогично механизму захвата липопротеинов низкой плотности [111].
Третий – и последний – шаг заключается в доставке содержимого ВВ в клетку-акцептор. Первый очевидный вариант – слияние ВВ с плазматической мембраной. Этот путь наиболее вероятен для эктосом, которые способны переносить ДНК [112], поскольку они имеют слишком большой размер, чтобы быть интернализированными, а также очень близкий по свойствам состав мембраны. Однако большинство публикаций на эту тему свидетельствуют об интернализации ВВ перед высвобождением груза. В таком случае ВВ сначала оказывается в составе эндосомы, а слияние их мембран происходит в процессе снижения pH [113]. Также описаны некоторые неожиданные механизмы доставки груза, например, напрямую в ядро путем слияния с ними содержащих ВВ эндосом [114, 115].
ПОВЕРХНОСТНЫЕ БЕЛКИ ЭКЗОСОМ (ПРОТЕОСТЕММА, ЭПИПРОТЕОМ)
На поверхности экзосом располагаются белки разных функциональных классов, они могут быть интегральными или периферическими. Интегральные белки могут иметь несколько трансмембранных доменов, а периферические белки взаимодействуют с поверхностью мембраны путем нековалентных взаимодействий с интегральными белками или электростатического взаимодействия с гидрофильными головками фосфолипидов наружного слоя мембраны. Всю совокупность периферических поверхностных белков для удобства стоило бы назвать одним словом, например, протеостемма (т.е. белковая корона). В целом, поверхностные белки экзосом – это тетраспанины (CD9, CD63, CD81) [116] белки транспорта/слияния (аннексин, флотиллин, Rab ГТФ-азы), антиген презентирующие белки, интегрины, молекулы клеточной адгезии, рецепторы (рецепторы ростовых факторов, цитокинов, сигнальных путей, липопротеинов [117]), шаперонины, гепарин-связывающие белки, ферменты, факторы свертывания крови, белки связывающие нуклеиновые кислоты и иммуноглобулины [118, 119]. Поверхностные белки отражают природу и состояние клетки-донора, а также позволяют различать субпопуляции ВВ [119, 120]. Среди маркеров экзосом клеток нервной системы достаточно широко изучены NCAM и L1CAM (CD171) (для нейронов) и GLAST (для астроцитов) [121–123]. Известно, что рецептор-опосредованный трансцитоз экзосом через ГЭБ зависит от трех типов рецепторов: рецептора трансферрина, рецептора инсулина и рецептора липопротеинов низкой плотности – которые находятся на апикальной мембране эндотелиоцитов, обращенной в просвет капилляров [36].
Поверхностные и внутренние белки экзосом различаются по составу: поверхностные белки на 51.1% состоят из цитоплазматических белков и на 16.8% из ядерных белков (вдвое больше, чем внутренние белки – 8.3%). Предполагается, что поверхностные белки на экзосомах выполняют те же функции, которые они выполняют на плазматической мембране клеток, особенно если их ориентация относительно мембраны совпадает [124]. Однако было показано, что почти треть поверхностных белков экзосом имеют обратную ориентацию, по сравнению с белками плазматической мембраны. Это может значительно влиять на результаты широко используемых методов иммунной маркировки (антительные микрочипы, конфокальная иммунофлуоресценция, проточная цитометрия и др.) и искажать их. Кроме того, определение поверхностных белков затрудняется их гидрофобностью, гетерогенностью и относительно малой представленностью, по сравнению с внутренними белками, что приводит к их вытеснению из общей протеомной картины.
В настоящее время наиболее надежное определение поверхностных белков достигается путем масс-спектрометрии [125]. Предложено несколько способов пробоподготовки для обогащения фракции мембранных белков в пробах для проведения масс-спектрометрии.
ЗАКЛЮЧЕНИЕ
Секреция внеклеточных везикул является эволюционно древним, наблюдаемым как у эукариот, так и у бактерий и архей, механизмом, который тесно взаимосвязан со многими другими фундаментальными процессами в клетке. Все процессы биогенеза ВВ строго и на многих уровнях регулируются. В настоящее время наибольшее внимание научного сообщества приковано к малым внеклеточным везикулам, в частности к экзосомам, благодаря их уникальным свойствам, которые делают экзосомы многообещающим предметом для изучения в качестве диагностического и терапевтического агента. Можно даже говорить о выделении отдельного направления современной биологии – везикуломике.
Несмотря на то, что машинерия биогенеза мВВ во многом пересекается с компонентами хорошо известных процессов и в последние годы появляется множество исследований, проливающих свет на те или иные аспекты биологии везикул, нам по-прежнему мало известно о строго специфических для них структурных и функциональных детерминантах, особенностях разных популяций везикул и везикул разного клеточного происхождения. Для того, чтобы лучше понять функции мВВ, мы считаем совершенно необходимым идентификацию их структурных детерминант, обусловливающих реализацию физиологического ответа в клетках-акцепторах.
Список литературы
Thery C., Witwer K.W., Aikawa E., Alcaraz M.J., Anderson J.D., Andriantsitohaina R., Antoniou A., Arab T., Archer F., Atkin-Smith G.K. et al. // J. Extracell. Vesicles. 2018. V. 7. № 1. P. 1535750.
Harding C., Heuser J., Stahl P. // J. Cell Biol. 1983. V. 97. № 2. P. 329–339.
Johnstone R.M., Adam M., Hammond J.R., Orr L., Turbide C. // J. Biol. Chem. 1987. V. 262. № 19. P. 9412–9420.
Raposo G., Nijman H.W., Stoorvogel W., Leijendekker R., Harding C., Melief C.J.M., Geuze H.J. // J. Exp. Med. 1996. V. 183. № 3. P. 1161–1172.
Valadi H., Ekström K., Bossios A., Sjöstrand M., Lee J.J., Lötvall J.O. // Nat. Cell Biol. 2007. V. 9. № 6. P. 654–659.
Nakano I., Garnier D., Minata M., Rak J. // Semin. Cell. Dev. Biol. 2015. V. 40. P. 17–26.
Hoshino A., Costa-Silva B., Shen T.L., Rodrigues G., Hashimoto A., Tesic Mark M., Molina H., Kohsaka S., Di Giannatale A., Ceder S., Singh S., Williams C., Soplop N., Uryu K., Pharmer L., King T., Bojmar L., Davies A.E., Ararso Y., Zhang T., Zhang H., Hernandez J., Weiss J.M., Dumont-Cole V.D., Kramer K., Wexler L.H., Narendran A., Schwartz G.K., Healey J.H., Sandstrom P., Labori K.J., Kure E.H., Grandgenett P.M., Hollingsworth M.A., de Sousa M., Kaur S., Jain M., Mallya K., Batra S.K., Jarnagin W.R., Brady M.S., Fodstad O., Muller V., Pantel K., Minn A.J., Bissell M.J., Garcia B.A., Kang Y., Rajasekhar V.K., Ghajar C.M., Matei I., Peinado H., Bromberg J., Lyden D. // Nature. 2015. V. 527. № 7578. P. 329–335.
Gill S., Catchpole R., Forterre P. // FEMS Microbiol. Rev. 2019. V. 43. № 3. P. 273–303.
Guerrero-Mandujano A., Hernández-Cortez C., Ibarra J.A., Castro-Escarpulli G. // Traffic. 2017. V. 18. № 7. P. 425–432.
Turnbull L., Toyofuku M., Hynen A.L., Kurosawa M., Pessi G., Petty N.K., Osvath S.R., Cárcamo-Oyarce G., Gloag E.S., Shimoni R., Omasits U., Ito S., Yap X., Monahan L.G., Cavaliere R., Ahrens C.H., Charles I.G., Nomura N., Eberl L., Whitchurch C.B. // Nat. Commun. 2016. V. 7. P. 11220.
Jan A.T. // Front. Microbiol. 2017. V. 8: 1053.
Cecil J.D., Sirisaengtaksin N., O’Brien-Simpson N.M., Krachler A.M. // Microbiol. Spectr. 2019. V. 7. № 1.
Domingues S., Nielsen K.M. // Curr. Opin. Microbiol. 2017. V. 38. P. 16–21.
Hatano T., Palani S., Papatziamou D., Salzer R., Souza D.P., Tamarit D., Makwana M., Potter A., Haig A., Xu W., Townsend D., Rochester D., Bellini D., Hussain H.M.A., Ettema T.J.G., Löwe J., Baum B., Robinson N.P., Balasubramanian M. // Nat. Commun. 2022. V. 13. № 1. P. 3398.
Liu J., Tassinari M., Souza D.P., Naskar S., Noel J.K., Bohuszewicz O., Buck M., Williams T.A., Baum B., Low H.H. // Cell. 2021. V. 184. № 14. P. 3660–3673.
Schwechheimer C., Kuehn M.J. // Nat. Rev. Microbiol. 2015. V. 13. № 10. P. 605–619.
Pisitkun T., Shen R.F., Knepper M.A. // Proc. Natl. Acad. Sci. USA. 2004. V. 101. № 36. P. 13 368–13 373.
Kalra H., Simpson R.J., Ji H., Aikawa E., Altevogt P., Askenase P., Bond V.C., Borràs F.E., Breakefield X., Budnik V., Buzas E., Camussi G., Clayton A., Cocucci E., Falcon-Perez J.M., Gabrielsson S., Gho Y.S., Gupta D., Harsha H.C., Hendrix A., Hill A.F., Inal J.M., Jenster G., Krämer-Albers E.M., Lim S.K., Llorente A., Lötvall J., Marcilla A., Mincheva-Nilsson L., Nazarenko I., Nieuwland R., Nolte-'t Hoen E.N., Pandey A., Patel T., Piper M.G., Pluchino S., Prasad T.S., Rajendran L., Raposo G., Record M., Reid G.E., Sánchez-Madrid F., Schiffelers R.M., Siljander P., Stensballe A., Stoorvogel W., Taylor D., Thery C., Valadi H., van Balkom B.W., Vázquez J., Vidal M., Wauben M.H., Yáñez-Mó M., Zoeller M., Mathivanan S. // PLoS Biol. 2012. V. 10. № 12. e1001450.
Kim D.K., Kang B., Kim O.Y., Choi D.S., Lee J., Kim S.R., Go G., Yoon Y.J., Kim J.H., Jang S.C., Park K.S., Choi E.J., Kim K.P., Desiderio D.M., Kim Y.K., Lötvall J., Hwang D., Gho Y.S. // J. Extracell. Vesicles. 2013. V. 2. № 1.
Gurung S., Perocheau D., Touramanidou L., Baruteau J. // Cell Commun. Signal. 2021. V. 19. № 1. P. 47.
Raposo G., Stoorvogel W. // J. Cell. Biol. 2013. V. 200. № 4. P. 373–383.
Möbius W., Ohno-Iwashita Y., van Donselaar E.G., Oorschot V.M.J., Shimada Y., Fujimoto T., Heijnen H.F.G., Geuze H.J., Slot J.W. // J. Histochem. Cytochem. 2002. V. 50. № 1. P. 43–55.
Babst M., Katzmann D.J., Estepa-Sabal E.J., Meerloo T., Emr S.D. // Dev. Cell. 2002. V. 3. № 2. P. 271–282.
Wollert T., Hurley J.H. // Nature. 2010. V. 464. № 7290. P. 864–869.
Teis D., Saksena S., Emr S.D. // Dev. Cell. 2008. V. 15. № 4. P. 578–589.
Borges F.T., Melo S.A., Özdemir B.C., Kato N., Revuelta I., Miller C.A., Gattone V.H., LeBleu V.S., Kalluri R. // J. Am. Soc. Nephrol. 2013. V. 24. № 3. P. 385–392.
Mathieu M., Martin-Jaular L., Lavieu G., Théry C. // Nat. Cell. Biol. 2019. V. 21. № 1. P. 9–17.
Buzás E.I., Tóth E., Sódar B.W., Szabó-Taylor K. // Semin. Immunopathol. 2018. V. 40. № 5. P. 453–464.
Tóth E., Turiák L., Visnovitz T., Cserép C., Mázló A., Sódar B.W., Försönits A.I., Petővári G., Sebestyén A., Komlósi Z., Drahos L., Kittel Á., Nagy G., Bácsi A., Dénes Á., Gho Y.S., Szabó-Taylor K.É., Buzás E.I. // J. Extracell. Vesicles. 2021. V. 10. № 11. e12140.
Яковлев А.А., Дружкова Т.А., Николаев Р.В., Кузнецова В.Е., Груздев С.К., Гехт А.Б., Гуляева Н.В. // Нейрохимия. 2019. V. 36. № 4. P. 346–352.
Ардаширова Н.С., Федотова Е.Ю., Иллариошкин С.Н. // Нейрохимия. 2020. V. 37. № 2. P. 99–105.
Иванова М.В., Чеканова Е.О., Белугин Б.В., Тутыхина И.Л., Должикова И.В., Закройщикова И.В., Васильев А.В., Захарова М.Н. // Нейрохимия. 2019. V. 36. № 3. P. 195–207.
Wang Y., Amdanee N., Zhang X. // Eur. Psychiatry. 2022. V. 65. № 1. e61.
Rajendran L., Honsho M., Zahn T.R., Keller P., Geiger K.D., Verkade P., Simons K. // Proc. Natl. Acad. Sci. USA. 2006. V. 103. № 30. P. 11172–11177.
Gruzdev S.K., Yakovlev A.A., Druzhkova T.A., Guekht A.B., Gulyaeva N.V. // Cell. Mol. Neurobiol. 2019. V. 39. № 6. P. 729–750.
Khaspekov L.G., Yakovlev A.A. // Neurochem. J. 2023. V. 39. № 1. P. 1–18.
van Niel G., D’Angelo G., Raposo G. // Nat. Rev. Mol. Cell. Biol. 2018. V. 19. № 4. P. 213–228.
Hurley J.H. // EMBO J. 2015. V. 34. № 19. P. 2398–2407.
Sadoul R., Laporte M.H., Chassefeyre R., Chi K., Goldberg Y., Chatellard C., Hemming F.J., Fraboulet S. // Semin. Cell. Dev. Biol. 2018. V. 74. P. 40–49.
Bissig C., Gruenberg J. // Trends Cell Biol. 2014. V. 24. № 1. P. 19–25.
Colombo M., Moita C., van Niel G., Kowal J., Vigneron J., Benaroch P., Manel N., Moita L.F., Théry C., Raposo G. // J. Cell. Sci. 2013. V. 126. № 24. P. 5553–5565.
Smith V.L., Jackson L., Schorey J.S. // J. Immunol. 2015. V. 195. № 6. P. 2722–2730.
Villarroya-Beltri C., Baixauli F., Mittelbrunn M., Fernández-Delgado I., Torralba D., Moreno-Gonzalo O., Baldanta S., Enrich C., Guerra S., Sánchez-Madrid F. // Nat. Commun. 2016. V. 7. P. 13588.
Nabhan J.F., Hu R., Oh R.S., Cohen S.N., Lu Q. // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 11. P. 4146–4151.
Mageswaran S.K., Dixon M.G., Curtiss M., Keener J.P., Babst M. // Traffic. 2014. V. 15. № 2. P. 212–229.
Shields S.B., Oestreich A.J., Winistorfer S., Nguyen D., Payne J.A., Katzmann D.J., Piper R. // J. Cell. Biol. 2009. V. 185. № 2. P. 213–224.
Reggiori F., Pelham H.R.B. // EMBO J. 2001. V. 20. № 18. P. 5176–5186.
Yamashita Y., Kojima K., Tsukahara T., Agawa H., Yamada K., Amano Y., Kurotori N., Tanaka N., Sugamura K., Takeshita T. // J. Cell. Sci. 2008. V. 121. № 10. P. 1727–1738.
Ferreira J.V., da Rosa Soares A., Ramalho J., Carvalho C.M., Cardoso M.H., Pintado P., Carvalho A.S., Beck H.C., Matthiesen R., Zuzarte M., Girão H., van Niel G., Pereira P. // Sci. Adv. 2022. V. 8. № 12. eabm1140.
Ferreira J.V., da Rosa Soares A., Pereira P. // Autophagy. 2022. V. 18. № 9. P. 2263–2265.
Trajkovic K., Hsu C., Chiantia S., Rajendran L., Wenzel D., Wieland F., Schwille P., Brügger B., Simons M. // Science. 2008. V. 319. № 5867. P. 1244–1247.
Shamseddine A.A., Airola M., Hannun Y.A. // Adv. Biol. Regul. 2015. V. 57. P. 24–41.
Menck K., Sönmezer C., Worst T.S., Schulz M., Dihazi G.H., Streit F., Erdmann G., Kling S., Boutros M., Binder C., Gross J.C. // J. Extracell. Vesicles. 2017. V. 6. № 1. P. 1378056.
Stoffel W., Hammels I., Jenke B., Binczek E., Schmidt-soltau I., Brodesser S., Schauss A., Etich J., Heilig J., Zaucke F. // Cell Death Dis. 2016. V. 7. № 11. P. e2488.
Scarlatti F., Bauvy C., Ventruti A., Sala G., Cluzeaud F., Vandewalle A., Ghidoni R., Codogno P. // J. Biol. Chem. 2004. V. 279. № 18. P. 18384–18391.
Beer K.B., Rivas-Castillo J., Kuhn K., Fazeli G., Karmann B., Nance J.F., Stigloher C., Wehman A.M. // Proc. Natl. Acad. Sci. USA. 2018. V. 115. № 6. P. E1127–E1136.
Fujii T., Sakata A., Nishimura S., Eto K., Nagata S. // Proc. Natl. Acad. Sci. USA. 2015. V. 112. № 41. P. 12 800–12 805.
Baietti M.F., Zhang Z., Mortier E., Melchior A., Degeest G., Geeraerts A., Ivarsson Y., Depoortere F., Coomans C., Vermeiren E., Zimmermann P., David G. // Nat. Cell Biol. 2012. V. 14. № 7. P. 677–685.
Imjeti N.S., Menck K., Egea-Jimenez A.L., Lecointre C., Lembo F., Bouguenina H., Badache A., Ghossoub R., David G., Roche S., Zimmermann P. // Proc. Natl. Acad. Sci. U S A. 2017. V. 114. № 47. P. 12 495–12 500.
Ghossoub R., Lembo F., Rubio A., Gaillard C.B., Bouchet J., Vitale N., Slavík J., Machala M., Zimmermann P. // Nat. Commun. 2014. V. 5. P. 2477.
Durcin M., Fleury A., Taillebois E., Hilairet G., Krupova Z., Henry C., Truchet S., Trötzmüller M., Köfeler H., Mabilleau G., Hue O., Andriantsitohaina R., Martin P., Le Lay S. // J. Extracell. Vesicles. 2017. V. 6. № 1. P. 1305677.
Muralidharan-Chari V., Clancy J., Plou C., Romao M., Chavrier P., Raposo G., D’Souza-Schorey C. // Curr. Biol. 2009. V. 19. № 22. P. 1875–1885.
Scott C.C., Gruenberg J. // Bioessays. 2011. V. 33. № 2. P. 103–110.
Forgac M. // Nat. Rev. Mol. Cell. Biol. 2007. V. 8. № 11. P. 917–929.
Gowrisankaran S., Milosevic I. // IUBMB Life. 2020. V. 72. № 4. P. 568–576.
Wang D., Hiesinger P.R. // J. Cell Biol. 2013. V. 203. № 2. P. 171–173.
Guo H., Chitiprolu M., Roncevic L., Javalet C., Hemming F.J., Trung M.T., Meng L., Latreille E., Tanese de Souza C., McCulloch D., Baldwin R.M., Auer R., Côté J., Russell R.C., Sadoul R., Gibbings D. // Dev. Cell. 2017. V. 43. № 6. P. 716–730.
Latifkar A., Ling L., Hingorani A., Johansen E., Clement A., Zhang X., Hartman J., Fischbach C., Lin H., Cerione R.A., Antonyak M.A. // Dev. Cell. 2019. V. 49. № 3. P. 393–408.
Wang L., Wu D., Robinson C. V., Wu H., Fu T.M. // Mol. Cell. 2020. V. 80. № 3. P. 501–511.
Choezom D., Gross J.C. // J. Cell Sci. 2022. V. 35. № 5. jcs259324.
Shelke G.V., Yin Y., Jang S.C., Lässer C., Wennmalm S., Hoffmann H.J., Li L., Gho Y.S., Nilsson J.A., Lötvall J. // J. Extracell. Vesicles. 2019. V. 8. № 1. P. 1650458.
Poëa-Guyon S., Ammar M.R., Erard M., Amar M., Moreau A.W., Fossier P., Gleize V., Vitale N., Morel N. // J. Cell Biol. 2013. V. 203. № 2. P. 283–298.
Stenmark H. // Nat. Rev. Mol. Cell. Biol. 2009. V. 10. № 8. P. 513–525.
Rink J., Ghigo E., Kalaidzidis Y., Zerial M. // Cell. 2005. V. 122. № 5. P. 735–749.
Wei D., Zhan W., Gao Y., Huang L., Gong R., Wang W., Zhang R., Wu Y., Gao S., Kang T. // Cell Res. 2021. V. 31. № 2. P. 157–177.
Verweij F.J., Bebelman M.P., George A.E., Couty M., Bécot A., Palmulli R., Heiligenstein X., Sirés-Campos J., Raposo G., Pegtel D.M., van Niel G. // J. Cell Biol. 2022. V. 221. № 12. e202112032.
Ostrowski M., Carmo N.B., Krumeich S., Fanget I., Raposo G., Savina A., Moita C.F., Schauer K., Hume A.N., Freitas R.P., Goud B., Benaroch P., Hacohen N., Fukuda M., Desnos C., Seabra M.C., Darchen F., Amigorena S., Moita L.F., Thery C. // Nat. Cell Biol. 2010. V. 12. № 1. P. 19–30.
Hsu C., Morohashi Y., Yoshimura S.I., Manrique-Hoyos N., Jung S.Y., Lauterbach M.A., Bakhti M., Grønborg M., Möbius W., Rhee J.S., Barr F.A., Simons M. // J. Cell Biol. 2010. V. 189. № 2. P. 223–232.
Savina A., Fader C.M., Damiani M.T., Colombo M.I. // Traffic. 2005. V. 6. № 2. P. 131–143.
Khvotchev M.V., Ren M., Takamori S., Jahn R., Südhof T.C. // J. Neurosci. 2003. V. 23. № 33. P. 10 531–10 539.
Laporte M.H., Chi K. il, Caudal L.C., Zhao N., Schwarz Y., Rolland M., Martinez-Hernandez J., Martineau M., Chatellard C., Denarier E., Mercier V., Lemaître F., Blot B., Moutaux E., Cazorla M., Perrais D., Lanté F., Bruns D., Fraboulet S., Hemming F.J., Kirchhoff F., Sadoul R. // PLoS Biol. 2022. V. 20. № 6. e3001659.
Sheehan P., Zhu M., Beskow A., Vollmer C., Waites C.L. // J. Neurosci. 2016. V. 36. № 33. P. 8668–8686.
Hemming F.J., Fraboulet S., Blot B., Sadoul R. // Neuroscience. 2004. V. 123. № 4. P. 887–895.
Giorgini F., Steinert J.R. // Commun. Integr. Biol. 2013. V. 6. № 6. e26807.
Ascaño M., Richmond A., Borden P., Kuruvilla R. // J. Neurosci. 2009. V. 29. № 37. P. 11674–11685.
Park M. // Front. Cell. Neurosci. 2018. V. 12: 361.
Sultana P., Novotny J. // ASN Neuro. 2022. V. 14. 175909142211423.
Gross J.C., Chaudhary V., Bartscherer K., Boutros M. // Nat. Cell. Biol. 2012. V. 14. № 10. P. 1036–1045.
Hyenne V., Apaydin A., Rodriguez D., Spiegelhalter C., Hoff-Yoessle S., Diem M., Tak S., Lefebvre O., Schwab Y., Goetz J.G., Labouesse M. // J. Cell Biol. 2015. V. 211. № 1. P. 27–37.
Koles K., Nunnari J., Korkut C., Barria R., Brewer C., Li Y., Leszyk J., Zhang B., Budnik V. // J. Biol. Chem. 2012. V. 287. № 20. P. 16820–16834.
Verweij F.J., Bebelman M.P., Jimenez C.R., Garcia-Vallejo J.J., Janssen H., Neefjes J., Knol J.C., de Goeij-de Haas R., Piersma S.R., Baglio S.R., Verhage M., Middeldorp J.M., Zomer A., van Rheenen J., Coppolino M.G., Hurbain I., Raposo G., Smit M.J., Toonen R.F.G., van Niel G., Pegtel D.M. // J. Cell Biol. 2018. V. 217. № 3. P. 1129–1142.
Sedgwick A.E., D’Souza-Schorey C. // Traffic. 2018. V. 19. № 5. P. 319–327.
Granger E., McNee G., Allan V., Woodman P. // Semin. Cell Dev. Biol. 2014. V. 31. № 100. P. 20–29.
Jackson C.E., Scruggs B.S., Schaffer J.E., Hanson P.I. // Biophys. J. 2017. V. 113. № 6. P. 1342–1352.
Mulcahy L.A., Pink R.C., Carter D.R.F. // J. Extracell. Vesicles. 2014. V. 3. P. 24641.
Tkach M., Kowal J., Zucchetti A.E., Enserink L., Jouve M., Lankar D., Saitakis M., Martin-Jaular L., Théry C. // EMBO J. 2017. V. 36. № 20. P. 3012–3028.
Luga V., Zhang L., Viloria-Petit A.M., Ogunjimi A.A., Inanlou M.R., Chiu E., Buchanan M., Hosein A.N., Basik M., Wrana J.L. // Cell. 2012. V. 151. № 7. P. 1542–1556.
Skog J., Würdinger T., van Rijn S., Meijer D.H., Gainche L., Curry W.T., Carter B.S., Krichevsky A.M., Breakefield X.O. // Nat. Cell Biol. 2008. V. 10. № 12. P. 1470–1476.
Al-Nedawi K., Meehan B., Micallef J., Lhotak V., May L., Guha A., Rak J. // Nat. Cell Biol. 2008. V. 10. № 5. P. 619–624.
Korkut C., Li Y., Koles K., Brewer C., Ashley J., Yoshihara M., Budnik V. // Neuron. 2013. V. 77. № 6. P. 1039–1046.
Vilcaes A.A., Chanaday N.L., Kavalali E.T. // Neuron. 2021. V. 109. № 6. P. 971–983.
Chivet M., Javalet C., Laulagnier K., Blot B., Hemming F.J., Sadoul R. // J. Extracell. Vesicles. 2014. V. 3. P. 24722.
Mack M., Kleinschmidt A., Brühl H., Klier C., Nelson P.J., Cihak J., Plachý J., Stangassinger M., Erfle V., Schlöndorff D. // Nat. Med. 2000. V. 6. № 7. P. 769–775.
Fitzner D., Schnaars M., van Rossum D., Krishnamoorthy G., Dibaj P., Bakhti M., Regen T., Hanisch U.K., Simons M. // J. Cell Sci. 2011. V. 124. № 3. P. 447–458.
Frühbeis C., Fröhlich D., Kuo W.P., Krämer-Albers E.M. // Front. Cell. Neurosci. 2013. V. 7. P. 182.
Costa Verdera H., Gitz-Francois J.J., Schiffelers R.M., Vader P. // J. Control. Release. 2017. V. 266. P. 100–108.
Horibe S., Tanahashi T., Kawauchi S., Murakami Y., Rikitake Y. // BMC Cancer. 2018. V. 18. № 1. P. 47.
Kamerkar S., Lebleu V.S., Sugimoto H., Yang S., Ruivo C.F., Melo S.A., Lee J.J., Kalluri R. // Nature. 2017. V. 546. № 7659. P. 498–503.
Christianson H.C., Svensson K.J., van Kuppevelt T.H., Li J.P., Belting M. // Proc. Natl. Acad. Sci. USA. 2013. V. 110. № 43. P. 17380–17385.
Miyanishi M., Tada K., Koike M., Uchiyama Y., Kitamura T., Nagata S. // Nature. 2007. V. 450. № 7168. P. 435–439.
Schneider W.J., Beisiegel U., Goldstein J.L., Brown M.S. // J. Biol. Chem. 1982. V. 257. № 5. P. 2664–2673.
Kanada M., Bachmann M.H., Hardy J.W., Frimannson D.O., Bronsart L., Wang A., Sylvester M.D., Schmidt T.L., Kaspar R.L., Butte M.J., Matin A.C., Contag C.H. // Proc. Natl. Acad. Sci. USA. 2015. V. 112. № 12. P. E1433–E1442.
Parolini I., Federici C., Raggi C., Lugini L., Palleschi S., de Milito A., Coscia C., Iessi E., Logozzi M., Molinari A., Colone M., Tatti M., Sargiacomo M., Fais S. // J. Biol. Chem. 2009. V. 284. № 49. P. 34211–34222.
Santos M.F., Rappa G., Karbanová J., Kurth T., Corbeil D., Lorico A. // J. Biol. Chem. 2018. V. 293. № 36. P. 13 834–13 848.
Heusermann W., Hean J., Trojer D., Steib E., von Bueren S., Graff-Meyer A., Genoud C., Martin K., Pizzato N., Voshol J., Morrissey D.V., Andaloussi S.E., Wood M.J., Meisner-Kober N.C. // J. Cell Biol. 2016. V. 213. № 2. P. 173–184.
Kowal J., Arras G., Colombo M., Jouve M., Morath J.P., Primdal-Bengtson B., Dingli F., Loew D., Tkach M., Théry C. // Proc. Natl. Acad. Sci. USA. 2016. V. 113. № 8. P. E968–E977.
Reátegui E., van der Vos K.E., Lai C.P., Zeinali M., Atai N.A., Aldikacti B., Floyd F.P., Khankhel A., Thapar V., Hochberg F.H., Sequist L.V., Nahed B.V., Carter B.S., Toner M., Balaj L., Ting D.T., Breakefield X.O., Stott S.L. // Nat. Commun. 2018. V. 9. № 1. P. 175.
Xu R., Greening D.W., Chen M., Rai A., Ji H., Takahashi N., Simpson R.J. // Proteomics. 2019. V. 19. № 8. e1700453.
Castillo J., Bernard V., San Lucas F.A., Allenson K., Capello M., Kim D.U., Gascoyne P., Mulu F.C., Stephens B.M., Huang J., Wang H., Momin A.A., Jacamo R.O., Katz M., Wolff R., Javle M., Varadhachary G., Wistuba I.I., Hanash S., Maitra A., Alvarez H. // Ann. Oncol. 2018. V. 29. № 1. P. 223–229.
Belov L., Matic K.J., Hallal S., Best O.G., Mulligan S.P., Christopherson R.I. // J. Extracell. Vesicles. 2016. V. 5. P. 25355.
Mustapic M., Eitan E., Werner J.K., Berkowitz S.T., Lazaropoulos M.P., Tran J., Goetzl E.J., Kapogiannis D. // Front. Neurosci. 2017. V. 11. P. 278.
Nogueras-Ortiz C.J., Mahairaki V., Delgado-Peraza F., Das D., Avgerinos K., Eren E., Hentschel M., Goetzl E.J., Mattson M.P., Kapogiannis D. // Cells. 2020. V. 9. № 7. P. 1618.
Goetzl E.J., Boxer A., Schwartz J.B., Abner E.L., Petersen R.C., Miller B.L., Kapogiannis D. // Neurology. 2015. V. 85. № 1. P. 40–47.
Cvjetkovic A., Jang S.C., Konečná B., Höög J.L., Sihlbom C., Lässer C., Lötvall J. // Sci. Rep. 2016. V. 6. P. 36338.
Bandu R., Oh J.W., Kim K.P. // Exp. Mol. Med. 2019. V. 51. № 3. P. 1–10.
Дополнительные материалы отсутствуют.


