Неорганические материалы, 2019, T. 55, № 1, стр. 94-100
Модель делокализованных атомов и свойства сульфатно-фосфатных стеколД. С. Сандитов, С. С. Бадмаев
Д. С. Сандитов 1, 2, *, С. С. Бадмаев 1, **
1 Бурятский государственный университет
670000 Улан-Удэ, ул. Смолина, 24а, Россия
2 Институт физического материаловедения СО Российской академии наук
670047 Улан-Удэ, ул. Сахьяновой, 6, Россия
* E-mail: sanditov@bsu.ru
** E-mail: sayan75@mail.ru
Поступила в редакцию 27.02.2018
Аннотация
Показана применимость основных положений модели делокализованных атомов к легкоплавким сульфатно-фосфатным стеклам. Рассчитаны параметры модели. На их основе высказаны определенные суждения о процессе “делокализации атома” в исследованных стеклах и об их свойствах (вязкость, микротвердость, стеклование, внутреннее давление). Установлено, что между энергией делокализации атома и температурой стеклования наблюдается линейная корреляция. При переходе жидкость – стекло замораживается процесс делокализации атома.
ВВЕДЕНИЕ
Легкоплавкие сульфатно-фосфатные стекла используются как среды, передающие давление при высокотемпературном гидростатическом уплотнении легких металлических сплавов, а также в качестве стеклосмазок при их термомеханической обработке (штамповке, прессовании) [1, 2]. Они находят применение и в других отраслях техники, например, в качестве аморфных припоев для скрепления керамических, кварцевых неметаллических деталей между собой [1].
Настоящая работа посвящена возможности описания ряда механических и тепловых свойств сульфатно-фосфатных стекол в рамках модели делокализованных атомов [3, 4]. Данные по свойствам этих стекол – вязкости η, модулю упругости E, коэффициенту Пуассона μ, микротвердости HV, температуре стеклования Tg – получены В.Л. Мамошиным [1, 2].
МОДЕЛЬ ДЕЛОКАЛИЗОВАННЫХ АТОМОВ НА ПРИМЕРЕ СИЛИКАТНЫХ СТЕКОЛ
Под делокализацией атома в силикатных стеклах и их расплавах подразумевается предельное смещение атома кислорода в мостике –Si–O–Si–, связанное с локальной низкоактивационной деформацией кремнекислородной сетки из валентных связей. На рис. 1 приведена схема элементарного акта вязкого течения силикатного стекла по Немилову [5], который, как мы считаем, состоит из двух этапов: делокализации мостикового атома кислорода (переход A–B) и переключения валентной связи (переход B–C). Полагаем, что делокализация мостикового атома кислорода служит необходимым условием переключения валентной связи и, следовательно, самого вязкого течения. Поэтому замораживание процесса делокализации активного атома в области стеклования приводит к прекращению вязкого течения и к переходу расплава в стеклообразное состояние [6, 7].
Методами статистической физики получена формула для относительного числа делокализованных атомов [3, 7]
(1)
$\frac{{{{N}_{е }}}}{N} = \exp \left( { - \frac{{\Delta {{{\varepsilon }}_{е }} + p\Delta {{v}_{e}}}}{{kT}}} \right),$Вязкое течение выше температуры стеклования Tg обеспечивается наличием возбужденных делокализованных атомов с энергией возбуждения Δεe
(2)
$\Delta {{{\varepsilon }}_{e}} = R{{T}_{g}}\ln ({1 \mathord{\left/ {\vphantom {1 {{{f}_{g}}}}} \right. \kern-0em} {{{f}_{g}}}}).$Здесь R – газовая постоянная, ${{f}_{g}} = {{({{\Delta {{V}_{e}}} \mathord{\left/ {\vphantom {{\Delta {{V}_{e}}} V}} \right. \kern-0em} V})}_{{T = {{T}_{g}}}}}$ – доля флуктуационного объема, замороженная при температуре стеклования Tg. Флуктуационный объем аморфного вещества обусловлен тепловыми смещениями (делокализацией) атомов
Величина fg определяется по данным о вязкости в области стеклования и слабо зависит от природы стеклообразующих веществ: у стекол одного класса она практически постоянна fg ≈ const.
При охлаждении расплава неорганических стекол относительное число делокализованных активных мостиковых атомов (Ne/N), ответственных за вязкое течение, в интервале стеклования уменьшается до ничтожно малого значения, порядка 3%, что равносильно их замораживанию [7, 8],
(4)
${{\left( {\frac{{{{N}_{е }}}}{N}} \right)}_{{T = {{T}_{g}}}}} \approx \exp \left( { - \frac{{\Delta {{{\varepsilon }}_{е }}}}{{k{{T}_{g}}}}} \right) \approx {\text{const}} \approx 0.03.$При T = Tg замораживается процесс делокализации атома – переход активной частицы из основного в возбужденное состояние.
Объем делокализации атома $\Delta {{v}_{е }}$ вычисляется по формуле [3, 7]
где μ – коэффициент Пуассона, E – модуль упругости при одноосной деформации, k – постоянная Больцмана.ЭНЕРГИЯ ДЕЛОКАЛИЗАЦИИ АТОМА И СВОЙСТВА СУЛЬФАТНО-ФОСФАТНЫХ СТЕКОЛ
Вязкое течение. Вязкое течение сульфатно-фосфатных стекол и их расплавов, как и других стеклообразных систем, вполне удовлетворительно описывается “двойной экспонентой” – уравнением Брэдбури–Шишкина (см. [2, 9])
которое может быть обосновано в рамках модели делокализованных атомов с помощью соотношений [3, 7]
(7)
$\begin{gathered} {\eta } = {{{\eta }}_{0}}\exp \left( {\frac{1}{f}} \right), \\ f = \left( {\frac{{\Delta {{v}_{e}}}}{v}} \right)\exp \left( { - \frac{{\Delta {{{\varepsilon }}_{e}}}}{{kT}}} \right), \\ \end{gathered} $Была разработана программа [1], по которой производился подбор эмпирических параметров η0, a, c (табл. 1). Предэкспоненциальный множитель η0 представляет собой высокотемпературный предел вязкости и равен η0 = 10–3–10–4 П, величина с для исследованных стекол меняется от 1960 до 2160 К. Параметр а близок к единице а = = 0.95–0.99. Это означает (см. (8)), что объем $\Delta {{v}_{е }}$, необходимый для делокализации атома (кинетической единицы), практически совпадает с объемом $v$, приходящимся на атом ($\Delta {{v}_{е }}$ ≈ $v$).
Таблица 1.
Свойства сульфатно-фосфатных стекол и параметры модели делокализованных атомов
| № | Стекло | Tg, K | E, $\frac{{{\text{к г с }}}}{{{\text{м }}{{{\text{м }}}^{{\text{2}}}}}}$ | μ | a | c, K | fg | $\Delta {{{\varepsilon }}_{e}}$, кДж/моль | Δve, Å3 | ${{p}_{i}}$, $\frac{{{\text{к г с }}}}{{{\text{м }}{{{\text{м }}}^{{\text{2}}}}}}$ | HV , $\frac{{{\text{к г с }}}}{{{\text{м }}{{{\text{м }}}^{{\text{2}}}}}}$ |
${{{\gamma }}_{D}}$ (15) | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (2) | (11) | ||||||||||||
| 1 | NaPO3 | 523 | 3610 | 0.294 | 0.99 | 2160 | 0.016 | 17.95 | 17.93 | 16 | 195 | 175 | 1.74 |
| 2 | 0.9 NaPO3–0.1 ZnSO4 | 493 | 4060 | 0.288 | 0.98 | 1990 | 0.018 | 16.45 | 16.52 | 12 | 231 | 210 | 1.70 |
| 3 | 0.8 NaPO3–0.2 ZnSO4 | 505 | 4220 | 0.284 | 0.98 | 2005 | 0.019 | 16.61 | 16.64 | 11 | 248 | 225 | 1.68 |
| 4 | 0.7 NaPO3–0.3 ZnSO4 | 510 | 4530 | 0.273 | 0.99 | 2000 | 0.020 | 16.56 | 16.60 | 11 | 260 | 235 | 1.62 |
| 5 | 0.6 NaPO3–0.4 ZnSO4 | 515 | 5210 | 0.259 | 0.98 | 2015 | 0.020 | 16.72 | 16.72 | 10 | 286 | 260 | 1.54 |
| 6 | 0.9 NaPO3–0.1 Li2SO4 | 451 | 4140 | 0.300 | 0.97 | 1940 | 0.014 | 15.98 | 16.10 | 13 | 206 | 200 | 1.72 |
| 7 | 0.8 NaPO3–0.2 Li2SO4 | 447 | 4210 | 0.303 | 0.95 | 1950 | 0.013 | 16.11 | 16.18 | 14 | 205 | 200 | 1.79 |
| 8 | 0.7 NaPO3–0.3 Li2SO4 | 429 | 4230 | 0.034 | 0.95 | 1860 | 0.014 | 15.20 | 15.44 | 11 | 212 | 215 | 1.80 |
| 9 | 0.9 NaPO3–0.1 Na2SO4 | 496 | 3730 | 0.299 | 0.97 | 2060 | 0.016 | 17.02 | 17.10 | 14 | 207 | 195 | 1.77 |
| 10 | 0.8 NaPO3–0.2 Na2SO4 | 493 | 3550 | 0.292 | 0.96 | 2050 | 0.016 | 16.92 | 17.01 | 15 | 191 | 190 | 1.72 |
| 11 | 0.7 NaPO3–0.3 Na2SO4 | 490 | 3540 | 0.288 | 0.95 | 2095 | 0.015 | 17.08 | 17.39 | 16 | 172 | 180 | 1.70 |
| 12 | 0.9 NaPO3–0.1 K2SO4 | 444 | 3380 | 0.316 | 0.95 | 1945 | 0.013 | 16.00 | 16.14 | 16 | 175 | 210 | 1.88 |
| 13 | 0.8 NaPO3–0.2 K2SO4 | 453 | 3350 | 0.316 | 0.96 | 1940 | 0.014 | 16.05 | 16.10 | 15 | 185 | 205 | 1.88 |
| 14 | 0.7 NaPO3–0.3 K2SO4 | 473 | 3340 | 0.313 | 0.99 | 2015 | 0.014 | 16.76 | 16.72 | 16 | 180 | 200 | 1.86 |
Долю флуктуационного объема fg, замороженную при температуре стеклования, вычисляем по формуле
вытекающей из сравнения уравнений вязкости (6) и (7) при f = fg и T = Tg. Значение fg у сульфатно-фосфатных стекол меняется в сравнительно узких пределах (табл. 1). При увеличении содержания сульфата цинка ZnSO4 в стеклах системы NaPO3–ZnSO4 от 0 до 40 мол. % величина fg слабо растет от 0.016 до 0.020. У стекол NaPO3–MSO4 (M = Li, Na, K) значение fg несколько ниже fg ≈ 0.014–0.016.
На основе данных о константе c = (1940–2160) K по формуле (9) (R = NAk – газовая постоянная)
была рассчитана энергия делокализации атома Δεe = 16–18 кДж/моль. Эти значения находятся в хорошем согласии с результатами расчета Δεe по формуле модели делокализованных атомов (2) (табл. 1).
Объем делокализации атома, вычисленный по формуле модели (5), для исследованных стекол составляет $\Delta {{v}_{e}} \approx 11{\kern 1pt} - {\kern 1pt} 16\,\,{{{\AA}}^{3}},$ что заметно выше, чем у силикатных стекол $\Delta {{v}_{e}} = 6{\kern 1pt} - {\kern 1pt} 8\,\,{{{\AA}}^{3}}$ [3, 4].
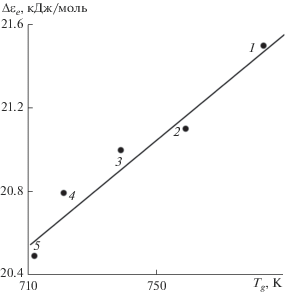
Температура стеклования. В соответствии с формулой энергии делокализации атома (2) при fg ≈ const следует ожидать линейную корреляцию между Δεe и Tg. Действительно, энергия Δεe, определенная независимым способом (по данным об эмпирической постоянной уравнения вязкости), у щелочно-силикатных стекол линейно зависит от температуры стеклования Tg (рис. 2) [6, 7].
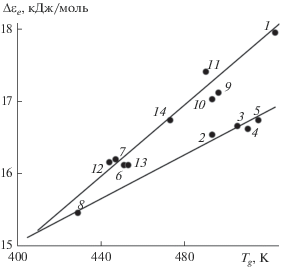
Как и следовало ожидать, энергия Δεe = Rc, вычисленная на основе данных о постоянной c (см. ур-е (11)), у сульфатно-фосфатных стекол линейно зависит от температуры стеклования (табл. 1 и рис. 3). При этом рассмотренные стекла делятся на две группы, которые отличаются наклонами прямых: у первой группы fg ≈ 0.018, у второй – fg ≈ 0.014 (табл. 1).
В соответствии с развиваемым нами представлением [6, 7] (см. выше) замораживание процесса делокализации атома приводит к прекращению вязкого течения и к переходу жидкости в стеклообразное состояние. Этот момент наступает тогда, когда энергия тепловых колебаний решетки (i/2)kT, отнесенная к атому, становится равной или меньше энергии делокализации атома: (i/2)kT ≤ Δεe, откуда следует приближенный критерий стеклования
где i – число степеней свободы кинетической единицы, ответственной за стеклование. Как отмечено выше (рис. 2 и 3, табл. 1), энергия Δεe, определенная независимыми способами из данных об эмпирических постоянных уравнений вязкости, а также по модели делокализованных атомов (2), линейно зависит от температуры стеклования, что согласуется с условием стеклования (12).Микротвердость. Под действием механического напряжения, превышающего некоторый порог σy, при 20°С в неорганических стеклах возникает деформация, которая после снятия напряжения может сохраняться сколь угодно долго (эффект пластичности стекла) (см. [9–12]). Однако примечательно то обстоятельство, что при нагревании (ниже Tg) данная деформация релаксирует до исчезновения. Следовательно, она оказывается замороженной обратимой деформацией [9, 11]. Тем не менее, следуя многим авторам, будем пользоваться термином “пластическая”, а величину σy назовем пределом текучести. Аналогичная замороженная обратимая деформация наблюдается у аморфных органических полимеров [9, 11] и массивных металлических стекол [13].
“Пластичность” хрупких неорганических стекол удобно изучать методом микротвердости. При вдавливании в них алмазной пирамидки Виккерса и других заостренных инденторов образуется “пластичный” микроотпечаток – лунка при 20°С. При этом микротвердость по Виккерсу HV у силикатных, германатных и других неорганических стекол совпадает с предельным напряжением σy. Следовательно, микротвердость для них служит пределом текучести HV ≈ σy, выше которого происходит “пластическая” деформация [12, 14].
Представление о том, что элементарный акт “пластической” деформации стекол сводится к делокализации атома (кинетической структурной единицы), находится в согласии с экспериментальными данными: расчеты предела текучести и энергии активации этой деформации согласуются с экспериментом [12].
Предел текучести σy имеет смысл напряжения, необходимого для критического смещения (делокализации) кинетической единицы. По величине σy совпадает с внутренним давлением
против которого совершается работа делокализации атома. Принимая во внимание равенство HV ≅ σy, приходим к заключению, что микротвердость стекол должна совпадать с их внутренним давлением
что подтверждается для силикатных и германатных стекол [9, 14].
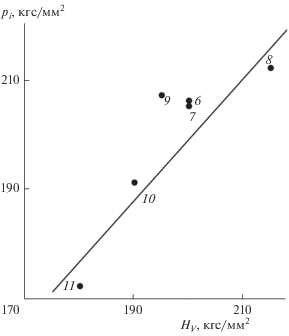
Как видно из табл. 1 и рис. 4 и 5, линейная корреляция между HV и pi удовлетворительно выполняется и для исследованных сульфатно-фосфатных стекол. Их микротвердость HV = 175–260 кгс/мм2 в пределах погрешности измерений (±10 кгс/мм2 [1]) совпадает с внутренним давлением, рассчитанным по модели делокализованных атомов,
(14)
${{p}_{i}} = \frac{{{{f}_{g}}\ln ({1 \mathord{\left/ {\vphantom {1 {{{f}_{g}}}}} \right. \kern-0em} {{{f}_{g}}}})}}{{3(1 - 2{\mu })}} = 180{\kern 1pt} - {\kern 1pt} 286\,\,{{{\text{к г с }}} \mathord{\left/ {\vphantom {{{\text{к г с }}} {{\text{м }}{{{\text{м }}}^{2}}}}} \right. \kern-0em} {{\text{м }}{{{\text{м }}}^{2}}}}.$Рис. 4.
Линейная корреляция между внутренним давлением pi и микротвердостью HV стекол в системе NaPO3–ZnSO4; номера точек соответствуют номерам стекол в табл. 1.

Рис. 5.
Корреляция между pi и HV для стекол системы NaPO3–M2SO4 (M = Li, Na); номера точек соответствуют номерам стекол в табл. 1, точка 9 (стекло 0.9NaPO3–0.1Na2SO4) выпадает из общей закономерности.
Ангармонизм колебаний решетки. Делокализация атома – его предельное смещение из равновесного положения – связана с отклонением зависимости силы межатомного (межмолекулярного) взаимодействия от смещения атома от линейной, иными словами, связана с нелинейностью этой силы и с ангармонизмом колебаний решетки (межцепочечных колебаний подрешетки), мерой которых служит параметр Грюнайзена γD (см., например, [10]). Его можно оценить с помощью формулы Беломестных–Теслевой [15] (табл. 1)
Примечательно то, что это соотношение находится в согласии с известным уравнением Грюнайзена для расчета γD [15, 16].
При переходе от стеклообразного метафосфата натрия NaPO3 к стеклам системы NaPO3–ZnSO4 (табл. 1) наблюдается убывание ангармонизма (γD), что согласуется с представлением о том, что катионы Zn2+ в структуре стекол играют связующую роль, образуя мостики типа –P–O…Zn…O–P– [1]. Увеличение содержания ZnSO4 (катионов Zn2+) приводит к укреплению структуры и к ослаблению ангармонизма колебаний цепей: параметр Грюнайзена уменьшается от 1.74 до 1.54. Об укреплении структуры при этом свидетельствует рост внутреннего давления с 195 до 286 кгс/мм2 и возрастание микротвердости с 175 до 260 кгс/мм2 (табл. 1).
Наоборот, при переходе от NaPO3 к стеклам NaPO3–K2SO4 наблюдается усиление степени ангармонизма колебаний решетки, величина γD растет с 1.74 до 1.88 (табл. 1), что связано с ослаблением и разрыхлением структуры. При этом падает и внутреннее давление – с 195 до 175 кгс/мм2.
О ДЕЛОКАЛИЗАЦИИ АТОМА В СУЛЬФАТНО-ФОСФАТНЫХ СТЕКЛАХ
Наряду с прочными ионно-ковалентными связями в цепях –P–O–P– и тетраэдрах PO4 и SO4 в процессах структурообразования сульфатно-фосфатных стекол принимают участие силы слабого межмолекулярного взаимодействия (ван-дер-ваальсовы силы) [1, 2], ответственные за повышенные значения коэффициента теплового расширения и низкие температуры плавления (легкоплавкость). В целом структура сульфатно-фосфатных стекол образована относительно короткими цепями –P–O–P– и изолированными тетраэдрами SO4, причем указанные структурные фрагменты соединены между собой слабыми силами межмолекулярного взаимодействия [1].
Небольшие значения энергии делокализации атома Δεe = 15–17 кДж/моль указывают на то обстоятельство, что делокализация атома в сульфатно-фосфатных стеклах связана с преодолением сил слабого взаимодействия.
Внутреннее давление pi (ур-е (14)), обусловленное реакцией квазирешетки на ее всестороннее растяжение или сжатие (табл. 1), для исследованных стекол определяется, очевидно, также указанными выше силами слабого взаимодействия. Они прежде всего реагируют на внешнее воздействие. Работа деформации при микровдавливании алмазной пирамидки Виккерса совершается против этих слабых сил, поэтому микротвердость HV практически совпадает с внутренним давлением HV ≈ pi (табл. 1).
К сожалению, полученных данных недостаточно для однозначного заключения по механизму делокализации атома в исследованных стеклах. По аналогии с силикатными стеклами под делокализацией атома в сульфатно-фосфатных стеклах подразумеваем предельное смещение мостикового атома кислорода в мостике P–O–P, связанное с локальной низкоактивационной деформацией структурной сетки из валентных связей.
Тот факт, что объем делокализации атома $\Delta {{v}_{e}} = 11{\kern 1pt} - {\kern 1pt} 16\,\,{{{\AA}}^{3}}$ у сульфатно-фосфатных стекол больше, чем у силикатных $\left( {\Delta {{v}_{e}} = 6{\kern 1pt} - {\kern 1pt} 8\,\,{{{\AA}}^{3}}} \right),$ объясняется, по-видимому, большей длиной связи P–O в мостике P–O–P и бóльшим смещением мостикового атома кислорода Δrm из равновесного положения, чем в случае силикатных стекол (см. рис. 1). В модели делокализованных атомов величина Δ${{v}_{e}}$ определяется площадью эффективного сечения атома πd 2 (d – диаметр атома) и его предельным отклонением Δrm [3]
Сульфатно-фосфатные стекла можно рассматривать, в принципе, как линейные и линейно-разветвленные аморфные полимеры. В органических аморфных полимерах внутри цепных макромолекул действуют сильные ковалентные связи, а участки соседних цепей сшиты между собой слабыми межмолекулярными связями. На основе данных Δεe = 5–10 кДж/моль и $\Delta {{v}_{e}} = 30{\kern 1pt} - {\kern 1pt} 60\,\,{{{\AA}}^{3}}$ предполагается, что процессу делокализации атома в стеклообразных органических полимерах соответствует предельное смещение небольшого фрагмента основной цепи макромолекулы – вероятно, группы атомов в соединительном звене [3, 4, 7, 8].
В связи с этим можно было предложить “полимерный” вариант процесса делокализации атома в сульфатно-фосфатных стеклах. Однако этот вариант считаем маловероятным.
ЗАКЛЮЧЕНИЕ
На основе экспериментальных данных для сульфатно-фосфатных стекол рассчитаны параметры модели делокализованных атомов. Небольшие значения энергии делокализации атома Δεe = 15–17 кДж/моль указывают на то обстоятельство, что процесс делокализации атома в этих стеклах и их расплавах связан с преодолением сил слабого взаимодействия типа ван-дер-ваальсовых сил. Элементарный объем, необходимый для делокализации атома, составляет около $\Delta {{v}_{e}} = 11{\kern 1pt} - {\kern 1pt} 16\,\,{{{\AA}}^{3}},$ что заметно выше, чем у силикатных стекол $\Delta {{v}_{e}} = 6{\kern 1pt} - {\kern 1pt} 8\,\,{{{\AA}}^{3}}$ (у которых делокализации подвергается мостиковый атом кислорода в мостике –Si–O–Si–). Такое различие объясняется большей длиной мостиковой связи P–O в мостике P–O–P и бóльшим отклонением мостикового атома кислорода из равновесного положения, чем в случае силикатного стекла. Высказано предположение, что процесс делокализации атома в исследованных сульфатно-фосфатных, как и в силикатных стеклах, представляет собой предельное смещение мостикового атома кислорода в мостике P–O–P, связанное с локальной деформацией структурной сетки из валентных связей.
Температурная зависимость вязкости рассматриваемых стекол удовлетворительно описывается эмпирическим уравнением Брэдбури–Шишкина, которое получает обоснование в рамках модели делокализованных атомов. По данным о параметре этого уравнения определяется энергия делокализации атома Δεe = Rс (R – газовая постоянная). Энергия Δεe = Rс линейно зависит от температуры стеклования Tg. Развито представление о том, что при T = Tg замораживается процесс делокализации атома. Микротвердость этих стекол практически совпадает с внутренним давлением, характеризующим межмолекулярное взаимодействие.
Список литературы
Мамошин В.Л. Структурные особенности и свойства неупорядоченных конденсированных систем на основе сульфатов и полифосфатов: Автореф. дис. докт. … хим. наук. Свердловск: УПИ им. С.М. Кирова, 1990. 40 с.
Сандитов Д.С., Мамошин В.Л., Архипов В.Г. Применение теории свободного объема к сульфатно-фосфатным стеклам и их расплавам // Физика и химия стекла. 1993. Т. 19. № 4. С. 593–601.
Сандитов Д.С. Модель делокализованных атомов в физике стеклообразного состояния // ЖЭТФ. 2012. Т. 142. Вып.1(7). С. 123–137.
Сандитов Д.С., Бадмаев С.С. О делокализации атома в стеклах и их расплавах // Физика и химия стекла. 2015. Т. 40. № 5. С. 621–630.
Немилов С.В. Природа вязкого течения стекол с замороженной структурой и некоторые следствия валентно-конфигурационной теории текучести // Физика и химия стекла. 1978. Т. 4. № 6. С. 662–674.
Сандитов Д.С. Модель вязкого течения стеклообразующих жидкостей и стекол // ДАН. 2013. Т. 451. № 6. С. 650–654.
Sanditov D.S., Ojovan M.I. On Relaxation Nature of Glass Transition in Amorphous Materials // Physica B. 2017. V. 523. P. 96–113.
Сандитов Д.С. О природе уравнения перехода жидкость-стекло // ЖЭТФ. 2016. Т. 150. Вып. 3(9). С. 501–515.
Сандитов Д.С., Бартенев Г.М. Физические свойства неупорядоченных структур. Новосибирск: Наука, 1982. 259 с.
Козлов Г.В., Сандитов Д.С. Ангармонические эффекты и физико-механические свойства полимеров. Новосибирск: Наука, 1994. 261 с.
Сандитов Д.С. Термостимулированная низкотемпературная релаксация пластической деформации стеклообразных органических полимеров и неорганических стекол // Высокомолек. соединения. Сер. А. 2007. Т. 49. № 5. С. 832–842.
Сандитов Д.С., Сангадиев С.Ш., Сандитов Б.Д. Пластичность и вязкость стеклообразных материалов // Деформация и разрушение материалов. 2013. № 3. С. 2–7.
Чах К., Ляхов С.А., Хоник В.А. Обратимая вязкоупругая деформация массивного металлического стекла // Деформация и разрушение материалов. 2006. № 8. С. 22–25.
Сандитов Д.С., Сангадиев С.Ш. О внутреннем давлении и микротвердости неорганических стекол // Физика и химия стекла. 1998. Т. 24. № 6. С. 741–751.
Беломестных В.Н., Теслева Е.П. Взаимосвязь ангармонизма и поперечной деформации квазиизотропных поликристалличсеских тел // Журн. техн. физики. 2004. Т. 74. Вып. 8. С. 140–142.
Сандитов Д.С., Беломестных В.Н. Взаимосвязь параметров теории упругости и усредненный модуль упругости твердых тел // Журн. техн. физики. 2011. Т. 81. Вып. 11. С. 77–83.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы