Неорганические материалы, 2019, T. 55, № 10, стр. 1051-1058
Гетерофазный синтез гидроксида циркония из оксихлорида циркония
А. В. Жуков 1, С. В. Чижевская 1, *, Пьяе Пьо 1, В. А. Панов 2
1 Российский химико-технологический университет им. Д.И. Менделеева
125480 Москва, ул. Героев Панфиловцев, 20, корп. 1, Россия
2 Институт общей физики им. А.М. Прохорова Российской академии наук
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: chizh@rctu.ru
Поступила в редакцию 12.10.2018
После доработки 23.02.2019
Принята к публикации 26.02.2019
Аннотация
Изучено влияние природы, концентрации основания и температуры процесса, а также соотношения реагентов на характеристики гидроксидов циркония, синтезированных гетерофазным методом из оксихлорида циркония. Установлен интервал концентраций основания, в котором происходит переход осадка из гелеобразного состояния в кристаллоподобное, сопровождающийся значительным уменьшением кажущегося объема. Показано, что синтезированный кристаллоподобный гидроксид циркония наследует морфологические особенности исходного оксихлорида циркония (является его анаморфозой).
ВВЕДЕНИЕ
Гидроксиды циркония используются в качестве прекурсоров наноструктурированных оксидов циркония, применяемых в производстве керамики, люминофоров, катализаторов и их носителей [1].
При осаждении гидроксидов циркония из растворов солей образуются гелеобразные осадки, которые плохо фильтруются и поэтому содержат большое количество примесей маточного раствора. Этих недостатков лишен метод гетерофазной конверсии, основанный на обработке твердой соли циркония (обычно кристаллогидрата) раствором основания [2, 3]. Несмотря на очевидные достоинства, метод до настоящего времени относительно мало изучен.
На примере гексафтороцирконата калия, получаемого при переработке циркона спеканием с гексафторосиликатом калия, установлены закономерности, связанные с влиянием на характеристики синтезированных гидроксидов и получаемых из них оксидов, природы и концентрации основания, температуры процесса и некоторых других факторов [3].
Из ряда соединений циркония, производимых в промышленных масштабах, значительный интерес как прекурсор кристаллоподобного гидроксида циркония [2] (термин означает, что рентгеноаморфные частицы осадка по внешнему виду похожи на кристаллы соли) представляет оксихлорид циркония (ОХЦ), однако систематические исследования, связанные с влиянием условий гетерофазного синтеза на характеристики получаемых гидроксидов, не проводились.
ОХЦ, получаемый кристаллизацией из солянокислых растворов, представляет собой бесцветные кристаллы игольчатой формы. Эмпирическая формула ОХЦ – ZrOCl2 ∙ 8H2O – не отражает его истинный состав, так как ни в твердом состоянии, ни в растворах он не содержит цирконильную группировку (Zr = O2+). Истинный состав ОХЦ отвечает формуле [Zr4(OH)8(H2O)16]Cl8 ∙ 12H2O, или сокращенно Zr(OH)2Cl2 · 7H2O. В основе структуры ОХЦ лежит циклический тетрамер, в котором атомы циркония связаны двойными оловыми мостиками [4–6]. Тетрамерные комплексы окружены молекулами воды и ионами хлора.
Тетрамерный цикл как основная структурная единица в твердом октагидрате ОХЦ сохраняется и при растворении его в воде. При термообработке ОХЦ происходит постепенное удаление воды, сопровождающееся изменением структуры [6].
Условия процесса осаждения гидроксида (скорость добавления реагента, pH раствора и др.) влияют на фазовый состав диоксида циркония, образующегося при последующей термообработке. Образование гидроксида является следствием протекания процессов полимеризации и образования полиядерных частиц, в которых атомы циркония в структуре одного тетрамера связаны с атомами в структуре другого тетрамера посредством двойных оловых мостиков [7, 8]. При старении гидроксидов происходит их дегидратация и переход модификаций в последовательности: α → β → γ → δ, причем последняя сохраняется вплоть до 400–450°С, постепенно превращаясь в аморфный диоксид циркония [9, 10].
В случае получения прекурсора диоксида циркония путем гетерофазного синтеза состав и свойства гидроксида циркония и продукта его термообработки зависят от таких факторов, как природа и дисперсность твердого реагента, условий проведения топохимической реакции, промывки и термообработки [3].
Целью настоящей работы являлось изучение закономерностей гетерофазного синтеза гидроксида циркония из ZrOCl2 · 8H2O с участием растворов разных оснований, связанных с влиянием на характеристики прекурсоров ZrO2 таких факторов, как концентрация основания, отношение его мольного количества к мольному количеству ОХЦ, температура.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходного соединения для гетерофазного синтеза гидроксида циркония использовали перекристаллизованный ZrOCl2 · 8H2O (“х. ч.”, ТУ 6-09-3677-74), в качестве оснований – водные растворы NaOH (“х. ч.”, ГОСТ 4328-77), KOH (“х. ч.”, ГОСТ 24363-80) и аммиака (“ос. ч.”, ГОСТ 24147-80).
Обработку кристаллов ОХЦ растворами оснований проводили в термостатируемом реакторе, снабженном мешалкой (оптимальная скорость перемешивания фаз подобрана в предварительных экспериментах), в интервале температур от 25 до 85°С. Расчет стехиометрически необходимого количества основания для гетерофазного синтеза гидроксида циркония из ОХЦ проводили по уравнению реакции
(1)
$\begin{gathered} {\text{ZrOC}}{{{\text{l}}}_{2}}\cdot{\text{ }}8{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{MOH}} = \\ = \,\,{\text{Zr}}{{{\text{O}}}_{x}}{{\left( {{\text{OH}}} \right)}_{{4--2x}}} + 2{\text{MCl}} + \left( {7{\text{ }} + x} \right){{{\text{H}}}_{{\text{2}}}}{\text{O}}~, \\ \end{gathered} $Отношение мольного количества основания к мольному количеству ОХЦ (S) рассчитывали как
(2)
${S = \frac{{n({\text{MOH}})}}{{{\text{4}}n\left( {{\text{Z}}{{{\text{r}}}^{{4 + }}}} \right)}}},$В процессе эксперимента через определенное время перемешивание фаз прекращали и проводили их разделение фильтрованием. Твердую фазу трехкратно промывали на фильтре ацетоном или дистиллированной водой при соотношении фаз Т : Ж = 1 : 10, промывные воды объединяли с фильтратом и в полученном растворе определяли содержание хлорид-иона кондуктометрическим титрованием раствором нитрата серебра.
Кажущуюся степень конверсии ОХЦ в гидроксид циркония (α) рассчитывали по уравнению:
где $m_{{{\text{Cl}}}}^{{\text{ф}}}$ – масса хлорид-иона в фильтрате, объединенном с промывными водами, $m_{{{\text{Cl}}}}^{{\text{н}}}$ – масса хлорид-иона в навеске, взятой для проведения эксперимента.В экспериментах по установлению влияния условий гетерофазного синтеза на кажущийся объем осадка (Vk) контактирование ОХЦ с растворами оснований проводили в пробирках путем их встряхивания в течение 10 мин. После 15 мин отстаивания системы измеряли величину Vk. Относительный кажущийся объем ζ рассчитывали как отношение Vk к количеству вещества циркония в навеске исходного ОХЦ.
Гидроксиды анализировали на содержание ОН-групп титриметрическим методом [11], влажность и содержание циркония – гравиметрическим методом. Термообработку предварительно высушенных продуктов гетерофазной конверсии (100°С, вакуумный сушильный шкаф DZF-6020, Labtex) осуществляли со скоростью нагрева 10°С/мин в муфельной печи KL 15/12 (Therm Concep).
Дифференциальный термический анализ (ДТА/ТГ) образцов выполняли на дериватографе EXSTAR TG/DTA 7300 (SII) (корундовые тигли, нагрев с постоянной скоростью 25°С/мин). Состав газообразных продуктов, выделяющихся при нагревании, анализировали с помощью квадрупольного масс-спектрометра THERMOSTAR (Pfeiffer Vacuum).
Рентгенофазовый анализ образцов, предварительно растертых в агатовой ступке, выполняли на дифрактометре D2 PHASER (Bruker) (Ni-фильтр, CuKα-излучение). Дифрактограммы снимали в интервале углов 10° ≤ 2θ ≤ 70° с шагом 0.02°. Фазы идентифицировали с использованием базы данных JCPDS PDF2. Морфологию исходного ОХЦ, продуктов гетерофазного синтеза изучали с помощью оптического микроскопа МБС-2 и сканирующего электронного микроскопа Vega 3 (Tescan).
Гранулометрический состав образцов устанавливали с помощью лазерного гранулометра Analysette-22 (Fritsch), величину удельной поверхности – с помощью прибора Quadrasorb SI/Kr (Quantachrome) методом низкотемпературной адсорбции газа (БЭТ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оксихлорид циркония, перекристаллизованный из реактивного ОХЦ, по данным РФА, представлял собой однофазный продукт, отвечающий составу ZrOCl2 ∙ 8H2O (JCPDS № 72-1153). По данным оптической микроскопии, это прозрачные кристаллы призматической формы со средней длиной и шириной около 500 и 50 мкм соответственно.
Согласно [3], на характеристики гидроксида, синтезированного гетерофазной конверсией из гексафтороцирконата калия, значительное влияние оказывают природа основания и его концентрация. В связи с этим в процессе контакта кристаллов ОХЦ при комнатной температуре с водными растворами оснований их концентрацию варьировали от 0.1 до 5 моль/л, а мольное отношение реагентов S от 0.5 до 2.
На рис. 1 показано влияние концентрации оснований на относительный кажущийся объем осадка синтезированного гидроксида циркония (S = 1).
Рис. 1.
Влияние концентрации основания на относительный кажущийся объем осадка гидроксида циркония: 1 – NH3 · H2O; 2 – NaOH; 3 – КОН.
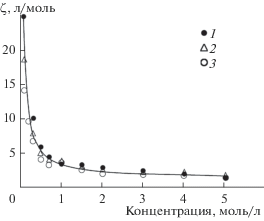
Согласно полученным результатам, наибольшее уменьшение относительного кажущегося объема осадка (в 5 раз) для всех использованных в работе оснований происходит в интервале концентраций от 0.1 до 1 моль/л (рис. 1). При более высоких концентрациях (от 1 до 5 моль/л) наблюдается незначительное изменение величины ζ. Полученные данные позволяют заключить, что переход осадка синтезированного гидроксида циркония из гелеобразного состояния в кристаллоподобное происходит преимущественно в интервале концентраций основания 0.3–0.5 моль/л независимо от природы основания.
Эксперименты по установлению влияния отношения реагентов на относительный кажущийся объем показали, что он мало зависит от величины S (полученные значения оказались близки к представленным на рис. 1).
Наглядное представление о влиянии концентрации основания на изменение морфологии частиц гидроксида при его переходе из гелеобразного в кристаллоподобное состояние дают результаты оптической микроскопии (рис. 2). Можно видеть, что гидроксид циркония, синтезированный с участием оснований с концентрацией 0.1 моль/л, представляет собой гелеобразный осадок, тогда как синтезированный при концентрации 0.5 моль/л и выше – кристаллоподобное вещество.
Рис. 2.
Морфология гидроксидов циркония, синтезированных с участием оснований разной концентрации (моль/л).

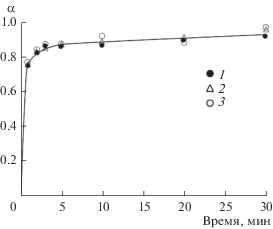
Эксперименты по конверсии ОХЦ в гидроксид концентрированными растворами оснований (С = 2.7 моль/л, t = 25°C, S = 2) показали, что процесс протекает довольно быстро: он практически завершается уже через 5 мин (рис. 3), поэтому эксперименты по изучению влияния концентрации основания на степень конверсии ОХЦ (t = = 25°C, S = 2) проводили в течение 5 мин.
Рис. 3.
Влияние длительности контактирования фаз на степень конверсии ОХЦ: 1 – NH3 ∙ H2O, 2 – NaOH, 3 – КОН.
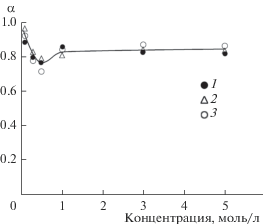
На рис. 4 представлена зависимость кажущейся степени конверсии ОХЦ в гидроксид от концентрации основания. Полученные результаты свидетельствуют о том, что природа основания практически не влияет на степень конверсии. Наблюдающееся в интервале концентраций оснований 0.1–0.5 моль/л снижение α (наиболее выражено для системы ОХЦ–KOH), совпадающее с переходом гидроксида из гелеобразного состояния в кристаллоподобное, связано, по нашему мнению, со сменой механизма процесса. Последующее небольшое увеличение α (0.5–1.0 моль/л) остается практически постоянным во всех системах вплоть до концентрации оснований 5 моль/л.
Рис. 4.
Влияние концентрации основания на кажущуюся степень конверсии ZrOCl2 ∙ 8H2O: 1 – NH3 ∙ H2O, 2 – NaOH, 3 – КОН.
Химический анализ продуктов гетерофазного синтеза (табл. 1) при варьировании концентрации оснований позволяет проанализировать изменение состава осадков гидроксидов (неполнота удаления хлорид-ионов обусловлена, по-видимому, условиями промывки осадков). Можно видеть, что концентрация оснований оказывает значительное влияние на характеристики и состав продуктов синтеза. Влажность и содержание ОН-групп в гидроксидах, синтезированных в системах с эквимолярными растворами оснований снижается в ряду: NH3 · H2O–NaOH–KOH. При увеличении концентрации оснований с 0.1 до 5 моль/л влажность гидроксидов циркония уменьшается с 71–78 до 27–43% (содержание диоксида циркония возрастает с 18–23 до 43–46%) и наблюдается выраженный процесс их старения: если состав гидроксидов в системах ОХЦ–NH3 ∙ H2O приближается к γ-форме, то в системах ОХЦ–NaOH(KOH) наряду с γ-формой присутствует также δ-форма.
Таблица 1.
Влияние природы и концентрации основания на состав синтезированных гидроксидов циркония
| Концентрация основания, моль/л | Основание | Относительная влажность, % |
Содержание ZrO2, % | OH/Zr | O2–/Zr | Состав |
|---|---|---|---|---|---|---|
| 0.1 | NH3 ∙ H2O | 78 | 17.5 | 3.8 | 0.1 | 0.8α + 0.2β |
| NaOH | 75 | 22.6 | 3.6 | 0.2 | 0.6α + 0.4β | |
| KOH | 71 | 22.7 | 3.6 | 0.2 | 0.6α + 0.4β | |
| 0.3 | NH3 ∙ H2O | 73 | 21.4 | 3.5 | 0.25 | α + β |
| NaOH | 65 | 29.6 | 3.4 | 0.3 | 0.4α + 0.6β | |
| KOH | 58 | 35.1 | 3.5 | 0.25 | α + β | |
| 0.5 | NH3 ∙ H2O | 65 | 29.5 | 3.0 | 0.5 | β |
| NaOH | 58 | 32.8 | 2.9 | 0.55 | β | |
| KOH | 56 | 36.2 | 3.0 | 0.5 | β | |
| 1 | NH3 ∙ H2O | 53 | 39.0 | 2.9 | 0.55 | β |
| NaOH | 44 | 40.4 | 2.7 | 0.65 | 0.7β + 0.3γ | |
| KOH | 41 | 41.0 | 2.8 | 0.6 | 0.8β + 0.2γ | |
| 3 | NH3 ∙ H2O | 50 | 39.8 | 2.3 | 0.85 | 0.3β + 0.7γ |
| NaOH | 37 | 42.8 | 1.9 | 1.05 | γ | |
| KOH | 30 | 45.4 | 1.8 | 1.1 | 0.8γ + 0.2δ | |
| 5 | NH3 ∙ H2O | 43 | 43.3 | 2.2 | 0.9 | 0.2β + 0.8γ |
| NaOH | 32 | 43.8 | 1.8 | 1.1 | 0.8γ + 0.2δ | |
| KOH | 27 | 46.1 | 1.6 | 1.2 | 0.6γ + 0.4δ |
При изучении гетерофазной конверсии K2ZrF6 в гидроксид циркония растворами КОН было установлено, что повышение температуры раствора щелочи существенно ускоряет процесс [3]. В связи с этим можно было ожидать аналогичного эффекта в случае ОХЦ. Однако при повышении температуры раствора оснований с 25 до 85°С (τк = 15 мин) кажущаяся степень конверсии увеличилась незначительно (на 3–5%).
Повышение температуры раствора оснований с 25 до 85°С незначительно влияло на влажность, содержание ZrO2 и количество ОН-групп, которое снизилось с 2.5–2.1 до 2.3–1.6. Следует отметить, что несмотря на это, размер первичных частиц, согласно результатам измерения удельной поверхности гидроксидов, высушенных при 100°С, в синтезированных гидроксидах уменьшился приблизительно в 2.5 раза (рис. 5).
Рис. 5.
Влияние температуры растворов оснований на величину удельной поверхности гидроксидов: 1 – NH3 ∙ H2O, 2 – NaOH, 3 – КОН.
С увеличением температуры растворов оснований в системах ОХЦ–MOH (М – ${\text{NH}}_{4}^{ + },$ Na+, K+) с 25 до 85°С величина удельной поверхности сухих гидроксидов возрастала от ~100 до 250 м2/г (M – Na+, K+) и с 70 до 190 м2/г (M – ${\text{NH}}_{4}^{ + }$).
По данным лазерной гранулометрии, средний размер агрегатов гидроксидов d50, синтезированных в системах ОХЦ–MOH (2.7 моль/л), после 1 мин ультразвуковой обработки составил 30–32 мкм.
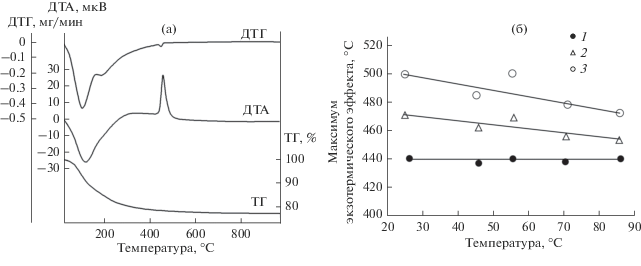
На кривых ДТА (рис. 6) синтезированных гидроксидов после сушки образцов проявляется ряд экзо- и эндотермических эффектов. Протяженный эндоэффект, начинающийся при 50°С и заканчивающийся при 300°С, обусловлен удалением воды и гидроксо-групп. Экзоэффект в интервале 400–550°С, связанный с кристаллизацией ZrO2, также сопровождается выделением небольшого количества воды (по данным масс-спектрометрии).
Рис. 6.
Результаты термического анализа синтезированных гидроксидов циркония (а) и влияние температуры оснований на температуру максимума экзотермического эффекта (б): 1 – NH3 ∙ H2O, 2 – NaOH, 3 – КОН.

С увеличением температуры растворов NaOH и KOH наблюдается смещение максимума экзотермического эффекта на кривой ДТА образцов в низкотемпературную область, тогда как для гидроксидов, синтезированных с участием раствора аммиака, смещения максимума экзоэффекта не происходит. Следует отметить, что температура максимума экзоэффекта зависит от природы основания и для гидроксидов циркония, синтезированных в сопоставимых условиях, увеличивается в ряду NH3 ∙ H2O–NaOH–KOH (рис. 6б).
По данным РФА, продукты гетерофазного синтеза после 1 мин взаимодействия являются рентгеноаморфными. Необходимо отметить, что на дифрактограммах гидроксидов, синтезированных в системах ОХЦ–NaOH(KOH), после их промывки ацетоном присутствуют рефлексы примесных фаз (хлоридов натрия и калия), тогда как после промывки водой они исчезают.
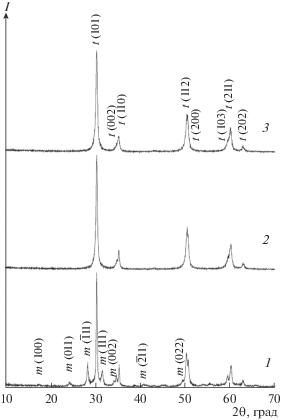
На рис. 7 представлены дифрактограммы оксидов циркония, полученных термообработкой при 550°С (длительность изотермической выдержки 2 ч) гидроксидов циркония, синтезированных с участием разных оснований (C = 2.7 моль/л, t = = 25°С). При использовании раствора аммиака продуктами термообработки гидроксида циркония являются тетрагональный ZrO2 (JCPDS № 79-1769) – 60% и моноклинный ZrO2 (JCPDS № 89-9066) – 40%. Продукты термообработки гидроксидов, синтезированных в системах с NaOH и KOH, представлены только тетрагональной модификацией ZrO2. Размер кристаллитов тетрагонального ZrO2 в образцах снижается с 34 (ОХЦ–NH3 ∙ H2O) до 23 (ОХЦ–NaOH) и 20 нм (ОХЦ–KOH).
Рис. 7.
Дифрактограммы ZrO2 (550°С) из гидроксидов, синтезированных с участием разных оснований: 1 – NH3 ∙ H2O, 2 – NaOH, 3 – КОН (m – моноклинная, t – тетрагональная модификация).
Как и следовало ожидать, ZrO2 наследует основные морфологические особенности синтезированных гидроксидов циркония, которые являются анаморфозами кристаллов ОХЦ (рис. 8).
По данным электронной микроскопии, в синтезированных гидроксидах можно выделить следующие группы агрегатов:
1) агрегаты призматической формы, по форме и размерам близкие к кристаллам ОХЦ;
2) агрегаты, являющиеся фрагментами агрегатов первого типа;
3) агрегаты неправильной формы, являющиеся “внутренним содержимым” агрегатов первого типа либо скоплениями фрагментов псевдокристаллов.
Анализ результатов просвечивающей оптической микроскопии отдельных кристаллов ОХЦ в системе с аммиаком показал, что уже через 1 мин по всему объему кристаллов проявляются микротрещины, образующиеся, очевидно, вследствие поверхностных и объемных напряжений, связанных с образованием продукта реакции. Микротрещины облегчают доступ реагента внутрь кристалла, дальнейшее развитие процесса приводит к дроблению кристалла на более мелкие фрагменты.
ЗАКЛЮЧЕНИЕ
Изучено влияние природы и концентрации основания, температуры процесса, а также отношения реагентов на характеристики гидроксидов циркония, синтезированных методом гетерофазной конверсии из октагидрата оксихлорида циркония. Установлено, что переход осадка из гелеобразного состояния в кристаллоподобное происходит в интервале концентраций оснований 0.3–0.5 М, при этом кажущийся объем осадков уменьшается в 5 раз.
Синтезированные гидроксиды наследуют морфологические особенности исходного ОХЦ. Тип основания и отношение реагентов мало влияют на процесс гетерофазной конверсии, который проходит быстро (в условиях эксперимента завершается через 5 мин). Температура основания оказывает значительное влияние на удельную поверхность гидроксидов.
Список литературы
Fletcher A. Zirconia. 3rd Edition. Oxford: Elsevier, 1993. 378 p.
Сахаров В.В., Зайцев Л.М., Забелин В.Н. и др. О свойствах гидроокисей гафния и циркония // Журн. неорган. химии. 1972. Т. 17. № 9. С. 2392–2398.
Жуков А.В., Чижевская С.В., Пьяе Пьо. Гетерофазная конверсия K2ZrF6 в гидроксид циркония // Неорган. материалы. 2017. Т. 53. № 7. С. 762–768.
Clearfield A., Vaughan P.A. The Crystal Structure of Zirconil Chloride Octahydrate and Zirconil Bromide Octahydrate // Acta Cristallogr. 1956. V. 9. P. 555–558. https://doi.org/10.1107/S0365110X56001558
Mak T. Refinement of the Crystal Structure of Zirconil Chloride Octahydrate // Can. J. Chem. 1968. V. 46. P. 3491–3497. https://doi.org/10.1139/v68-579
Scholz J., Scholz K., McQuillan A.J. In Situ Infrared Spectroscopic Analysis of the Water Modes of [Zr4(OH)8(H2O)16]8+ during the Thermal Dehydration of ZrOCl2 · 8H2O // Phys. Chem. A. 2010. V. 114. P. 7733–7741. https://doi.org/10.1021/jp102589v
Jutson J.A., Richardson R.M., Jones S.L., Norman C. Small Angle X-Ray Scattering Studies of Polymeric Zirconium Species in Aqueous Solution // Mater. Res. Soc. Symp. Proc. 1990. V. 180. P. 123–128. https://doi.org/10.1557/PROC-180-123P
Clearfield A. The Mechanism of Hydrolytic Polymerization of Zirconil Solutions // J. Mater. Res. 1990. V. 5. № 1. P. 161–162. https://doi.org/10.1557/JMR.1990.0161
Зайцев Л.М. О гидроокисях циркония // Журн. неорган. химии. 1966. Т. 11. № 7. С. 1684–1692.
Зайцев Л.М., Шубина Т.Н. Старение гидроокисей циркония // Изв. АН СССР. Неорган. материалы. 1966. Т. 11. № 9. С. 1592–1598.
Поспелова Л.А., Зайцев Л.М. Карбонатные соединения циркония // Журн. неорган. химии. 1966. Т. 11. № 8. С. 1863–1865.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы



