Неорганические материалы, 2019, T. 55, № 3, стр. 264-270
Синтез высокодисперсных образцов системы Al2O3–ZrO2–MgO с использованием электрогенерированных реагентов
А. Ф. Дресвянников 1, Е. В. Петрова 1, А. И. Хайруллина 1, *
1 Казанский национальный исследовательский технологический университет
420015 Казань, ул. К. Маркса, 68, Россия
* E-mail: alina17xaj@mail.ru
Поступила в редакцию 17.04.2018
После доработки 15.10.2018
Принята к публикации 15.09.2018
Аннотация
Исследованы морфология и фазовый состав прекурсоров высокодисперсной алюмооксидной системы Al2O3–ZrO2–MgO, полученных в коаксиальном бездиафрагменном электролизере с растворимым анодом и введением ионов Zr(IV) и Mg(II) в процессе синтеза. Показано, что варьирование условий электролиза позволяет управлять размерами частиц и фазовым составом осадков. Установлено, что в процессе синтеза формируется шпинель Al2MgO4, увеличение содержания которой способствует сохранению метастабильной фазы θ-Al2O3.
ВВЕДЕНИЕ
В основе современной технической керамики лежит оксидная система Al2O3–ZrO2. Как следует из результатов многочисленных исследований [1–4], для повышения физико-механических свойств керамики важна стабилизация тетрагональной фазы оксида циркония. Размер зерен образцов алюмоциркониевой оксидной системы может быть снижен за счет введения модифицирующих добавок, например MgO, способствующих увеличению дефектов и вакансий, вызывающих ускорение спекания за счет опережающего роста пор по сравнению с процессами роста кристаллитов.
Одним из вариантов получения керамики в этой системе является осаждение прекурсоров соответствующих оксидов металлов. В некоторых случаях эффективным может оказаться соосаждение гидроксидов металлов в условиях воздействия электрического поля. При этом соответствующие реагенты могут быть получены путем электрогенерирования.
Целью работы является изучение закономерностей соосаждения ионов Al(III), Zr(IV) и Mg(II) в условиях воздействия внешнего электрического поля в коаксиальном реакторе-электролизере с растворимым алюминиевым анодом и существенно различающимися площадями электродов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электролизер для получения прекурсоров высокодисперсных оксидов в водных растворах содержал корпус с размещенными в нем коаксиально установленными цилиндрическими электродами, которые были выполнены так, что отношение площадей внешнего и внутреннего электродов удовлетворяли условию 102 ≤ Sвнеш/Sвнутр < 103, конструктивно он аналогичен конденсатору с сильно неоднородным электрическим полем [5]. Центральный электрод изготовлен из стали Х18Н10Т, анодом являлся алюминиевый цилиндр (алюминий марки А7, чистота не ниже 99.7%). После окончания процесса осадок подвергали старению в маточном растворе. Далее его отфильтровывали и промывали бидистиллятом до нейтральной реакции.
Фазовый состав синтезированных образцов определяли на рентгеновском дифрактометре D2 PHASER, Bruker с использованием CoKα-излучения. Идентификацию кристаллических фаз осуществляли путем сопоставления полученных экспериментальных значений межплоскостных расстояний и относительных интенсивностей с эталонными, приведенными в международной картотеке PDF-2. Значения областей когерентного рассеяния (ОКР) D рассчитывали с помощью программы EVA.
Рентгенофлуоресцентный анализ на предмет установления элементного состава синтезированных образцов проводили с помощью спектрометра S1 TITAN, Bruker.
Термохимические исследования осуществляли с применением синхронного термоанализатора STA 409 PCLuxx, Netzsch. Термическое разложение образцов изучали в интервале температур 30–1100°С, при скорости нагрева 8°С/мин, на воздухе.
Морфологию образцов исследовали методом сканирующей электронной микроскопии на высокоразрешающем автоэмиссионном электронном микроскопе Auriga CrossBeam, Carl Zeiss.
Исследование состояния поверхности анода после электролиза проводили с помощью сканирующего электронного микроскопа Mini SEM SX-3000, EVEX.
Для установления закономерностей анодного поведения алюминия в исследуемых растворах использовали потенциодинамический (скорость развертки потенциала 2 мВ/с) и хронопотенциометрический методы.
Поляризационные измерения проводили в трехэлектродной электролитической ячейке с разделенными катодным и анодным пространствами при температуре 20 ± 1°С и естественной аэрации. В качестве вспомогательного использовали платиновый электрод, в качестве электрода сравнения – насыщенный хлоридсеребряный электрод марки ЭЛВ-1 (Е = 0.222 В). Поляризацию рабочего электрода и соответствующие измерения обеспечивали с помощью потенциостата P-301M, Ellins, при скорости развертки 16 мВ/с.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При получении высокодисперсных предшественников образцов в качестве электролита использовали раствор хлорида натрия с концентрацией 0.5 моль/л; при этом цирконий(IV) вводили в электролит в виде раствора Zr(NO3)4 с концентрацией 0.5 моль/л (табл. 1). Содержание ионов магния в электролите регулировали посредством введением хлорида магния с концентрацией 0.05 моль/л (табл. 1).
Таблица 1.
Состав синтезированных образцов в пересчете на оксиды, по результатам рентгенофлуоресцентного анализа
| Образец | ω (Al2O3), мас. % | ω (ZrO2), мас. % | ω (MgO), мас. % |
|---|---|---|---|
| 1 | 95 | 5 | – |
| 2 | 88 | 9 | 3 |
| 3 | 88 | 8 | 4 |
| 4 | 87 | 6 | 6 |
Определяющим фактором формирования дисперсных прекурсоров оксидов в данном случае является специфический гидродинамический режим, обеспечивающий перенос продуктов реакции по торообразной траектории по направлению от центра к периферийному электроду (аноду) в результате интенсивного выделения водорода на центральном электроде.
Движение пузырьков газа, выделяющегося на центральном электроде (катоде), обеспечивает перемещение электролита вверх и, в силу непрерывности потока, образует вихрь, а высокая скорость движения электролита (0.1–0.2 м/с) способствует быстрому смешиванию реагентов.
Пузырьки водорода имеют отрицательный заряд, что объясняется адсорбцией OH–-ионов. На поверхности частиц также создается избыток OH–-ионов, генерируемых катодом. Электрическое поле может поляризовать частицы гидроксидов и определенным образом ориентировать молекулы растворителя (воды) [6].
Согласно [7], активирующее действие хлорид-ионов, связанное с трансформацией и пробоем оксидной пленки алюминия, обусловлено адсорбцией на поверхности электрода хлорид-ионов, полностью или частично вытесняющих пассивирующий кислород. В результате этого металл приобретает способность переходить в раствор в виде хлоридного комплекса [7–9]. Хемосорбционные соединения алюминия гидролизуются, причем продукты гидролиза способствуют разрушению поверхностного слоя и депассивации металла. Кроме того, при анодной поляризации алюминия увеличивается скорость саморастворения металла, т.е. имеет место т. н. отрицательный дифференц-эффект [9].
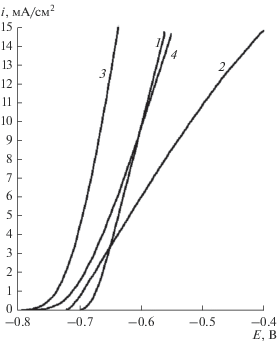
Закономерности анодного растворения алюминия в исследуемых средах представлены характерными поляризационными кривыми на рис. 1. Наличие прямолинейного участка, берущего начало практически от оси абсцисс на поляризационной кривой, свидетельствует об активном растворении алюминия. Введение хлорида магния и нитрата циркония в электролит незначительно влияет на активность растворения, что проявляется в аутентичности анодных поляризационных кривых и отсутствии четко выраженной площадки, соответствующей области пассивности.
Рис. 1.
Анодные поляризационные кривые растворения Al-анода в электролите различного состава: 1 – 0.5 M NaCl + 0.5 M Zr(NO3)4, 2 – 0.5 M NaCl + 0.5 M Zr(NO3)4 + 0.05 M MgCl2, 3 – 0.5 M NaCl + 0.5 M Zr(NO3)4 + 0.1 M MgCl2, 4 – 0.5 M NaCl + 0.5 M Zr(NO3)4 + 0.2 M MgCl2.
Микрофотографии поверхности анода (рис. 2) подтверждают тот факт, что ионизация алюминия сопровождается разрушением поверхности электрода, протекающим преимущественно по границам зерен металла [10].
Управляя стадиями электрогенерирования реагентов, гидролиза, конвективного массопереноса, взаимодействия электрогенерированных ионов, можно создавать сложные композиции прекурсоров оксидов через полиядерные, полигетероядерные комплексы, образующиеся в результате поликонденсации [11]. В конечном итоге это позволяет регулировать размеры частиц, пор и другие физико-химические свойства оксидов.
Реализуемый в коаксиальном реакторе-электролизере гидродинамический режим позволяет в течение короткого времени доставлять OH–-ионы и другие продукты катодной реакции к поверхности анода. В результате гидролиза и взаимодействия с OH–-ионами ионов алюминия, магния и циркония в реакторе формируются соединения, которые идентифицируются как простые и сложные гидроксиды на основе Al и Mg.
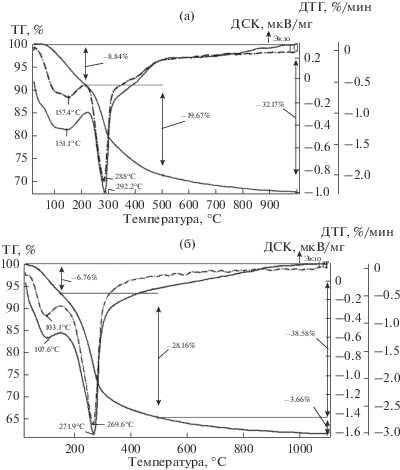
Для установления механизма процессов дегидратации синтезированные образцы исследовали методами термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК). Фазовые превращения кристаллических гидроксидов при нагреве характеризуются стадиями удаления физически связанной воды и формирования кристаллической структуры гидроксида, оксигидроксида или оксида. В свою очередь последний процесс заключается в перестройке кислородного каркаса и миграции катионов.
На рис. 3 приведены результаты термического анализа синтезированных оксидных систем.
Согласно данным термического анализа (табл. 2), в случае прекурсора тройной оксидной системы Al2O3–ZrO2–MgO наблюдается эндотермический пик с tmax = 247–290°С и потерей массы образца, характеризующий процесс удаления координационно-связанной воды из структуры байерита, сопровождающийся формированием η-Al2O3 и дегидратацией гидроксида циркония(IV). Эффекты при t ≥ 500°С на кривых ДСК можно отнести к процессу кристаллизации аморфного диоксида циркония и к фазовому переходу моноклинного диоксида циркония в тетрагональную фазу; переход в t-ZrO2 наблюдается выше 900°С. Эффекты при t ≥ 1000°С могут относиться к образованию шпинели Al2MgO4.
Таблица 2.
Результаты исследования термогравиметрическим методом синтезированных прекурсоров на основе алюминия
| $\frac{{{\text{И н т е р в а л ы т е м п е р а т у р }}\left( {{м а к с и м у м э ф ф е к т а , ^\circ С }} \right)}}{{{П о т е р я м а с с ы , \% }}}$ | Общая потеря массы в интервале 30–1100°С, % |
n(H2O), ммоль/г | ||
|---|---|---|---|---|
| $\frac{{30{\kern 1pt} --{\kern 1pt} 170\,\,\left( {96} \right)}}{{4.50}}$ | $\frac{{170{\kern 1pt} --360{\text{ }}{\kern 1pt} \left( {290} \right)}}{{21.25}}$ | $\frac{{945{\kern 1pt} --{\kern 1pt} 1000{\text{ }}\left( {973} \right)}}{{0.28}}$ | 33.81 | 3.00 |
| $\frac{{30{\kern 1pt} --{\kern 1pt} {\kern 1pt} 155\,\,(103)}}{{6.76}}$ | $\frac{{155{\kern 1pt} --{\kern 1pt} 500\,\,(270)}}{{28.16}}$ | $\frac{{500{\kern 1pt} --{\kern 1pt} 1100\,\,\left( -- \right)}}{{3.66}}$ | 38.58 | 22.00 |
Сублимационное удаление воды из гелей приводит к получению прекурсора, представляющего собой пористый каркас, который состоит из частиц дисперсной фазы, связанных между собой силами Ван-дер-Ваальса с глобулами на поверхности. При нагревании эти глобулы выступают центрами кристаллизации.
Известно [12], что при введении MgO на поверхности зерен корунда α-Al2O3 образуется микроразмерная прослойка магнезиальной шпинели, что способствует получению мелкозернистой структуры и, как следствие, повышению прочностных свойств материала. Таким образом, оксид магния играет роль армирующей добавки и, по литературным данным, независимо от способа получения Al2O3 приводит к его упрочнению примерно в 1.5–2 раза.
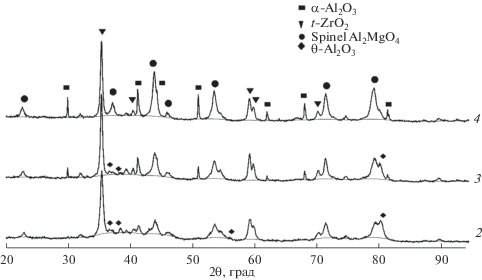
Согласно данным рентгенофазового анализа, полученные образцы представлены фазами гиббсита, байерита и сложного гидроксида на основе Al и Mg. После термообработки образцов при 1100°С на дифрактограмме наблюдаются четко выраженные рефлексы t-ZrO2 и шпинели Al2MgO4 (в случае образцов, модифицированных оксидом магния) (рис. 4, 5).
Рис. 4.
Дифрактограммы исследуемых образцов, высушенных при 80°С (номера дифрактограмм соответствуют номерам образцов в табл. 1).
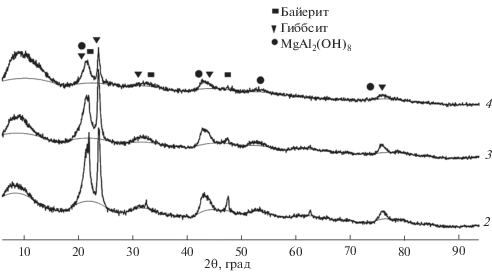
Рис. 5.
Дифрактограммы исследуемых образцов после термообработки при температуре 1100°С (номера дифрактограмм соответствуют номерам образцов в табл. 1).
Рентгенофлуоресцентный анализ полученных гидроксидов демонстрирует наличие Zr в осадке, при этом отсутствие рефлексов гидроксидов Zr и вид дифрактограммы указывают на аморфизованную составляющую гидроксидной системы (рис. 4), в которой и находится цирконийсодержащее гидроксидное соединение.
Рассчитанные значения ОКР приведены в табл. 3 и 4 и демонстрируют небольшой рост размеров кристаллитов в процессе термического воздействия, связанный с фазовыми превращениями.
Таблица 3.
Результаты рентгенофазового анализа предшественников оксидов, синтезированных при температуре 80°С
| Образец | Фазовый состав | Содержание фаз, мас. % | D(ОКР), нм |
|---|---|---|---|
| 1 | Байерит Бемит |
80 20 |
62 5 |
| 2 | Байерит Гиббсит |
36 60 |
19 5 |
| MgAl2(OН)8 | 4 | 3 | |
| 3 | Байерит Гиббсит |
50 46 |
26 18 |
| MgAl2(OН)8 | 4 | 12 | |
| 4 | Байерит Гиббсит |
48 48 |
18 5 |
| MgAl2(OН)8 | 4 | 3 |
Таблица 4.
Результаты рентгенофазового анализа образцов, термообработанных при температуре 1100°С
| Образец | Фазовый состав | Содержание фаз, мас. % | D(ОКР), нм |
|---|---|---|---|
| 1 | θ-Al2O3 | 98 | 25 |
| t-ZrO2 | 2 | 20 | |
| 2 | θ-Al2O3 | 22 | 23 |
| t-ZrO2 | 24 | 19 | |
| Al2MgO4 | 53 | 13 | |
| 3 | θ-Al2O3 | 6 | 32 |
| α-Al2O3 | 23 | 71 | |
| t-ZrO2 | 46 | 26 | |
| Al2MgO4 | 25 | 27 | |
| 4 | α-Al2O3 | 31 | 63 |
| t-ZrO2 | 24 | 27 | |
| Al2MgO4 | 45 | 25 |
По данным рентгенофлуоресцентного (табл. 1) и рентгенофазового (табл. 4, рис. 5) анализов установлено, что содержание алюмомагнезиальной шпинели Al2MgO4 и фазы t-ZrO2 зависит от количества Mg в составе тройной оксидной системы Al2O3–ZrO2–MgO.
Исследование поверхности полученных образцов с помощью сканирующей электронной микроскопии выявило зависимость морфологии и размеров частиц от условий получения. Частицы образца алюмоциркониевой оксидной системы (рис. 6а) имеют форму, близкую к сферической. Для образца системы Al2O3–ZrO2–MgO (рис. 6б) характерна пластинчатая форма частиц с закругленными углами. Средний размер этих частиц находится в пределах 20–80 нм.
ЗАКЛЮЧЕНИЕ
Экспериментально установлена возможность управления размером и фазовым составом образцов оксидных систем в процессе синтеза их предшественников путем осуществления электролиза в коаксиальном электрохимическом реакторе с существенно различающимися электродами и растворимым алюминиевым анодом в условиях гальваностатической поляризации. Введение в электролит ионов магния позволяет получить предшественники, образующие с оксидом алюминия термостабильные соединения, с размерами частиц до 100 нм. Установлено, что в процессе термообработки синтезированных прекурсоров протекают сложные фазовые превращения, которые, в конечном итоге, приводят к образованию шпинели Al2MgO4 и стабилизации тетрагональной фазы диоксида циркония t-ZrO2.
Список литературы
Погребенков В.М., Ушакова Т.В., Андриец С.П., Горбатенко В.В. Плазмохимические порошки на основе оксида алюминия. Исследование физико-химических свойств и структуры для определения способов их подготовки к формованию керамических изделий // Огнеупоры и техническая керамика. 2013. № 4–5. С. 28–34.
Meng F., Liu C., Zhang F., Tian Z., Huang W. Densification and Mechanical Properties of Fine-Grained Al2O3–ZrO2 Composites Consolidated by Spark Plasma Sintering // J. Alloys Comp. 2012. V. 512. № 1. P. 63–67.
Подзорова Л.И., Шворнева Л.И., Ильичева А.А., Аладьев А.А., Пенькова О.И. Микроструктура и фазовый состав образцов системы ZrO2–CeO2–Al2O3, модифицированных MgО и Y2O3 // Неорган. материалы. 2013. Т. 49. № 4. С. 389–394.
Габелков С.В., Тарасов Р.В., Полтавцев Н.С., Курило Ю.П., Старолат Н.Ф. Фазовые превращения при низкотемпературном синтезе MgAl2O4 // Неорган. материалы. 2007. Т. 43. № 4. С. 462–470.
Дресвянников А.Ф., Дресвянников Ф.Н., Ситников С.Ю. Электрохимическая очистка воды: монография. Казань: Фэн, 2004. 206 с.
Батаронов И.Л. О механизме анодного окисления алюминия в водных растворах электролитов // Альтернативная энергетика и экология. 2007. № 1. С. 118–126.
Чернова Г.П., Корниенко Л.П. Влияние хлорид-ионов на электрохимические свойства анодированных алюминиевых сплавов АВ и Д16 в водном и водно-глицериновом растворах сульфата натрия // Физикохимия поверхности и защита материалов. 2010. Т. 46. № 6. С. 651–656.
Amokrane S., Ladjouzi M.A. Electrochemical Influence of the Nature and Composition of Halides on Al–12Si // J. Solid State Electrochem. 2007. V. 11. № 12. P. 1655–1661.
Борисенкова Т.А., Калужина С.А. Анодное поведение алюминия в нейтральных электролитах различного анионного состава // Конденсированные среды и межфазные границы. 2009. Т. 11. № 2. С. 106–110.
Дресвянников А.Ф., Петрова Е.В., Хайруллина А.И. Технология получения бинарных оксидных систем алюминия и циркония // Хим. технология. 2017. Т. 18. № 8. С. 367–376.
Борисенкова Т.А., Калужина С.А. Пассивация и локальная активация алюминия в водных растворах под действием неорганических и органических добавок // Конденсированные среды и межфазные границы. 2011. Т. 13. № 2. С. 132–136.
Непочатов Ю.К., Маликова Е.В., Плетнев П.М. Влияние комплексных добавок на спекание и броневые свойства корундовой керамики // Огнеупоры и техническая керамика. 2013. № 10. С. 14–19.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы