Неорганические материалы, 2019, T. 55, № 3, стр. 336-342
Синтез из соломы риса и сорбционные свойства наноструктурированного алюмосиликата натрия
С. Б. Ярусова 1, 2, *, А. Е. Панасенко 1, 3, П. С. Гордиенко 1, Л. А. Земнухова 1, 3, Ю. А. Азарова 1
1 Институт химии ДВО Российской академии наук
690022 Владивосток, пр. 100-летия Владивостока, 159 Д, Россия
2 Владивостокский государственный университет экономики и сервиса
690014 Владивосток, ул. Гоголя, 41, Россия
3 Дальневосточный федеральный университет
690091 Владивосток, ул. Суханова, 8, Россия
* E-mail: yarusova_10@mail.ru
Поступила в редакцию 17.08.2018
После доработки 15.10.2018
Принята к публикации 07.09.2018
Аннотация
Показана возможность получения наноструктурированного рентгеноаморфного алюмосиликата натрия с удельной поверхностью 364 м2/г из щелочного гидролизата рисовой соломы. Изучены его сорбционные свойства по отношению к ионам Cs+ в статических условиях при сорбции из растворов различного солевого состава (морской воды и растворов на основе нитратов).
ВВЕДЕНИЕ
Отходы растительного производства все чаще рассматриваются в качестве сырья для получения ряда функциональных материалов, в том числе цеолитов различного состава и структуры, различных композиционных сорбентов. Большое количество работ в этой области посвящено автоклавному синтезу цеолитов из золы рисовой шелухи [1–6]. При этом при производстве риса в качестве отходов образуется большое количество кремнийсодержащей соломы, в несколько раз превышающее количество шелухи. Однако работ, связанных с синтезом, модификацией и исследованием свойств алюмосиликатов из рисовой соломы, сравнительно немного [7, 8].
Известны работы [9–11] по получению сорбентов для извлечения ионов тяжелых металлов путем термической и химической модификации рисовой соломы. В работе [7] исследован процесс автоклавного синтеза (до 160°C) цеолита ZSM-5 с использованием кремнийсодержащего компонента из рисовой соломы и в качестве темплатных агентов, лигнина и бромида тетрапропиламмония (C12H28NBr). Образец цеолита с удельной поверхностью 397 м2/г, полученный с использованием лигнина при температуре 160°C, дополнительно модифицировали различным количеством бромида тетрапропиламмония и исследовали процесс извлечения Cr(VI) из водных растворов хромата калия при комнатной температуре, соотношении Т : Ж = 500 и рН 5. Показано, что модифицированный цеолит характеризуется лучшими сорбционными характеристиками по сравнению с немодифицированным.
Позднее авторы [8] предложили модифицировать на этапе синтеза с использованием соломы риса цеолит ZSM-5 ферроцианидными комплексами с получением прусского синего пигмента (берлинской лазури).
Ранее в Институте химии ДВО РАН была показана возможность получения силикатов кальция [12] и алюмосиликатов натрия и калия [13] из щелочных растворов, образующихся при щелочном гидролизе соломы риса. Были исследованы сорбционные свойства алюмосиликатов натрия с удельной поверхностью 69–134 м2/г, полученных из соломы риса, по отношению к ионам Cs+. Показано, что сорбционная емкость образцов достигает Amax = 1.3 ммоль/г. Оценка кинетики сорбции ионов Cs+ в интервале времени от 1 до 60 мин показала, что кинетическая кривая выходит на плато уже через 5–10 мин, и в дальнейшем величина сорбции не изменяется. При исследовании влияния температуры на кинетику извлечения ионов Cs+ установлено, что с повышением температуры от 20 до 60°С сорбционная емкость алюмосиликатов натрия не изменяется и степень извлечения ионов Cs+ при 20°С составляет 82.6–88.6% [14]. При выработке практических рекомендаций по использованию сорбентов важны данные по влиянию ионного состава солевого фона на процесс извлечения соответствующих ионов из водных растворов, в том числе и на его кинетические параметры.
Целью данной работы является синтез наноструктурированного алюмосиликата натрия из щелочного гидролизата рисовой соломы и изучение его сорбционных свойств по отношению к ионам Cs+ при сорбции из растворов различного солевого состава (морской воды и нитратов).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез алюмосиликата натрия. В качестве кремнийсодержащего сырья использовали солому риса (Oryza sativa) сорта дальневосточной селекции “Луговой”, отобранную в п. Тимирязевский Приморского края (урожай 2008–2017 гг.). Солому измельчали на части длиной 5–10 мм, промывали водой и сушили на воздухе. Навеску соломы обрабатывали 1 М раствором NaOH при 90°С в течение 1 ч (соотношение Т : Ж = 1 : 13). Нерастворившийся твердый остаток представляет собой волокнистый целлюлозный материал, который может быть использован в качестве сырья для целлюлозно-бумажной промышленности. Раствор, содержащий силикат-ион, отделяли фильтрованием, при комнатной температуре добавляли к нему при интенсивном перемешивании насыщенный раствор сульфата алюминия до достижения рН 7. Выпавший осадок выдерживали до его полного отстаивания (не менее 5 ч), отделяли на фильтре и промывали водой до полного удаления сульфат-ионов (контроль промывных вод по реакции с BaCl2). Полученный осадок сушили при 105°С, выход твердого продукта – 12.2% от массы исходного сырья.
Эксперименты по сорбции ионов Cs+. Опыты по сорбции проводили в статических условиях при соотношении твердой и жидкой фаз (Т : Ж), равном 1 : 400, и температуре 20°С из водных растворов хлорида цезия на основе дистиллированной или морской воды с различными начальными концентрациями ионов Cs+ в диапазоне от 0.16 до 3.2 ммоль/л при перемешивании на магнитной мешалке в течение 3 ч. Коэффициенты распределения Kd при сорбции ионов Cs+ из дистиллированной и морской воды определяли при соотношениях Т : Ж, равных 1 : 100; 1 : 400; 1 : 1000; 1 : 2000.
В качестве контрольного опыта навески сорбента помещали в пробирки с дистиллированной и морской водой и перемешивали параллельно с исследуемыми пробами. Затем растворы отделяли от сорбента фильтрованием (бумажный фильтр “синяя лента”) и определяли в нем концентрации ионов Cs+ и Na+.
Морскую воду, на основе которой были приготовлены растворы с различным содержанием ионов Cs+, отбирали в Японском море в акватории Амурского залива (г. Владивосток), фильтровали через фильтр “белая лента”. Концентрация ионов в морской воде (мкг/мл): Na+ – 9443.8, K+ – 364.0, Ca2+ – 357.3, Mg2+ – 1246.2.
Опыты по кинетике сорбции проводили в статических условиях при соотношении твердой и жидкой фаз, равном 1 : 400, и температуре 20°С из водных растворов хлорида цезия на основе дистиллированной или морской воды и 0.01 М NaNO3, KNO3, NH4NO3 квалификации “ч.” при различных временных интервалах – от 1 до 60 мин. Исходная концентрация ионов Cs+ и pH исходных растворов приведены в табл. 1. Коэффициенты распределения Kd при сорбции ионов Cs+ из растворов вышеуказанных нитратов с концентрациями 0.01, 0.1 и 0.5 М определяли при соотношении твердой и жидкой фаз, равном 1 : 400 (время сорбции 3 ч).
Таблица 1.
Характеристики исходных растворов для исследования кинетики извлечения ионов Cs+
| Тип раствора | pH раствора | Исходная концентрация ионов Cs+, ммоль/л |
|---|---|---|
| Морская вода | 8.1 | 0.76 |
| Дистиллированная вода | 6.2 | 0.78 |
| 0.01 М NaNO3 | 7.8 | 0.95 |
| 0.01 М KNO3 | 7.7 | 0.8 |
| 0.01 М NH4NO3 | 7.7 | 0.78 |
Методы анализа. Элементный анализ выполняли методом энергодисперсионной рентгенофлуоресцентной спектроскопии на спектрометре Shimadzu EDX 800 HS (Япония). Анализ проводили без учета легких элементов с использованием программного обеспечения спектрометра. Относительная погрешность определения не превышала ±2%. Рентгеновские дифрактограммы записывали на дифрактометре Bruker D8 Advance (Германия) в Сu Кα-излучении. Удельную поверхность образцов определяли методом низкотемпературной адсорбции азота с использованием прибора “Сорбтометр-М” (Россия). Термический анализ выполняли на дериватографе МОМ Q-1000 (скорость нагрева 5 К/мин). Распределение частиц по размерам находили с использованием лазерного анализатора размеров частиц Fritsch ANALYSETTE 22 Micro Tec plus (Германия).
Содержание ионов цезия и натрия в растворах определяли методом атомно-абсорбционной спектрометрии (ААС) на двулучевом спектрометре Solaar M6 (Thermo Scientific, США) по аналитическим линиям 852.1 и 586.6 нм соответственно. Предел обнаружения ионов цезия в водных растворах составляет 0.01 мкг/мл, натрия – 0.0002 мкг/мл. Относительная ошибка определения указанных ионов методом ААС составляет 15%.
Концентрацию ионов водорода во всех опытах контролировали с помощью рН-метра Sartorius PB-11 с электродом PY-P11 (Германия).
Сорбционную емкость (Ас, ммоль/г) образцов рассчитывали по формуле
где Сисх – исходная концентрация ионов Cs+ в растворе, ммоль/л; Ср – равновесная концентрация ионов Cs+ в растворе, ммоль/л; V – объем раствора, л; m – масса сорбента, г.Степень извлечения ионов Cs+ (α, %) рассчитывали по формуле
(2)
$\alpha = \frac{{({{C}_{{{\text{и с х }}}}} - {{С }_{{\text{р }}}})}}{{{{C}_{{{\text{и с х }}}}}}} \times 100\% .$Коэффициент межфазного распределения (Kd, мл/г) рассчитывали по формуле
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определение количественного элементного состава полученного образца показало следующие содержания элементов, мас. %: Si – 49.6, Al – 30.7, Na – 17.1, K – 2.1. Такой состав отвечает мольному соотношению элементов M : Si : Al = 0.45 : 1 : 0.64.
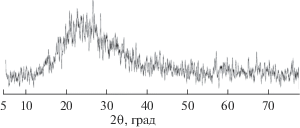
Согласно данным рентгенофазового анализа, полученный образец является рентгеноаморфным. На дифрактограмме (рис. 1) наблюдается гало с максимумом, соответствующим межплоскостному расстоянию 3.21–3.28 Å.
Удельная поверхность алюмосиликата натрия составляет 364 м2/г.
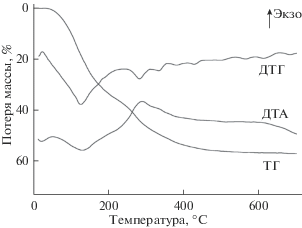
Термогравиметрический анализ образца (рис. 2) показал, что удаление воды начинается примерно при 40°С и заканчивается к 220°С. Потеря массы составляет 15.3%. Выше 220°С начинается окисление органического компонента, сопровождающееся экзоэффектом на кривой ДТА с максимумом при 280°С, что соответствует окислению некристаллической или слабо кристаллизованной целлюлозы. Небольшой максимум на кривой ДТА в районе 600–620°С связан с окислением карбонизированного остатка. Потери при прокаливании до 1000°С составляют 31.7%.
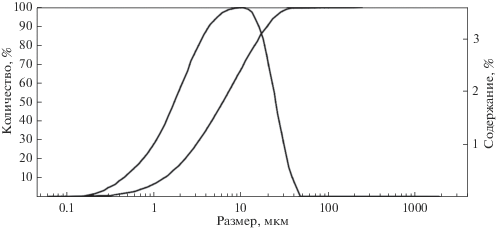
Размер частиц образца составляет от 0.2 до 50 мкм, максимум распределения приходится на 10 мкм (рис. 3).
На основании полученных экспериментальных данных по сорбции ионов Cs+ исследуемым сорбентом построены изотермы сорбции (рис. 4).
Рис. 4.
Изотермы сорбции ионов Cs+ алюмосиликатом натрия из растворов на основе дистиллированной (а) и морской (б) воды.
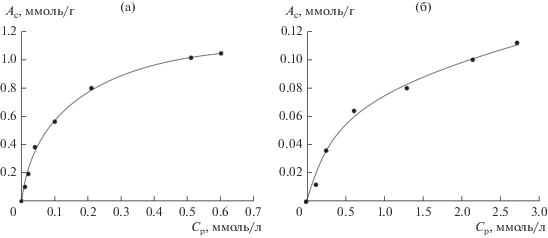
Как видно из рис. 4, при сорбции ионов Cs+ из морской воды наблюдается существенное снижение сорбционной емкости алюмосиликата натрия. Найдено, что степень извлечения ионов Cs+ из растворов без солевого фона достигает 96.2%, а из морской воды – не превышает 25.7%.
Для оценки сорбционных свойств полученные изотермы анализировали в координатах уравнения Ленгмюра:
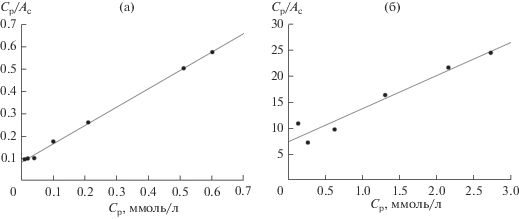
Константы уравнения были рассчитаны из наклона и пересечения прямых на графике в соответствующих координатах линейного уравнения Ср/Ас от Ср (рис. 5).
Рис. 5.
Изотермы сорбции ионов Cs+ синтетическим алюмосиликатом натрия из растворов на основе дистиллированной (а) и морской (б) воды в координатах линейного уравнения Ленгмюра.
Логарифмическую форму уравнения Фрейндлиха применяли для построения линейной зависимости lnAc–lnCр и графического определения параметров KF и n:
где a – величина адсорбции (ммоль/г); KF – константа равновесия уравнения Фрейндлиха, относящаяся к сорбционной емкости; 1/n – параметр, указывающий на интенсивность взаимодействия сорбент–сорбат.Найденные графическим способом параметры уравнений Ленгмюра и Фрейндлиха представлены в табл. 2. Из табл. 2 видно, что для описания сорбции ионов Cs+ синтетическим алюмосиликатом натрия наиболее подходящей является модель Ленгмюра, о чем свидетельствуют соответствующие коэффициенты корреляции. Максимальная сорбционная емкость Amax при сорбции ионов Cs+ из растворов без солевого фона и из морской воды составляет 1.2 и 0.16 ммоль/г соответственно.
Таблица 2.
Параметры уравнений Ленгмюра и Фрейндлиха, полученные при анализе изотерм сорбции ионов Cs+ синтетическим алюмосиликатом натрия
| Тип раствора, содержащего Cs+ | Дистиллиро-ванная вода | Морская вода |
|---|---|---|
| Уравнение Ленгмюра | ||
| k, л/ммоль | 9.5 | 0.875 |
| Amax, ммоль/г | 1.2 | 0.16 |
| R2 | 0.9985 | 0.9427 |
| Уравнение Фрейндлиха | ||
| KF, (ммоль/г) (л/ммоль)1/n | 1.7 | 14.9 |
| 1/n | 0.5521 | 14.9 |
| R2 | 0.9452 | 0.6589 |
Значения коэффициента распределения цезия на алюмосиликате натрия при сорбции из раствора без солевого фона (дистиллированной воды) и морской воды приведены в табл. 3. Видно, что высокие значения коэффициента распределения наблюдаются при сорбции цезия из растворов без солевого фона при всех соотношениях твердой и жидкой фаз, при этом максимальное значение Kd (11 000 мл/г) наблюдается при соотношении Т : Ж, равном 2000. В случае морской воды сорбция цезия при всех выбранных соотношениях твердой и жидкой фаз существенно снижается.
Таблица 3.
Зависимость коэффициента распределения Кd цезия на алюмосиликате натрия при сорбции из раствора без солевого фона и морской воды
| Т : Ж | Кd, мл/г | |
|---|---|---|
| дистиллированная вода (pH 6.2) | морская вода (pH 8.1) |
|
| 1 : 100 | 8567 | 111 |
| 1 : 400 | 7400 | 107 |
| 1 : 1000 | 8750 | 86 |
| 1 : 2000 | 11 000 | 82 |
На рис. 6 представлены интегральные кинетические кривые сорбции ионов Cs+ из растворов различного солевого состава исследуемым сорбентом. Во всех рассматриваемых случаях кинетические кривые выходят на плато уже в течение 5 мин и в дальнейшем величина сорбции не изменяется. Через указанный интервал времени степень извлечения ионов Cs+ составляет в случае дистиллированной воды 96.4%, морской – 19.7%, NaNO3 – 87.4%, KNO3 – 70.0%, NH4NO3 – 69.2%. Таким образом, сорбция цезия в морской воде значительно снижается по сравнению со всеми исследуемыми типами растворов. При сорбции ионов Cs+ из 0.01 М растворов нитратов наибольшие значения степени извлечения наблюдаются при сорбции из 0.01 М раствора NaNO3. Аналогичные данные были получены авторами [15] при исследовании сорбционных свойств синтетического наноструктурированного алюмосиликата калия при извлечении 137Cs из растворов нитратов натрия, калия и аммония.
Рис. 6.
Интегральные кинетические кривые сорбции цезия алюмосиликатом натрия из растворов различного солевого состава: а – 0.01 М нитраты натрия, калия и аммония; б – дистиллированная и морская вода.

Значения коэффициента распределения цезия на алюмосиликате натрия в зависимости от концентрации солей нитратов приведены в табл. 4. Видно, что наибольшие значения коэффициента распределения наблюдаются при сорбции цезия из растворов нитрата натрия. При сорбции ионов Cs+ из растворов нитрата калия и аммония коэффициент распределения уменьшается. С увеличением концентрации нитратов в растворе сорбция ионов Cs+ снижается во всех случаях.
ЗАКЛЮЧЕНИЕ
Из щелочного гидролизата рисовой соломы синтезирован наноструктурированный рентгеноаморфный алюмосиликат натрия с удельной поверхностью 364 м2/г. Изучены его сорбционные свойства по отношению к ионам Cs+ при сорбции из растворов различного солевого состава (морской воды и растворов на основе нитратов).
Установлено, что в случае морской воды наблюдается существенное снижение сорбционной емкости исследуемого соединения. Найдено, что степень извлечения ионов Cs+ из растворов без солевого фона достигает 96.2%, а из морской воды – не превышает 25.7%. Показано, что для описания сорбции ионов Cs+ синтетическим алюмосиликатом натрия из растворов без солевого фона и из морской воды наиболее подходящей является модель Ленгмюра, о чем свидетельствуют соответствующие коэффициенты корреляции. Максимальная сорбционная емкость Amax при сорбции ионов Cs+ из растворов без солевого фона и из морской воды составляет 1.2 и 0.16 ммоль/г соответственно. Установлено, что высокие значения коэффициента распределения наблюдаются при сорбции цезия из растворов без солевого фона при всех соотношениях твердой и жидкой фаз, при этом максимальное значение коэффициента распределения Kd (11 000 мл/г) наблюдается при соотношении Т : Ж, равном 2000. При сорбции из морской воды при всех выбранных соотношениях твердой и жидкой фаз значения коэффициента распределения существенно снижаются.
При исследовании кинетики сорбции из исследуемых типов растворов найдено, что кинетические кривые выходят на плато уже в течение 5 мин и в дальнейшем величина сорбции не изменяется. Через указанный интервал времени степень извлечения ионов Cs+ составляет в случае дистиллированной воды 96.4%, морской воды – 19.7%, NaNO3 – 87.4%, KNO3 – 70.0%, NH4NO3 – 69.2%. При сорбции ионов Cs+ из 0.01 М растворов нитратов наибольшие значения степени извлечения ионов Cs+ наблюдаются для раствора NaNO3. Установлено, что наибольшие значения коэффициента распределения наблюдаются при сорбции цезия из растворов нитрата натрия. При сорбции ионов Cs+ из растворов нитрата калия и аммония коэффициент распределения существенно уменьшается. С увеличением концентрации нитратов в растворе сорбция ионов Cs+ снижается во всех случаях.
БЛАГОДАРНОСТЬ
Работа выполнена при финансовой поддержке гранта Президента РФ для государственной поддержки молодых российских ученых – кандидатов наук МК-2884.2017.3 и проекта 4.5913.2017/8.9 в рамках базовой части государственного задания образовательных организаций высшего образования, находящихся в ведении Министерства науки и высшего образования Российской Федерации.
Список литературы
Tan W.-C., Yap S.-Y., Matsumoto A., Othman R., Yeoh F.-Y. Synthesis and Characterization of Zeolites NaA and NaY from Rice Husk Ash // Adsorption. 2011. V. 17. P. 863–868.
Thuadaij P., Nuntiya A. Preparation and Characterization of Faujasite using Fly Ash and Amorphous Silica from Rice Husk Ash // Proc. Eng. 2012. V. 32. P. 1026–1032.
Bohra S., Kundu D., Naskar M.K. One-Pot Synthesis of NaA and NaP Zeolite Powders Using Agro-Waste Material and Other Low Cost Organic-Free Precursors // Ceram. Int. 2014. V. 40. P. 1229–1234.
Mohamed R.M., Mkhalid I.A., Barakat M.A. Rice Husk Ash as a Renewable Source for the Production of Zeolite NaY and Its Characterization // Arab. J. Chem. 2015. V. 8. № 1. P. 48–53.
Ng E.-P., Awala H., Tan K.-H., Adama F., Retoux R., Mintova S. EMT-type Zeolite Nanocrystals Synthesized from Rice Husk // Micropor. Mesopor. Mater. 2015. V. 204. P. 204–209.
Prasara A.J., Gheewala S.H. Sustainable Utilization of Rice Husk Ash from Power Plants: A Review // J. Cleaner Production. 2017. V. 167. P. 1020–1028.
Ali I.O., Thabet M.S., El-Nasser K.S., Hassan A.M., Salama T.M. Synthesis of Nanosized ZSM-5 Zeolite from Rice Straw Using Lignin as a Template: Surface-Modified Zeolite with Quaternary Ammonium Cation for Removal of Chromium from Aqueous Solution // Micropor. Mesopor. Mater. 2012. V. 160. P. 97–105.
Ali I.O., Salama T.M., Thabet M.S., El-Nasser K.S., Hassan A.M. Encapsulation of Ferro- and Ferricyanide Complexes Inside ZSM-5 Zeolite Synthesized from Rice Straw: Implications for Synthesis of Prussian Blue Pigment // Mater. Chem. Phys. 2013. V. 140. P. 81–88.
Tan G., Wu Y., Liu Y., Xiao D. Removal of Pb(II) Ions from Aqueous Solution by Manganese Oxide Coated Rice Straw Biochar – A Low-Cost and Highly Effective Sorbent // J. Taiwan Institute Chem. Eng. 2018. V. 84. P. 85–92.
Lin C., Luo W., Luo T., Zhou Q., Li H., Jing L. A Study on Adsorption of Cr(VI) by Modified Rice Straw: Characteristics, Performances and Mechanism // J. Cleaner Production. 2018. V. 196. P. 626–634.
Swelam A.A., Awad M.B., Salem A.M.A., El-Feky A.S. An Economically Viable Method for the Removal of Cobalt Ions from Aqueous Solution Using Raw and Modified Rice Straw // HBRC J. 2016. Article in press. https://doi.org/10.1016/j.hbrcj.2016.10.001.
Гордиенко П.С., Ярусова С.Б., Земнухова Л.А., Чередниченко А.И. Синтез силикатов кальция из щелочных экстрактов соломы риса // Тез. докл. VI Междунар. конф. “Материалы и покрытия в экстремальных условиях: исследование, применение, экологически чистые технологии производства и утилизации изделий”, 20–24 сентября Большая Ялта, Понизовка, 2010. С. 370.
Земнухова Л.А., Федорищева Г.А., Цой Е.А., Арефьева О.Д. Способ получения алюмосиликатов натрия или калия из кремнийсодержащего растительного сырья: Пат. 2557607 РФ. № 2014113045/05; Б.И. № 21.
Panasenko A.E., Yarusova S.B., Zemnukhova L.A., Gordienko P.S. Kinetics of Cesium Sorption by Aluminosilicate Sorbents Prepared from Rice Straw // Book of Abstracts of the International Conference “Renewable Plant Resources: Chemistry, Technology, Medicine”, Saint Petersburg, (September 18–22) 2017. P. 63.
Гордиенко П.С., Ярусова С.Б., Шабалин И.А., Железнов В.В., Зарубина Н.В., Буланова С.Б. Сорбционные свойства наноструктурированного алюмосиликата калия // Радиохимия. 2014. Т. 56. № 6. С. 518–523.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы