Неорганические материалы, 2019, T. 55, № 5, стр. 528-533
Синтез при высоких давлениях H2 – xTa2O6 – 0.5x · 2/3 H2O (0 ≤ x ≤ 2) со структурой гексагональной вольфрамовой бронзы
И. П. Зибров 1, *, В. П. Филоненко 1, М. В. Тренихин 2, 3, Е. Е. Никишина 4, Е. Н. Лебедева 4, Д. В. Дробот 4
1 Институт физики высоких давлений им. Л.Ф. Верещагина Российской академии наук
108840 Москва, Троицк, Калужское ш., 14, Россия
2 Омский научный центр СО Российской академии наук
644024 Омск, пр. Карла Маркса, 15, Россия
3 Омский государственный технический университет
644050 Омск, пр. Мира 11, Россия
4 МИРЭА – Российский технологический университет
119454 Москва, пр. Вернадского, 78, Россия
* E-mail: zibrov@hppi.troitsk.ru
Поступила в редакцию 23.08.2018
После доработки 17.10.2018
Принята к публикации 04.09.2018
Аннотация
Термобарической обработкой аморфного маловодного гидроксида тантала TaO0.5–2.0(OH)4–1 · 1.0–2.5 H2O при p = 5.0–6.0 ГПа и t = 800–900°С получена смесь двух фаз: Ta2O5 · 2/3 H2O (пр. гр. P63/mсm, а = 7.4736(2) Å, с = 7.6798(2) Å, Z = 3, V = 371.48(1) Å3) и H2Ta2O6 · 2/3 H2O (пр. гр. P63/mсm, а = 7.4998(1) Å, с = 7.6171(2) Å, Z = 3, V = 371.04(1) Å3), кристаллизующихся в структурном типе гексагональной вольфрамовой бронзы (ГВБ). Термогравиметрический анализ показал наличие 4.9(3)% воды в материале. После удаления воды, при нагреве на воздухе до 550°С структура ГВБ переходит в δ-Ta2O5. Проведен полнопрофильный анализ рентгеновской дифрактограммы и получены значения структурных факторов достоверности: RF = 0.0374 для Ta2O5 · 2/3 H2O и RF = 0.0416 для H2Ta2O6 · 2/3 H2O. Предполагается, что в этих соединениях действуют разные механизмы реализации стехиометрии базовой ячейки ГВБ МO3.
ВВЕДЕНИЕ
Ранее мы сообщали, что при термобарической обработке аморфного маловодного гидроксида (МВГ) тантала [1] получены гидрат F-Ta2O5 · · 2/3 H2O (p = 5.0–8.0 ГПа, t = 950–1100°С) [2, 3] и смесь двух фаз: H2Ta2O6 · H2O со структурой дефектного пирохлора и δ-Ta2O5 (p = 5.0 ГПа, t = = 600–750°С) [4]. В работе [4] отмечено, что при обработке МВГ Та при t = 800°С на дифрактограмме продуктов появляются новые пики, т.е. происходит кристаллизация новых соединений.
Целью настоящей работы явилась термобарическая обработка МВГ тантала при температурах 800–900°С, определение состава и структуры получаемых продуктов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Порошок МВГ тантала состава TaO0.5–2.0(OH)4–1 · · 1.0–2.5 H2O предварительно прессовали в таблетки диаметром 5 и высотой 3–4 мм. Схема экспериментов при высоких давлениях с использованием камеры “тороид” описана в [5, 6]. Для предотвращения химического взаимодействия образцы изолировали от графитового нагревателя тугоплавкой фольгой (Ta, W). После набора давления до требуемого значения образец разогревали и выдерживали под давлением при заданной температуре в течение 5 мин. Затем образец охлаждали со скоростью около 100°С/с, давление плавно снижали и извлекали материал из контейнера.
Фазовый анализ продуктов нагрева осуществляли на порошковом рентгеновском дифрактометре D-Max IIIC (RIGAKU, Япония) (CuKα-излучение, Si-монохроматор).
Структурные исследования материала проводили в Imaging Plate Гинье-камере G670 (Huber, Германия) в геометрии на просвет с использованием CuKα1-излучения (λ = 1.540598 Å) в области углов 2θ = 4°–100°.
Электронно-микроскопические исследования проводили на просвечивающем электронном микроскопе (ПЭМ) JEOL JEM-2100 (ускоряющее напряжение 200 кВ, разрешение на решетке 0.14 нм). Для этого небольшие количества порошков растирали в агатовой ступке. Затем порошок диспергировали в этиловом спирте, полученную суспензию наносили на медную сетку, покрытую перфорированной углеродной пленкой.
Дифференциальный термический анализ (ДТА), совмещенный с термогравиметрией (ТГ), проводили на воздухе на установке ULVAC TGD 7000 (SINKU-RIKO, Япония).
ИК-спектр изучали на спектрофотометре Specord M-80. Для измерения ИК-спектров готовили таблетки путем прессования смеси порошков исследуемого материала (0.5%) с чистым KBr.
МВГ тантала получали взаимодействием TaCl5 с раствором аммиака (6.0–9.5 моль/л) [1]. Полученный МВГ тантала представлял собой белый порошок с содержанием Ta2O5 82–85 мас. % и низким содержанием примесей хлорид-иона (менее 0.05 мас. %).
Термобарическую обработку МВГ проводили при давлении 5.0 ГПа и температурах 800–900°С (всего было получено 5 образцов).
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
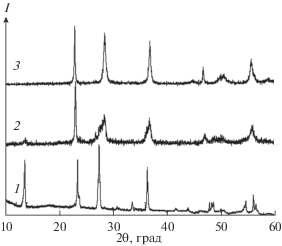
Результаты РФА двух образцов представлены на рис. 1. Их дифрактограммы практически полностью совпадают с дифрактограммой гексагональной вольфрамовой бронзы (ГВБ). Отличие состоит в расщеплении некоторых пиков, например 002, 102, 202. Анализ характера расщепления пиков показал, что оно не может определяться ромбическим или моноклинным искажением гексагональной ячейки ГВБ (в этом случае пики с индексами 00l не расщепляются), а связано с присутствием в материале двух гексагональных фаз с близкими параметрами элементарной ячейки. Из рис. 1 также следует, что количество фаз в смеси может меняться в зависимости от температуры обработки: при 800°С количество фаз примерно одинаково, а при 900°С фазы с меньшим параметром с больше (пик 002). Структура фаз представлена на рис. 2.
Рис. 1.
Дифрактограммы гексагональной модификации WO3 [7] (структурный тип ГВБ) (1) и образцов, полученных после термобарической (р = 5.0 ГПа) обработки МВГ тантала при t = 800 (2) и 900°С (3).
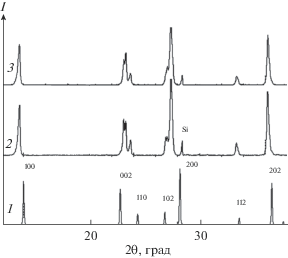
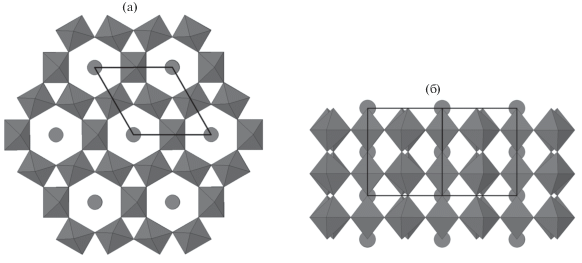
Рис. 2.
Структура Та2О5 · 2/3 Н2О и H2Ta2O6 · 2/3 H2O в направлении [001] (a), [110] (б): темные полиэдры – октаэдры [ТаО6], темные кружки – молекулы воды в каналах структуры.
Базовая ячейка ГВБ имеет стехиометрию МО3. Она образуется соединенными вершинами октаэдрами, формирующими каналы гексагональной формы. Требуемая стехиометрия М2О5 может быть реализована в данном случае тремя способами: 1 – внедрением дополнительного тантала (1.2 атома Та на ячейку), 2 – дефицитом кислорода (3 атома О на ячейку), 3 – замещением кислорода ОН-группами (6 ОН-групп вместо шести атомов кислорода).
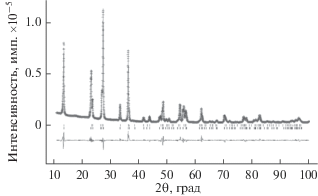
Образец, полученный после термобарической обработки МВГ тантала при t = 900°С и p = 5.0 ГПа (рис. 1, дифрактограмма 3), использовали для уточнения структуры. Собранные рентгеновские данные подвергли процедуре полнопрофильного анализа с использованием пакета программ GSAS [8, 9]. В качестве стартовой модели структуры взяты координаты атомов из работы [10]. Результаты уточнения представлены в табл. 1, координаты атомов – в табл. 2 и 3, а межатомные расстояния – в табл. 4. На рис. 3 показаны экспериментальные данные, рассчитанная дифракционная кривая и разность между ними.
Таблица 1.
Экспериментальные данные для H2Ta2O6 · 2/3 H2O и Та2О5 · 2/3 Н2О (T = 298 K)
| Химическая формула | H2Ta2O6 · 2/3 H2O | Та2О5 · 2/3 Н2О |
|---|---|---|
| Молекулярный вес | 471.896 | 453.896 |
| Пр. гр. | P63/mсm | P63/mсm |
| a, Å | 7.4998(1) | 7.4736(2) |
| c, Å | 7.6171(2) | 7.6798(2) |
| V, Å3 | 371.04(1) | 371.48(1) |
| Z | 3 | 3 |
| dвыч, г/см3 | 6.334 | 6.085 |
| Доля в смеси | 0.63(5) | 0.37(5) |
| RF | 0.0416 | 0.0374 |
| RP | 0.0541 | |
| RWP | 0.0774 | |
| Уточняемые параметры | 39 | 39 |
Таблица 2.
Атомные координаты, изотропные тепловые параметры Uiso (Å2) и занятости позиций для H2Ta2O6 · · 2/3 H2O
| Атом | Позиция | Заполнение позиции | x | y | z | Uiso |
|---|---|---|---|---|---|---|
| Ta | 6g | 1.0 | 0.4959(5) | 0 | 0.25 | 0.0327(4) |
| O1 | 12j | 0.75 | 0.22 | 0.42 | 0.25 | 0.025 |
| O2 | 6f | 1.0 | 0.5 | 0 | 0 | 0.025 |
| O3(H2O) | 2b | 1.0 | 0 | 0 | 0 | 0.025 |
Таблица 3.
Атомные координаты, изотропные тепловые параметры Uiso (Å2) и занятости позиций для Та2О5 · · 2/3 Н2О
| Атом | Положение | Заполнение позиции | x | y | z | Uiso |
|---|---|---|---|---|---|---|
| Ta | 6g | 1.0 | 0.5001(19) | 0 | 0.25 | 0.0188(5) |
| O1 | 12j | 0.75 | 0.22 | 0.42 | 0.25 | 0.025 |
| O2 | 6f | 1.0 | 0.5 | 0 | 0 | 0.025 |
| O3(H2O) | 2b | 1.0 | 0 | 0 | 0 | 0.025 |
Таблица 4.
Некоторые межатомные расстояния rij (Å) для H2Ta2O6 · 2/3 H2O и Та2О5 · 2/3 Н2О
| Фаза | H2Ta2O6 · 2/3 H2O | Та2О5 · 2/3 Н2О |
|---|---|---|
| Ta–O1iv | 1.8958(26) | 1.866(10) |
| Ta–O1i | 1.9963(25) | 2.012(10) |
| Ta–O1ii | 1.8958(26) | 1.866(10) |
| Ta–O1iii | 1.9963(25) | 2.012(10) |
| Ta–O2v | 1.90453(7) | 1.91996(6) |
| Ta–O2vi | 1.90453(7) | 1.91996(6) |
| O1–O1iv | 2.77795(4) | 2.76825(6) |
| O1–O1iii | 2.59800(4) | 2.58892(6) |
| O1–O1ii | 2.85780(4) | 2.84781(6) |
| O1–O2vii | 2.77463(4) | 2.78031(5) |
| O1–O2viii | 2.67134(4) | 2.67798(5) |
Рис. 3.
Результаты полнопрофильного анализа по методу Ритвельда: верхняя кривая соответствует рассчитанным данным (экспериментальные точки также показаны), нижняя кривая ‑ разность между экспериментальными и рассчитанными данными, вертикальные штрихи показывают все возможные брэгговские рефлексы (верхний ряд ‑ H2Ta2O6 · 2/3 H2O, нижний ряд – Та2О5 · 2/3 Н2О).
На следующем этапе протестирована возможность реализации стехиометрии по первому механизму. Дополнительный тантал может занимать две позиции в ячейке: в гексагональном канале в плоскости атомов тантала (0 0 0.25) и в тригональной призме (0.33 0.33 0). Уточнение занятости этих позиций танталом показало, что эти величины практически равны нулю, что дает однозначный ответ относительно первого механизма – дополнительного тантала в ячейке нет. Относительно второго и третьего механизмов сказать что-либо невозможно, т.к. электронная плотность на кислороде и водороде пренебрежимо мала по сравнению с танталом. По этой же причине не удалось уточнить координаты О1, поэтому они зафиксированы в соответствии с моделью [10]. Тепловые параметры кислорода также не уточнялись. Однако результаты ТГ-анализа позволяют сделать выводы о действии второго и третьего механизмов.
Результаты ТГ-анализа образца, полученного после термобарической обработки МВГ тантала при t = 900°С и p = 5.0 ГПа, представлены на рис. 4. Общее количество воды в образце составляет 4.9(3) мас. %. Из кривой ТГ видно, что вода удаляется из образца в два этапа: в интервале температур 200–400°С образец теряет примерно 1.5 мас. %, от 400 до 600°С – остальные 3.4 мас. %. При этом второй этап сопровождается более сильным эндотермическим эффектом, чем первый. Вероятно, такое поведение связано с действием разных механизмов: на первом этапе удаляется слабо связанная в каналах структуры вода, а на втором – вода, связанная с гидроксильными группами.
Рис. 4.
Результаты термического анализа образца после термобарической обработки МВГ тантала при t = = 900°С и р = 5.0 ГПа (скорость нагрева на воздухе 10°С/мин, масса образца 27.3 мг).
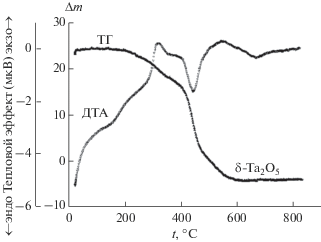
Дифрактограммы исследуемого образца, нагретого до 550 и 830°С, представлены на рис. 5. Видно, что при удалении воды исходная структура не сохраняется, происходит переход в δ-Ta2O5, структура которого также может быть отнесена к ГВБ [11, 12]. Для изучения этого превращения образец нагревали в аргоне до 300°С со скоростью 3°С/мин и выдерживали при этой температуре в течение 1 ч.
Рис. 5.
Дифрактограммы образца, полученного при t = 900°С (дифрактограмма 3 на рис. 1) и нагретого в атмосфере аргона до 300°С со скоростью 3°С/мин с последующей выдержкой в течение 1 ч (1), на воздухе до 550°С со скоростью 10°С/мин (2), на воздухе до 830°С со скоростью 10°С/мин (3).
При такой термообработке количество оставшейся в материале воды составило 1–1.5 мас. %, а смесь двух гексагональных фаз превратилась в одну фазу с параметрами a = 7.5014(22) Å, c = = 7.5918(12) Å, V = 369.96 Å3, т.е. ее объем меньше, чем объем исходных соединений (табл. 1).
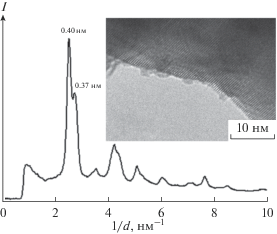
На рис. 6 представлено ПЭМ-изображение гексагональной структуры в направлении [001], на вставке показана соответствующая ей электронограмма (фурье-преобразование). Межплоскостные расстояния хорошо совпадают со структурой полученных гексагональных фаз. Профиль радиального распределения контраста, полученный с электронограммы, показан на рис. 7. На нем четко видны два максимума, соответствующие c/2. Это является прямым подтверждением наличия в материале двух фаз с отличающимися параметрами c, т.е. подтверждением результатов уточнения структуры по рентгеновским данным. При этом следует учитывать, что точность измерений в электронной микроскопии значительно уступает точности рентгеновских данных.
Рис. 6.
ПЭМ-изображение образца, полученного после термобарической обработки МВГ тантала при t = = 900°С и p = 5.0 ГПа, вдоль оси с и соответствующая электронограмма.

Рис. 7.
Профиль радиального распределения контраста, полученный с электронограммы; на вставке – характерное ПЭМ-изображение.
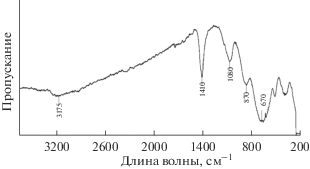
ИК-спектр образца (рис. 8) практически совпадает с ИК-спектром дефектного пирохлора H2Ta2O6 · · H2O [4]. В обоих спектрах имеются линии поглощения, связанные с наличием молекул воды в каналах структуры: 3175, 1410, 1080, 870, 670 cм–1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Молекулы воды располагаются в гексагональных каналах структуры между плоскостями атомов тантала. При полностью заполненных позициях воды формула соединения соответствует Та2О5 · 2/3 Н2О, что составляет 2.65 мас. % воды. Если стехиометрия реализуется по механизму дефицита кислорода (по такому же механизму реализуется стехиометрия в F-Та2О5 [3], стехиометрия базовой ячейки в котором М3О8), то его отсутствие не отражается на содержании воды в фазе, которое также составляет 2.65 мас. %. При действии третьего механизма (замещение кислорода ОН-группами) формулу соединения можно представить как Н2Та2О6 · 2/3 Н2О или Та2О4–ОН–ОН · 2/3 Н2О, что соответствует 6.38 мас. % воды в материале. Получить общее содержание воды в образце на уровне 5 мас. % можно, если предположить, что в одной фазе действует второй (дефицит кислорода), а в другой – третий механизмы реализации стехиометрии. Для образца, на котором проводили уточнение структуры, расчетное содержание воды составило 6.38 мас. % × × 0.63 + 2.65 мас. % × 0.37 = 5.0 мас. %, что практически совпадает с результатом его ТГ-анализа. Именно на основании этого расчета мы предположили, что в образце присутствуют 63% соединения Н2Та2О6 · 2/3 Н2О и 37% – соединения Та2О5 · 2/3 Н2О, т.к. на основании рентгеновских данных они неразличимы. Очевидно, что оба механизма реализации требуемой стехиометрии могут действовать одновременно в одной фазе, но тогда без ответа остается вопрос, почему при термобарической обработке МВГ тантала всегда получается смесь двух гексагональных фаз.
Существенным отличием между F-Та2О5 · 2/3 Н2О [3] и гексагональными гидратами является схема их превращений при нагреве при обычном давлении. F-Та2О5 · 2/3 Н2О при удалении воды переходит в оксид F-Та2О5, который при дальнейшем нагреве превращается в δ-Ta2O5. Две гексагональные фазы превращаются сначала в одну с содержанием воды 1–1.5 мас. %, а при полном удалении воды переходят в фазу δ-Ta2O5, структура которой также относится к ГВБ [11, 12]. Отличие δ‑фазы от гексагонального WO3 состоит в формуле элементарной ячейки – Ta4O10 и W3O9 соответственно. Четвертый атом тантала занимает позицию в гексагональном канале в плоскости танталовых атомов, а десятый атом кислорода – в гексагональном канале между плоскостями танталовых атомов. Таким образом, между гексагональными гидратами и δ-Ta2O5 существует практически полное структурное соответствие, которое и приводит к прямому переходу гидратов в δ‑модификацию. Можно также отметить сходство структуры полученных фаз со структурой дефектного пирохлора H2Ta2O6 · H2O [4], который построен из точно таких же плоскостей (гексагональных сеток). Отличие состоит только в способе соединения этих плоскостей между собой.
ЗАКЛЮЧЕНИЕ
Методом кристаллизации аморфного МВГ тантала при давлении 5.0 ГПа в температурном интервале 800–900°С получена смесь двух фаз: H2Ta2O6 · 2/3 H2O и Ta2O5 · 2/3 H2O, кристаллизующихся в структурном типе ГВБ (WO3 гекс.).
Проведен полнопрофильный анализ дифрактограммы на основе ГВБ-структуры этих соединений. Полученные величины факторов достоверности (RF = 0.0416 и RF = 0.0374) свидетельствуют о правильности выбранной модели.
Показано, что при нагреве H2Ta2O6 · 2/3 H2O и Ta2O5 · 2/3 H2O на воздухе они теряют воду в интервале 200–600°С, что приводит к их превращению в δ-Ta2O5.
Вероятно, прямой переход происходит благодаря структурному соответствию между гексагональными гидратами и гексагональной фазой δ-Ta2O5.
Список литературы
Никишина Е.Е., Лебедева Е.Н., Дробот Д.В. Способ получения гидроксида тантала: Патент РФ 2314258. 2008. Бюл. № 1.
Nikishina E.E., Drobot D.V., Filonenko V.P., Zibrov I.P., Lebedeva E.N. Crystallization Features of Amorphous Tantalum Pentoxide under Atmospheric and High Pressure // Russ. J. Inorg. Chem. 2002. V. 47. № 1. P. 10–13.
Zibrov I.P., Filonenko V.P., Drobot D.V., Nikishina E.E. Structure of a High-Pressure Hydroxide Ta2O5 · 2/3 H2O and a Derivative Metastable Oxide Ta2O5 // Russ. J. Inorg. Chem. 2003. V. 48. № 4. P. 464–471.
Zibrov I.P., Filonenko V.P., Nikishina E.E., Lebedeva E.N., Drobot D.V. High-Pressure Synthesis of H2Ta2O6 · H2O with a Defect Pyrochlore Structure // Inorg. Mater. 2016. V. 52. № 1. P. 38–43.
Filonenko V.P., Zibrov I.P. High-Pressure Phase Transitions of M2O5 (M = V, Nb, Ta) and Thermal Stability of New Polymorphs // Inorg. Mater. 2001. V. 37. № 9. P. 953–959.
Zibrov I.P., Filonenko V.P., Werner P.-E., Marinder B.-O., Sundberg M.A. New High-Pressure Modification of Nb2O5 // J. Solid State Chem. 1998. V. 141. P. 205–211.
Gerand B., Nowogrocki G., Guenot J., Figlarz M. Structural Study of a New Hexagonal Form of Tungsten Trioxide // J. Solid State Chem. 1979. V. 29. P. 429–434.
Larson A.C., Von Dreele R.B. General Structure Analysis System (GSAS) // Los Alamos National Laboratory. 1987. Report LA-UR-86-748.
Toby B.H. EXPGUI, a Graphical User Interface for GSAS // J. Appl. Crystallogr. 2001. V. 34. P. 210–213.
Magnéli A. Studies on the Hexagonal Tungsten Bronzes of Potassium, Rubidium and Cesium // Acta Chem. Scand. 1953. V. 7. P. 315–324.
Fukumoto A., Miwa K. Prediction of Hexagonal Ta2O5 Structure by First-Principles Calculations // Phys. Rev. B. 1997. V. 55. № 17. P. 11155–11160.
Pérez-Walton S., Valencia-Balvín C., Padilha A.C.M., Dalpian G.M., Osorio-Guillén J.M. A Search for the Ground State Structure and the Phase Stability of Tantalum Pentoxide // J. Phys. Condens. Matter. 2016. V. 28. P. 1–11.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы