Неорганические материалы, 2019, T. 55, № 9, стр. 1007-1013
Теплоемкость германатов редкоземельных элементов R2Ge2O7 (R = Pr–Lu, Y)
Л. Т. Денисова 1, *, Ю. Ф. Каргин 2, Н. В. Белоусова 1, Л. А. Иртюго 1, В. М. Денисов 1, В. В. Белецкий 1
1 Институт цветных металлов и материаловедения Сибирского федерального университета
660041 Красноярск, Свободный пр., 79, Россия
2 Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук
119991 Москва, Ленинский пр., 49, Россия
* E-mail: antluba@mail.ru
Поступила в редакцию 07.02.2019
После доработки 06.03.2019
Принята к публикации 12.04.2019
Аннотация
Германаты редкоземельных элементов R2Ge2O7 (R = Pr–Lu, Y) синтезированы методом твердофазных реакций обжигом на воздухе стехиометрических смесей GeO2 + R2O3 в интервале температур 1273–1473 K. Установлена линейная зависимость параметров элементарной ячейки (a, c, V) соединений R2Ge2O7 от ионного радиуса РЗЭ (R = Tb–Lu). Методом дифференциальной сканирующей калориметрии измерена высокотемпературная теплоемкость поликристаллических образцов в области температур 350–1000 K. Показано, что имеется корреляция между характером изменения удельной теплоемкости R2Ge2O7 и зависимостью теплоемкости оксидов РЗЭ от ионного радиуса РЗЭ в пределах соответствующих тетрад.
ВВЕДЕНИЕ
Двойные системы R2O3–GeO2 характеризуются наличием промежуточных соединений, соответствующих молярным отношениям компонентов R2O3 : GeO2 = 2 : 1, 1 : 1 и 1 : 2 (для La2O3 возможно образование соединения 7 : 9) [1–3]. Наибольший интерес представляют соединения R2GeO5 [1, 2, 4–8] и R2Ge2O7 [1, 2, 9–12]. По данным [1, 2], соединения R2Ge2O7 по типу структур делятся на четыре структурные подгруппы: La–Pr, Nd–Gd, Tb–Lu, Sc. При описании атомного строения соединений с легкими РЗЭ можно выделить два островных германий-кислородных радикала – [Ge3O10] и [GeO4], их химическую формулу представляют в виде R4[Ge3O10][GeO4] [1, 2]. Следует отметить, что при повышенном давлении возможно получение соединений R2Ge2O7 (R = Gd, Ho, Er, Tm, Lu, Sc, Y) со структурой типа пирохлора [3, 13, 14].
Известно, что измерение теплоемкости – один из путей определения теплофизических и термодинамических свойств сложных оксидных соединений [15]. Поэтому представляется целесообразным исследовать теплофизические свойства соединений R2Ge2O7, принадлежащих к разным структурным подгруппам.
Цель настоящей работы – установление закономерностей изменения теплоемкости германатов редкоземельных элементов состава R2Ge2O7 (R = Pr–Lu, Y) в области 350–1000 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез германатов редкоземельных элементов R2Ge2O7 проводили методом твердофазных реакций обжигом стехиометрических смесей исходных компонентов на воздухе в интервале температур 1273–1473 K. В качестве исходных компонентов использовали оксиды R2O3 (все квалификации “х. ч.”) и GeO2 (99.9999%). Продолжительность синтеза, количество добавляемого сверх стехиометрии GeO2 (вследствие летучести при высоких температурах), подобно [16, 17], подбирали экспериментально. Контроль фазового состава образцов в процессе синтеза германатов R2Ge2O7 проводили с использованием рентгенофазового анализа (дифрактометр X´Pert Pro MPD PANalytical, Нидерланды).
Методика измерения теплоемкости методом дифференциальной сканирующей калориметрии описана в [18, 19]. Полученные результаты обрабатывали с помощью пакета анализа NETZSCH Proteus Thermal Analysis и лицензионного программного инструмента Systat Sigma Plot 12 (Systat Software Inc., США). Погрешность измерений не превышала 2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Параметры элементарных ячеек синтезированных германатов РЗЭ представлены в табл. 1, где для сравнения приведены также данные других авторов. Можно видеть, что наблюдается удовлетворительное согласие между полученными нами значениями параметров ячеек и литературными данными.
Таблица 1.
Параметры элементарной ячейки кристаллов R2Ge2O7 (R = Pr, Nd, Sm, Eu, Gd – пр. гр. P1; Pr* – пр. гр. $\bar {P};$ Tb, Dy, Ho, Er, Tm, Yb, Lu, Y – пр. гр. P41212)
| R2Ge2O7 | a, Å | b, Å | c, Å | α , град | β, град | γ, град | Источник |
|---|---|---|---|---|---|---|---|
| Pr2Ge2O7 | 18.9618(8) | 6.9575(3) | 6.9462(4) | 88.735(4) | 90.824(3) | 95.832(2) | [16] |
| Pr2Ge2O7* | 18.935×2 | 6.948(1) | 6.931(1) | 88.75(2) | 90.78(2) | 95.83(2) | [9] |
| Nd2Ge2O7 | 18.8549(8) | 6.9207(3) | 6.9254(3) | 88.565(2) | 90.972(2) | 95.491(2) | [16] |
| Sm2Ge2O7 | 18.6673(5) | 6.8547(2) | 6.8826(2) | 88.333(1) | 91.225(1) | 95.143(1) | [20] |
| 18.660(2) | 6.853(1) | 6.882(1) | 88.34(1) | 91.23(1) | 95.06(1) | [9] | |
| Eu2Ge2O7 | 18.5804(5) | 6.8232(2) | 6.8655(2) | 88.163(2) | 91.359(1) | 94.943(2) | [20] |
| 18.559(5) | 6.815(1) | 6.867(2) | 88.20(2) | 91.72(2) | 94.58(2) | [9] | |
| Gd2Ge2O7 | 18.4793(2) | 6.7859(2) | 6.8573(7) | 87.959(6) | 91.519(5) | 94.381(6) | HP |
| 18.499(3) | 6.795(1) | 6.865(1) | 87.95(2) | 91.51(2) | 94.35(2) | [9] | |
| Tb2Ge2O7 | 6.8554(1) | 12.4634(2) | HP | ||||
| 6.856(5) | 12.47(1) | [9] | |||||
| Dy2Ge2O7 | 6.8269(1) | 12.4289(2) | [21] | ||||
| 6.828(5) | 12.43(1) | [9] | |||||
| Ho2Ge2O7 | 6.8068(1) | 12.3812(2) | [21] | ||||
| 6.806(5) | 12.38(1) | [9] | |||||
| Er2Ge2O7 | 6.7849(3) | 12.3380(8) | [22] | ||||
| 6.778(5) | 12.34(1) | [9] | |||||
| Tm2Ge2O7 | 6.7645(1) | 12.2930(2) | [23] | ||||
| 6.755(1) | 12.272(2) | [9] | |||||
| 6.7426(3) | 12.2604(3) | HP | |||||
| Yb2Ge2O7 | 6.745(5) | 12.26(1) | [9] | ||||
| 6.7278(4) | 12.2246(8) | HP | |||||
| Lu2Ge2O7 | 6.720(1) | 12.205(2) | [9] | ||||
| 6.8029(2) | 12.3740(4) | [17] | |||||
| Y2Ge2O7 | 6.8022(4) | 12.3759(7) | [12] |
Ранее показано влияние ионного радиуса РЗЭ на параметры элементарной ячейки соединений R2Ge2O7, имеющих пр. гр. P1 [16]. Установлено, что с увеличением ионного радиуса r3+ РЗЭ практически все параметры элементарной ячейки увеличиваются и могут быть описаны линейными уравнениями. Линейный характер зависимостей на рис. 1 показывает, что и для соединений R2Ge2O7, характеризующихся пр. гр. P41212, соблюдается подобная закономерность. Значения a, c и V с ростом r3+ закономерно увеличиваются и могут быть описаны линейными уравнениями
(1)
$a = \left( {5.0266{\text{ }} \pm {\text{ }}0.0388} \right) + \left( {1.9767{\text{ }} \pm {\text{ }}0.0435} \right){{r}^{{3 + }}},$(2)
$c = \left( {8.8990{\text{ }} \pm {\text{ }}0.0827} \right) + \left( {3.8647{\text{ }} \pm {\text{ }}0.9280} \right){{r}^{{3 + }}},$(3)
$V = \left( {111.31{\text{ }} \pm {\text{ }}8.22} \right) + \left( {513.2048{\text{ }} \pm {\text{ }}9.2233} \right){{r}^{{3 + }}}.$Рис. 1.
Влияние ионного радиуса редкоземельных элементов r3+ на параметры элементарной ячейки соединений R2Ge2O7 (R = Tb–Lu).
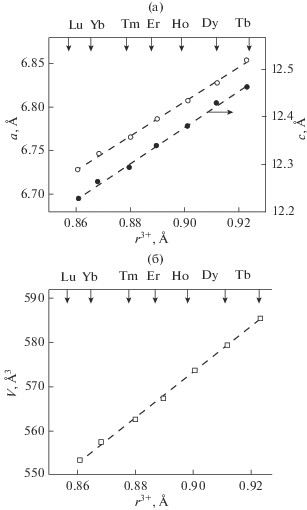
Коэффициенты корреляции для уравнений (1)–(3) равны 0.9988, 0.9986 и 0.9992 соответственно. Значения параметров элементарной ячейки для R2Ge2O7 (R = Tb, Dy, Ho, Er, Tm, Yb, Lu) получены нами, а ионные радиусы РЗЭ r3+ взяты из работы [24].
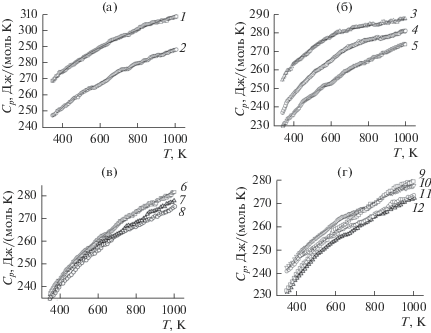
Влияние температуры на молярную теплоемкость R2Ge2O7 (литературные источники для каждого германата РЗЭ указаны в табл. 1) представлено в виде соответствующих экспериментальных зависимостей на рис. 2. Поскольку значения Cp для Pr2Ge2O7 и Nd2Ge2O7 практически совпадают, значения теплоемкости для Pr2Ge2O7 на рис. 2а смещены в сторону увеличения на 20 Дж/(моль K). На рис. 2 видно, что для всех германатов РЗЭ значения Cp с ростом температуры увеличиваются, при этом на зависимостях Cp = f(T) не наблюдается каких-либо экстремумов и аномалий. Характер полученных зависимостей теплоемкости позволяет допустить, что соединения R2Ge2O7 в области температур 350–1000 K не испытывают полиморфных превращений. Таким образом, полученные экспериментальные данные Cp = f(T) могут быть описаны классическим уравнением Майера–Келли [25]
Рис. 2.
Температурные зависимости молярной теплоемкости германатов R2Ge2O7: R = Pr (1), Nd (2), Sm (3), Eu (4), Gd (5), Tb (6), Dy (7), Ho (8), Er (9), Tm (10), Yb (11), Lu (12) (значения Cp (Pr2Ge2O7) смещены на +20 кДж/(моль К) относительно значений Cp (Nd2Ge2O7).
Параметры уравнения (4) для германатов R2Ge2O7 приведены в табл. 2. Исключением является соединение Y2Ge2O7, для которого уравнение [26]
Таблица 2.
Параметры уравнения (4) для германатов R2Ge2O7 (Дж/(моль K); ΔT = 350–1000 K)
| R2Ge2O7 | a | b × 103 | –c × 10–5 | r |
|---|---|---|---|---|
| Pr2Ge2O7 | 250.84 ± 0.58 | 10.76 ± 0.60 | 21.18 ± 0.66 | 0.9981 |
| Nd2Ge2O7 | 244.01 ± 0.90 | 46.29 ± 0.90 | 13.06 ± 0.98 | 0.9974 |
| Sm2Ge2O7 | 265.21 ± 1.26 | 20.27 ± 1.30 | 43.98 ± 1.35 | 0.9955 |
| Eu2Ge2O7 | 283.59 ± 0.77 | 7.20 ± 0.80 | 39.37 ± 0.82 | 0.9968 |
| Gd2Ge2O7 | 236.46 ± 0.52 | 40.10 ± 0.60 | 25.98 ± 0.55 | 0.9988 |
| Tb2Ge2O7 | 243.40 ± 0.46 | 41.48 ± 0.50 | 25.50 ± 5.03 | 0.9989 |
| Dy2Ge2O7 | 241.80 ± 0.36 | 38.31 ± 0.40 | 21.62 ± 4.20 | 0.9992 |
| Ho2Ge2O7 | 243.90 ± 0.61 | 34.15 ± 0.60 | 26.74 ± 6.50 | 0.9989 |
| Er2Ge2O7 | 240.04 ± 0.89 | 43.20 ± 0.90 | 28.15 ± 0.95 | 0.9979 |
| Tm2Ge2O7 | 239.20 ± 0.61 | 35.29 ± 0.60 | 12.98 ± 0.66 | 0.9983 |
| Yb2Ge2O7 | 249.42 ± 0.48 | 30.40 ± 0.50 | 23.14 ± 5.20 | 0.9982 |
| Lu2Ge2O7 | 242.27 ± 0.48 | 32.40 ± 0.60 | 28.38 ± 5.45 | 0.9996 |
лучше, чем уравнение (4), описывает экспериментальные значения Cp в интервале температур 320–1000 K. Для Y2Ge2O7уравнение (5) имеет следующий вид
(6)
$\begin{gathered} {{C}_{p}} = (143.64 \pm 1.56) + (256.0 \pm 8.0) \times {{10}^{{ - 3}}}T - \\ - \,\,(217.21 \pm 12.94) \times {{10}^{{ - 6}}}{{T}^{2}} + \\ + \,\,(56.83 \pm 6.64) \times {{10}^{{ - 9}}}{{T}^{3}}. \\ \end{gathered} $Коэффициент корреляции для уравнения (6) равен 0.9993.
Сравнить полученные нами значения по высокотемпературной теплоемкости R2Ge2O7 с данными других авторов не представлялось возможным вследствие их отсутствия. Имеющиеся в литературе сведения относятся к области низких температур, например, Gd2Ge2O7 [14], Tb2Ge2O7 [27], Dy2Ge2O7 [28], Ho2Ge2O7 [29–31]. В то же время можно оценить значения теплоемкости фаз различными методами (как аналитическими, так и графическими) [32, 33]. Нами проведен расчет значения ${{C}_{p}}$ (298 K) германатов R2Ge2O7 методами Неймана–Коппа (НК) [34], Келлога (К) [32] и инкрементным методом Кумока (ИМК) [35]. Полученные результаты приведены в табл. 3. Можно отметить, что лучшее согласие с экспериментальными значениями Cp дает инкрементный метод Кумока.
Таблица 3.
Сравнение экспериментальных значений Cp (298 K) (Дж/(моль K)) с рассчитанными по различным модельным уравнениям значениями
| R2Ge2O7 | Cp | Cp (НК) | –ΔCp, % | Cp (ИМК) | ΔCp, % | Cp (К) | ΔCp, % |
|---|---|---|---|---|---|---|---|
| Pr2Ge2O7 | 239.2 | 220.6 | 7.8 | 225.9 | –5.6 | 217.1 | –9.2 |
| Nd2Ge2O7 | 243.1 | 215.3 | 11.4 | 219.5 | –9.7 | 217.1 | –10.7 |
| Sm2Ge2O7 | 221.7 | 219.8 | 0.85 | 231.7 | +4.5 | 219.3 | –1.1 |
| Eu2Ge2O7 | 241.4 | 231.1 | 4.3 | 229.5 | –4.9 | ||
| Gd2Ge2O7 | 219.2 | 210.6 | 3.9 | 218.5 | –0.3 | 215.7 | –1.6 |
| Tb2Ge2O7 | 227.1 | 222.5 | 2.0 | 228.9 | +0.8 | ||
| Dy2Ge2O7 | 228.9 | 220.3 | 3.8 | 224.9 | –1.7 | ||
| Ho2Ge2O7 | 223.9 | 219.0 | 2.2 | 222.1 | –0.8 | 215.1 | –3.9 |
| Er2Ge2O7 | 221.2 | 212.5 | 3.9 | 221.1 | –0.05 | ||
| Tm2Ge2O7 | 235.1 | 220.7 | 6.1 | 229.5 | –2.4 | ||
| Yb2Ge2O7 | 232.4 | 219.4 | 5.6 | 228.1 | –1.8 | ||
| Lu2Ge2O7 | 220.0 | 205.8 | 6.5 | 220.3 | +0.1 | ||
| Y2Ge2O7 | 218.6 | 206.5 | 5.5 | 210.9 | –3.5 | 219.3 | +0.3 |
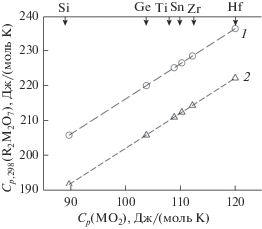
Известен метод сравнительного расчета термодинамических величин, заключающийся в установлении линейных зависимостей свойств для одноформульных соединений, переменные члены которых принадлежат к одной группе (подгруппе) Периодической системы элементов. Этим методом в [36] проведен расчет термодинамических свойств апатитов, формула которых была представлена в виде 3Ca3(PO4)2 ∙ X, где X = CaF2, CaCl2, Ca(OH)2. Было показано, что зависимости стандартных энтальпий образования, энергий Гиббса и энтропий апатитов 3Ca3(PO4)2 ∙ X от аналогичных термодинамических функций для структурных частей X имеют линейный характер. Отмечено, что при этом строение твердой фазы в расчетах не принималось во внимание. Следуя авторам работы [36], представим германаты R2M2O7 в виде R2O3 ∙ 2MO2 (M – элементы IV группы Периодической системы). Установлено, что зависимости Cp,298(Sm2M2O7) = f(Cp,298(2MO2)) и Cp,298(Lu2M2O7) = = f(Cp,298(2MO2)) имеют линейный вид (рис. 3) и могут быть описаны уравнениями
Рис. 3.
Корреляционные зависимости между значениями Cp,298 (R2M2O7) и Cp,298 (2MO2): R = Sm (1), Lu (2).
(7)
${{C}_{{p,298}}}\left( {{\text{S}}{{{\text{m}}}_{2}}{{{\text{M}}}_{{\text{2}}}}{{{\text{O}}}_{7}}} \right) = 115.82 + {{C}_{{p,298}}}\left( {2{\text{M}}{{{\text{O}}}_{2}}} \right),$(8)
$\begin{gathered} {{C}_{{p,298}}}\left( {{\text{L}}{{{\text{u}}}_{{\text{2}}}}{{{\text{M}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}} \right) = \left( {101.91{\text{ }} \pm {\text{ }}0.04} \right) + \\ + \,\,\left( {0.9986 \pm 0.0004} \right){{C}_{{p,298}}}\left( {2{\text{M}}{{{\text{O}}}_{2}}} \right). \\ \end{gathered} $Коэффициенты корреляции для уравнений (7) и (8) равны соответственно 0.9999 и 0.9998. Заметим, что на рис. 3 данные для Sm2M2O7 и Lu2M2O7 приведены в качестве примера. Подобные закономерности наблюдаются и для других германатов РЗЭ. Необходимые сведения о теплоемкости исходных оксидов брали из литературы: R2O3 [34, 37, 38], GeO2, ZrO2, HfO2 [34], SnO2 [39], TiO2 [40]. Данные по теплоемкости соединений R2M2O7 (R = Sm, Lu; M = Si, Ge, Ti, Sn, Zr, Hf) (в виду отсутствия экспериментальных значений практически для большинства из них) получены методом НК. Экстраполяция по уравнениям (7) и (8) на Sm2O3 и Lu2O3 дает для них значения Сp,298, равные 115.82 и 101.91 Дж/(моль K), что совпадает с экспериментальными величинами [34].
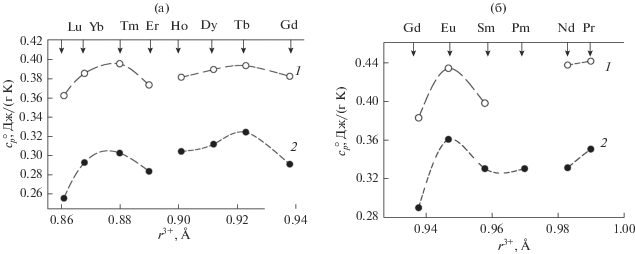
При анализе свойств РЗЭ и их соединений принимают во внимание наличие тетрад-эффекта, выделяя при этом четыре подгруппы: La–Nd, Pm–Gd, Gd–Ho, Er–Lu [41]. Ранее показано, что значения удельной теплоемкости различных оксидных соединений на основе РЗЭ (купратов, ортованадатов, гранатов) закономерно изменяются в пределах соответствующих тетрад [42]. Характер зависимостей удельной теплоемкости $c_{p}^{{\text{o}}}$ германатов (1) и оксидов (2) РЗМ при 298 K от величины ионных радиусов РЗЭ на рис. 4 показывает, что в целом аналогичная корреляция наблюдается и для соединений R2Ge2O7.
ЗАКЛЮЧЕНИЕ
Обжигом стехиометрических смесей R2O3 + + GeO2 на воздухе в интервале температур 1273–1473 K синтезированы однофазные образцы R2Ge2O7 (R = Pr–Lu, Y). Установлена линейная зависимость параметров элементарной ячейки (a, c, V) от ионного радиуса РЗЭ соединений R2Ge2O7 (R = Tb–Lu). Измерена высокотемпературная теплоемкость германатов R2M2O7 в области 350–1000 K и показано, что зависимости Cp = f(T) описываются уравнением Майера–Келли (за исключением Y2Ge2O7). Показано, что взаимосвязь между Cp,298(R2M2O7) и Cp,298(2MO2) имеет линейный характер. Выявлена корреляция между характером изменения удельной теплоемкости R2Ge2O7 и зависимотью теплоемкости оксидов РЗЭ от ионного радиуса РЗЭ в пределах соответствующих тетрад.
БЛАГОДАРНОСТЬ
Работа выполнена при финансовой поддержке работ, выполняемых в рамках Государственного задания Министерства науки и высшего образования Российской Федерации Сибирскому федеральному университету на 2017–2019 годы (проект 4.8083.2017/ 8.9 “Формирование банка данных термодинамических характеристик сложнооксидных полифункциональных материалов, содержащих редкие и рассеянные элементы”).
Список литературы
Демьянец Л.Н., Лобачев А.Н., Емельченко Г.А. Германаты редкоземельных элементов. М.: Наука, 1980. 152 с.
Бондарь И.А., Виноградова В.Н., Демьянец Л.Н. и др. Соединения редкоземельных элементов. Силикаты, германаты, фосфаты, арсенаты, ванадаты. М.: Наука, 1983. 288 с.
Портной К.И., Тимофеева Н.И. Кислородные соединения редкоземельных элементов. М.: Металлургия, 1986. 480 с.
Козлов В.Д., Магунов Р.Л., Ковалевская И.П. и др. Получение германатов неодима, самария и европия // Укр. хим. журн. 1973. Т. 39. С. 658–662.
Ding L., Zhang Q., Liu W. et al. Preparation and Luminescence Properties of Yb3+ Activated Gd2GeO5 // J. sAlloys Compd. 2013. V. 557. P. 261–264.
Brixner L., Galabrese J., Chen H.Y. Structure and Luminescence of Gd2GeO5 and Dy2GeO5 // J. Less-Common Met. 1985. V. 110. P. 397–410.
Chattopadhyay K.N., Mondal S., Chakrabarti P.K. Measurements of Magnetic Susceptibilities, their Anisotropies and Crystal Fild Investigations of Monoclinic Single Crystals of Ho2GeO5 // J. Magn. Magn. Mater. 2008. V. 320. P. 3288–3292.
Tyagi A., Shah A., Sudarsan V. et al. Difference in the Luminescence Properties of Orthorhombic and Monoclinic fForms of Y2GeO5: Ln (Ln = Tb3+ and Dy3+) // Mater. Res. Bull. 2015. V. 64. P. 182–186.
Becker U.W., Felsche J. Phases and Structural Relations of the Rare Earth Germinates RE2Ge2O7, RE ≡ La–Lu // J. Less-Common Met. // 1987. V. 128. P. 269–280.
Moran D.M., Richardson F.S., Koralewski M. et al. Chiroptical Activity of Holmium Pyrogermanate: Tetragonal Ho2Ge2O7 // J. Alloys Compd. 1992. V. 180. P. 171–175.
Stadnicka K., Glazer A.M., Koralewski M. et al. Structure and Absolute Optical Chirality of Thulium Pyrogermanate Crystals // J. Phys.: Condens. Matter. 1990. V. 2. P. 4795–4805.
Redhammer G.J., Royh G., Amthauer G. Yttrium Pyrogermanate, Y2Ge2O7 // Acta Crystallogr., Sect. C. 2007. V. 63. P. i93–i95.
Subramanian M.A., Sleight A.W. Rare Earth Pyrochlores // Handbook Phys. Chem. Rare Earths. 1993. V. 16. P. 225–248.
Li X., Cai Y.Q., Cui Q. et al. Long-Range Magnetic Order in the Heisenberg Pyrochlore Antiferromagnets Gd2Ge2O7 and Gd2Pt2O7 Synthesized under High Pressure // Phys. Rev. B. 2016. V. 94. P. 214429-1–214429-9.
Гавричев К.С., Рюмин М.А., Никифорова Г.Е. и др. Фазовые переходы и термодинамические свойства соединений лантаноидов LnAO4 (A = P, V, Nb) // Рос. хим. журн. (Журн. Рос. хим. об-ва им. Д.И. Менделеева). 2005. Т. LIX. № 1–2. С. 11–18.
Денисова Л.Т., Иртюго Л.А., Белецкий В.В. и др. Высокотемпературная теплоемкость германатов Pr2Ge2O7 и Nd2Ge2O7 в области 350–1000 K // Физика твердого тела. 2018. Т. 60. № 3. С. 618–622.
Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. Синтез и исследование высокотемпературной теплоемкости Y2Ge2O7 // Журн. неорган. химии. 2018. Т. 63. № 3. С. 361–363.
Денисов В.М., Денисова Л.Т., Иртюго Л.А. и др. Теплофизические свойства монокристаллов Bi4Ge3O12 // Физика твердого тела. 2010. Т. 52. № 7. С. 1274–1277.
Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. Высокотемпературная теплоемкость и термодинамические свойства Tb2Sn2O7 // Неорган. материалы. 2017. Т. 53. № 1. С. 71–73.
Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. Синтез и исследование высокотемпературной теплоемкости Sm2Ge2O7 и Eu2Ge2O7 // Неорган. материалы. 2018. Т. 54. № 2. С. 193–196.
Денисова Л.Т., Каргин Ю.Ф., Белоусова Н.В. и др. Синтез и исследование высокотемпературной теплоемкости Dy2Ge2O7 и Ho2Ge2O7 // Неорган. материалы. 2018. Т. 54. № 4. С. 382–386.
Денисова Л.Т., Иртюго Л.А., Денисов В.М. Теплоемкость твердых растворов системы Er2Ge2O7–Er2Sn2O7 в области 350–1000 K // Физика твердого тела. 2019. Т. 61. № 4. С. 660–663.
Денисова Л.Т., Иртюго Л.А., Белоусова Н.В. и др. Высокотемпературная теплоемкость и термодинамические свойства германатов Tm2Ge2O7 и TmInGe2O7 в области 350–1000 K // Журн. физ. химии. 2019. Т. 93. № 3. С. 476–479.
Shannon R.D. Revised Effective Ionic Radii and Systematic Studies of Interatomic Distances in Halides and Chalcogenides // Acta Crystallogr., Sect. A. 1976. V. 32. P. 751–767.
Maier C.G., Kelley K.K. An Equation for the Representation of High Temperature Heat Content Data // J. Am. Chem. Soc. 1932. V. 54. № 8. P. 3243–3246.
Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей. Л.: Химия, 1982. 592 с.
Jana Y.M., Ghosh M., Ghosh D. et al. Measurements of the Magnetic Susceptibility and Anisotropy of Tb2Ge2O7 Single Crystal // J. Magn. Magn. Mater. 2000. V. 210. P. 93–103.
Ke X., Dahlberg M.L., Morosan E. et al. Magnetothermodynamic of the Ising Antiferromagnet Dy2Ge2O7 // Phys. Rev. B. 2008. V. 78. P. 104411-1–104411-6.
Jana Y.M., Ghosh D., Manklyn B.M. Magnetic Susceptibilities and Anisotropy Studies of Holmium Pyrogermanate (Ho2Ge2O7) Crystal // J. Magn. Magn. Mater. 1998. V. 183. P. 135–142.
Jana Y.M., Ghosh D. Crystal-Field of Magnetic Susceptibility, Hyperfine, and Specific Heat Properties of a Ho2Ge2O7 Single Crystal // Phys. Rev. B. 2000. V. 61. № 14. P. 9657–9664.
Morosan E., Fleitman J.A., Huang Q. et al. Structure and Magnetic Properties of the Ho2Ge2O7 Pyrogermanate // Phys. Rev. B. 2008. V. 77. P. 224423-1–224423-7.
Морачевский А.Г., Сладков И.Б., Фирсова Е.Г. Термодинамические расчеты в химии и металлургии. СПб.: Лань, 2018. 208 с.
Кубашевский О., Олкокк С.Б. Металлургическая термохимия. М.: Металлургия, 1982. 390 с.
Leitner J., Chuchvalec P., Sedmidyský D. et al. Estimation of Heat Capacities of Solid Mixed Oxides // Thermochim. Acta. 2003. V. 295. P. 27–46.
Кумок В.Н. Проблема согласования методик оценки термодинамических характеристик // Прямые и обратные задачи химической термодинамики. Новосибирск: Наука, 1987. С. 108–123.
Богач В.В., Добрыднев С.В., Бесков В.С. Расчет термодинамических свойств апатитов // Журн. неорган. химии. 2001. Т. 46. № 7. С. 1127–1131.
Гордиенко С.П., Феночка Б.В., Виксман Г.Ш. Термодинамика соединений лантаноидов. Киев: Наук. думка, 1979. 376 с.
Leitner J., Sedmidubský D., Chuchvalec P. Prediction of Heat Capacities of Solid Binary Oxides from Group Contribution Method // Ceramics-Silikaty. 2002. V. 46. № 1. P. 29–32.
Гуревич В.М., Гавричев К.С., Горбунов В.Е. и др. Термодинамические свойства касситерита SnO2(к) в области 0–1500 K // Геохимия. 2004. № 10. С. 1096–1105.
De Ligny D., Richet P., Vestrum E.F., Jr. et al. Heat Capacity and Entropy of Rutile (TiO2) and Nepheline (NaAlSiO4) // Phys. Chem. Miner. 2002. V. 29. P. 267–272.
Третьяков Ю.Д., Мартыненко Л.И., Григорьев А.Н. и др. Неорганическая химия. Химия элементов. М.: Химия, 2001. Т. 1. 472 с.
Денисова Л.Т., Каргин Ю.Ф., Денисов В.М. Теплоемкость редкоземельных купратов, ортованадатов и алюмо-, гало- и феррогранатов // Физика твердого тела. 2015. Т. 57. № 8. С. 1658–1662.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы